Method Article
Активированный перекрестный связаны Агароуз для быстрого развития аффинити Хроматография resins - Захват антител как пример
В этой статье
Резюме
В этой процедуре, DsRed основе эпитопа лиганд обездвижен для получения весьма селективной смолы сродства для захвата моноклональных антител из сырой растительных экстрактов или клеточной культуры супернатантов, в качестве альтернативы белка А.
Аннотация
Очистка моноклональных антител (mAbs) обычно достигается протеиновой хроматографией сродства, которая может составлять до 25% от общих затрат процесса. Таким образом, альтернативные, экономически эффективные шаги по улавливанию имеют важное значение для промышленного производства, где производится большое количество одного мАб. Здесь мы представляем метод иммобилизации лиганда на основе DsRed на основе эпитопа в перекрестную агарозную смолу, позволяющую селективное улавливание НЕйтрализующих ВИЧ антител 2F5 из сырых растительных экстрактов без использования белка А. Линейный эпитоп ELDKWA был впервые генетически слиты с флуоресцентным белком DsRed и синтез белка была выражена в трансгенных табака(Nicotiana tabacum) растений до очистки с помощью обездвиженного металла ионсроды хроматографии. Кроме того, метод, основанный на активированной перекрестной агарозе, был оптимизирован для высокой плотности лиганда, эффективного соединения и низких затрат. Состав рН и буфера и концентрация растворимых лиганд были наиболее важными параметрами во время процедуры соединения, которая была улучшена с помощью подхода, предусматривающего проектирование экспериментов. В результате сродство сродни была проверена на его способность избирательно связывать целевой mAb в сырой экстракт завода и elution буфер был оптимизирован для высокого восстановления mAb, активность продукта и сродни сродни устойчивости. Метод можно легко адаптировать к другим антителам с линейными эпитопами. Новые резолю позволяют более мягкие условия elution чем протеин a и смогли также уменьшить цены первоначально шага захвата для продукции mAb.
Введение
Биофармацевтические препараты имеют важное значение для лечения широкогоспектра заболеваний почти в каждой отрасли медицины 1. Моноклональные антитела (mAbs) доминируют на биофармацевтическом рынке, а мировые продажи, как ожидается, достигнут почти 110 миллиардов евро в 2020 году2. Излюбленным выражением платформы для mAbs являются китайские линии яичников хомяка, которые обычно производят высокие мАб титеры до 10 г-ле-1 в культуре supernatant3,4. Тем не менее, производство mAbs в культурах клеток млекопитающих стоит дорого из-за высокой стоимости среды и необходимости стерильного брожения5. Альтернативные платформы выражения, такие как заводы потенциально предлагают более быстрый,простой, менее дорогой и более масштабируемый подход для промышленного производства 6,7.
В дополнение к затратам, связанным с культурами клеток млекопитающих, широкое использование хроматографии сродства белка А для сбора продукта является основным фактором затрат для промышленного производства mAbs. Белок А, естественно, находится на поверхности клеток золотистого стафилококка и связывается с кристаллизованной (Fc) областью определенных муриновых и человеческих антител, тем самым действуя в качестве защитного механизма, чтобы избежать гуморальной иммунной системы8. Белок А стал золотым стандартом промышленности для захвата mAbs из клеточной культуры supernatants, а также широко используется научно-исследовательским сообществом, потому что это очень избирательно, как правило, достижения mAb чистоты в размере 95% в один шаг8. Неудивительно, что продажи белка А за последние два десятилетия тесно отражают продажи mAbs8. В зависимости от производственной шкалы, затраты на белок А могут составить более 25% от общих затрат на процесс и тем самым повлиять на рыночную цену терапевтических mAbs, которая может составить до 2000 гр-15,9. Таким образом, альтернативные хроматографии с аналогичными показателями очистки имеют потенциал, чтобы существенно сократить производственные затраты, что делает антитела на основе терапии доступны для большего числа пациентов10,11 ,12. Такие альтернативы могут также обойти недостатки хроматографии белка А, в том числе суровые условия elution при низком рН (обычно йlt;3.5), которые потенциально могут привести к изменениям, которые способствуют агрегации13 . Важно отметить, что Белок А селективна только для региона FC некоторых подклассов IgG, поэтому нефункциональные молекулы с усеченными связывающими доменами могут со-очиститься с нетронутым продуктом5, в то время как mAb произвносит такие как одноцепные переменные фрагменты не связываются с протеином А вообще.
Здесь мы описываем альтернативную сродство хроматографии мели исчерпать для захвата ВИЧ-нейтрализующей mAb 2F5 с использованием его линейного эпитопа ELDKWA (одна буква аминокислотного кода)5,14. Мы генетически сплавили эпитоп 2F5 в C-термину флуоресцентного белка DsRed, который функционировал как несущая молекула и репортёр, и произвели полученный белок DsRed-2F5-Epitope (DFE) в трансгенном табаке ( Nicotiana tabacum) растений. DFE очищалась одноступенчатой обездвиженной хроматографией сродства металла иона (IMAC). Иммобилизация очищенной лиги Сродства DFE на перекрестную агарозную осину была достигнута путем химического соединения с использованием N-гидроксисуччинимид (NHS)-активированных кросс-связанных агароузных колонн. Статистические экспериментальные проекты были затем использованы для оптимизации процедуры иммобилизации и связи эффективности15. Стратегия очистки mAb 2F5 была оценена с точки зрения чистоты антител, урожайности и устойчивости лиганда. В отличие от протеина А, который связывает регион Fc, DFE связан с областью комплементарности, определяющей 2F5, обеспечивая очистку молекул нетронутым паратопом. Наша концепция может быть легко адаптирована к любому mAb с линейным эпитопом или к другим лигандам на основе пептида, которые могут быть легко идентифицированы по исследованиям microarray16.
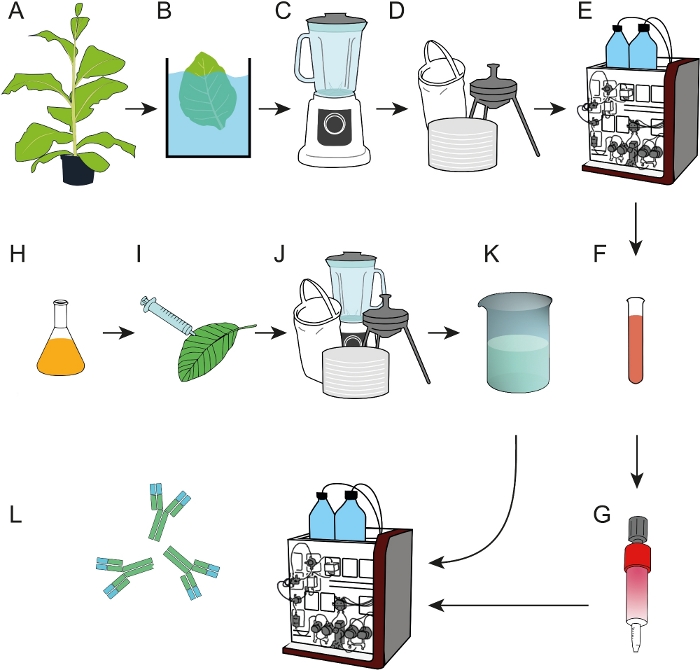
Рисунок 1: Схема потока процесса для подготовки эпитопных сродства сводки сечения сводки, которые могут быть использованы для захвата mAbs из сырой экстрактов растений или клеточной культуры supernatants. (A) Сродство лиганд DFE было выражено в трансгенных табачных растений. Шаг выпадения жары (B) был включен прежде чем собранные листья были однородны (C). (D) Экстракт сырой завода был уточнен путем фильтрации мешка, фильтрации глубины и 0,2 мкм стерильной фильтрации. (E) DFE был очищен IMAC. (F, G) Очищенный Ligand сродства DFE был обездвижен на столбцах агарозы EDC/NHS-активированных перекрестных. (H) Бактериальные культуры, несущие T-ДНК кодирования антитела 2F5 были использованы для преходящее выражение в N. benthamiana растений (I) выросли в фитотроне. (J) N. benthamiana листья были собраны и обработаны, как описано в D. (K) mAb 2F5 был очищен от уточненного экстракта с использованием DFE сродство столбцов (L). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
протокол
1. Культивировать трансгенные табачные растения
ПРИМЕЧАНИЕ: Конструкция белка синтеза DFE и генерации трансгенных растений описаны в другом месте5,17.
- Пронзить трансгенные саженцы табака в почве. Орошать растения с 1,0 г Раствор удобрений L-1. Перенесите растения в одноместные, 100 мм х 100 мм х 60 мм (длина, ширина, высота) горшки, когда они вырастают до диаметра 0,04 м.
- Выращивайте трансгенные табачные растения в теплице с 16-h фотопериодом (25/22 c свет/темный температурный режим), с 70% относительной влажностью и автоматизированным оплодотворением с 1,0 г L-1 раствор удобрений в течение 15 минут каждый час.
- После 7 недель, урожай всех листьев, за исключением четырех листьев котледона в основании стебля растения. Немедленно обработайте собранные листья, как описано ниже.
2. Тепловые осадки белков клеток-хозяев
- Навяжните водяную баню с рабочим объемом 20 л в сосуде с подогревом из нержавеющей стали (0,3 м х 0,3 м х 0,3 м). В начале поместите магнитный насос в водяной бане, чтобы постоянно агитировать жидкость с потоком 5 л мин-1. Установите регулируемый термостат на водяной бане для контроля температуры (шаги 2.4 и 2.8).
ПРЕДЕКТО: Все следующие шаги до 2.10 включают обработку горячей жидкости. Носите соответствующее оборудование для индивидуальной защиты, включая термически изолированные перчатки и очки. - Добавьте 15 л деионированной воды в водяную ванну и нагрейте жидкость до 70 градусов по Цельсию.
- Поместите 10 л ведро заполнены 5 л деионизированной воды на магнитный мешалка. Добавьте фосфат натрия к конечной концентрации 120 мМ. Отрегулируйте рН до 8,14 с помощью 10 М соляной кислоты. Когда все компоненты растворятся, добавьте полученный концентрированный буфер бланширования (5 л) к водяной бане со ступени 2.2.
- Агитировать водяную ванну до тех пор, пока температура не достигнет 70 градусов по Цельсию. Используйте 10 M соляной кислоты, чтобы настроить рН до 8,14 при необходимости. Продолжайте агитировать не менее 15 минут после достижения требуемой температуры и рН, чтобы убедиться, что вся сборка находится в тепловом равновесии.
- Подготовьте ведро 20 л (0,3 м х 0,3 м х 0,3 м), наполненное деионизированной водой при температуре 17 градусов по Цельсию (требуется для шага 2,9).
- Приготовьте 400 г аликвотизов собранных табачных листьев со ступени 1.3. Поместите один аликот в перфорированную корзину (0,2 м х 0,2 м х 0,2 м; ширина пор не менее 0,02 м х 0,02 м). Избегайте перелива корзины растительным материалом или упаковки листьев слишком плотно, чтобы избежать повреждения ткани.
- Полностью погрузите корзину в горячий буфер бланширования со ступени 2.4 и убедитесь, что все листья остаются под жидкой поверхностью. Используйте термостабильную силиконовую ложку, чтобы удерживать листья под поверхностью, если это необходимо.
- Инкубировать табачные листья в течение 1,5 мин в бланширующей жидкости в то время как насос по-прежнему агитации жидкости. Мониторинг температуры жидкости в течение всего инкубационного периода. Избегайте блокирования насоса впуске с табачными листьями.
- Снимите корзину с табачными листьями из буфера бланширования и слейте остаточный буфер из листьев на 30 с. Перенесите корзину в ведро, наполненное холодной водой (от шага 2.5) и погрузите листья на 30 с. Удалите корзину и слейте остаточную воду из ле aves за 30 с до гомогенизации (шаг 3).
- Повторите шаги от 2,6 до 2,9 со свежими аликвотами от 2,6 до обработки всей собранной биомассы. Постоянно контролировать и регулировать рН и температуру бланширования буфера в водяной бане.
ПРИМЕЧАНИЕ: Бланшированный растительный материал может храниться на льду до 30 мин, когда требуется несколько циклов бланширования для обработки всей биомассы. Бланшированные листья также могут храниться в вакуумно-запечатанных мешках при уровне -80 градусов по Цельсию в течение не менее 3 недель. Тем не менее, немедленная обработка рекомендуется, потому что длительное хранение может снизить выход DFE.
3. Экстракция и уточнение белка
ПРЕДЕКТО: Следующие шаги включают блендер с вращающимися лезвиями. Не работайте в блендере, когда питание или установлен на двигательном блоке.
- Поместите 150 г (влажная масса) бланшированных табачных листьев (шаг 2,9) в блендерный сосуд и добавьте 450 мл буфера экстракции (50 мм фосфат натрия, 500 мм хлорида натрия, 10 мМ дисульфит натрия, рН 7,5). Закройте крышку блендера плотно, чтобы предотвратить разлив растительного материала или буфера.
- Гомогенизировать листья в течение 3 раз на 30 с, с 30 s перерывов между каждым пульсом. Убедитесь, что все листья однородны и что никто не прилипает к верхней части блендера сосуда. При необходимости откройте блендер во время перерывов и оттолкните листья, которые прилипают к верхней части сосуда, используя чистую силиконовую ложку.
- После гомогенизации возьмите образец гомената 1,0 мл для последующего анализа (шаг 7).
- Соберите гоменат в сосуде адекватного размера (например, при работе с общей биомассой 1,0 кг, используйте сосуд емкостью не менее 5 л). Повторите шаги от 3,1 до 3,3 до тех пор, пока вся бланшированная биомасса не станет однородной.
- Установите мешок фильтра в фильтр крепления и место другого адекватного размера судна (см. 3.4) под сборки. Нанесите гоменат на фильтр мешка из тарифа 0,15 л мин-1. Возьмите образцы фильтрата мешка после каждого литра для последующего анализа (шаг 7) и измерьте мутность пула фильтрации мешка как 1:10 разбавления в буфере экстракции с помощью мутбидиметра или аналогичного устройства.
- Дальнейшее уточнение мешок фильтрованный бассейн, используя 0,02 м2 из K700 (вверху) и KS50 (внизу) глубина фильтра сочетание на литр мешок фильтрбассейн. Нанесите скорость потока 3,0 л мин-1м-2 до максимального давления 0,2 MPa. Затем удалите остаточные частицы, пройдя очищенный фильтрт через стерильный фильтр 0,2 мкм, как описано ранее5.
4. Очистка DFE Affinity Ligand
- Подготовьте быструю систему жидкой хроматографии белка путем промывки с помощью элютионного буфера (10 мм фосфат натрия, 300 мм имидазола, рН 7,4), буфер амтрия (10 ММ натрия, рН 7,4). Смонтировать столбец, содержащий 50 мл хелатирующей перекрестной агарозной массы на килограмм листовой биомассы (фильтрат глубины 2,5 л).
- Зарядите колонку никелевыми ионами, применяя 5 объемов столбцов (CV) раствора сульфата никеля 200 мм и промойте ее 5 CV элуционного буфера. Используйте скорость потока 50 смч -1 и следите за ультрафиолетовыми сигналами на 260, 280 и 558 нм для всех последующих шагов хроматографии.
- Уравновесите столбец 10 CV буфера равновесия. Затем загрузите 50 CV уточненного растительного экстракта (от шага 3.6) на кондиционированную колонку.
- Вымойте столбец 10 CV буфера для мытья. Elute DFE синтеза белка с 5 CV elution буфера и собирать продукт-содержащую фракцию, как только УФ сигналы на 280 нм и 558 нм увеличились до более чем 5 mAU выше базового.
- Возьмите образец 0,2 мл из фракции elution для измерения общей концентрации растворимого белка (TSP) (шаг 7.1), концентрации DFE (шаги 7.2 и 7.3) и чистоты DFE (шаг 7.4).
- Установите колонну, содержащую 50 мл перекрестной девроновой мели на хроматографию. Уравновесите колонку с 5 CV буфера соединения (200 мМ HEPES, 500 мМ хлорид натрия, рН 8.5). Впрысните 10 мл фракции elution DFE (шаг 4.4) для буферного обмена и мониторинга УФ-абсорбции на уровне 280 и 558 нм.
- Сбор DFE-содержащих фракции, как только УФ-сигналы на 280 нм и 558 нм увеличились до более чем 5 MAU выше базовой линии. Возьмите образец 0,2 мл и определите концентрацию TSP, концентрацию DFE и чистоту DFE (шаг 7).
- Сосредоточьтесь на очищенном образце DFE (от шага 4,7) до 15 г L-1 с помощью центробежной концентраторной трубки при 3000 х г при 4 градусах по Цельсию в течение 30 мин в центрифуге. Продолжить с соединением реакции (шаг 5).
ПРИМЕЧАНИЕ: Храните раствор DFE при 4 градусах по Цельсию, если шаги концентрации или соединения не могут быть выполнены немедленно.
5. Соединение DFE с активированным кросс-связанным Агаросе Ясин
ПРИМЕЧАНИЕ: Не заменяйте изопропанол, используемый для хранения активированных ГСЗ столбцов, пока все оборудование и решения для соединения не будут готовы. Никогда не позволяйте столбцы иссякнут.
- Настройка дизайна модели экспериментов (DoE) для оптимизации соединения DFE с активированной мисиной, с рН, буферным составом и концентрацией DFE в качестве факторов. Детали метода DoE описаны в другом месте15.
- Приготовьте раствор лиганда сродства (от шага 4.8) в диапазоне концентрации от 0,5-15 г L-1 или, как определено в DoE и хранить его на льду, пока соединение реакция готова (шаг 5.5). Заполните по крайней мере десять шприцев 2 мл с решением DFE и подготовить адаптер для установки шприцев на NHS-активированных кросс-связанных агароузных колонн с объемом кровати 1,0 мл.
- Для каждых 10 столбцов, используемых для сцепления, приготовьте 30 мл раствора деактивации (0,5 М этаноламин, 0,5 М хлорида натрия, рН 8,3), 30 мл раствора с низким рН (0,1 м ацетата натрия, 0,5 м хлорида натрия, рН 4,0) и 10 мл раствора для хранения (0,05 М. , 0,1% (м/в) азид натрия, рН 7,0).
- Приготовьте 20 мл соляной кислоты мощностью 1 мм в трубке и инкубируйте ее на льду не менее 20 мин. Подготовьте точную шкалу для мониторинга проточных фракций для всех шагов во время спутывания реакции (шаг 5.7).
- Откройте запечатанную колонку агарозы, активированную NHS, и установите адаптер шприца на входе колонны. Предотвращение попадания воздуха в столбец, применяя каплю буфера на вход адаптера, прежде чем соединить его со шприцем.
- Вымойте колонку с 6 мл ледяной 1 мм соляной кислоты (от шага 5.4) при скорости потока юlt;1 мл мин-1 и сразу же приступить к шагу 5,7.
- Введите 1,5 мл раствора DFE (шаг 5.2) с помощью шприца 2 мл при скорости потока в 1 мл мин-1 и соберите проточную фракцию по точной шкале (шаг 5.4) для последующего анализа (шаг 7). Печать колонки на обоих концах и инкубировать в течение 15-45 минут при 22 градусах Цельсия, в зависимости от установки DoE.
- Вводят 6 мл раствора деактивации, за которым следует 6 мл раствора с низким рН при скорости потока в 1 мл мин-1, чтобы удалить из нековалентно связанных лигандов из мисинки. Затем введите 6 мл раствора деактивации и инкубируют колонну в течение 15 минут.
- Впрысните 6 мл раствора с низким рН в колонку, а затем 6 мл раствора деактивации. Затем введите еще 6 мл раствора с низким рН в колонку.
- Введите 2 мл раствора для хранения в колонку и храните при 4 градусах Цельсия.
6. Тестирование очистки mAbs от экстрактов выясненных растений
- Приготовьте 100 мл очищенного растительного экстракта, содержащего 2F55 или супернатант из предпочтительной системы выражения на основе клеток, также содержащей 2F5.
- Подготовка буфера эквилибриации (20 мМ фосфат атримы, 500 мМ хлорид натрия, рН 7,4), буфер элютации с низким рН (0,05 М цитрат, 0,05 М хлорид натрия, рН 4,0-3,25) и буфер элюции высокой ионической силы (1,0-4,0 М хлорид магния, 0,1 М ХЕПЕС, pH 8.0)
- Промыть систему хроматографии с буферами. Смонтировать столбец сродства DFE (от шага 5.10) на системе хроматографии и уравновесить с 5 CV буфера равновесия на скорости потока 1.0 mL мин-1. Мониторинг УФ-абсорбции на 280 нм.
ПРИМЕЧАНИЕ: Загрузка растительного экстракта или супернатанта клеточной культуры на столбец может привести к увеличению давления спины. Установите предупреждение высокого давления на 0.2 MPa, чтобы избежать повреждения системы хроматографии или столбца DFE. - Нагрузка 80 мл прояснения растительного экстракта или супернатанта (шаг 6.1) на колонку со скоростью потока 0,5 мл мин-1, чтобы гарантировать время контакта 2 мин. Соберите проточные образцы в 2 мл фракций для прорывной кривой реконструкции (шаг 7.3). Храните проточные образцы при 4 градусах По Цельсию, если немедленный анализ выборки невозможен.
- Вымойте столбец 6 CV буфера равновесия. Соберите образец стирки в начале, середине и конце этого шага.
-
Elute mAb 2F5 с 5 CV буфера элуции с низким рН или высокоионно-сильным элуистическим буфером (0.1 M HEPES, 1.25 M хлорид магния, pH 8.0). Соберите фракцию DFE, когда сигнал UV 280 нм увеличился до 5 МАУ выше базовой линии.
- Оптимизируйте буфер elution для каждой пары эпитопа-антитела. Для 2F5 хлорид магния 1,25 М достиг оптимального баланса между восстановлением продукта и устойчивостью лиганда.
ПРИМЕЧАНИЕ: Раствор хлорида магния склонен к осадкам. Таким образом, растворить хлорид магния в 700 мл воды. Отдельно растворить HEPES в 100 мл воды и настроить рН до 8,0. Добавьте раствор раствора хлорида магния в раствор HEPES и добавьте воду в окончательный объем 1,0 л. Не отрегулируйте рН после растворения хлорида магния, так как это вызовет осадки.
- Оптимизируйте буфер elution для каждой пары эпитопа-антитела. Для 2F5 хлорид магния 1,25 М достиг оптимального баланса между восстановлением продукта и устойчивостью лиганда.
- Проанализируйте все образцы, взятые во время шагов 6.4-6.6 с использованием метода Брэдфорда, литий dodecylsulfate полиакриламимид гель электрофоресис (LDS-PAGE) и поверхностный плазмон резонанс (SPR) спектроскопии (шаг 7).
7. Анализ проб
- Измерьте концентрацию TSP с помощью метода Брэдфорда18,19.
- В тройном, пипетка 2,5 л каждого образца в один колодец из 96-хорошо пластины. Используйте восемь бычьих сывороточных альбуминов (BSA) стандартов в тройной, охватывающих диапазон 0-2,000 мг L-1.
- Добавьте 200 кL реагента Брэдфорда к каждому колодцу и смешайте, аккуратно пипеткая вверх и вниз. Держите уровень пипетки, чтобы избежать образования пузырьков, которые искажают последующее считывание.
- Инкубировать пластину в течение 10 мин при 22 градусах Цельсия и измерять абсорбцию на 595 нм в спектрофотометре. Рассчитайте концентрацию TSP в образцах на основе стандартной кривой через ориентиры BSA.
- Количественная DFE по фторметрии
- В тройном, пипетка 50 л каждого образца в одиночные скважины черного 96-хорошо полурайонпластины. Включите шесть стандартов DsRed, охватывающих диапазон 0-225 мг L-1.
- Измерьте флуоресценцию дважды, используя фильтр возбуждения 530 и 30 нм и эмиссионный фильтр 590 и 35 нм в спектрофотометре. Рассчитайте концентрацию DFE в образцах на основе стандартной кривой через ориентиры DsRed.
- Измерьте концентрацию 2F5 с помощью спектроскопии SPR20.
- Подготовка HBS-EP работает буфер (10 мМ 4-(2-гидроксиэтил)-1-пиперазинетанетанетанесульфоновой кислоты (HEPES), 3 мМ этиленедиадиаминететрацетической кислоты (EDTA), 150 мм хлорид натрия, 0.005% v/v Tween-20, pH 7.4) и фильтр стерилизовать его путем проходить его через вакуум 0.2 мкм фильтр для бутылок. Дега буфер в течение 15 минут.
- Подключите буфер HBS-EP к инструменту SPR перед стыковкой карбоксиметилированный поверхностный чип и уравновешивать систему с помощью основной функции. Начните ручной запуск с скоростью потока 30 мл мин-1 и обусловливайте поверхность чипа путем поочередного введения 30 мм соляной кислоты и гидроксида натрия 25 мм (две инъекции каждая) над клетками потока 1 и 2 при скорости потока 30 мл мин-1 на 1 мин.
- Приготовьте 300 л из 500 мг L-1 Белок Раствор в ацетате натрия 10 мМ (pH 4.0). Оттепели флаконы, содержащие 0,4 М 1-этил-3-(3-диметиламинопропил) карбодимид гидрохлорид (EDC) и 0,1 М ГСЗ и центрифуги на 16000 х г в течение 1 мин до смешивания 70 л EDC и 70 л ГСЗ.
- Перенесите смесь EDC/NHS и раствор Protein A на 7-мм пластиковые флаконы и поместите в стойку образца. Активируйте carboxymethylated dextran поверхность обломока путем впрыскивать смесь EDC/NHS над клетками потока 1 и 2 на скорости потока 10 мин/1 для 10 минут.
- Пара Белок А к активированной carboxymethylated dextran поверхности путем введения белка раствора над потоком ячейки 2 при скорости потока 15 мл мин-1 в течение 15 мин.
- При соединении белка А, оттаивать флакон 1,0 М этаноламин гидрохлорид (pH 8.5) и центрифуги на 16000 х г в течение 1 мин. Передача 150 л на 7-мм пластиковый флакон и место в инструмент. Когда шаг 7.3.5 завершен, деактивировать поверхность чипа путем введения этаноламина раствора над клетками потока 1 и 2 при скорости потока 10 мл мин-1 в течение 7 мин.
- Состояние поверхности чипа путем поочередного введения 30 мм соляной кислоты и 25 мМ гидроксида натрия (две инъекции каждый) над клетками потока 1 и 2 при скорости потока 30 мл мин-1 для 0,5 мин.
- Подготовьте стандарты антител 2F5 в беговом буфере HBS-EP при концентрации 500 мкг L-1 и разбавлять образцы, содержащие 2F5 в HBS-EP до конечной концентрации в диапазоне 20-1000 мкг L-1. Впрыскивать образцы и стандарты над клетками потока 1 и 2 при скорости потока 30 м/ мин-1 на 3 мин. Введите стандарт 2F5 после каждых 15 образцов.
- Вычесть относительный сигнал (RU) ячейки потока 1 (справочная ячейка) из сигнала ячейки потока 2 (измерительная ячейка) для каждого образца и вычислить концентрацию антитела на основе сигнала RU стандартных инъекций 2F5.
- После каждого образца или стандартной инъекции, регенерировать поверхность чипа путем введения 30 мМ соляной кислоты на скорости потока 30 мл мин-1 для 0,5 мин над потоком клеток 1 и 2.
- Участок 2F5 концентрации для каждого потока через образец от шага 6.4 против потока через объем, чтобы получить 2F5 прорыв кривой. Рассчитайте количество впрыскиваемых 2F5, когда 10% от концентрации загрузки 2F5 было достигнуто, чтобы получить 10% динамическую связывающую емкость (DBC).
- Проанализируйте образцы белка с помощью LDS-PAGE.
- Откройте готовый к использованию 4-12% полиакриламидный гель BisTris LDS и поместите его в модуль электрофорасиса. Передача 800 мл бегового буфера (50 мМ МЧС, база 50 мм Tris, 0,1% (м/в) SDS, 1 мМ EDTA, рН 7,3) в модуль и добавить 0,5 мл антиоксидантного раствора.
- В реакционной трубке 1,5 мл смешайте 10 qL погрузочного буфера с 4 злителю редукционного агента и 26 л образца белка. Инкубировать трубку в теплоблоке в течение 10 мин при температуре 80 градусов по Цельсию. Центрифуга трубки на 500 х г в течение 30 с.
- Загрузите полиакриламидный гель СПД (10 л образца на полосу) и загрузите 5 зЛ стандарта предварительно окрашенных белков (10–180 кД) в отдельную полосу.
- Закройте камеру электрофореза и подключите блок питания. Электрофорезаз должен работать 40 мин и при постоянном 200 В.
- Удалите гель из камеры электрофореза. Откройте гель и промойте гель в течение 15 минут в воде на шейкере при 19 об/мин. Пятно гель на 1 ч в окрашивая раствор на шейкере при 19 об/мин.
- Destain гель на 1 ч в воде на шейкере при 19 об/мин. Сканирование геля с помощью сканера пленки.
Результаты
Выражение и очищение лигании сродства
Термоядерный белок DFE был выражен в трансгенных табачных растениях, выращенных в теплице. Урожайность составила 120 мг кг-1 листовая масса со средней биомассой 130 г на растение. Чистота DFE была йт;5% TSP в экстрактах сырой растений до бланширования, но увеличилась до 40% после тепловой обработки при температуре 70 градусов по Цельсию в течение 1,5 мин, что осаждали йgt;97% белков клеток-хозяев. Шаг бланширования был легко интегрирован в уборку и добычу рутины(рисунок 1) и занимает менее 2 ч дополнительного времени, в том числе создание водяной бани. Общее восстановление DFE было 23,5 мг кг1 с чистотой Шагами, ответственными за потерю продукта, были бланширование, фильтрация глубины и IMAC, с конкретными потерями 40%, 27% и 45%, соответственно. Емкость фильтра глубины была в среднем 135 и 36 лм -2 (SD, n'3) и, таким образом, в верхнем диапазоне значений, о которых сообщается в литературе21. Урожайность DFE увеличилась с возрастом растений(рисунок 2).
Иммобилизация лиганд сродства на столбцах хроматографии, активированной ГСЗ
Во время первоначальных испытаний соединения, мы обнаружили, что буфер HEPES (pH 8.3) увеличил эффективность соединения до 89 и 6% (SD, n'3) по сравнению с 78 и 9% (SD, n'3) для буфера бикарбоната, рекомендованных производителем. Таким образом, HEPES использовался для всех последующих экспериментов по совмещению. Подход DoE был выбран для оптимизации эффективности связи DFE с активированной NHS кросс-связанной агароузной осиной. Абсолютное количество DFE обездвиженных на мисиной увеличивается с массой DFE вводят в колонку и плато на 15 г L-1 в то время как выход соединения непрерывно снижался, как больше DFE был введен(Рисунок 2). Соединение выход был также йgt;50% ниже в кислых буфера, что свидетельствует о необходимости проверки для подходящих условий соединения для каждого лиганд на индивидуальной основе. С помощью цифрового инструмента оптимизации программного обеспечения DoE были определены идеальные условия с точки зрения доходности сцепления, абсолютного количества обездвиженных DFE и стоимости столбцов. Наиболее желательные условия (pH 9.0 и 7.0 мг DFE на 1 мл перекрестной агарозной оси) были расположены на большом плато и поэтому были надежными. Молекулы DFE сохранили свою красную флуоресценцию даже после соединения, а интенсивность цвета соответствовала общему количеству обездвиженных DFE (Рисунок 2). Таким образом, цвет столбцов может быть использован в качестве простого параметра контроля качества для оценки эффективности соединения и качества столбца. Флуоресценция также подтвердила, что белок синтеза DFE, собранный в тетрамерном состоянии родного DsRed.
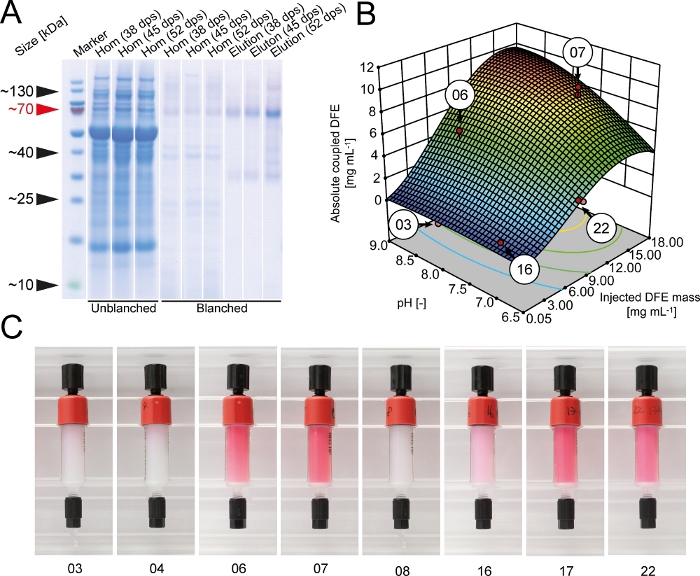
Рисунок 2: Оптимизация симмобилизации DFE к NHS-активированной перекрестно-связанной агарозной осине. (A) Гель LDS-PAA с западным наложением помарка гомената и элютификации образцов из небланшированных и бланшированных трансгенных экстрактов растений DFE. Урожай растений был выполнен через 38, 45 или 52 дня после посева. Западные помарки выполнялись сиспользованием анти-Его 6-антител5. (B) Общее количество соединенных DFE сродство лиганд в зависимости, если соединение рН и общая масса очищенных DFE вводят на ГСЗ-активированный кросс-связанных агароуз столбцов. Красные точки указывают на фактические эксперименты, выполненные для построения модели поверхности ответа. (C) DFE сродство столбцов после процедуры соединения. Цифры соответствуют условиям соединения, выделенным в панели B. dps и дней после посева. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Тестирование изоляции 2F5 с использованием срододрую сродства DFE
Рекомбинантные антитела 2F5 были временно произведены в растениях Nicotiana benthamiana, выращенных в фитотроне5. Захват 2F5 из экстракта сырой завода был протестирован с использованием столбцов сродства в сочетании с 7,0 мг очищенной DFE (шаг 6). Удаление из протеина а, как правило, включает в себя кислый буфер (pH 3.3)13. Поэтому мы изначально оценивали различные буферы elution с низким рН (pH 6.0-3.25) для столбцов DFE. Elution 2F5 был успешным при значениях pH ниже 4,5 с самым высоким восстановлением 35% при рН 3,25. Тем не менее, низкор-рН elution инактивировал оба антитела (как подтверждено sPR спектрометрии) и DFE лиганд (как указано на потерю цвета и нижней DBC, Рисунок 3). Последний был ожидаем, учитывая, что родной DsRed денатурации на рН злт;4.022,23. Чтобы избежать денатурации продукта и лиганда, мы протестировали хлорид магния в качестве альтернативного агента elution, потому что он ранее использовался для elute mAbs от других сродни сечения сечения ранс24. Концентрация хлорида магния в 1,25 М была достаточна для того, чтобы вылететь из сродни сродни Сродни сагины DFE с восстановлением 105 и 11% (SD, n'3) и чистотой 97 и 3% (SD, n'3). Этот спектакль был сопоставим с протеиной а по шрейн25,26. Равновесие диссоциации постоянной (KD) из DFE очищенных 2F5 антитела и синтетический лиганд Fuzeon был 791 pM в то время как у белка-очищенный аналог был 763 pM5. Кроме того, в драке не наблюдалось существенной потери цвета в течение в общей сложности 25 циклов bind-and-elute. DBC сродства сродности сроды на 10% 2F5 прорыв снизился линейно в течение 25 циклов до 15% от первоначального значения (Рисунок 3).
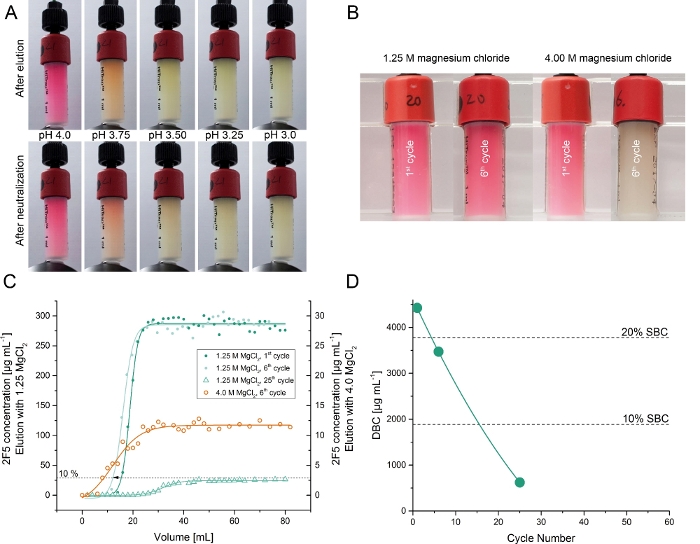
Рисунок 3: Тестирование изоляции 2F5 от уточненных растительных экстрактов с использованием сродства DFE. (A) DFE сродство сферы сечения семы после одного цикла elution используя буферы с по-разному значениями pH в ряде 4.0-3.0 и такие же resins после шага нейтрализации на pH 6.0. (B) DFE сродство сродни серекции мели после одного и шести циклов 2F5 очистки с использованием 1,25 М или 4,00 М хлорида магния, как eluent. (C) Хроматограммы экспериментов по лобной нагрузке (прорывные кривые) для определения цикло-зависимой динамической связывающей способности рецина DFE с использованием хлорида магния в качестве элуентного. Кривые прорыва были измерены для 4.0 M и 1.25 M буферов элевции хлорида магния и различных чисел цикла. (D) Цикл-зависимая динамическая связывающая способность DFE используя хлорид магния 1.25 M как eluent. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Применение романа сродство сроды
Мы показали, что пользовательские сродство хроматографии рании для захвата mAbs могут быть изготовлены путем иммобилизации лиганд, содержащий mAb-специфический эпитоп NHS-активированный кросс-связанных агарозы. Чтобы спроектировать такую миошку, необходимо было знать эпитопную последовательность и использовать линейный эпитоп. В результате мели сыбы выгодны для захвата mAbs, поскольку они потенциально могут заменить дорогие шаги сродства белка сродства хроматографии. Взаимодействие между 2F5 и DFE в нашем тематином исследовании было опосредовано эпитоп-паратоп связывания, так что наш лиганд должен быть более избирательным, чем белок, который связывается с FC регионе большинства мурин и человека IgGs. Поскольку индивидуальные лиганды необходимы для каждого mAb, наш метод может первоначально показаться подходящим в основном для антител, которые производятся в очень больших масштабах. Однако, сочетая наш подход с быстрым растительным переходным выражением белка, новые лиганды сродства могут быть подготовлены менее чем за 2 недели27 с минимальными усилиями28. Таким образом, метод также подходит для мелкомасштабного очищения mAb.
Производство и потенциальное улучшение сродства лиганда
Растения предлагают быструю и безопасную производственную платформу для сродства лигандов5,29,30, таких как белок синтеза DFE признакам в нашем исследовании. Бланширование растительного материала значительно уменьшило количество белков клеток-хозяев за один шаг и было легко интегрировано в стандартную процедуру выяснения. Тем не менее, восстановление лиганда было низким в текущей установке, вероятно, из-за его умеренной тепловой устойчивости и некоторых неспецифических связывания с слоями фильтра, как сообщалось для других продуктов31,32,33. Инженерные перевозчика для повышения его тепловой стабильности, следовательно, может помочь улучшить выход лиганда в будущем, как описано для кандидата вакцины против малярии CCT, противоопухолевый фермент PpADI или мезофильной й-глюкозидаза34, 35,36. То же самое относится и к этапу фильтрации глубины, где белковая инженерия может помочь уменьшить неспецифическую привязку к фильтрованию материала37. Затраты на производство DFE и аналогичных лигандов также могут быть сокращены за счет повышения общей эффективности уточнения с использованием флоктантов или фильтровых добавок38,39.
Когда DsRed используется в качестве носителя, он образует тетрамерический комплекс. Это выгодно, потому что это увеличивает количество эпитопов на лиганд, но это также может сделать лиганд более восприимчивы к разборке или денатурации во время сродства хроматографии. Мономерный белок перевозчика, таких как mCherry поэтому может быть предпочтительным, потому что он стабилен при низком рН40, и включение тандемных повторов эпитопа увеличит алчность лиганда и тем самым увеличить мощность мелины5, 26 , 41. Для простых белков-эпитопов-носителей (т.е. тех, у кого нет дисульфидных связей или посттрансляционных модификаций) микробные производственные системы могут снизить производственные затраты и сделать лиганды более конкурентоспособными с протеином А. Например, зеленый флуоресцентный белок был выражен в бактериальных клетках с выходом биомассы в 1 г-кг-1, что значительно снизило бы затраты на производство лиганда42.
Независимо от хозяина выражения, очищенная лиганд сродства была необходима во время соединения для того чтобы уменьшить immobilization протеинов клетки хозяина или компоненты средств которые могут в противном случае уменьшить селективность и емкость сверженности. Включение полигистидина для очистки IMAC увеличило чистоту до 90% за один шаг, способствуябыстрому и недорогому производству лиганд 5,43,44. Тем не менее, положение термоядерного тега имеет важное значение, поскольку он имеет потенциал, чтобы стерически препятствовать эпитопной привязки или вызвать расщепление либо тегили или эпитоп от носителя45,46.
Иммобилизация лиганд сродства на столбцах хроматографии, активированной ГСЗ
Иммобилизация проводилась вручную или с использованием хроматографии. Небольшие объемы буфера на столбец, как представляется, отдают предпочтение ручной обработке (например, из-за минимальных объемов отходов). Однако, если требуется несколько/больших столбцов, система хроматографии облегчает управление условиями соединения (например, регулируемые темпы потока) и, следовательно, с большей вероятностью достигает воспроизводимых результатов с точки зрения DBC. Наши данные позволяют предположить, что буфер соединения и рН оказывают существенное влияние на эффективность соединения и общие затраты на столбец. Таким образом, факторы скрининга, влияющие на реакцию соединения и регулировку их для каждого белка носителя (или даже для каждого синтеза несущих- лиганд), могут, таким образом, повысить эффективность соединения и производительность сыщивания, и мы рекомендуем этот подход.
Тестирование изоляции 2F5 с использованием срододрую сродства DFE
Урожайность и чистота продукции являются важными аспектами производительности мели, и в случае DFE мы достигли урожайности 105 и 11% (SD, n'3) и чистоты 97 и 3% (SD, n'3), что сопоставимо с производительностью эталона Промыки A мелисс25 ,26. Другим ключевым показателем производительности для брасв в целом (и особенно для тех, на основе лигандов сродства) является DBC на 10% прорыв продукта, потому что этот параметр влияет на количество мисы, необходимые для конкретного процесса и, следовательно, расходы. Для лиганда DFE, начальный DBC был «4 g» L-1 сисины, которая составляет 13% от соответствующего значения для белка А при аналогичных условиях (только 2 мин время контакта)25,47, но примерно в 15 раз выше по сравнению с другими пользовательскими сродством сечения сечения, таких как анти-FSH-иммуноаффинити лиганд с использованием того же времени проживания 2 мин48. DBC DFE снизился до 15% от начального значения после 25 циклов bind-and-elute, в то время как более 50 циклов требуется для той же потери DBC в коммерческих протеина мели49. Тем не менее, важно отметить, что наш перевозчик еще не был оптимизирован в той же степени, как белок А, который был всесторонне исследован ы и улучшен в течение последних четырех десятилетий8.
До сих пор мы улучшили стабильность мелины и восстановление продукта путем перехода от низкой рН элуционного буфера к высокой концентрации хлорида магния(рисунок 3), как это было рекомендовано в предыдущих исследованиях13. Характерный красный цвет ligand сродства не увядал существенн во время 25 bind-and-elute циклов, поэтому мы спекулируем что эндогенные protease завода в уторенных выдержках завода31 могут усеченный и таким образом inactivated epitope лиганд. Таким образом, проектирование протеаз-устойчивых связующих для подключения носителя и эпитопа может помочь сохранить первоначальный DBC в течение длительного числа циклов. Учитывая быстрое и простое выражение и очищение лиганда DFE, его простое соединение с коммерческими шрантами хроматографии, и его превосходный выход и чистоту продукта, мы считаем, что наш метод предлагает подходящую альтернативу Белену А для очищение mAbs и производных антител, которые не связываются с протеином А, особенно если улучшения носителя и связующим звеном могут улучшить стабильность DBC и ligand. Это предположение было поддержано небольшой разницей в диссоциации постоянной DFE-очищенных и белков A-очищенных 2F5 антитела5, указывая, что наш новый лиганий сродства позволяет восстановление высококачественных mAbs.
Преимущества и текущие ограничения метода
Производство лиганда сродства как генетического синтеза с несущим белком увеличивает растворимость в вакуческих буферах и, таким образом, совместимость с типичными условиями соединения лиганда. В отличие от этого, пустые пептиды, полученные из синтеза твердой фазы пептида, могут иметь ограниченную растворимость в этих условиях из-за их последовательности50, которые не могут быть изменены, потому что это продиктовано аминокислотной последовательностью эпитопа, признанной mAb быть очищены. Поэтому другие использовали синтез пептидных лигандов51. Статические связывающие способности результирующей мизины была высокой (80 г) L-1), но процесс подготовки к голени является длительным, динамические связывающие мощности не сообщалось и полученная чистота и восстановление были ниже, чем в нашем подходе. Дополнительным преимуществом лиганда синтеза белка в лабораторной шкале является то, что лиганд и его варианты могут быть быстро произведены, очищены и протестированы с минимальными усилиями в простой в использовании высокой в использовании системы экспрессии52.
Двумя текущими ограничениями метода, представленным здесь, являются низкая динамическая связывающая способность в 3 г L-1 и его 90% сокращение в течение 25 связывания и elute циклов5. Эти ограничения могут быть устранены в будущем путем применения менее строгих условий загрузки и замены текущего перевозчика DsRed с инженерией, более стабильный вариант соответственно. Например, удвоение текущего времени контакта с 2 до 4 минут может удвоить динамическую связывающую способность, как было показано для некоторых протеинов A, которые были показаны26.
Устранение неполадок
В следующей таблице освещаются потенциальные проблемы, которые могут возникнуть во время этого протокола, и содержатся подсказки о том, как их решить(таблица 1).
| Таблица 1: Потенциальные проблемы, с которыми можно столкнуться, и возможные исправления. | |||
| Протокол шаг | Проблема | Каус | Исправить |
| 1 | Растения не растут | Компромиссные условия роста | Проверьте рН и проводимость удобрений |
| Проверка температуры и освещений | |||
| 2 и 3 | Большое количество белков клеток-хозяев присутствуют после экстракции | Неполные осадки | Проверьте температуру во время бланширования |
| Проверьте агитацию в бланширующей ванне | |||
| 2 и 3 | В растительном экстракте не найдено продукта | Температура бланширования слишком высока | Проверьте температуру и рН во время бланширования |
| рН в бланширование буфера слишком низко | |||
| 3 | Большие части стебля или листьев остаются после извлечения | Неполное смешивание в блендере | Убедитесь, что растительный материал не образует штепсельную вилку в блендере |
| 3 | Быстрое повышение давления при фильтрации глубины | Неправильный выбор фильтра и/или ориентация | Проверьте тип и ориентацию фильтра |
| 4 | Маленький белок синтеза во время elution / много белка синтеза в потоке через | IMAC Resin не был обвинен в металлических ионах | Проверьте, правильно ли заряжена с ионами |
| Фьюжн-белок потерял тег сродства | Избегайте интенсивного солнечного света и высоких температур при выращивании растений | ||
| 4 | Фьюжн-белок, потерянный во время концентрации | Сплавливание протеин прыгнутое к мембране | Проверьте тип мембраны |
| Убедитесь, что фактор концентрации не был слишком высоким | |||
| 5 | Низкая доходность сцепления | Неправильная последовательность добавления реагента соединения | Проверьте этикетки реагентов и последовательность добавления |
| Неправильная подготовка столбцов перед стыковкой | Проверьте условия препараитона колонны | ||
| 5 и 6 | Низкая доходность mAb | Низкое выражение mAb в биомассе растений | Тест mAb выражение в биомассе |
| Низкая плотность лиганда | Проверьте чистоту подготовки к термоядерному протеину | ||
| 7 | Очень низкие/высокие концентрации белка в Брэдфорде анализ | Формирование пузыря во время пипетки | Проверьте наличие пузырьков в 96-хорошем палте |
| 7 | Низкая концентрация mAb во время измерения SPR | Компромиссный протеиновый чип А | Сравните с результатами стандартного mAb с известной концентрацией |
| Неправильное разбавление образцов | Проверьте скорость разбавления и буфер | ||
Таблица 1: Стрельба по неприятностям.
Раскрытие информации
Авторы не имеют конфликта интересов раскрыть.
Благодарности
Мы хотели бы отметить Ибрагима аль-Ареди за выращивание трансгенных табачных растений и д-ра Томаса Радемахера за обеспечение вектора экспрессии табака. Авторы хотели бы поблагодарить д-ра Ричарда М. Тваймана за редакционную помощь и Маркуса Сака за плодотворные дискуссии о структуре лиганды сродства DFE. Эта работа была частично профинансирована Внутренними программами Фраунхофера-Гезельшафта в рамках ГрантА No. Привлечь 125-600164 и штат Северный Рейн-Вестфалия в рамках гранта Leistungszentrum No 423 "Сетевое, адаптивное производство". Эта работа была поддержана Deutsche Forschungsgemeinschaft (DFG) в рамках научно-исследовательской учебной группы "Tumor-targeted Доставка наркотиков" грант 331065168. GE здравоохранения поддержали публикацию открытой доступности этой статьи.
Материалы
| Name | Company | Catalog Number | Comments |
| 10 L/20 L Bucket | n/a | n/a | Blanching equipment |
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| ÄKTApure | GE Helthcare | 29018226 | Chromatography system |
| Allegra 25R | Beckman Coulter | 369434 | Centrifuge |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Antibody 2G12 | Fraunhofer IME | n/a | Standard for SPR quantification |
| Blender | Waring | 800EG | Blender |
| BP-410 | Fuhr | 2632410001 | Bag filter |
| CanoScan 5600F | Canon | 2925B009 | Scanner |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| Chelating Sepharose FF | GE Helthcare | 17-0575-01 | Chromatography resin |
| Cond 3320 | WTW | EKA 3338 | Conductometer |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n/a | DoE software |
| Discovery Compfort | Gilson | F81029 | Multichannel pipette |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Diverse bottles | Schott Duran | n/a | Glas bottles |
| Dri Block DB8 | Techne | Z381373 | Heat block |
| DsRed | Fraunhofe IME | n/a | Standart |
| EDTA | Carl Roth GmbH | 8043.2 | Buffer component |
| EnSpire | Perkin Elmer | 2390-0000 | Plate reader |
| ETHG-912 | Oregon Scientific | 086L001499-230 | Thermometer |
| F9-C | GE Helthcare | 29027743 | Fraction collector |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| HEPES | Carl Roth GmbH | 9105.3 | Buffer component |
| Hettich Centrifuge Mikro 200 | Hettich | 2400 | Centrifuge |
| HiPrep 26/10 | GE Helthcare | GE17-5087-01 | Chromtography column |
| HiTrap NHS-activated Sepharose HP, 1 mL | GE Helthcare | 17-0716-01 | Chromatography columns |
| Hydrochloric acid | Carl Roth GmbH | 4625.1 | Buffer component |
| Imidazole | Carl Roth GmbH | 3899.2 | Buffer component |
| K700 | Pall | 5302305 | Depth filter layer |
| KM02 basic | IKA | n/a | Magnetic stirrer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Immersion circulator |
| Magnesium chloride | Carl Roth GmbH | KK36.2 | Buffer component |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Minisart 0.2 µm | Sartorius | 16534K | Filter unit |
| Nalgene Rapid-Flow PES bottle top filter | Thermo Fischer Scientific | 595-4520 | Vacuum filtration of SPR buffers |
| Nickel sulphate | Carl Roth GmbH | T111.1 | Buffer component |
| Novex NuPAGE 4-12% BisTris LDS gels | Invitrogen | NP0336BOX | LDS-PAA gels |
| Novex X-cell Mini Cell | Invitrogen | EI0001 | PAGE chamber |
| NuPAGE 20x running buffer | Invitrogen | NP0002 | Buffer concentrate |
| NuPAGE antioxidant | Invitrogen | NP0005 | Antioxidant |
| PageRuler protein ladder (10-180 kDa) | Invitrogen | 26616 | Protein standart |
| Perforated bucked | n/a | n/a | Blanching |
| PH 3110 | WTW | 2AA110 | PH meter |
| PowerPac HC | Biorad | 1645052 | Electrophoresis module |
| Protein A from Staphylococcus aureus | Sigma-Aldrich | P7837-5MG | Coating of SPR chips |
| Sephadex G-25 fine, cross linked dextran | GE Helthcare | 17003301 | Chromatography resin |
| Silicone spoon | n/a | n/a | Spoon |
| Simply Blue SafeStain | Invitrogen | LC6060 | Gel staining solution |
| Sodium acetate | Carl Roth GmbH | 6773.1 | Buffer component |
| Sodium acetate | Carl Roth GmbH | X891.1 | Media component |
| Sodium azide | Sigma Aldrich | S2002-100G | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Buffer component |
| Sodium citrate | Carl Roth GmbH | HN13.2 | Buffer component |
| Sodium bisulfite | Carl Roth GmbH | 243973-100G | Media component |
| Sodium phosophate | Carl Roth GmbH | T877.2 | Media component |
| SPR Affinity Sensor - High Capacity Amine | Sierra Sensors GmbH/Bruker Daltonics | SPR-AS-HCA | SPR chip |
| SPR-2/4 Surface Plasmon Resonance Analyzer | Sierra Sensors GmbH/Bruker Daltonics | n/a | SPR device |
| SSM3 | Stuart | 10034264 | Mini Gyro-rocker |
| Heated vessel, 20 L | Clatronic | n/a | Blanching chamber |
| Sterile syringes, 2 mL | B. Braun | 4606027V | Syringes |
| Syringe adpter (Union Luer F) | GE Helthcare | 181112-51 | Syringe adapter |
| TE6101 | Sartorius | TE6101 | Precision scale |
| Tween-20 (Polysorbate) | Merck | 8170721000 | Buffer component |
| Unicorn 6.4 | GE Helthcare | 29056102 | Chromatography software |
| Vacuum bags | Ikea | 203.392.84 | Plant storge |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Vortex-Genie 2 | Scientific industries | SI-0236 | Vortex |
| XK-26/20 column housing | GE Helthcare | 28-9889-48 | Chromtography column |
Ссылки
- Kesik-Brodacka, M. Progress in biopharmaceutical development. Biotechnology and Applied Biochemistry. 65 (3), 306-322 (2018).
- Ecker, D. M., Jones, S. D., Levine, H. L. The therapeutic monoclonal antibody market. MAbs. 7 (1), 9-14 (2015).
- Jayapal, K., Wlaschin, K. F., Hu, W. S., Yap, M. G. S. Recombinant Protein Therapeutics from CHO Cells - 20 Years and Counting. Chemical Engineering Progress. 103, 40-47 (2007).
- Kunert, R., Reinhart, D. Advances in recombinant antibody manufacturing. Applied Microbiology and Biotechnology. 100 (8), 3451-3461 (2016).
- Rühl, C., Knödler, M., Opdensteinen, P., Buyel, J. F. A linear epitope coupled to DsRed provides an affinity ligand for the capture of monoclonal antibodies. Journal of Chromatography A. 1571, 55-64 (2018).
- Edgue, G., Twyman, R. M., Beiss, V., Fischer, R., Sack, M. Antibodies from plants for bionanomaterials. Nanomedicine and Nanobiotechnology. 9 (6), e1462 (2017).
- Buyel, J. F., Fischer, R. Very-large-scale production of antibodies in plants: The biologization of manufacturing. Biotechnology Advances. 35 (4), 458-465 (2017).
- Bolton, G. R., Mehta, K. K. The role of more than 40 years of improvement in protein A chromatography in the growth of the therapeutic antibody industry. Biotechnology Progress. 32 (5), 1193-1202 (2016).
- Kelley, B. Industrialization of mAb production technology: the bioprocessing industry at a crossroads. MAbs. 1 (5), 443-452 (2009).
- Brochier, V., Ravault, V. High throughput development of a non protein A monoclonal antibody purification process using mini-columns and bio-layer interferometry. Engineering in Life Sciences. 16 (2), 152-159 (2016).
- Arakawa, T., Futatsumori-Sugai, M., Tsumoto, K., Kita, Y., Sato, H., Ejima, D. MEP HyperCel chromatography II: binding, washing and elution. Protein Expression and Purification. 71 (2), 168-173 (2010).
- Barroso, T. B., Aguiar-Ricardo, R. J., Roque, A. C. Structural evaluation of an alternative Protein A biomimetic ligand for antibody purification. Journal of Computer-aided Molecular Design. 28 (1), 25-34 (2014).
- Mazzer, A. R., Perraud, X., Halley, J., O'Hara, J., Bracewell, D. G. Protein A chromatography increases monoclonal antibody aggregation rate during subsequent low pH virus inactivation hold. Journal of Chromatography A. 1415, 83-90 (2015).
- Sack, M., et al. Functional analysis of the broadly neutralizing human anti-HIV-1 antibody 2F5 produced in transgenic BY-2 suspension cultures. FASEB Journal. 21 (8), 1655-1664 (2007).
- Buyel, J. F., Fischer, R. Characterization of Complex Systems Using the Design of Experiments Approach: Transient Protein Expression in Tobacco as a Case Study. Journal of Visualized Experiments. (83), 51216 (2014).
- Trasatti, J. P., Woo, J., Ladiwala, A., Cramer, S., Karande, P. Rational design of peptide affinity ligands for the purification of therapeutic enzymes. Biotechnology Progress. 34 (4), 987-998 (2018).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochemical Engineering Journal. 88, 162-170 (2014).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Current Protocols in Molecular Biology. 76 (Chapter 10), (2006).
- Buyel, F. J., Kaever, T., Buyel, J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5'UTR combination. Biotchnology and Bioengeneering. 110 (2), 471-483 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods in Molecular Biology. 503, 65-88 (2009).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnology Journal. 9 (3), 415-425 (2014).
- Baird, G. S., Zacharias, D. A., Tsien, R. Y. Biochemistry, mutagenesis, and oligomerization of DsRed, a red fluorescent protein from coral. Proceedings of the National Academy of Sciences, USA. 97 (22), 11984-11989 (2000).
- Vrzheshch, P. V., Akovbian, N. A., Varfolomeyev, S. D., Verkhusha, V. V. Denaturation and partial renaturation of a tightly tetramerized DsRed protein under mildly acidic conditions. FEBS Letters. 487 (2), 203-208 (2000).
- Firer, M. A. Efficient elution of functional proteins in affinity chromatography. Journal of Biochemical and Biophysical Methods. 49 (1-3), 433-442 (2001).
- Pabst, T. M., et al. Engineering of novel Staphylococcal Protein A ligands to enable milder elution pH and high dynamic binding capacity. Journal of Chromatography A. 1362, 180-185 (2014).
- Müller, E., Vajda, J. Routes to improve binding capacities of affinity resins demonstrated for Protein A chromatography. Journal of Chromatography B. 1021, 159-168 (2016).
- Shamloul, M., Trusa, J., Vadim, M., Vidadi, Y. Optimization and Utilization of Agrobacterium-mediated Transient Protein Production in Nicotiana. Journal of Visualized Experiments. (86), 51204 (2014).
- Rademacher, T., et al. Plant cell packs: a scalable platform for recombinant protein production and metabolic engineering. Plant Biotechnology Journal. , (2018).
- Saxena, L., Iyer, B. K., Ananthanarayan, L. Purification of a bifunctional amylase/protease inhibitor from ragi (Eleusine coracana) by chromatography and its use as an affinity ligand. Journal of Chromatography. B. 878 (19), 1549-1554 (2010).
- Kurppa, K., Reuter, L. J., Ritala, A., Linder, M. B., Joensuu, J. J. In-solution antibody harvesting with a plant-produced hydrophobin-Protein A fusion. Plant Biotechnology Journal. 16 (2), 404-414 (2018).
- Menzel, S., et al. Optimized Blanching Reduces the Host Cell Protein Content and Substantially Enhances the Recovery and Stability of Two Plant-Derived Malaria Vaccine Candidates. Frontiers in Plant Science. 7 (159), 1-7 (2016).
- Yigzaw, Y., Piper, R., Tran, M., Shukla, A. A. Exploitation of the adsorptive properties of depth filters for host cell protein removal during monoclonal antibody purification. Biotechnology Progress. 22 (1), 288-296 (2006).
- Menzel, S., et al. Downstream processing of a plant-derived malaria transmission-blocking vaccine candidate. Protein Expression and Purification. 152, 122-130 (2018).
- Vöpel, N., Boes, A., Edgü, G., Beiss, V. Malaria vaccine candidate antigen targeting the pre-erythrocytic stage of Plasmodium falciparum produced at high level in plants. Biotechnology Journal. 9 (11), 1435-1445 (2014).
- Lee, C. W., Wang, H. J., Hwang, J. K., Tseng, C. P. Protein thermal stability enhancement by designing salt bridges: a combined computational and experimental study. PLoS ONE. 9 (11), e112751 (2014).
- Zhu, L., Cheng, F., Piatkowski, V., Schwaneberg, U. Protein engineering of the antitumor enzyme PpADI for improved thermal resistance. Chembiochem. 15 (2), 276-283 (2014).
- Khanal, O., et al. Contributions of depth filter components to protein adsorption in bioprocessing. Biotechnology and Bioengineering. 115 (8), 1938-1948 (2018).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5 (2), 138-142 (2014).
- Buyel, J. F. Procedure to Evaluate the Efficiency of Flocculants for the Removal of Dispersed Particles from Plant Extracts. Journal of Visualized Experiments. (110), e53940 (2016).
- Fink, D., et al. Ubiquitous expression of the monomeric red fluorescent protein mCherry in transgenic mice. Genesis. 48 (12), 723-729 (2010).
- Gagnon, P. Technology trends in antibody purification. Journal of Chromatography A. 1221, 57-70 (2012).
- Figueira, M., Laramée, L., Murrell, J. C., Groleau, D., Míguez, C. Production of green fluorescent protein by the methylotrophic bacterium Methylobacterium extorquens. FEMS Microbiology Letters. 193 (2), 195-200 (2001).
- Bornhorst, J. A., Falke, J. J. Purification of proteins using polyhistidine affinity tags. Methods in enzymology. 326, 245-254 (2000).
- Sainsbury, F., Jutras, P. V., Vorster, J., Goulet, M., Michaud, D. A. Chimeric Affinity Tag for Efficient Expression and Chromatographic Purification of Heterologous Proteins from Plants. Frontiers in Plant Science. 7, 141-141 (2016).
- Krupka, M., et al. The Position of His-Tag in Recombinant OspC and Application of Various Adjuvants Affects the Intensity and Quality of Specific Antibody Response after Immunization of Experimental Mice. PLoS ONE. 11 (2), e0148497 (2016).
- Goel, A., et al. Relative position of the hexahistidine tag effects binding properties of a tumor-associated single-chain Fv construct. Biochimica et Biophysica Acta. 1523 (1), 13-20 (2000).
- Tustian, A. D., et al. Development of a novel affinity chromatography resin for platform purification of bispecific antibodies with modified protein a binding avidity. Biotechnology Progress. , (2018).
- Zandian, M., Jungbauer, A. An immunoaffinity column with a monoclonal antibody as ligand for human follicle stimulating hormone. Journal of Separation Science. 32 (10), 1585-1591 (2009).
- Kelley, B. Very large scale monoclonal antibody purification: the case for conventional unit operations. Biotechnology Progress. 23 (5), 995-1008 (2007).
- Petrou, C., Sarigiannis, Y., S, K. o. u. t. s. o. p. o. u. l. o. s. Ch. 1. Peptide Applications in Biomedicine, Biotechnology and Bioengineering. , 1-21 (2018).
- Menegatti, S., et al. Design of protease-resistant peptide ligands for the purification of antibodies from human plasma. Journal of Chromatography A. 1445, 93-104 (2016).
- Rademacher, T., et al. Plant cell packs: a scalable platform for recombinant protein production and metabolic engineering. Plant Biotechnology Journal. , 1-7 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены