Method Article
הכנה לדוגמא להגשת מתקנים פרוטאומניקס וניתוח נתונים שלאחר מכן
In This Article
Summary
אנו מציגים את פרוטוקול התיוג הממוטב המותאם לשני הכוללים מידע מפורט עבור כל אחד מהצעדים הבאים: חילוץ חלבונים, כימות, משקעים, עיכול, תיוג, הגשה למתקן הפרוטאוניקס וניתוחי מידע.
Abstract
טכנולוגיות פרוטאוממית הן מתודולוגיות רבות עוצמה שיכולות לסייע לנו בהבנת מנגנוני פעולה במערכות ביולוגיות על ידי מתן השקפה גלובלית של ההשפעה של מחלה, טיפול, או תנאי אחר על פרוטאום כולו. דו ח זה מספק פרוטוקול מפורט להפקת, כימות, משקעים, עיכול, תיוג וניתוח נתונים שלאחר מכן של דגימות חלבונים. פרוטוקול התיוג הממוטב שלנו דורש ריכוז תוויות תגים נמוך יותר ומשיג נתונים אמינים בעקביות. השתמשנו בפרוטוקול זה כדי להעריך פרופילים של ביטוי חלבונים במגוון של רקמות העכבר (כלומר, לב, שריר השלד, ואת המוח), כמו גם תאים המתורבית מבחנה. בנוסף, אנו מדגימים כיצד להעריך אלפי חלבונים מערכת הנתונים הנוצרת.
Introduction
המונח "פרוטאומניקס" הוגדר לראשונה כאפיון בקנה מידה גדול של משלים החלבון כולו של תא, רקמה או אורגניזם1. מנתח פרוטאוממית מאפשר חקירה של מנגנונים ותהליכים סלולריים המעורבים בפיתוח מחלות, מסלולים טיפוליים, ומערכות בריאות באמצעות טכניקות לבצע כימות יחסית של רמות ביטוי חלבונים2. התיאורים הראשוניים של מחקרים כאלה פורסמו בשנת 1975 והפגינו שימוש בשני מימדים של האלקטרופורזה ג'ל מגנטית (2d-PAGE) למטרה זו1,3. השיטה הדו מפרידה חלבונים המבוססים על תשלום (איזואלקטריים התמקדות, הארה ב) ומסה מולקולרית (נתרן dodecyl סולפט אלקטרופורזה ג'ל לג, או sds-PAGE)4. במשך שנים, השילוב של דף דו-ממדי וספקטרומטר המסה העוקבות המבוצעים על כל רכיב ג'ל היה השיטה הנפוצה ביותר לניתוח ביטוי חלבון בלתי ממוקד, שבוצעה וזיהתה מספר רב של פרופילי חלבון לא ידועים בעבר,5,6. חסרונות כלליים הגישה 2d-עמוד הם שזה זמן רב, לא עובד טוב עבור חלבונים הידרופובי, ויש מגבלות במספר הכולל של חלבונים המשוער בשל רגישות נמוכה7,8.
האיזוטופ היציב תיוג על ידי חומצות אמינו בשיטת התרבות התא (SILAC) הפך הגישה הפופולרית הבאה כדי לזהות ולכמת שפע חלבון בדגימות9. הוא מורכב תיוג מטבולית של תאים שאינם מודבטים בינונית חסר חומצת אמינו חיוניים סטנדרטיים והוא שיושלם עם גרסה מתויג איזוטופ של חומצת אמינו ספציפית זו10. היתרון של טכניקה זו הוא יעילותו ותיוג מדויק9. המגבלה העיקרית של הגישה SILAC היא בעיקר את שיעור הצמיחה של התא מופחת הנגרמת על ידי התאגדות התווית איזוטופ, אשר יכול להיות מאתגר במיוחד בקווי התאים רגיש יחסית מידול מחלות אדם11.
בשנת 2003, הוצגה בפני השדה12טכניקת הפרוטאומיקס החדשנית והאיתנה הכוללת מדבקות בצמד המסה (מתורה). התיוג הכולל הוא שיטה רבת-עוצמה בשל רגישותו המוגברת לזיהוי רמות ביטוי החלבון היחסיות והשינויים בפוסט-שינוי13. מתאריך פרסום זה פותחו ערכות מתורה שיכולות לתייג בו 6, 10, 11 או 16 דגימות. כתוצאה מכך, ניתן למדוד שפע של פפטיד בתנאים מרובים עם שכפול ביולוגי באותו זמן14,15,16. השתמשנו לאחרונה בכולל כדי לאפיין את הפרופיל הפרוטאומית לב של מודל העכבר של תסמונת Barth (BTHS)17. בכך, הצלחנו להפגין שיפור נרחב בפרופילי הלב של העכברים BTHS שטופלו בטיפול גנטי ולזהות חלבונים הרומן המושפעים על ידי BTHS שחשף מסלולים טיפוליים הרומן מעורב cardiomyopathies.
כאן, אנו מתארים שיטה מפורטת לביצוע מערכות מתאר כמותיים מתאר כמותי באמצעות דגימות רקמה או כדורי תא. זה יכול להיות מועיל לבצע את ההכנה לדוגמה ותיוג לפני ההגשה לליבה כי הפפטידים הטריפטיים המסומנים הם יציבים יותר מאשר מדגמים קפואים גולמיים, לא כל הליבות יש ניסיון טיפול בכל סוגי המדגם, והכנת דגימות במעבדה יכול לחסוך זמן עבור ליבות, אשר לעתים קרובות יש יומני חזרה ארוכה. לתיאורים מפורטים של חלק הספקטרוסקופיית ההמוני בתהליך זה נא לראות את קירשבאום ואח ' ו-perumal ואח '18,19.
פרוטוקול ההכנה לדוגמה מורכב מהצעדים העיקריים הבאים: חילוץ, כימות, משקעים, עיכול ותיוג. היתרונות העיקריים של פרוטוקול ממוטב זה הם שהוא מפחית את העלויות של תיוג, משפר את חילוץ החלבון, ומייצר בעקביות נתונים באיכות גבוהה. בנוסף, אנו מתארים כיצד לנתח את נתוני הכולל כדי להקרין אלפי חלבונים במשך זמן קצר. אנו מקווים כי פרוטוקול זה מעודד קבוצות מחקר אחרות לשקול שילוב מתודולוגיה רבת עוצמה זו ללימודיו.
Protocol
הוועדה לטיפול בבעלי חיים מוסדיים ושימוש מאוניברסיטת פלורידה אישרה את כל לימודי החיות.
1. הכנת ריאגנטים
- הכנת מאגר הליזה בחורים (150 mM KCl, 50 mM HEPES pH = 7.4, 0.1% ברנשים, ו 1 מעכב פרוטאז הלוח קוקטייל לכל 50 mL של מאגר). מאגר ללא מעכבי פרוטאז ניתן לאחסן ב 4 ° צ' עד 6 חודשים או מאגר עם מעכבי פרוטאז מאוחסנים ב-20 ° c עד 1 שנה.
- הכינו 100 מילימטר triethylammonium ביקרבונט (TEAB): להוסיף 500 μL של 1 M TEAB כדי 4.5 mL של מים באולטרטהורים.
- להכין 200 mM טריס (2-carboxyethyl) פוספלין הידרוכלוריד (tcep): להוסיף 70 μl של 0.5 M tcep, מגיב הרפתקאות, כדי 70 μl של מים אלקטרופורזה. לאחר מכן להוסיף 35 μL של 1 M TEAB.
- הכינו 5% hydroxylamine: להוסיף 50 μL של 50% הידרוקסילטין כדי 450 μL של 100 mM TEAB.
2. הפקת חלבון
- בודד השריר הארבע ראשי מעכבר מורדמים על פי פרוטוקול IACUC מאושר. הקפא ושמור ב-80 ° צ' או המשך בפרוטוקול לשימוש מיידי.
- חותכים כדי לבודד כ 10 מ"ג של רקמת העכבר טרי או קפוא הארבע. סיבים נפרדים באמצעות מלקחיים כאשר עובדים עם שריר השלד. לחילופין, אם עבודה עם תרביות תאים, השהה מחדש ~ 3 x 106 תאים ב 300 μl של מאגר בחורים לליזה ולדלג לשלב 2.4.
- המגון רקמת להשתמש באמצעות שימוש בשפופרות של 2 מ ל עם מילוי של כ-200 μL של 1 מ"מ מחרוזות/סיליקה ו 500 μL של מאגר הליזה בחורים. למעלה או למטה בהתאם לצורך (למשל, 5 מ ג של רקמות ב 250 μL של מאגר לליזה בחורים).
- לבצע sonication (10x עבור 10 כל אחד עם 50% משרעת ו 30 s מרווחי על קרח) כדי לשחרר חלבון מאוגד ל-DNA. אותן תוצאות השפלה DNA ניתן להשיג גם עם הליזה מזרק על ידי העברת ליפוסט 10x באמצעות מחט של 21 גרם מוצמד ל 1 מזרק mL, או על ידי דגירה הבנאואז (44 U/mL) ב 37 ° צ' עבור 30 דקות.
- צנטריפוגה את הליפוסט ב 16,000 x g עבור 10 דקות ב 4 ° צ' ולהעביר את supernatant לצינור צנטריפוגה חדש.
3. מדידת חלבון
- קבע את ריכוז החלבון של הסופרנטנט באמצעות פרוטוקולים מבוססים (ראה טבלת חומרים).
הערה: מומלץ להשתמש בדגימות ב ≥ 2 μg/μL, אך ניתן להשתמש גם בדוגמאות מרוכזים פחות. אם נעשה שימוש במדגם פחות מרוכז, יהיה צורך לכוונן כראוי את אמצעי האחסון של ריאגנטים הפחתת/הפחתה בשלב 5.1. - הכנת דילול מסוג BSA בעקומה באמצעות מאגר הליזה.
- עקבו אחר הוראות היצרן, ואחרי 15 דקות, קראו את ספיגת הספיגה ב-750 ננומטר.
4. הפחתה/הפחתת טיפול מגיב
- העברת 200 μg של חלבון לכל תנאי לתוך שפופרת צנטריפוגה חדשה ולהתאים לנפח הסופי של 100 μL באמצעות מאגר הליזה בחורים. ניתן לשנות את קנה המידה עד 200 μL כאשר ריכוז החלבון נמוך מדי, אך אל תשכחו לכוונן כראוי את נפח הצמצום/הפחתת הכמות הכימית.
- הוסף 5 μL של 200 mM TCEP ודגימות הדגירה ב 55 ° צ' עבור 1 h.
- מיד לפני השימוש, להכין 375 mM iodoacetamide על ידי המסת שפופרת אחת של iodoacetamide (כלומר, 9 מ"ג) לתוך 132 μL של 100 mM TEAB. הגן על פתרון זה מפני האור.
- להוסיף 5 μL של 375 mM iodoacetamide כדי לדגום את מודטה עבור 30 דקות בטמפרטורת החדר (RT) מוגן מפני אור.
5. מתנול/כלורופורם משקעים20
- הוסף 400 μL של מתנול לכל 100 μL של חלבונים ובקצרה דגימות מערבולת.
- צנטריפוגה ב 9,000 x g עבור 10 s ב RT. זה לשלב נוזלים שהופקדו בצידי הצינורית לדוגמה.
- הוסף 100 μL של כלורופורם לתערובת ומערבולת לזמן קצר. השתמש 200 μL של כלורופורם אם המדגם יש ריכוז גבוה של פוספוליפידים.
- צנטריפוגה ב 9,000 x g עבור 10 s ב RT. זה לשלב נוזלים שהופקדו בצידי הצינורית לדוגמה.
- הוסף 300 μL של מים ומערבולת במרץ. חשוב להשיג פתרון הומוגנית.
- צנטריפוגה ב 9,000 x g עבור 1 דקות בשעה RT. היזהר מאוד להימנע מהפרעה לשכבות בעת העברת הצינורית לארון תקשורת.
הערה: הצינורית מכילה כעת שלושה שלבים: 1) השכבה העליונה (כלומר, סופרנטאנט), תערובת של מים ומתנול; 2) השכבה האמצעית (כלומר, אינטרפאזה), חלבון זירז לבן; ו-3) השכבה התחתונה (כלומר, בשלב התחתון), כלורופורם. - הסר בזהירות את הסופרנטאנט.
- הוסף 300 μL של מתנול לשלב הבין-פאזי והתחתון הנותרים. . מערבולת בחוזקה
- צנטריפוגה ב 9,000 x g עבור 2 דקות ב RT. היזהר מאוד להימנע מהפרעה לשכבות בעת העברת הצינורית לארון תקשורת.
- הסר בזהירות את הסופרנטאנט.
- בעדינות לשאוב כמו נוזל ככל האפשר תחת זרם של אוויר (למשל, באמצעות מרכז ואקום) ב RT עד הגלולה היא רק קצת לח (~ 10 דקות). ככל שהזמן הדרוש יכול להיות שונה עבור כל דוגמה, לבדוק כל 2 דקות כדי להעריך. אחסן את הגלולה ב-80 ° צ' עד לעיבוד נוסף.
6. עיכול החלבון
- השהה מחדש את הגלולה חלבון זירז ב 100 μL של מאגר הליזה TEAB.
הערה: היא אופציונלית למדוד את ריכוז החלבון בשלב זה. - מיד לפני השימוש, להכין 1 μg/μL טריפסין על-ידי הוספת 100 μL של פתרון האחסון טריפסין (50 מילימטר חומצה אצטית) לחלק התחתון של 100 μg טריפסין זכוכית בקבוקון ו דגירה עבור 5 דקות ב RT. לאחסן את המינון הנותר במינונים לשימוש יחיד ב-80 ° c.
- הוסף 2.5 μL של טריפסין לכל 100 μg של חלבון. לעכל את המדגם לילה ב 37 ° c. שלב זה חיוני עבור פתרונות משלימים של החלבון; אל תשנה תנאים אלה. בעקבות העיכול, זה אופציונלי כדי למדוד את ריכוז החלבון באמצעות חלבון סטנדרטי אומר.
7. פפטיד תיוג
- מיד לפני השימוש, באופן מיידי את התווית הערכה הכולל ריאגנטים כדי RT.
- התמוססות כל אחד מהתגים 0.8 mg מסדר הכולל בתוספת 41 μL של הידרוטוניטטריל לכל צינור. מודקון את המיגיב עבור 5 דקות ב-RT עם הורטקנג מדי פעם. צנטריפוגה בקצרה את הצינורות.
הערה: ריכוז של 0.8 מ ג של תג מתורה, הוא בדרך כלל מספיק כדי לתייג שתי קבוצות. חוקרים אחרים, לעומת זאת, הוכיחו כי ריכוז זה ניתן לצמצם עוד יותר ועדיין להניב נתונים אמין15. - הוסף בקפידה 41 μL של התווית מתורה מגיב לכל דוגמה 100 μL.
- מודג את התגובה עבור 1 h ב RT.
- הוסף 8 μL של 5% הידרוקסילטין למדגם ו דגירה עבור 15 דקות כדי להרוות את התגובה.
- פצל את הדגימות לכמויות שוות בשפופרת צנטריפוגה חדשה ואחסן ב-80 ° c.
הערה: בשלב זה הדגימות יציבות וניתן להגיש אותן לספקטרוסקופיית המונים. זה אופציונלי למדוד ריכוז בשלב זה באמצעות החלבון תקן שאומר.
8. ספקטרוסקופיית מסה
- להגיש את הדגימות למתקן פרוטאומניקס (מחקר זה השתמשו במתקן הליבה של UF ICBR פרוטאומניקס), שבו כל הדגימות משולבות ומטוהרים באמצעות סי18 ספין עמודות.
הערה: דונו עם מתקן הליבה כיצד להגיש את הדגימות לפני הכנת אותם כדי לאשר את הצעדים המדויקים שהם מעדיפים עבור שליחה. - בקשו את ההליכים הבאים לכל מדגם משולב: הפקת פאזה מוצקה, מידע מבוסס (SCX, SE), מיקוד, ו-LC-MS/MS (הדרגה 2 h עבור מזהה חלבון, אם > 10QE פלוס).
- לאחר איסוף הנתונים, מתקן הליבה יעבד קובצי RAW באמצעות תוכנה שסופקה על-ידי הספק לזיהוי חלבונים.
9. ניתוח נתונים
- נתונים מועברים בדרך כלל מליבת בחזרה למשתמש בפורמט 7z, אשר יכול לדרוש כ -16 GB של שטח דיסק לכל ערכת נתונים (במקרה זה 11 דגימות). לעיבוד נתונים, ודא שהמחשב זמין ושהוא לפחות 3.4 GHz.
- חלץ קבצים באמצעות מנהל הקבצים של 7-Zip. קבצים אלה שחולצו מכילים נתוני RAW, קובץ בפורמט pdStudy, ו pdResultView קובץ בפורמט. שמור את כל הקבצים לניתוח נוסף.
- הקובץ הפתוח באמצעות פרוטאום הדיסקברי 2.2 תוכנה.
הערה: תבנית הקובץ היא "שם קובץ. pdStudy ימוד". אם "שם הקובץ. pdResultView" נפתח לא ניתן לבחור את דגימת הבקרה. - בחר דגימות בקרה בלוח "דוגמיות".
- פתח תוצאה על-ידי בחירה באפשרות מזהה בלוח "תוצאות ניתוח".
- ייצוא לתוכנת גיליון אלקטרוני.
- שמור נתונים גולמיים (כל החלבונים המזוהים).
- פתח את קובץ תוכנת הגיליון האלקטרוני. פעולה זו תכלול את כל החלבונים שזוהו.
- בקובץ הנתונים של הגיליון האלקטרוני השתמש בפונקציה "Filter" כדי לבצע מסך "חלבון רוזוולט בטוח: משולב" ברמה גבוהה (עמודה B),"#Unique פפטידים" גבוה מ- 2 (עמודה K), ואחד מתוך "יחס שפע" ריק באופן בלעדי (בעמודה של עד W).
- הוסף עמודה עבור החישוב "p-value" עם הפונקציה
= TTEST (קבוצת בקרה, קבוצה ניסיונית, זנבות, סוג) - הוסף עמודה עבור "מובהקות סטטיסטית" עם הפונקציה
= IF (פי-ערך < 0.05, "משמעות", "NS") - השתמש בפונקציה "Filter" כדי להקרין "משמעות סטטיסטית" המציגה "משמעות". התוצאה מראה את החלבונים שנותחו עם המשמעות הסטטיסטית בקבוצת הביקורת והקבוצה הניסיונית.
- קבע באופן משמעותי שפע של ביטוי חלבון גבוה או נמוך יותר בקבוצה הניסיונית בהשוואה לקבוצת הביקורת, הוסף עמודה עבור "תקנה" עם הפונקציה
= IF (ממוצע (קבוצת בפקד) > ממוצע (קבוצת הניסויים), "Upregulated", "הורדת מוסדרים")
10. שיטות להערכת כניסות משמעותיות
- כדי לזהות אינטראקציות חלבונים בחלבון בין הלהיטים המשמעותיים המזוהים במחקרים הללו, השתמשו בכלי החיפוש לצורך שליפת האינטראקציה של גנים/חלבונים (STRING) גירסה 11.021: https://string-db.org/
- כדי לסווג לפי קבוצות (כלומר, תפקוד מולקולרי, תהליכים ביולוגיים, ושיעורי חלבונים) להשתמש בניתוח חלבונים באמצעות קשרים אבולוציוניים (פנתר) מיון התוכנה22: http://www.pantherdb.org/
- כדי לזהות אינטראקציות חלבונים במגוון של מסלולים, להשתמש בתוכנת ניתוח מסלול23.
11. העלאת נתונים פרוטאוממית לבנק מאגר
- כדי לשלוח נתונים פרוטאוליים לזהויות פרוטאומטיקה של מסדי נתונים (גאווה) או לסביבה וירטואלית אינטראקטיבית של ספקטרומטר המסה (MassIVE) כלול את המידע הבא: קבצי רשימת השיא (קבצים מעובדים ספקטרום מסה בתבנית סטנדרטית כגון mzXML, Mzxml, או MGF), קבצי התוצאה (מזהה הספקטרום בפורמט סטנדרטי כגון Mzxml או Mzxml), וקבצי ספקטרום raw (קבצי ספקטרום המוני גולמיים בפורמט לא סטנדרטי או ספציפי לכלי כגון. קבצי RAW או. קבצי WIFF).
- כדי לשלוח, צור חשבון וכלול מידע כגון השתייכות ופרטי פרוייקט. לאחר מכן, בחר את הקבצים המפורטים בשלב 11.1 והעלה אותם.
- כדי ליצור ערכת נתונים רשמית, הפעל זרימת עבודה של השליחה בקבצים אלה שהועלו.
הערה: לאחר השליחה, ערכת הנתונים תהיה פרטית בבנק המאגר. עם האפשרות הפרטית, הנתונים זמינים רק למשתמשים מורשים. קיימות שתי אפשרויות נוספות: 1) ערכת נתונים משותפת, המספקת גישה לבודקים יומן ולמשתפי פעולה; או 2) ערכת נתונים ציבורית, שתופיע בחיפושי נתונים ציבוריים. תכונה חשובה נוספת של מאגרים אלה היא היכולת לעדכן את הנתונים שהועלו ולשייך את הפרסומים הבאים עם ערכת הנתונים הקיימת.
תוצאות
תאים בריאים וחולים היו לאחר מאגר בחורים, הכין כמפורט בשיטה שלנו תיוג מציון, והוגשה לאוניברסיטת פלורידה המרכז הבינתחומי למחקר ביוטכנולוגיה (UF-ICBR) פרוטאומניקס ליבה עבור כרומטוגרפיה נוזלית עם ספקטרומטר מסה מאסיבית. בעקבות רכישת נתונים ומשלוח מהמרכז, ערכת הנתונים נפתחה בתוכנה שסופקה על-ידי היצרן ומסנני הקיצוץ הבאים הוחלו: ≥ 2 פפטידים ייחודיים, יוני עיתונאי עבור כל דגימת חלבון הקיימת בכל הערוצים, וכוללים רק חלבונים ששונו באופן משמעותי (p ≤ 0.05). טבלה 1 מסכמת את הנתונים: 39,653 כולל פפטידים, אשר 7,211 יש שווה או גדול יותר משני פפטידים ייחודיים, ו 3,829 כוללים יוני כתב עבור כל הערוצים. ערכי p עבור אלה 3,829 פפטידים חושבו על ידי מבחן t של הסטודנט p ≤ 0.05 נחשב משמעותי. בנוסף, חיתוך שינוי קיפול שימש כדי לקבוע את ההתפלגות היחסית של חלבונים מפני חולים בהשוואה לתאים בריאים: מוסדרות (כחול) או upregulated (אדום) (איור 1).
הרשימה של ביטוי חלבון באופן משמעותי מוסדר הוערך באמצעות מערכת הדיאונטולוגיה של הפנתר וניתוחי מחרוזות. ניתוח הפנתר הראה רשימה מחולקת לקטגוריות של חלבונים המבוססים על נמוך באופן משמעותי (איור 2א) או שפע גבוה יותר בתאים חולים המבוססים על פונקציה מולקולרית (איור 2ב). ניתוח מחרוזות של חלבונים בעלי מספר נמוך באופן משמעותי (איור 2ג) ומעלה (איור 2ד) שפע זיהה אינטראקציות מרובות ואסוציאציות חזקות בין חלבונים.
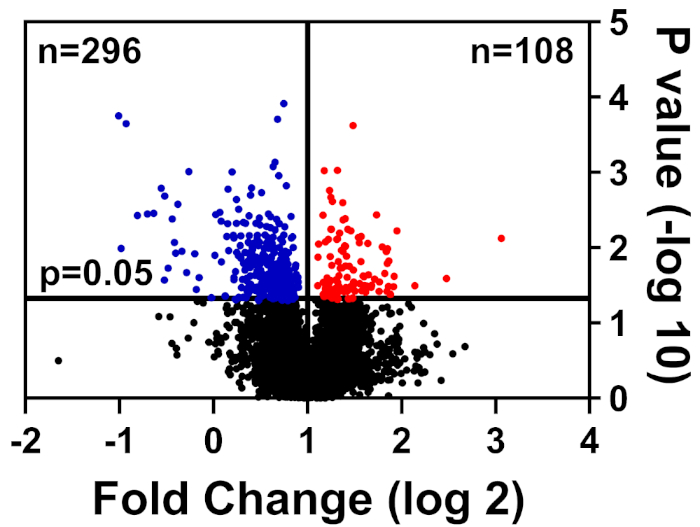
איור 1: העלילה הר הגעש הצגת חלבונים אשר השפע לא שונה באופן משמעותי (שחור), הוריד באופן משמעותי (כחול), או גדל באופן משמעותי (אדום) בתאי בקרה לעומת חולה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
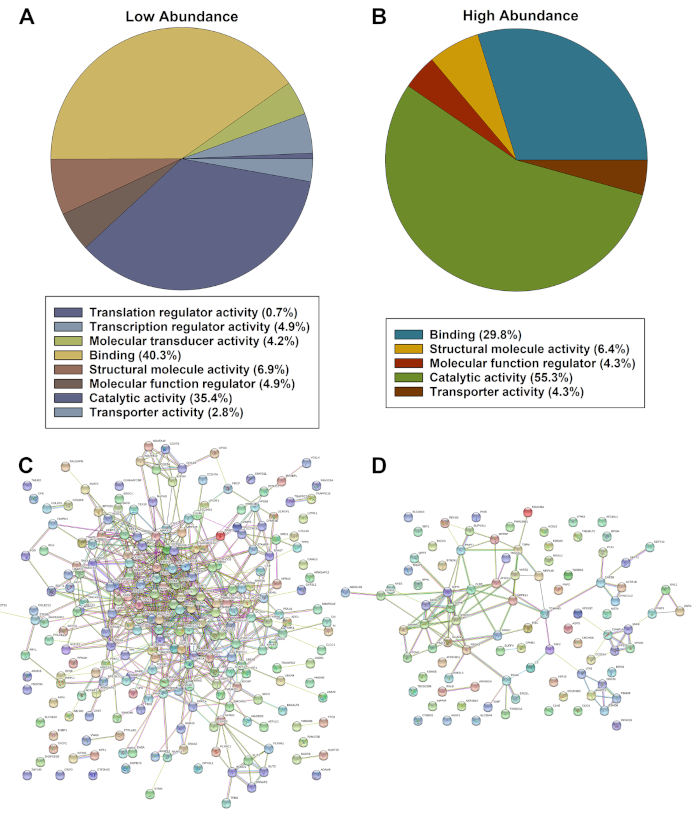
איור 2: הערכות מייצגות של להיטים מוסדרים באופן משמעותי המזוהים על ידי פנתר (A, B) ו-String (C, D) של חלבונים שפע נמוך או גבוה באופן משמעותי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| פפטידים כולל | סה כ זוהו | ≥ 2 פפטידים ייחודי | חלבונים בעלי כימות | חלבונים ששונו באופן משמעותי | |
| נמוך | גבוהה | ||||
| 39653 | 7211 | 4457 | 3829 | 296 | 108 |
טבלה 1: טבלה מייצגת של חלבונים הניתנים לכימות לכל ניתוח של ערכת נתונים.
Discussion
כדי להכין בהצלחה דוגמאות לניתוח פרוטאומית באמצעות מתודולוגיות מבוססות מחקר של מתודולוגיה יציבה מבוססת על מערכות חלבונים, חשוב לבצע עקירת חלבון בזהירות רבה ב-4 ° c ולהשתמש במאגר פירוק המכיל קוקטייל מעכב פרוטאז24,25. הקוקטייל מעכב פרוטאז הוא מגיב מכריע כדי למנוע השפלה חלבון בלתי צפוי במהלך עיכול החלבון. הבדל מפתח אחד בין הפרוטוקול שלנו לבין הנוכחי שסופק על ידי הספק הוא שאנו ממליצים בחום על השימוש במאגר הליזה בחורים המבוססים על הניסיון שלנו עם תאים ורקמות. אנו מציעים גם באמצעות גישה משקעים מתנול/כלורופורם חלבון עבור כדורי תא ורקמות.
באופן אידיאלי, חילוץ חלבונים, מדידה, הפחתה/הפחתת טיפולים מגיב, ו מתנול/כלורופורם מצמצמים מבוצעים באותו יום. לאחר המלצה זו תגרום לריכוזי חלבון מדויקים יותר עבור תיוג הבאים. צעד המשקעים בחלבון חשוב להסרת ריאגנטים שיתערב בספקטרומטר מסה דו-מושביים. כולל שלב המשקעים מגביר באופן משמעותי את הרזולוציה של הכולל26. בסיכום, היתרונות העיקריים של פרוטוקול התורה שלנו הם היעילות של התיוג הגבוה לסוגים שונים של דגימות, התוכונות והנתונים האמינים שנרכשו.
כמו הטבע של האסטרטגיה הפרוטמניקה מתורה זו ממשיכה להתרחב, זה יהיה בהדרגה לשפר את היכולת של חוקרים ברחבי מגוון רחב של שדות כדי ליצור תגליות הרומן. במיוחד בתחום ביו-רפואי, אנחנו ואחרים מצאנו את הטכנולוגיה הזאת אינפורמטיבי יותר ויותר במחקרים לחקור מנגנונים חדשניים של פעולה במחלות והשפעות יחסיות של therapeutics שונים. מכל הסיבות הללו, טכנולוגיה רבת עוצמה זו משלימה את הרפרטואר של גישות אחרות של OMICS המשמשות במחקרי מחקר מודרניים ומספקת מידע מפתח שיכול להדריך את ההתפתחות הטיפולית.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
היינו רוצים להכיר את UF-ICBR מתקן פרוטאוניקס על העיבוד שלהם של דגימות שלנו. עבודה זו נתמכת בחלקו על ידי המכון הלאומי לבריאות R01 HL136759-01A1 (CAP).
Materials
| Name | Company | Catalog Number | Comments |
| 1 M Triethylammonium bicarbonate (TEAB), 50 mL | Thermo Fisher | 90114 | Reagent for protein labeling |
| 50% Hydroxylamine, 5 mL | Thermo Fisher | 90115 | Reagent for protein labeling |
| Acetic acid | Sigma | A6283 | Reagent for protein digestion |
| Anhydrous acetonitrile, LC-MS Grade | Thermo Fisher | 51101 | Reagent for protein labeling |
| Benzonaze nuclease | Sigma-Aldrich | E1014 | DNA shearing |
| Bond-Breaker TCEP solution, 5 mL | Thermo Fisher | 77720 | Reagent for protein labeling |
| BSA standard | Thermo | 23209 | Reagent for protein measurement |
| CHAPS | Thermo Fisher | 28300 | Reagent for protein extraction |
| Chloroform | Fisher | BP1145-1 | Reagent for protein precipitation |
| cOmplete, EDTA-free Protease Inhibitor Cocktail Tablet | Roche | 4693132001 | Reagent for protein extraction |
| DC Protein Assay | BioRad | 500-0116 | Reagent for protein measurement |
| Excel | Microsoft Office | Software for data analyses | |
| Heat block | VWR analog | 12621-104 | Equipment for protein digestion incubation |
| HEPES | Sigma | RDD002 | Reagent for protein extraction |
| Methanol | Fisher | A452-4 | Reagent for protein precipitation |
| Pierce Trypsin Protease, MS Grade | Thermo Fisher | 90058 | Reagent for protein digestion |
| Potassium chloride | Sigma | 46436 | Reagent for protein extraction |
| Sigma Plot 14.0 | Sigma Plot 14.0 | Software for data analyses | |
| Sonicator | Fisher Scientific | FB120 | DNA shearing |
| Spectra Max i3x Multi-Mode Detection Platform | Molecular Devices | Plate reader for protein measurement | |
| Thermo Scientific Pierce Quantitative Colorimetric Peptide Assay | Thermo Fisher | 23275 | Reagent for protein measurement |
| Thermo Scientific Pierce Quantitative Fluorescent Peptide Assay | Thermo Fisher | 23290 | Reagent for protein measurement |
| Thermo Scientific Proteome Discoverer Software | Thermo Fisher | OPTON-30945 | Software for data analyses |
| TMT 10plex Isobaric Label Reagent Set 0.8 mg, sufficient reagents for one 10plex isobaric experiment | Thermo Fisher | 90110 | Reagent for protein labeling |
| TMT11-131C Label Reagent 5 mg | Thermo Fisher | A34807 | Reagent for protein labeling |
| Water, LC-MS Grade | Thermo Fisher | 51140 | Reagent for protein extraction |
References
- Graves, P. R., Haystead, T. A. Molecular biologist's guide to proteomics. Microbiology and Molecular Biology Reviews. 66 (1), 39-63 (2002).
- Erdjument-Bromage, H., Huang, F. K., Neubert, T. A. Sample Preparation for Relative Quantitation of Proteins Using Tandem Mass Tags (TMT) and Mass Spectrometry (MS). Methods in Molecular Biology. 1741, 135-149 (2018).
- O'Farrell, P. H. High resolution two-dimensional electrophoresis of proteins. Journal of Biological Chemistry. 250 (10), 4007-4021 (1975).
- Rabilloud, T., Lelong, C. Two-dimensional gel electrophoresis in proteomics: a tutorial. Journal of Proteomics. 74 (10), 1829-1841 (2011).
- Ong, S. E., et al. Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics. Molecular & Cellular Proteomics. 1 (5), 376-386 (2002).
- Anderson, N. G., Anderson, N. L. Twenty years of two-dimensional electrophoresis: Past, present and future. Electrophoresis. 17 (3), 443-453 (1996).
- Haynes, P. A., Yates, J. R. Proteome profiling-pitfalls and progress. Yeast. 17 (2), 81-87 (2000).
- Bunai, K., Yamane, K. Effectiveness and limitation of two-dimensional gel electrophoresis in bacterial membrane protein proteomics and perspectives. Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences. 815 (1-2), 227-236 (2005).
- Sury, M. D., Chen, J. X., Selbach, M. The SILAC fly allows for accurate protein quantification in vivo. Molecular & Cellular Proteomics. 9 (10), 2173-2183 (2010).
- Zhang, G., Neubert, T. A. Use of stable isotope labeling by amino acids in cell culture (SILAC) for phosphotyrosine protein identification and quantitation. Methods in Molecular Biology. 527, 79-92 (2009).
- Wang, X., et al. SILAC-based quantitative MS approach for real-time recording protein-mediated cell-cell interactions. Scientific Reports. 8 (1), 8441 (2018).
- Thompson, A., et al. Tandem Mass Tags: A Novel Quantification Strategy for Comparative Analysis of Complex Protein Mixtures by MS/MS. Analytical Chemistry. 75, 1895-1904 (2003).
- Cheng, L., Pisitkun, T., Knepper, M. A., Hoffert, J. D. Peptide Labeling Using Isobaric Tagging Reagents for Quantitative Phosphoproteomics. Methods in Molecular Biology. 1355, 53-70 (2016).
- Navarrete-Perea, J., Yu, Q., Gygi, S. P., Paulo, J. A. Streamlined Tandem Mass Tag (SL-TMT) Protocol: An Efficient Strategy for Quantitative (Phospho)proteome Profiling Using Tandem Mass Tag-Synchronous Precursor Selection-MS3. Journal of Proteome Research. 17 (6), 2226-2236 (2018).
- Zecha, J., et al. TMT Labeling for the Masses: A Robust and Cost-efficient, In-solution Labeling Approach. Molecular & Cellular Proteomics. 18 (7), 1468-1478 (2019).
- Bachor, R., Waliczek, M., Stefanowicz, P., Szewczuk, Z. Trends in the Design of New Isobaric Labeling Reagents for Quantitative Proteomics. Molecules. 24 (4), E701 (2019).
- Suzuki-Hatano, S., et al. AAV9-TAZ Gene Replacement Ameliorates Cardiac TMT Proteomic Profiles in a Mouse Model of Barth Syndrome. Molecular Therapy - Methods & Clinical Development. 13, 167-179 (2019).
- Kirshenbaum, N., Michaelevski, I., Sharon, M. Analyzing large protein complexes by structural mass spectrometry. Journal of Visualized Experiments. (40), e1954 (2010).
- Perumal, N., et al. Sample Preparation for Mass-spectrometry-based Proteomics Analysis of Ocular Microvessels. Journal of Visualized Experiments. (144), e59140 (2019).
- Wessel, D., Flügge, U. I. A method for the quantitative recovery of protein in dilute solution in the presence of detergents and lipids. Analytical Biochemistry. 138, 141-143 (1984).
- Jensen, L. J., et al. STRING 8--a global view on proteins and their functional interactions in 630 organisms. Nucleic Acids Research. 37, D412-D416 (2009).
- Mi, H., Muruganujan, A., Casagrande, J. T., Thomas, P. D. Large-scale gene function analysis with the PANTHER classification system. Nature Protocols. 8 (8), 1551-1566 (2013).
- Cirillo, E., Parnell, L. D., Evelo, C. T. A Review of Pathway-Based Analysis Tools That Visualize Genetic Variants. Frontiers in Genetics. 8, 174 (2017).
- Plaxton, W. C. Avoiding Proteolysis during the Extraction and Purification of Active Plant Enzymes. Plant and Cell Physiology. 60 (4), 715-724 (2019).
- Ryan, B. J., Henehan, G. T., Walls, D., Loughran, S. T. . Protein Chromatography: Methods and Protocols. , 53-69 (2017).
- Fic, E., Kedracka-Krok, S., Jankowska, U., Pirog, A., Dziedzicka-Wasylewska, M. Comparison of protein precipitation methods for various rat brain structures prior to proteomic analysis. Electrophoresis. 31 (21), 3573-3579 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved