Method Article
הערכת היכולת הייחודית ביותר לגיל מיוחד למבוגרים דרוזופילה מלאנוטציטים באמצעות שיטת בVivo פגוציטוזה
In This Article
Summary
פרוטוקול זה מתאר בvivo של פאיגוציטוזה המשמש להערכת ולכמת את היכולת של דרוסופילה מלאנוזוזה בגיל צעיר ומיושן לחיידק הפאגוציטוז.
Abstract
Phagocyציטוזה היא פונקציה חיונית של התגובה החיסונית מולדת. תהליך זה מבוצע על ידי הומוציטים phagocytic אשר תפקידה העיקרי הוא לזהות מגוון רחב של חלקיקים ולהרוס פתוגנים מיקרוביאלית. כמו בגיל האורגניזמים, תהליך זה מתחיל לרדת, אך מעט ידוע על המנגנונים הבסיסיים או את הבסיס הגנטי של החיסוני. כאן, זריקה המבוססת על הvivo של phagocyציטוזה משמש להערכת שינויים הקשורים גיל בהיבטים שונים של phagocyציטוזה, כגון קשירה, השפלה והשפלות של חלקיקי הפנפניט, על ידי החלפת אירועים מסוג phagocytosis ב הומוציטים אצל מבוגרים דרוזופילה. דרוזופילה מלאנוגסטר הפך למודל אידיאלי כדי לחקור שינויים הקשורים גיל בתפקוד החיסוני הטבוע מסיבות רבות. עבור אחד, מרכיבים גנטיים רבים ופונקציות של התגובה החיסונית מולדת, כולל phagocyציטוזה, הם שמרו אבולוציונית בין היונקים האלה. בגלל זה, התוצאות שהתקבלו משימוש בפרוטוקול זה צפויים להיות רלוונטיים באופן נרחב כדי להבין את גיל שינויים הקשורים בתפקוד החיסוני במגוון של אורגניזמים. בנוסף, אנו מודעים לכך ששיטה זו מספקת הערכות כמותיים של יכולת phagocytic, אשר יכול להיות שימושי עבור מגוון של נושאי מחקר, ולא צריך להיות מוגבל למחקרים של הזדקנות.
Introduction
המערכת החיסונית הטבועה, המורכבת ממחסומים פיזיים וכימיים לזיהום, כמו גם רכיבים סלולריים, הוא שימור אבולוציוני על פני אורגניזמים רב-תאיים1,2. כמו קו ההגנה הראשון, מערכת החיסון מולדת משחק תפקיד קריטי במאבק הפולשים פתוגנים בכל החיות1,2,3. המרכיבים של התגובה החיסונית מולדת כוללים מגוון רחב של סוגי תאים אשר מסווגים על בסיס כי הם חסרים ספציפיות זיכרון אימונולוגיים2,3,4. בבני אדם, סוגי תאים אלה כוללים מונוציטים phagocytic ו מקרופאגים, נויטרופילים, ו ציטוטוקסיים טבעי הרוצח תאים4,5. בעוד שיש מערכת חיסונית תפקודית היא הכרחית עבור הישרדות מארח, ברור כי הפונקציה של תאים חיסוניים ירידות עם הגיל, תופעה הידועה בשם חיסוני5,6. היכולת להעריך את השינויים הקשורים בגיל בתגובה החיסונית, כולל היבטים שונים של תהליך של phagocyציטוזה, יכול לסייע ההבנה שלנו של המערכת החיסונית. ההליך שאנו מתארים כאן מספק גישה יעילה לשחזור להעריך ולכמת אירועים phagocytic ידי הומוציטים ב Drosophila ילה melanogaster.
דרוזופילה היא מודל אידיאלי לחקר התגובה החיסונית מסיבות רבות. עבור אחד, יש קבוצה נרחבת של כלים גנטיים זמינים אשר מאפשרים לתמרן בקלות ביטוי גנים בצורה תלוית רקמות7. כלים אלה כוללים אוסף של מוטציות, RNA הפרעות מניות, GAL4/UAS מניות, ואת Drosophila פאנל התייחסות גנטית המכילה 205 שונים שורות שונות שעבורן רצפי הגנום כולו מקוטלגים8. מחזור החיים הקצר של דרוסופילה והמספר הגדול של אנשים שיוצרו מאפשרים לחוקרים לבדוק אנשים מרובים בסביבה מבוקרת, בפרק זמן קצר. זה משפר מאוד את היכולת לזהות הבדלים עדינים בתגובות החיסונית לזיהום בין גנוטיפים, בין המינים או לאורך הגילאים. חשוב מכך, רכיבים גנטיים רבים ופונקציות של התגובה החיסונית מולדת, כולל phagocyציטוזה, הם שימור אבולוציונית בין מדרוזוהילה ויונקים1,2.
בדרוזופילה, תהליך הפייגוציטוזה הנובע מזיהום מבוצע על ידי המטוציטים phagocytosis המכונה פלמטוציטים, אשר שוות ערך למקפאגים של יונקים9. הומוציטים חיוניים לזיהוי מגוון רחב של חלקיקים וניקוי פתוגנים מחיידקים9,10,11,12,13. תאים אלה לבטא מגוון של קולטנים שחייבים להבדיל את עצמי מפני לא עצמית, וליזום אירועים איתות הדרושים כדי לבצע את התהליך phagocytic10,11,12,13,14,15. לאחר חלקיק מאוגד, הוא מתחיל להיות הפנימו על ידי ארגון משנה של שלד אקטין ושיפוץ של קרום פלזמה להתרחב סביב החלקיקים, ויצרו גביע phagocytic11,12,13,14. במהלך תהליך זה, קבוצה נוספת של אותות מורה לתא להפנים את החלקיקים עוד על ידי סגירת הגביע phagocytic, ויוצרים ממברנה מאוגד phagoכמה11,12,13,14,15. Phagosome לאחר מכן עובר תהליך התבגרות, שיוך עם חלבונים שונים ומיזוג עם ליסוזומים, ויצרו phagolyso, חומצי חומציים11,12,13,14,15. בשלב זה, חלקיקים יכולים ביעילות להיות מושפל ומסולק11,12,13,14,15. מחקרים דרוזוהילה חשפו כי זבובים מבוגרים יותר (4 שבועות של גיל) יש יכולת מופחתת לנקות זיהום בהשוואה לזבובים צעירים (בן שבוע אחד), כנראה בשל, לפחות בחלק, לירידה בהיבטים מסוימים של phagocyציטוזה16,17.
השיטה המתוארת כאן משתמשת בשני חלקיקים שאינם מתויג בחום של החיידק הקולי , האחד הנושא את מערכת האנטי-וולופפור הסטנדרטית, והוא בעל החומציות הרגישה, כדי להעריך שני היבטים שונים של פאגוציטוזה: הדבר הראשוני של חלקיקים, ואת השפלה של חלקיקים phagolyso, בתוך הקפדה זו, פלואורו-חלקיק פלואורסצנטית הוא הנצפה כאשר החלקיקים מאוגדים ונבלע על-ידי הומוציטים, ואילו חלקיקי ה-pH רגישים בלבד בתנאי ה-pH נמוך של phagosome. אירועי פלורסנט ניתן לצפות הומוציטים הנמצאים לאורך כלי הקיבול. אנו מתמקדים הומוציטים מקומי לכלי הקיבול, אשר מספקים נקודת ציון אנטומית לאתר הומוציטים אשר ידועים לתרום לסיווג חיידקי, ולבודד אותם בעקביות. עם זאת, הומוציטים בחלקים אחרים של הגוף המוליקמ הם גם חשובים עבור סיווג. למרות שאנחנו לא למדו את האוכלוסייה הזאת התאים, ההליך הכללי שלנו יכול להיות ישים עבור phagocytic בחני ספר של תאים אלה גם. אחד היתרונות של הגישה שלנו הוא שאנחנו יכולים לכמת אירועים phagocytic בתוך הומוציטים בודדים, המאפשר לנו לזהות וריאציה עדינה בתהליכים phagocytic. מחקרים אחרים המדמיינים את אירועי הפלורסנט דרך הקוטיקולה18,19 אין להתחשב בהבדלים במספרי הומוציטים הנוכחים, שחשוב במיוחד לשקול במקרה שלנו כספירות מוחלטת של הומוציטוט צפויים להשתנות עם הגיל17.
Protocol
1. איסוף וגיל דרוזופילה
- כדי ליצור זבובים בגילאי F1 לבדיקת phagocyציטוזה, להוסיף 5-10 נקבות הבתולה ו 5 הזכרים של גנוטיפים המתאימים לבקבוקון המכיל מזון לעוף טרי. אנחנו משתמשים בארוחה תירס אגר מזון המבוסס על20, אבל את השיטה צריך לעבוד ללא קשר לסוג של דיאטה הזבובים הם גדלו. לניסוי זה השתמשנו Hemese (הוא)-GAL4; . הומוציטים בצורה גנטית
הערה: ניתן להשתמש בזבובים נוספים, אך קווים מסוימים של D. melanogaster עשויים שלא להזדווג או להתרבות היטב כאשר צפוף, וצפיפות יתר עלולה להיות השפעות שליליות על התפתחות הזחל21 ו phagocyציטוזה. - שמרו על זבובים תחת התנאים הניסיוניים הרצויים. לניסוי זה, לשמור על הוא-GAL4; המלון טס ב -24 ° c. אפשר למבוגרים זבובים להזדווג במשך שבוע, ולאחר מכן להסיר מבוגרים. זבובים F1 לאחר מכן ייאספו מבקבוקונים אלה לאחר eclosion לשימוש ניסיוני.
- לאסוף זבובים בתולה במהלך השבוע, או עד המספר המבוקש של זבובים נאספים. בתולות אינן נדרשות; עם זאת, ההזדווגות עלולה להשפיע על התגובה החיסונית. אם יש לבחון את הזבובים של F1 כבתולות, זכרים נפרדים ונקבות בתוך 8 שעות של הפקיון ולתחזק בבקבוקונים נפרדים כדי למנוע הזדווגות. לאסוף מספיק זבובים כדי לאפשר הערכה של phagocyציטוזה בלפחות 10 זבובים לכל גנוטיפ/טיפול/מין לגיל.
- אם הזדקנות זבובים לשבוע אחד, לאסוף לפחות 50 זבובים סך הכל, או 20 זבובים לכל תנאי טיפול עבור כל חלקיק, או fluoro-חלקיקים או החלקיקים הרגישים pH, כדי להיות מוזרק. פעולה זו תבטיח לפחות 10 זבובים לתוך הזמן בניסוי.
- אם הזדקנות זבובים יותר מ 3 שבועות, לאסוף לפחות 100-150 זבובים סך הכל, או 50-75 זבובים לכל תנאי טיפול כדי להבטיח שיש מספיק זבובים זמינים כדי למדוד phagocyציטוזה. כאשר הזדקנות זבובים במעבדה, אנחנו בדרך כלל משתמשים בכלובים חרקים מתוחזקים 24 ° צ' ב 12:12 L:D תנאים. ולהחליף את האוכל בכל יום אם נעשה שימוש בבקבוקונים במקום בכלובים, הטיפ טס לבקבוקונים חדשים כל 3-5 ימים, תלוי במצב המזון בבקבוקון. מספר הזבובים הדרושים יהיה תלוי עד כמה מאוחר בגיל phagocyציטוזה יהיה מנותח, ואת שיעורי ההישרדות הספציפיים לגיל של גנוטיפ זה במצב סביבתי מסוים.
- אם מוערך זבובים צעירים ומבוגרים, תכנן בהתאם, כך שבאותו היום יוזריקו זבובים בני שבוע וותיקים. זה יהיה למזער וריאציות בריכוז חלקיקים בין ניסויים להבטיח כי ההשפעה של הגיל על המדידה phagocytic לא מבולבל עם ההשפעה של היום את היכולת בוצעה.
- הבית את הזבובים שנאספו ב 24 ° צ' עד שהם 5-7 ימים, או לשמור את הזבובים לגיל הרצוי.
2. להכין חלקיקים בעלי תווית שכותרתו
- מהווים מחדש את החום e. coli fluoro-חלקיקים או PH רגישות e. coli חלקיקים לריכוז מניות של 20 מ"ג/ml או 1 מ"ג/ml, בהתאמה. חיידקים אחרים זמינים לשימוש זה עשוי להיות מתאים יותר עבור ניסויים מסוימים, אך עיין הוראות היצרן עבור ריכוזי מניות המתאים.
- עבור fluoro-חלקיקים, להוסיף 990 μL של 1x PBS (pH 7.4) או מאגר מועדף 10 μL של 2 מ"מ (20%) נתרן עזידה. . מערבולת לערבב
הערה: נתרן עזידה הוא חומר משמר שעשוי להיות מושמט; עם זאת, חלקיקים שהוכנו ללא נתרן אזיד לא להימשך זמן רב. Fluoro-חלקיקים יש להשתמש בתוך 24 שעות ו-pH החלקיקים הרגישים יש להשתמש בתוך 7 ימים. - עבור חלקיקים רגישים pH, להוסיף 1,980 μL של 1x PBS (pH 7.4) או מאגר מועדף 20 μL של 2 מ"מ (20%) נתרן עזידה. . מערבולת לערבב
- בצע מספר שימוש מרובה בודד 20 μL לשימוש בצינורות מיקרוצנטריפוגה 1.5 mL. החנות fluoro-חלקיקים ב-20 ° c עבור עד שנה, ו-pH רגיש חלקיקים ב 4 ° צ' עד 6 חודשים, מוגן מפני אור.
- עבור fluoro-חלקיקים, להוסיף 990 μL של 1x PBS (pH 7.4) או מאגר מועדף 10 μL של 2 מ"מ (20%) נתרן עזידה. . מערבולת לערבב
- ביום של זריקות, להסיר נתרן אזיד מן החלקיקים לפני השימוש. כדי לעשות זאת, צנטריפוגה את החלקיקים עבור 5 דקות ב 15,000 x g בטמפרטורת החדר.
- הסר את supernatant ולשטוף את החלקיקים פעמיים על ידי השעיית מחדש ב 50 μL של 1x PBS או מאגר מועדף, ו צנטריפוגה עבור 5 דקות ב 15,000 x g.
- לאחר השטיפה השנייה, הסר את החלקיקים הסופרנטאנט והשהה מחדש את חלקיקי ה100 μL של המאגר המועדף על 1x PBS או מאגר מועדף. שמרו על הפתרון בשפופרת ומזער את החשיפה לאור במהלך הניסוי. ברגע שהסיר את הנתרן, השתמש fluoro-חלקיקים בתוך 24 h, ולהשתמש בחלקיקים רגישים pH בשימוש בתוך 5-7 ימים.
הערה: בניסויים הקודמים שלנו, מצאנו כי ריכוז זה של חלקיקים סיפק מספרי ספירות של האירועים phagocytic וכי מספר החלקיקים הזמינים עבור phagocytic על ידי הומוציטים לא הגבלת17. עם זאת, משתמשי פרוטוקול זה עשויים לרצות להשוות את התוצאות באמצעות ריכוזים אחרים כדי להבטיח כי יש מספר הולם של חלקיקים זמינים עבור phagocyציטוזה על ידי הומוציטים בתנאים של הניסויים שלהם.- אם נתרן אזיד הושמט, לדלל את החלקיקים 1:5 באותו מאגר החלקיקים הוכנו, עבור זריקות.
- הוסף טיפה (~ 10 μL) של צביעה מאכל ירוק לחלקיקים. כך קל יותר לוודא. שהוזרקו את הזבובים
3. הכנס את הזבובים
- הכינו מחטי זכוכית לזריקות.
- למשוך מחטי זכוכית. בעזרת מיכל הצינורות הגדר את מחמם הצינורות מ55 ° c והסולנואיד ל 45. השתמשו רק במחטים שסופקו עם מזרק, משום שאין זה מובטח שמחטים אחרות יעבדו עם אותו דיוק.
- למלא מזרק סטרילי 1 מ ל עם שמן מינרלי, ולצרף את 30 מד תת-עורית (G) מחט, המסופקים עם ננו מזרק.
- Backfill את המחט נימי משכו על ידי החדרת המחט 30 גרם לקצה קהה של מחט זכוכית משכה ומילוי עם שמן מינרלי. לאט להסיר את המחט 30 G, להבטיח כי אין בועות אוויר לאורך המחט, כמו זה יכול לגרום כרכים הזרקה מדויק. מזרק לא יעבוד כראוי ללא גב מילוי המחט.
- באמצעות מלקחיים, לשבור את קצה המחט כדי ליצור פתח כדי לאפשר פליטה של הפתרון.
- . תאספו את הננו-מזרק
הערה: ניתן להשתמש במזזרקים אחרים. השיטה המתוארת להלן חלה על הננו-מזרק. עבור מרססים אחרים, עיין במדריך למשתמש לקבלת הוראות.- הגדר את המזרק לכרך הרצוי (בין 46 nL ו 69 nL).
- הסר את הקולתן והניחו את האיטום O-ring, הרווח הלבן עם ההזחה הפונה כלפי מעלה כדי לקבל את הקצה האחורי של המחט, ואת הטבעת הגדולה על הבוכנה המתכת, בסדר זה. חבר מחברו את הקולטן מבלי להדק אותו.
- הכנס את הבוכנה לתוך הקצה הקהה של מחט הזכוכית המלאה בשמן. דחף בעדינות את המחט למטה, והכנס אותו לתוך הטבעת הגדולה יותר. . הדקו את הקולר עד שיהיה בטוח
הערה: אם הבוכנה אינה מאריכה את הקולר, לחץ והחזק את ' ריק ' עד שהבוכנה תהיה גלויה. כך קל יותר להבטיח את הבוכנה מוכנס לתוך המחט. - לחץ והחזק את ' ריק ' עד שהזרק מצפצף. זה פולט את רוב שמן מינרלי מן המחט, משאיר נפח קטן של שמן לפעול כמכשול בין שני הנוזלים, כמו גם מסיר בועות אוויר.
- ממלאים את המחט עם או fluoro-חלקיקים או החלקיקים הרגישים pH על ידי הוספת קצה מחט זכוכית לתוך הצינורית מיקרוצנטריפוגה המכילה את החלקיקים המוכנים.
- לחץ והחזק את ' מילוי ' עד שהזרק מצפצף.
- זריקות
- להעביר את הזבובים כי יש להזריק לתוך בקבוקון ריק. לשתק את הזבובים על ידי הצבת הבקבוקון בקרח. CO2 יכול לשמש גם כדי לשתק את הזבובים. עם זאת, שים לב, כאשר באמצעות חלקיקי pH רגישים, שיתוף מוגבה2 רמות יכול באופן מלאכותי acidify כל המאגרים בשימוש והוא יכול לרומם את הרקע של זריחה.
- הכנס את הזבובים בצלחת הסטרפלבית של בית החזה (איור 1A). ההזרקה מוצלחת אם הצבע הירוק נראה נכנס לתוך הזבוב (איור 1B). אם הזבוב לא הופך לירוק, ודא שהמחט אינה סתומה.
הערה: לחילופין, זבובים יכולים להיות מוזרק בבטן, אבל לשמור על אתר ההזרקה עקבי בכל הניסויים. - מניחים זבובים לתוך בקבוקון מזון חדש, לציין את הזמן כי הראשון והאחרון הוזרק. כדי למזער את השגיאה הניסיונית בשל כמות הזמן שלוקח להשלים זריקות, זריקות להשלים בזמן. עם התרגול, זה צריך לקחת לא יותר מ 10 דקות להזריק סט אחד של זבובים. הנח את הבקבוקון על צידו עד שכל הזבובים החלימו, כדי למנוע מהזבובים להיתקע באוכל.
- אפשר לזבובים להתאושש 60-90 דקות, בהתאם לתנאים הניסיוניים. כאן, נעשה שימוש בזמן התאוששות של 60 דקות. לידיעתכם, טווח זמן ההחלמה הזה היה אופטימלי לספירת אירועי phagocytic בתנאים הניסיוניים של הקרן והמחקר17. עם זאת, בתנאים מסוימים, זה עשוי להיות ארוך מדי כדי לזהות הבדלים עדינים בין קבוצות הטיפול. זה עשוי להיות שימושי כדי לבצע ניסויים בקורס זמן כפי שנעשה בעבר17 כדי לקבוע את זמן ההחלמה שיגלה הבדלים מרביים בין שליטה ותוצאות ניסיוני. כל זמן ההחלמה נבחר, שמור על זה עקבי בכל הטיפולים הניסיוניים.
- במקרה של הזרקת פלואורו-חלקיקים ו-pH רגישים באותו יום, השתמשו במחט חדשה לכל פתרון. אין להזריק זבובים בודדים עם שני החלקיקים אם הם שניהם לזוהר אדום, מאז התוצאה לא יהיה להבדיל בין שני ההיבטים של phagocyציטוזה, כריכת חלקיקים/שריפת החלקיקים vs. חלקיק ב phagoחלקן.
4. מבתר את כלי הקיבול
- לאחר שהזבובים התאושש 60-90 דקות, להעביר את כל הזבובים חי לבקבוקון ריק לשתק על הקרח.
- העבר זבוב אחד בכל פעם אל צלחת חיתוך אלסטונר סיליקון.
הערה: הכינו את לוחיות הניתוח לפחות שבוע לפני השימוש, אם יש לרפא בטמפרטורת החדר. כדי לעשות זאת, להכין את האלסטומר ולשפוך אותו לתוך 33 מ"מ x 10 מ"מ צלחת פטרי, מילוי המנה בחצי הדרך. הקש בעדינות על המנה על משטח שטוח כדי למזער את בועות האוויר. תנו ללוחות לשבת בטמפרטורת החדר, ללא הפרעה, למשך שבוע לפחות.- , מתחת למיקרוסקופ סטריאו. מכוון את הצד הגעף למעלה
- באמצעות סיכות חרק, להצמיד את הזבוב אל הצלחת על ידי החדרת סיכה אחת דרך בית החזה ועוד סיכה דרך הקצה האחורי ביותר של הבטן, ליד אברי המין (איור 2A). זה יכול להיות שימושי כדי לחתוך את הפינים לחצי לפני הצמדת הדגימה כדי לא לחסום את הקרע. חזור על הפעולה עם עד 10 זבובים לכל לוחית חיתוך.
הערה: אופציונלי: הסר את הכנפיים והרגליים לפני שההצמדה תעוף לצלחת. פעולה זו תסייע במניעת היווצרות בועות סביב הזבוב בעת הוספת מדיה. - לאחר כל הזבובים המוצמדים לצלחת, להוסיף מדיה לחיתוך מספיק כדי לכסות את הזבובים (~ 1 mL) באמצעות pipet העברה.
- באמצעות מלקחיים או מספריים לקוטיקולה, הסר את הראש.
- באמצעות מספריים לקוטיקולה, עשו שני חתכים אופקיים: אחד ישירות מעל הפין האחורי בבטן, ועוד בקצה הקדמי ביותר של הבטן, שם נפגשים בית החזה והבטן (איור 2ב, ג). באיור 2, הראש נותר שלם כדי להבהיר אוריינטציה.
- לעשות חתך אנכי, חיבור שני חתכים אופקיים (שלושת החתכים דומה האות I). זה יפתח את חלל הבטן (איור 2D).
- באמצעות מלקחיים, להסיר את האיברים הפנימיים ורקמות, הימנעות כלי הקיבול. אם ללא הפרעה, הספינה השקופה השקופה יכולה לעתים קרובות להיראות פועמת בסמוך לקצה הקדמי של הבטן. פינים נוספים ניתן להשתמש כדי להצמיד את הקצוות החדשים לחתוך של הקוטיקולה (איור 2E, F).
- , שימוש במספריים לקוטיקולה. מסירים את החזה לחילופין, בית החזה ניתן להסיר לפני טעינת הספינה גזור ציפורנייך ומעל על שקופית המיקרוסקופ.
- חזור עם הזבובים הנותרים. לנתח זבובים בזמן, כדי למזער וריאציות אפשריות בשיעור phagocytic. ברגע שכל הזבובים בוטלה, השאירו את הציפורנייך עם הספינה המצורפת המוצמדת לצלחת. כל צעד 5 יבוצע בלוחית הניתוח. פעולה זו תמנע מנזק או בשוגג להשליך ציפורנייך בין שלבים.
5. קיבוע וצביעת
- לתקן גזור ציפורנייך עם כלי מצורף המצורפת ב 4% פאראפורמלדהיד (בכיוון הבמה).
- באמצעות העברת העברה חד פעמית חדשה עבור כל שלב, למחוק את מדיית החיתוך, ולהחליף עם 1 מ ל של 4% בתחתית. במהלך הקיבוע וההכתמים, השאר את הניתוח מוגן מפני אור עד כמה שאפשר.
- דגירה בטמפרטורת החדר עבור 15 דקות עם נדנדה ב 20 סל ד. אל תאפשר לניתוח לשבת בתיקונים במשך יותר מ -20 דקות, משום שזה יכול להתחיל לפגוע ברקמה.
- שטוף ציפורנייך 2x ב-1x PBS + 0.1% יצירת רצף (PBST).
- הסר את התיקונים והחלף ב-1 מ ל של 1x PBST.
- לרחוץ בטמפרטורת החדר במשך 15 דקות עם נדנדה.
- חזור על 1x.
הערה: גזור, רקמה קבועה ניתן לאחסן ב 4 ° c, עד 3 ימים, מוגן מפני אור, לאחר השטיפה הראשונה על ידי החלפת לשטוף עם PBST טרי. אין לאחסן רקמה קבועה אם נעשה שימוש בנוגדנים. יש להשתמש בנוגדנים עם רקמה טרייה לקבלת התוצאות הטובות ביותר.
- אופציונלי: כתמים נוגדן. ניתן להשתמש בנוגדנים כדי להמחיש בבהירות את כלי הקיבול (איור 3), או לאתר סמנים ספציפיים של הומוציטוט. זה יכול להבטיח רק תאים לאורך הספינה התחתית נספרות או לסמן את קרום ההיציטים.
- להסיר את הכביסה השנייה, להוסיף נוגדן העיקרי בדילול המתאים. מודטה לילה ב 4 ° c, עם נדנדה.
- להסיר את הנוגדן העיקרי, ולשטוף פעמיים עם PBST עבור 15 דקות עם נדנדה.
- הוסף נוגדן משני פלורסנט. אנו ממליצים על נוגדן ירוק-פלורסנט כך שהוא לא מטשטש את חלקיקי הפלורסנט. דגירה בטמפרטורת החדר עבור 2 h, עם נדנדה.
- להסיר נוגדן משני, לשטוף פעמיים עבור 15 דקות כל אחד עם PBST.
- כתם עם DAPI.
- להסיר את השטיפה הסופית ולהחליף עם 1 מ ל DAPI מדולל ב PBST (1:1000).
- כתם 20 דקות עם נדנדה בטמפרטורת החדר.
- הסר DAPI ושטוף את 2x (חזור על שלב 5.2).
- החלף את השטיפה הסופית עם PBST חדש של 1x.
הערה: ניתן לאחסן זבובים ב -4 ° c, עד 3 ימים, מוגן מפני אור, לאחר השטיפה הראשונה על-ידי החלפת השטיפה בPBST טרי.
6. הרכבה ציפורנייך על שקופיות מיקרוסקופ והדמיה
- להכין גזור ציפורנייך.
- מתחת לחתך הstereomicroscope, חתכו את הקוטיקולה העודפת שעלולה להפריע להדמיה.
- באמצעות מלקחיים, להעביר את הציפורנייך עם כלי מצורף המצורפת לתוך שפופרת מיקרוצנטריפוגה 1.5 mL המכילה 70% גליצרול. הצבת הציפורנייך בגליצרול תסייע להסרת PBST ומאפשרת תמונה ברורה יותר במהלך ההדמיה.
- הר ציפורנייך על שקופית המיקרוסקופ.
- להוסיף כמה טיפות של 70% גליצרול לשקופית מיקרוסקופ.
- באמצעות מלקחיים, להסיר ציפורנייך מצינור גליצרול ומקום בגליצרול על השקופית.
- תחת ניתוח מיקרוסקופ סטריאו, השתמש מלקחיים כדי אוריינט ציפורנייך גחוני למעלה, להבטיח את הספינה הצדדית גלוי. הפיגמנט הכהה ביותר של הקוטיקולה יהיה עם הפנים כלפי מטה.
- הוסיפו טיפה נוספת של גליצרול, במידת הצורך. זה עוזר למנוע בועות אוויר ומאפשר תמונה ברורה.
- בעדינות למקם שמיכות מעל ציפורנייך ולאטום קצוות עם ציפורן ציפורניים. אפשר ייבוש עבור 10-15 דקות לפני שתמשיך. לצלם את הזבובים מיד או לאחסן בקופסת אור ב -4 ° c.
- . צלם את הספינה הזאת
- בעזרת מיקרוסקופ פלורסנט, השתמשו במערכת ההפרעות המבנית כדי ליצור חלקים אופטיים של כלי הקיבול. ניתן להשתמש במיקרוסקופ קונפוקלית וקד לחילופין, אשר עשוי לספק דיוק נוסף. השג תמונות Z-מחסנית של כלי הקיבול באמצעות תוכנת דימות מטרה 20x ומועדפת. הוסף סרגל בקנה מידה 10 מ"מ, ותייג כראוי ושמור תמונות כקבצי tiff (איור 4) או התבנית הרצויה.
הערה: מספר התמונות Z-מחסנית שהתקבלו יכול להשתנות בין הניתוח ותלוי במידת הטוב של כלי הקיבול, ובגודל השלב הרצוי בין התמונות. כאן, גודל המדרגה הוגדר ל 0.49 מ"מ. מספר זה יכול לנוע בכל מקום מ 3 עד 40 תמונות לכל מחסנית בניסיון שלנו.
- בעזרת מיקרוסקופ פלורסנט, השתמשו במערכת ההפרעות המבנית כדי ליצור חלקים אופטיים של כלי הקיבול. ניתן להשתמש במיקרוסקופ קונפוקלית וקד לחילופין, אשר עשוי לספק דיוק נוסף. השג תמונות Z-מחסנית של כלי הקיבול באמצעות תוכנת דימות מטרה 20x ומועדפת. הוסף סרגל בקנה מידה 10 מ"מ, ותייג כראוי ושמור תמונות כקבצי tiff (איור 4) או התבנית הרצויה.
7. ניתוח תמונות
- מכמת אירועי פלורסנט באמצעות ImageJ.
- פתח תמונות ומחסנית אותם: התמונה à בערימות של תמונות à כדי לערום.
- לספור רק האותות פלורסנט בגודל ~ 1 מ מ בתוך קוטר 10 מ"מ ממורכז על-ידי הגרעין DAPI-חיוביים על ידי לחיצה על כל אירוע מתוך 10 תאים לפחות לטוס, מ 10 זבובים לפחות לגיל לכל סוג חלקיק הוזרק: תוספים à לנתח à à מונה התא הודעה (איור 5a). כלי ההודעה של מונה התא מקצה צבע שונה לכל תא במעקב, עם נקודה צבעונית המתאימה לכל אירוע פלורסנט שלוחצים עליו בתוך התא.
- כדי לפרט את מיקום המונה והמחסנית המשויך לכל נקודה, הקש ' אני ' או בחר מדידה תחת הכרטיסיה ' ניתוח ', או כדי להציג את מספר האירועים הנספרים בכל תא בטבלת תוצאות, הקש על ' alt + y ' (איור 5b).
- העבר את ספירת התא לגיליון אלקטרוני שישמש לניתוח סטטיסטי.
- בצע ניתוח סטטיסטי.
- לנתח את ההבדלים באירועים phagocytic באמצעות הפונקציה ANOVA או מסוג מעורב-מודל אנובה. מודלים מעורבים יכולים לשמש כדי לבדוק את ההשפעות הקבועות העיקריות של גיל ו-גנוטיפ ואת ההשפעה האקראית של אנשים מקוננים בתוך כל גנוטיפ17.
הערה: על החוקרים להיות קפדניים בבדיקת ההנחות של כל הליך סטטיסטי המשמש לניתוח הנתונים.
- לנתח את ההבדלים באירועים phagocytic באמצעות הפונקציה ANOVA או מסוג מעורב-מודל אנובה. מודלים מעורבים יכולים לשמש כדי לבדוק את ההשפעות הקבועות העיקריות של גיל ו-גנוטיפ ואת ההשפעה האקראית של אנשים מקוננים בתוך כל גנוטיפ17.
תוצאות
כדי להמחיש את שיטות ההזרקה המתוארות, איור 1A מציג את אתר ההזרקה על דרוסופילה מלאנוסטר, כמו גם איך צבע המזון מאפשר אישור חזותי שהזבוב הזריק (איור 1a). תוספת של צבע מזון גם מסייע הכרה של מחט סתומה. זריקות ניתן לבצע בבטן, אבל לשמור על אתר ההזרקה עקבית על פני ניסויים. פעולה זו תסייע למזער את הווריאציות האפשריות בין כל ניסוי.
כדי להמחיש את החלקיקים המסומנים באופן פלואורוסקופים בתוך הומוציטים הקבועים לאורך כלי הקיבול, ניתחנו את הכלי הפנימי וקוטיקולה הבטן המצורפת. איור 2א-פ מתווה את שיטות החיתוך.
כדי להעריך את היכולת הספציפית לגיל של זבובים צעירים ובגיל לבצע phagocyציטוזה, הומוציטים לאורך הספינה הרכה הם דמיינו באמצעות מיקרוסקופ פלורסנט. כדי להבטיח כי רק תאים לאורך כלי הקיבול הם נספרים, נוגדנים או gfp-מתויגים גנים עבור סמנים תא דם מסוימים או קולגן ספציפי הלב, כגון Hemese ו- הומולטין, או קרום הלב (איור 3), בהתאמה, ניתן להשתמש22,23,24. התוויות של החיידק הקולי הם 1 מ"מ באורך, בעוד הומוציטים הם 10 מ"מ בקוטר17. רק אירועי פלורסנט הממוקמים בקוטר של 10 מ"מ ממורכזים בגרעין DAPI-חיוביים נספרים (איור 4). כדי לכמת אירועי פלורסנט, נעשה שימוש בתוכנת ImageJ (איור 5).

איור 1: אתר הזרקה ואימות חזותי. (א) צד צדדי של בית החזה הוא נדקר עם מחט משכה נימי. (ב) זריקות מאומתות באופן חזותי על ידי הוספת צבע מזון ירוק לפתרון חלקיקים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
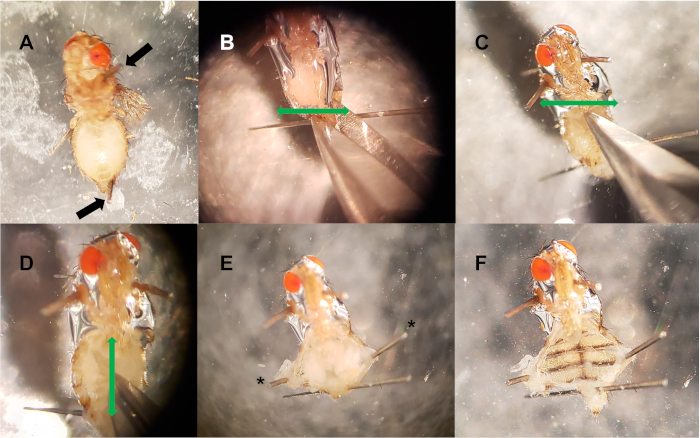
איור 2: קרע בכלי הקיבול. (א) פינים מוצבים בבית החזה ובבטן האחורי (חיצים שחורים). (B-C) שני חתכים אופקיים (חיצים ירוקים) נעשים בקצה האחורי של הבטן (ב), ואת הקצה הקדמי (C). (ד) חתך אנכי (חץ ירוק) מורכב באמצע הבטן, חיבור שתי החתכים האופקיים. (ה) פינים אופציונליים (*) משמשים לפילה את חלל הבטן וחשיפת רקמות פנימיות. (ו) רקמות פנימיות (חיתוך, בטן, רחם, שחלות, גופי שומן) מוסרים, וחושפים את הכלי הקדמי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
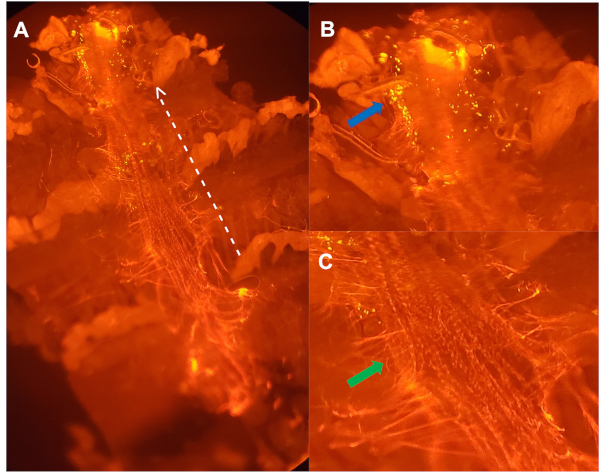
איור 3: מבט מגחוני על כלי גזור מנקבה בת 5 שבועות שהוזרק עם חלקיקים בעלי חומציות רגישה, ומוכתם בנוגדן המכוון נגד רקמת הלב (א). קו לבן מנוקד מתווה את הצד הצדדי של הספינה הקדמית, עם חץ המצביע לעבר האזור הקדמי. (ב) תמונה מוגדלת של (א): אשכולות של הומוציטים (חץ כחול) שהיו חיידקים משפילים באופן פעיל, בתוך תא אבי העורקים הראשון של הספינה הראשונה. (ג) תמונה מוגדלת של (א) לחלוקה לרמות של מטריצה המומנת (ecm) חלבון כמו קולגן, בקרום הלב (החץ הירוק), המחזיק את הכלי הראשוני במקום24. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
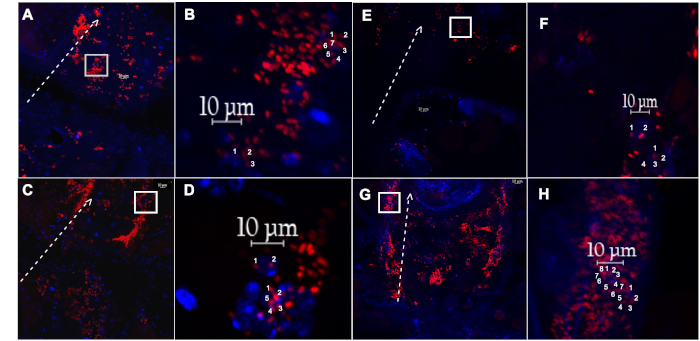
איור 4: בגזור הספינה הקשורים הומוציטים מתוך זבוב נקבה הוזרק עם חלקיקי pH רגישים, או fluoro-חלקיקים. (א) הכלי הגבי והומוציטים המשויכים לאלה הקשורים ל-pH-מתויג בעלי רגישות גבוהה . הקולי חלקיקים (אדום), או (E) Fluoro-מתויג החלקיקים E. coli (אדום), מבודד מזבוב בן שבוע 1, לאחר התאוששות עבור 60 דקות (ב, F) הזחה מוגדלת של (A) ו (E) (קופסה לבנה), בהתאמה, מראה שני הומוציטים בודדים עם אירועים משני. (ג) הכלי הדו והומוציטים המשויכים עםהחומרהמשוכן הרגיש של pH . הקולי חלקיקים (אדום), או ( G) Fluoro-מתויג החלקיקים E. coli (אדום), מבודד מזבוב בן 5 שבועות, לאחר שהחלים עבור 60 דקות (D, H) הכניסה מוגדלת של (C) ו (G) (קופסה לבנה), בהתאמה, מראה שני הומוציטים בודדים עם אירועים בטבלה. קו לבן מנוקד מתווה את הצד הצדדי של הספינה הקדמית, עם חץ המצביע לעבר האזור הקדמי. גרעינים מוכתם עם DAPI (כחול). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
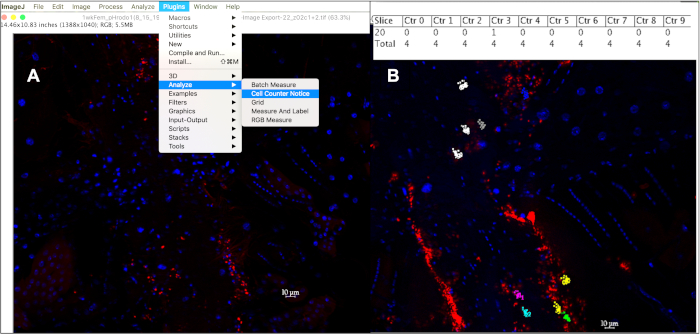
איור 5: בדיקת אירועי phagocytic בתוך 10 מ"מ הומוציטים באמצעות מונה התא ב-imagej. (א) לאחר פתיחת תמונות ב-imagej, ניתן להשתמש בכלי ההודעה של מונה התא כדי לעקוב אחר אירועי phagocytic לכל תא. (ב) כלי זה יקצה צבע שונה לכל תא שנבחר לספירה, כאשר כל נקודה מתאימה לאירוע פלורסנט בתוך תא זה. לחיצה על ' alt + y ' תציג טבלה המציגה את מספר האירועים שנספרו לכל תא. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
הפרוטוקול המתואר כאן הוא דרך אמינה לכמת היבטים שונים של phagocyציטוזה, תחת תנאים ניסיוניים מבוקרת. אנו מודעים לכך יש לנו רק בדקנו את ההליך הזה עם חלקיקים בקטריאלי גראם שליליים ותוצאות עשויות להיות שונות אם חלקיקים בקטריאלי גראם חיוביים משמשים. אכן, זה יהיה מעניין להשוות את התגובות phagocytic הן חיידקים גרם שלילית גראם חיוביים בתנאים ניסיוניים שונים. השימוש בננו-מזרק מאפשר שליטה מדויקת על אמצעי הזרקה, ולהבטיח שכל זבוב מוזרק באותו נפח של חלקיקים. מגבלה אחת לפרוטוקול נובעת מחוסר עקביות בהכנות לחלקיקים. חלקיקים יהיה לצבור פעם קפואים, אז וריאציות קטנות בכמויות דילול, או חוסר vortexing, יכול להשפיע על ריכוז חלקיקים בין ניסויים. כדי למזער וריאציות אפשריות בריכוזי חלקיקים בין הגילאים, מועיל להזריק זבובים בני 1 ו-5 שבועות באותו היום, תוך שימוש באותו פתרון מחט וחלקיקים. חיסרון פוטנציאלי נוסף הוא שבמהלך הניתוח ניתן לפגוע בכלי הקיבול ו/או בקוטיקולה בקלות אם פינים אינם מטופלים כראוי. כדי להימנע מהפרעה לכלי הקיבול, יש למזער את מספר הפינים הנמצאים בשימוש בכל ניתוח. היתרון של שיטת הניתוח הוא כי כל קיבעון, שטיפת שלבים וכתמים ניתן לבצע בלוחית הניתוח. מכיוון שציפורנייך מוצמדים, פעולה זו מונעת את הציפורנייך מאיבוד בין שלבים.
בהשוואה לשיטות הקיימות18,19,25,26,27,28,29, לפרוטוקול המתואר יש יתרונות ומגבלות. על ידי מבתר את הכלי הגבי, אנו מסוגלים להמחיש ולכמת הומוציטים הפרט במיקום זה. זה מאפשר לזהות וריאציות עדינות בפעילות phagocytic בין קבוצות ניסיוני. שיטות אחרות להמחיש חלקיקים מתויג באופן שונה על ידי איסוף הומוציטים באמצעות בליד/שריטהבדקה19,25,26,27, או באמצעות קוטיקולה שלמה,18,19,28,29; עם זאת, הומוציטים בודדים לא ניתן להעריך כאשר דמיינו דרך הקוטיקולה הגבי. היתרון של פרוטוקול זה, כאשר בהשוואה לשיטת הבליד/שריטה הוא שהשיטה שלנו מאפשרת לנו להעריך רק את אותם הומוציטים הקשורים לכלי הקיבול, והיא מהווה חשבון למחזור תאים או לאלה שלאורך קיר הגוף, שעשויים להיות שונים מבחינה פונקציונלית. מבתר את הספינה התחתית גם מסיר את הצורך לכלול סיבוב שני של זריקות עם הקונקויום הפלואורסצנטית, כמו טרימין כחול19,26. הסיבה לכך היא כי כל החלקיקים לא מאוגד או נבלע על ידי תא יהיה שטף משם במהלך שטיפת שלבים. לעומת זאת, שיטות חלופיות עשויות להיות קלות יותר לביצוע מכיוון שהן אינן דורשות ניתוח. בעוד מבתר את הספינה התחתית קל ללמוד, שלב זה מוסיף רמה של מורכבות זה לא יכול להיות אפשרי בכמה עיצובים ניסיוניים.
למרות השימוש המתואר זה בשנת vivo phagocyציטוזה להעריך ולכמת אירועים phagocytosis בין גילאים שונים, פרוטוקול זה הוא מאוד להתאמה והוא יכול לשמש כדי לנתח היבטים שונים של phagocyציטוזה בין גנוטיפ, מין, או רקמה סוג. עם phagocyציטוזה להיות בעל חשיבות מרכזית עבור רוב בעלי חיים מטבעות, הבנת כיצד תהליך זה מסרב עם הגיל יכול להוביל טיפולים טיפוליים טובים יותר עבור אוכלוסיית ההזדקנות. גישה זו מציעה פוטנציאל לטווח ארוך להסבר היבטים של שינויים הקשורים לגיל בתגובה החיסונית, עם דגש מיוחד על phagocyציטוזה.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
עבודה זו היתה נתמכת על ידי מענקים מן המכון הלאומי לבריאות R03 AG061484-02 ואת המכללה המדע הטבעי והמתמטי של מדעי המדינה באלה דיקנסון הפקולטה קרן.
Materials
| Name | Company | Catalog Number | Comments |
| 0.10 mm Insect pins | Fine Science Tools | 26002-10 | Here: pins are cut in half, and the sharp end is used |
| 1 mL sterile syringes | Becton Dickinson | 309602 | Filled with mineral oil to load needle |
| 15% Fetal Bovine Serum (FBS) | Gibco | 16000-044 | for dissection media |
| 16 % Paraformaldehyde | Electron Microscopy Sciences | 15710 | EM-grade, 4% working, diluted in 1X PBS |
| 1x Phosphate buffered saline (PBS) | Sigma | P3813 | |
| 3 mL Trasnfer Pipet | Falcon | 357524 | |
| 3.5" Glass Capillaries | Drummond | 3-000-203-G/X | 1.14mm O.D X 3.5" length X 0.53" I.D |
| 35x10 mm Petri dishes | Becton Dickinson | 351008 | Used as dissection plate, filled half way with Sylgard |
| 6x penicillin/streptomycin | Life Technologies | 15140-122 | for dissection media |
| 70% Glycerol | Sigma | G9012 | |
| Analog Vortex mixer | VWR | 58816-121 | |
| Biological point forceps, Dumont No. 5 | Fine Science Tools | 11295-10 | |
| DAPI (4',6-diamidino-2-phenylindole) | Life Technologies | D1306 | Diluted 1:1000 in 1x PBST |
| Drosophila strain | w[*]; P{w[+mC]=He-GAL4.Z}85, P{w[+mC]=UAS-GFP.nls}8 | ||
| E. coli (K-12 strain) BioParticles™, Alexa Fluor™ 594 conjugate | Life Technologies | E23370 | |
| Glass slides | Premiere | D17026102 | |
| Live cell imaging solution | Life Technologies | A14291DJ | preferred buffer for particle preparation and dilutions |
| Mineral oil | Mpbio | 194836 | |
| Nanoject II automatic nanoliter injector | Drummond | 3-000-204 | |
| Narrow Polystyrene Super Bulk Drosophila Vials | Genesee | 32-116SB | Size: 25 X 95 mm |
| Nutating Mixer | Fisher Scientific | 88-861-043 | Speed used: 20 rpm |
| pHrodo™ Red E. coli BioParticles™ Conjugate for Phagocytosis | Life Technologies | P35361 | |
| Schneider's Drosophila cell culture media (1x) | Gibco | 21720-024 | Dissection media, combine: Schneiders, FBS, and pen/strep; filter sterilize |
| Sodium azide | Sigma-Aldrich | S2002 | 2mM (or 20%) working |
| Spring scissors | Fine Science Tools | 15000-00 | |
| Sylgard 184 Silicone elastomer | Electron Microscopy Sciences | 24236-10 | Prepare according to provided protocol |
| Tween 20 | Sigma | P1379 | For PBS + 0.1% tween |
| Vertical Pipette Puller Model 700C | David Kopf Instruments | 812368 | Heater: 55? Solenoid: 45 |
| Zeiss AxioImager.Z1 fluorescent microscope | Zeiss | Here: Apotome structural interference system with Zeiss Zen imaging software |
References
- Abhyankar, V., Kaduskar, B., Kamat, S. S., Deobagkar, D., Ratnaparkhi, G. S. Drosophila DNA/RNA methyltransferase contributes to robust host defense in ageing animals by regulating sphingolipid metabolism. The Journal of Experimental Biology. 221, (2018).
- DeVeale, B., Brummel, T., Seroude, L. Immunity and aging: the enemy within. Aging Cell. 3 (4), 195-208 (2004).
- Gomez, C. R., Nomellini, V., Faunce, D. E., Kovacs, E. J. Innate immunity and aging. Experimental Gerontology. 43 (8), 718-728 (2008).
- Panda, A., et al. Human innate immunosenescence: causes and consequences for immunity in old age. Trends in Immunology. 30 (7), 325-333 (2009).
- Aw, D., Silva, A. B., Palmer, D. B. Immunosenescence: emerging challenges for an ageing population. Immunology. 120 (4), 435-446 (2007).
- Min, K. -. J., Tatar, M. Unraveling the molecular mechanism of immunosenescence in Drosophila. International Journal of Molecular Sciences. 19 (9), 2472 (2018).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Hales, K. G., Korey, C. A., Larracuente, A. M., Roberts, D. M. Genetics on the fly: a primer on the Drosophila model system. Genetics. 201 (3), 815-842 (2015).
- Banerjee, U., Girard, J. R., Goins, L. M., Spratford, C. M. Drosophila as a genetic model for hematopoiesis. Genetics. 211 (2), 367-417 (2019).
- Rämet, M., Manfruelli, P., Pearson, A., Mathey-Prevot, B., Ezekowitz, R. A. B. Functional genomic analysis of phagocytosis and identification of a Drosophila receptor for E. coli. Nature. 416 (6881), 644-648 (2002).
- Garschall, K., Flatt, T. The interplay between immunity and aging in Drosophila. F1000Research. 7, (2018).
- Brennan, C. A., Anderson, K. V. Drosophila: The genetics of innate immune recognition and response. Annual Review of Immunology. 22 (1), 457-483 (2004).
- Rosales, C., Uribe-Querol, E. Phagocytosis: a fundamental process in immunity. BioMed Research International. 9042851, (2017).
- Kinchen, J. M., Ravichandran, K. S. Phagosome maturation: going through the acid test. Nature Reviews. Molecular Cell Biology. 9 (10), 781-795 (2008).
- Stuart, L., et al. A systems biology analysis of the Drosophila phagosome. Nature. 445 (7123), 95-101 (2007).
- Mackenzie, D. K., Bussière, L. F., Tinsley, M. C. Senescence of the cellular immune response in Drosophila melanogaster. Experimental Gerontology. 46 (11), 853-859 (2011).
- Horn, L., Leips, J., Starz-Gaiano, M. Phagocytic ability declines with age in adult Drosophila hemocytes. Aging Cell. 13 (4), 719-728 (2014).
- Elrod-Erickson, M., Mishra, S., Schneider, D. Interactions between the cellular and humoral immune responses in Drosophila. Current Biology. 10 (13), 781-784 (2000).
- Garg, A., Wu, L. P. Drosophila Rab14 mediates phagocytosis in the immune response to Staphylococcus aureus. Cellular Microbiology. 16 (2), 296-310 (2014).
- . Bloomington Drosophila Stock Center: Indiana University Bloomington Available from: https://bdsc.indiana.edu/innformation/recipes/molassesfood.html (2019)
- Fellous, S., Lazzaro, B. P. Larval food quality affects adult (but not larval) immune gene expression independent of effects on general condition. Molecular Ecology. 19 (7), 1462-1468 (2010).
- Kurucz, E., et al. Hemese, a hemocyte-specific transmembrane protein, affects the cellular immune response in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 100 (5), 2622-2627 (2003).
- Goto, A., et al. A Drosophila haemocyte-specific protein, hemolectin, similar to human von Willebrand factor. Biochemical Journal. 359, 99-108 (2001).
- Cevik, D., Acker, M., Michalski, C., Jacobs, J. R. Pericardin, a Drosophila collagen, facilitates accumulation of hemocytes at the heart. Developmental Biology. 454 (1), 52-65 (2019).
- Ghosh, S., Mandal, S., Mandal, L. Detecting proliferation of adult hemocytes in Drosophila by BrdU incorporation and PH3 expression in response to bacterial infection. Wellcome Open Research. 3, (2018).
- Hao, Y., Yu, S., Luo, F., Jin, L. H. Jumu is required for circulating hemocyte differentiation and phagocytosis in Drosophila. Cell Communication and Signaling. 16 (1), 95 (2018).
- Petraki, S., Alexander, B., Brückner, K. Assaying blood cell populations of the Drosophila melanogaster larva. Journal of Visualized Experiments. (105), (2015).
- Gyoergy, A., et al. Tools allowing independent visualization and genetic manipulation of Drosophila melanogaster macrophages and surrounding Tissues. G3: Genes, Genomes, Genetics. 8 (3), 845-857 (2018).
- Bosch, P. S., et al. Blood cells of adult Drosophila do not expand, but control survival after bacterial infection by induction of Drosocin around their reservoir at the respiratory epithelia. BioRxiv. 578864, (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved