Method Article
인 비보 식세포 분석기를 사용하여 성인 Drosophila 멜라노가스터 혈구의 연령별 식세포 능력 평가
요약
이 프로토콜은 소아 세포토균에 젊고 숙성된 Drosophila 멜라노가스터 혈구세포의 능력을 평가하고 정량화하는 데 사용되는 phagocytosis의 생체 내 분석방법을설명합니다.
초록
식세포증은 타고난 면역 반응의 필수적인 기능입니다. 이 과정은 광범위한 입자를 인식하고 미생물 병원균을 파괴하는 기본 기능이 있는 식세포 혈구에 의해 수행됩니다. 유기체가 나이로, 이 과정은 쇠퇴하기 시작하지만, 면역 노화의 근본적인 기계장치 또는 유전적 기초에 관하여 거의 알려지지 않습니다. 여기서, 생체 내 식세포 분석체에 기초한 주사는 성자 Drosophila의 Drosophila 혈청세포에서 의식세포 이벤트를 정량화함으로써, 내화된 입자의 결합, 침몰 및 저하와 같은 phagocytosis의 다양한 양상에서 연령 관련 변화를 평가하는 데 사용됩니다. 하나에 대 한, 많은 유전 구성 요소 및 타고난 면역 반응의 기능, phagocytosis를 포함 하 여, 진화 드로 소 필라와 포유류 사이 보존. 그 때문에, 이 프로토콜을 사용하여 얻은 결과는 다양한 유기체에서 면역 기능에 있는 나이 관련 변경을 이해하는 것과 널리 관련이 있을 가능성이 높습니다. 또한,이 방법은 다양한 연구 주제에 유용 할 수있는 혈낭 세포 세포의 정량적 추정을 제공하며 노화 연구에 국한 될 필요가 없습니다.
서문
감염뿐만 아니라 세포 성분에 대한 물리적 및 화학적 장벽으로 구성된 타고난 면역 체계는 다세포 유기체1,,2에걸쳐 진화적으로 보존된다. 방어의 첫 번째 선으로, 타고난 면역 계통은 모든,동물1,2,23에있는 침략병원체를 퇴치에 있는 중요한 역할을 합니다. 선천성 면역 반응의 성분은 특이성 및 면역학적2기억2, 3,3,4가부족하다는 이유로 분류되는 광범위한 세포 유형을 포함한다. 인간에서, 이 세포 모형은 phagocytic 단핵세포 및 대식세포, 호중구 및 세포독성 자연 살인자 세포4,,5를포함합니다. 기능성 면역 계통이 호스트 생존을 위해 필수적이지만, 면역 세포의 기능이 나이가 들면서 감소하는 것이 분명하며, 면역 노화5,,6로알려진 현상이 분명하다. phagocytosis의 프로세스의 다른 양상을 포함하여 면역 반응에 있는 나이 관련 변경을 평가할 수 있다는 것은, 면역 노화의 우리의 이해에 도움이 될 수 있었습니다. 우리가 여기에서 설명하는 절차는 Drosophila melanogaster에 있는 혈투세포에 의하여 phagocytic 사건을 평가하고 정량화하기 위하여 효과적이고 반복가능한 접근법을 제공합니다.
Drosophila는 여러 가지 이유로 면역 반응을 공부하기위한 이상적인 모델입니다. 하나에 대 한, 조직 의존 방식으로 유전자 발현을 쉽게 조작 할 수 있도록 사용할 수 있는 유전 도구의 광범위 한 세트가 있다7. 이러한 도구에는 돌연변이체, RNA 간섭 주식, GAL4/UAS 주식 및 전체 게놈 서열이 분류된 205개의 서로 다른 근친선이 포함된 Drosophila 유전자 참조 패널의 컬렉션이 포함됩니다8. Drosophila의 짧은 수명 주기및 생산된 개별의 다수는 연구원이 통제된 환경에서, 시간의 짧은 기간에 있는 다중 개별을 시험하는 것을 허용합니다. 이것은 크게 유전자형 중 감염에 면역 반응에 미묘한 차이를 식별하는 능력을 향상, 남녀 사이 또는 나이에 걸쳐. 중요하게도, 많은 유전 성분과 충혈증을 포함한 타고난 면역 반응의 기능은 드로소필라와 포유동물1,,2사이에서 진화적으로 보존된다.
Drosophila에서, 감염을 따르는 phagocytosis의 과정은 포유류 대식세포9에해당하는 혈장 세포에게 불린 phagocytic 혈구에 의해 수행됩니다. 혈청세포는 광범위한 입자를 인식하고 미생물 병원균9,10,,11,,,12,,13을클리어하는 데 필수적이다. 이들 세포는 자기로부터 자아를 분화해야 하는 다양한 수용체를 발현하고,,,10,11,,12,13,,14,,15를수행하는 데 필요한 신호 이벤트를 개시한다. 일단 입자가 결합되면, 입자 주위로 팽창하는 플라즈마 멤브레인의 액틴 사이토골격의 재구성 및 리모델링에 의해 내면화되기 시작하여, 식세포컵(11,12,,13,14)을형성한다.,, 이 과정에서, 신호의 또 다른 세트는 파고세포 컵을 닫음으로써 입자를 더 내면화하도록 세포에 지시하고, 막 경계식섬(11,,12,,13,,14,15)을15형성한다. 그런 다음 phagosome은 다른 단백질과 연결되고 리소좀과 융합하여 산성 성 식질11,12,,,13,,14,,15를형성하여 성숙 과정을 겪습니다. 이 시점에서 입자는 효율적으로 분해되고11,,12,,13,,14,,15를제거할 수 있다. Drosophila 연구 결과는 오래된 파리 (4 주)가 더 젊은 파리에 비해 감염을 취소하는 감소 된 능력을 가지고 있음을 밝혔다 (1 주 오래), 가능성이 적어도 부분적으로, phagocytosis의 일부 양상에서감소16,,17.
여기서 설명한 방법은 2개의 별도 형광 표시 열 사멸 한 대장균 입자, 표준 형광소를 베어링 하나 및 pH 민감하나, phagocytosis의 두 가지 다른 측면을 평가하기 위해 활용: 입자의 초기 침몰, 그리고 phagolysososome에서 입자의 분해. 이 분석에서, 형광 입자형광은 입자가 혈구에 의해 결합되고 침몰할 때 관찰할 수 있으며, pH 민감한 입자는 파고종의 낮은 pH 조건에서만 형광을 한다. 형광 이벤트는 그 때 등류 혈관을 따라 현지화하는 혈구에서 관찰될 수 있습니다. 우리는 세균 성 통관에 기여하는 것으로 알려진 혈구를 찾고 일관되게 분리하는 해부학적 랜드 마크를 제공하는 등등 용기에 국한 된 혈구에 초점을 맞추고 있습니다. 그러나, 신체의 다른 부분에서 혈청과 혈청은 또한 정리에 대 한 중요 한. 비록 우리가 이 세포 인구를 공부하지 않더라도, 우리의 일반적인 절차는 또한 이 세포의 phagocytic 분석에 적용될 수 있었습니다. 우리의 접근 방식의 한 가지 장점은 우리가 식세포 프로세스에 있는 미묘한 변이를 검출하는 것을 허용하는 개별 혈구 내의 phagocytic 사건을 정량화할 수 있다는 것입니다. 18,19를 통해 형광 이벤트를18시각화하는 다른 연구는17세에따라 총 혈구 수가 변경될 것으로 예상되는 우리의 경우 고려해야 할 중요한 혈구 수의 차이를 고려하지 않는다.
프로토콜
1. 드로소필라를 수집하고 나이
- 동일한 숙성 F1 파리를 생성하려면 5-10 처녀 암컷과 5명의 수컷을 신선한 플라이 푸드를 함유한 바이알에 추가합니다. 옥수수밀 당밀 을 사용 하 여식품(20)하지만,파리가 사육되는 식단의 종류에 관계없이 방법이 작동해야 합니다. 이 실험을 위해 우리는 Hemese (He)-GAL4를사용했습니다. UAS-GFP는 혈구를 유전적으로 라벨로 부착하기 위해 날아갑니다.
참고: 더 많은 파리를 사용할 수 있습니다., 하지만 D. 멜라노 가스터의 일부 라인 짝짓기 또는 과밀 때 잘 재현 하지 않을 수 있습니다., 그리고 과밀 애벌레 개발에 부정적인 영향을 미칠 수 있습니다21 그리고 phagocytosis. - 원하는 실험 조건에서 파리를 유지합니다. 이 실험을 위해, He-GAL4유지; UAS-GFP는 24°C에서 비행합니다. 성인 파리가 일주일 동안 짝짓기를 한 다음 성인을 제거하도록 허용하십시오. 그런 다음 F1 파리는 실험용으로 백과사 후 이러한 바이알에서 수집됩니다.
- 일주일 내내 또는 원하는 수의 파리가 수집될 때까지 처녀 파리를 수집합니다. 처녀는 필요하지 않습니다. 그러나, 짝짓기 는 면역 반응에 영향을 미칠 수 있습니다. F1 파리가 처녀로 테스트되어야하는 경우, 백과의 8 시간 이내에 별도의 남성과 여성을 분리하고 짝짓기를 방지하기 위해 별도의 바이알에서 유지. 연령당 유전자형/치료/성별당 최소 10마리의 파리에서 식세포증을 평가할 수 있도록 충분한 파리를 수집합니다.
- 파리를 1주일간 노화시키면, 플루오로 입자 또는 pH 에 민감한 입자에 대해 처리 조건당 최소 50파리 또는 20파리를 수집하여 주입한다. 이렇게 하면 실험 시 분석시 최소 10개의 파리가 표시됩니다.
- 노화가 3주 이상 날아가면, 식세포증을 측정하기에 충분한 파리가 있는지 확인하기 위해 치료 조건당 최소 100-150파리 또는 치료 조건당 50-75파리를 수집합니다. 실험실에서 노화 파리를 노화하는 경우, 우리는 일반적으로 12:12 L:D에서 24 °C에서 유지 되는 곤충 케이지를 사용 하 여 조건, 그리고 매일 음식을 변경합니다. 바이알대신 케이지를 사용하는 경우, 팁은 유리병에 있는 음식의 상태에 따라 3-5일마다 새로운 바이알로 날아갑니다. 필요한 파리의 수는 나이 phagocytosis에서 얼마나 늦게 분석될 지에 달려, 특정 환경 조건에서 그 유전자형의 나이 특정 생존율.
- 영숙파리가 평가된다면, 1주일 된 파리와 노후된 파리가 같은 날 주입되도록 계획에 따라 계획하십시오. 이것은 실험 사이 입자 농도의 변화를 최소화하고 분석이 수행된 날의 효력과 함께 phagocytic 측정에 나이의 효력이 혼동되지 않다는 것을 보장할 것입니다.
- 수집된 파리는 5-7일 전까지 24°C로 보관하거나 원하는 연령까지 파리를 유지합니다.
2. 형광으로 표시된 입자 를 준비합니다.
- 열사성 대장균 플루오로 입자 또는 pH 민감한 대장균 입자를 각각 20 mg/mL 또는 1 mg/mL의 육수 농도로 재구성한다. 다른 박테리아는 특정 실험에 더 적합 할 수 있습니다 사용에 사용할 수 있습니다., 하지만 적절 한 재고 농도대 한 제조 업체의 지침을 참조.
- 플루오로 입자의 경우 1x PBS(pH 7.4) 또는 선호하는 버퍼 990 μL및 2mM(20%)의 10 μL을 추가합니다. 아지드 나트륨. 혼합 소용돌이.
참고: 아지드 나트륨은 생략될 수 있는 방부제입니다. 그러나 아지드 나트륨 없이 제조된 입자는 오래 지속되지 않습니다. 플루오로 입자는 24시간 이내에 사용해야 하며 pH 에 민감한 입자는 7일 이내에 사용해야 합니다. - pH 민감 입자의 경우 1x PBS(pH 7.4) 또는 바람직한 버퍼의 1,980 μL과 2mM(20%)의 20 μL을 추가합니다. 아지드 나트륨. 혼합 소용돌이.
- 1.5mL 마이크로센심분리기 튜브에서 여러 일회용 20 μL 알리코트만 드십시오. 불소 입자를 -20°C에서 최대 1년 동안 저장하고 pH 민감입자를 최대 6개월 동안 4°C로 저장하여 빛으로부터 보호합니다.
- 플루오로 입자의 경우 1x PBS(pH 7.4) 또는 선호하는 버퍼 990 μL및 2mM(20%)의 10 μL을 추가합니다. 아지드 나트륨. 혼합 소용돌이.
- 주사 당일, 사용하기 전에 입자에서 아지드 나트륨을 제거하십시오. 이렇게 하려면 실온에서 15,000 x g에서 5 분 동안 입자를 원심 분리합니다.
- 1x PBS 또는 바람직한 완충제의 50 μL로 재연하여 상체및 세척 입자를 두 번 제거하고 원심분리기를 15,000 x g에서5분 동안 재연합니다.
- 두 번째 세척 후, 1x PBS 또는 바람직한 버퍼의 100 μL에서 상체를 제거하고 입자를 재축한다. 용액을 튜브에 보관하고 실험 전반에 걸쳐 빛에 대한 노출을 최소화합니다. 아지드 나트륨을 제거하면 24시간 이내에 플루오로 입자를 사용하고 5-7일 이내에 사용되는 pH 민감 입자를 사용합니다.
참고 : 우리의 이전 실험에서, 우리는 입자의이 농도가 식세포 이벤트의 수수와 혈구에 의해 phagocytosis에 사용할 수있는 입자의 수가17을제한하지 않은 것을 발견했다. 그러나, 이 프로토콜의 사용자는 실험 조건에서 혈청세포에 의해 phagocytosis에 사용할 수 있는 입자의 적수가 있는지 확인하기 위하여 그밖 농도를 사용하여 결과를 비교할 수 있습니다.- 아지드 나트륨을 생략한 경우, 입자를 주사를 위해 제조된 동일한 버퍼에서 입자를 1:5로 희석시켰다.
- 입자에 녹색 음식 착색(~10 μL)을 추가합니다. 이렇게 하면 파리가 주입되었는지 쉽게 확인할 수 있습니다.
3. 파리를 주입
- 주사를 위해 유리 바늘을 준비합니다.
- 파이펫 풀러를 사용하여 유리 바늘을 당깁니다. 파이펫 풀러 히터를 55°C로 설정하고 솔레노이드를 45로 설정합니다. 다른 바늘이 동일한 정밀도로 작동한다는 것을 보장하지 않기 때문에 인젝터와 함께 제공되는 바늘만 사용하십시오.
- 1mL 멸균 주사기를 미네랄 오일로 채우고 나노 인젝터와 함께 제공되는 30 게이지 피하(G) 바늘을 부착합니다.
- 당겨진 유리 바늘의 무딘 끝에 30 G 바늘을 삽입하여 뽑아낸 모세관 바늘을 채우고 미네랄 오일로 채웁니다. 30G 바늘을 천천히 제거하여 바늘 전체에 기포가 없도록 하면 부정확한 사출 량이 발생할 수 있습니다. 인젝터는 바늘을 다시 채우지 않고 제대로 작동하지 않습니다.
- 집게를 사용하여 바늘 끝을 부수고 용액을 배출 할 수있는 개구부를 만듭니다.
- 나노 인젝터를 조립합니다.
참고: 다른 인젝터를 사용할 수 있습니다. 아래에 설명된 방법은 나노 인젝터에 적용됩니다. 다른 인젝터의 경우 사용자 설명서에 문의하여 지침을 참조하십시오.- 인젝터를 원하는 부피(46nL와 69nL 사이)로 설정합니다.
- 콜릿을 제거하고 밀봉 O-링, 바늘의 백 엔드를 수신하기 위해 최대 를 향한 들여쓰기가있는 흰색 스페이서, 그리고 더 큰 O 링을 금속 플런저에 배치하십시오. 콜릿을 조이지 않고 다시 부착합니다.
- 오일로 채워진 유리 바늘의 무딘 끝에 금속 플런저를 삽입합니다. 바늘을 부드럽게 아래로 밀어 더 큰 O 링에 삽입합니다. 콜릿이 안전할 때까지 조입니다.
참고: 금속 플런저가 콜릿을 지나가지 않으면 플런저가 표시될 때까지 'EMPTY'를 누르고 누릅니다. 이렇게 하면 플런서가 바늘에 삽입되도록 쉽게 보장할 수 있습니다. - 인젝터가 경고음이 울릴 때까지 '빈'을 누르고 누릅니다. 이것은 바늘에서 미네랄 오일의 대부분을 배출, 두 액체 사이의 장벽 역할을 오일의 작은 볼륨을 떠나, 뿐만 아니라 기포를 제거.
- 제조된 입자를 포함하는 마이크로원심분리기 관에 유리 바늘의 끝을 삽입하여 플루오로 입자 또는 pH 에 민감한 입자로 바늘을 채웁니다.
- 인젝터가 비프음이 울릴 때까지 'FILL'를 누르고 누릅니다.
- 주사
- 빈 유리병에 주입될 파리를 이송합니다. 유리병을 얼음에 배치하여 파리를 움직이지 못하게 합니다. CO2는 또한 파리를 고정하는 데 사용할 수 있습니다. 그러나 pH 에민감한 입자를 사용할 때 CO2 수준이 상승하면 사용되는 버퍼를 인위적으로 산성화할 수 있으며 배경 형광을 높일 수 있습니다.
- 흉부(도 1A)의스테인날루라 플레이트에 파리를 주입합니다. 녹색 염료가 즉석로 들어가는 것을 볼 경우 주사가 성공(도 1B). 비행이 녹색으로 바뀌지 않으면 바늘이 막히지 않았는지 확인하십시오.
참고: 대안적으로, 파리는 복부에 주입될 수 있습니다, 그러나 모든 실험에 걸쳐 일관되게 주사 사이트를 유지합니다. - 주입된 파리를 새로운 음식 병병으로 배치하여 첫 번째와 마지막 비행이 주입된 시간을 지적합니다. 주사를 완료하는 데 걸리는 시간으로 인한 실험 오류를 최소화하기 위해 적시에 주사를 완료하십시오. 연습을 통해 한 세트의 파리를 주입하는 데 10 분 이상이 걸리지 않습니다. 파리가 모두 회복될 때까지 유리병을 옆으로 눕혀서 파리가 음식에 갇히는 것을 방지합니다.
- 실험 조건에 따라 파리가 60-90분 동안 복구할 수 있도록 허용합니다. 여기서는 60분의 복구 시간이 사용되었습니다. 이 회복 시간 범위는 Horn 외 의 실험 조건에서 phagocytic 이벤트를 계수하는 데최적이었습니다. 그러나, 어떤 조건하에서, 이것은 처리 단 사이 phagocytosis에 있는 미묘한 다름을 검출하기 위하여 너무 오래 있을 지도 모릅니다. 제어 및 실험 결과 간의 최대 차이를 드러내는 복구 시간을 결정하기 위해 이전에17이전에 수행되었던 시간 과정 실험을 수행하는 것이 유용할 수 있다. 어떤 회복 시간이 선택되든 모든 실험 적 치료에 걸쳐 일관된 상태를 유지하십시오.
- 같은 날 플루오로 입자 및 pH 에 민감한 입자를 주입하는 경우 각 용액에 새 바늘을 사용하십시오. 그 결과 식세포증, 입자 결합/침몰 대 입자 포함의 두 측면을 구별하지 않기 때문에 두 입자모두 적색으로 개별 파리를 주입하지 마십시오.
4. 등쪽 선박을 해부
- 파리가 60-90분 동안 회복된 후, 살아있는 모든 파리를 빈 유리병으로 옮기고 얼음 위를 움직이지 못하게 합니다.
- 실리콘 엘라스토머 해부 플레이트에 한 번에 한 번의 비행을 옮김합니다.
참고: 실온에서 경화하는 경우 사용 최소 1주일 전에 해부 플레이트를 준비합니다. 이렇게하려면 탄성 동포를 준비하고 33mm x 10mm 페트리 접시에 붓고 접시를 반쯤 채웁니다. 평평한 표면에 접시를 부드럽게 탭하여 기포를 최소화합니다. 접시가 적어도 일주일 동안 방해받지 않고 실온에 앉게하십시오.- 해부 스테레오 현미경에서, 플라이 복부 측면을 위로 오리엔팅.
- 곤충 핀을 사용하여 흉부와 복부의 가장 후방 끝을 통해 다른 핀을 삽입하여 접시에 비행을 고정시생식기(도2A). 해부를 방해하지 않도록 시편을 고정하기 전에 핀을 반으로 자르는 것이 유용할 수 있습니다. 해부 플레이트 당 최대 10 개의 파리와 함께 반복하십시오.
참고: 선택 사항: 날개와 다리를 제거한 후 플레이트로 날아가세요. 이렇게 하면 미디어가 추가될 때 비행 주위의 거품이 형성되는 것을 방지하는 데 도움이 됩니다. - 모든 파리가 접시에 고정되면 전송 파이프를 사용하여 파리 (~1 mL)를 덮을 충분한 해부 미디어를 추가하십시오.
- 집게 또는 큐티클 가위를 사용하여 머리를 제거합니다.
- 큐티클 가위를 사용하여, 두 개의 수평 절개를 합니다: 복부의 후방 핀 바로 위에, 또 다른 하나는 복부의 가장 앞쪽 끝에, 흉부와 복부가 만나는곳(도 2B, C). 도 2에서,머리는 방향을 명확히하기 위해 그대로 남아 있었다.
- 두 개의 수평 절개를 연결하여 수직 절개를 합니다(세 컷은 문자 I와 유사합니다). 이것은 복강을 엽니 다(그림 2D).
- 집게를 사용하여 내부 장기와 조직을 제거하여 등불 혈관을 피하십시오. 방해받지 않으면 투명한 등쪽 용기가 복부의 전방 끝 근처에서 맥동하는 것을 종종 볼 수 있습니다. 추가 핀은 큐티클(그림 2E, F)의새로 잘라 낸 끝을 열어 고정하는 데 사용할 수 있습니다.
- 큐티클 가위를 사용하여 흉부를 제거합니다. 대안적으로, 흉부는 현미경 슬라이드에 해부 된 큐티클 및 등대 혈관을 장착하기 전에 제거 할 수 있습니다.
- 남은 파리와 함께 반복합니다. 해부는 식세포 속도의 가능한 변화를 최소화하기 위해 적시에 날아갑니다. 모든 파리가 해부되면, 부착 된 등대 용기와 큐티스를 접시에 고정. 모든 단계 5는 해부 플레이트에서 수행됩니다. 이렇게 하면 단계 간에 큐티클이 손상또는 실수로 삭제되는 것을 방지할 수 있습니다.
5. 고정 및 염색
- 4% 파라포름알데히드(PFA)에 부착된 등쪽 용기로 해부된 큐디클을 수정합니다.
- 각 단계에 대해 새로운 일회용 이송 파이펫을 사용하여 해부 미디어를 폐기하고 4% PFA의 1mL로 교체하십시오. 고정 및 염색 을 통해 해부를 가능한 한 빛으로부터 보호하십시오.
- 실온에서 15분 동안 배양하고 20rpm에서 흔들리면 됩니다. 이 조직을 손상하기 시작할 수 있기 때문에, 20 분 이상 고정에 앉아 해부를 허용하지 마십시오.
- 1x PBS + 0.1% 트웬(PBST)으로 큐티클 2배 세척.
- 고정을 제거하고 1x PBST의 1mL로 교체하십시오.
- 실온에서 15분 간 흔들어 씻으실 수 있습니다.
- 1x를 반복합니다.
참고 : 해부, 고정 조직은 신선한 PBST로 세척을 대체하여 첫 번째 세척 후, 빛으로부터 보호, 최대 3 일 동안 4 ° C에 저장 할 수 있습니다. 항체가 사용될 경우 고정 된 조직을 저장하지 마십시오. 항체는 최상의 결과를 위해 신선한 조직과 함께 사용되어야 합니다.
- 선택 사항: 항체 염색. 항체는 등쪽 용기를 명확하게시각화(도 3)또는 혈구 특이적 마커를 검출하는 데 사용될 수 있다. 이것은 등쪽 용기를 따라 단지 세포가 계산되거나 혈구의 막을 표시하는 것을 보장할 수 있습니다.
- 두 번째 세척을 제거하고 적절한 희석시 1차 항체를 추가합니다. 4 °C에서 하룻밤 동안 배양하고 흔들수 있습니다.
- 1 차적인 항체를 제거하고, 흔들로 15 분 동안 PBST로 두 번 씻으라.
- 형광 이차 항체를 추가합니다. 형광 입자를 가리지 않도록 녹색 형광 항체를 권장합니다. 2 시간 동안 실온에서 배양하고 흔들수 있습니다.
- 이차 항체를 제거하고 PBST로 각각 15 분 동안 두 번 씻으하십시오.
- DAPI와 얼룩.
- 최종 세척을 제거하고 PBST (1:1000)에서 희석 된 DAPI 1 mL로 교체하십시오.
- 실온에서 흔들리며 20 분 동안 얼룩.
- DAPI를 제거하고 2배 세척합니다(반복 단계 5.2).
- 최종 세척을 신선한 1x PBST로 대체하십시오.
참고 : 파리는 신선한 PBST로 세척을 대체하여 첫 번째 세척 후, 빛으로부터 보호, 최대 3 일 동안 4 ° C에서 저장할 수 있습니다.
6. 현미경 슬라이드 및 이미징에 큐치클 장착
- 해부 된 큐디클을 준비합니다.
- 해부 스테레오 현미경에서, 이미징을 방해할 수 있는 과잉 표피를 잘라.
- 집게를 사용하여, 70% 글리세롤을 포함하는 1.5 mL 마이크로 센트리립후지 튜브로 부착된 등쪽 용기로 큐디클을 전송합니다. 글리세롤에 큐티클을 배치하면 PBST를 제거하고 이미징 중에 더 선명한 이미지를 할 수 있습니다.
- 현미경 슬라이드에 큐치클 마운트.
- 현미경 슬라이드에 70 % 글리세롤 몇 방울을 추가하십시오.
- 집게를 사용하여 글리세롤 튜브에서 큐티클을 제거하고 슬라이드에 글리세롤에 놓습니다.
- 해부 스테레오 현미경에서, 등쪽 혈관이 볼 수 있도록, 혈관을 오리엔트 큐티클 복부 측에 집게사용합니다. 표피의 어두운 안료는 아래로 향합니다.
- 필요한 경우 글리세롤을 추가로 추가합니다. 이렇게 하면 기포를 방지하고 더 선명한 이미지를 할 수 있습니다.
- 큐치클 위에 커버슬립을 부드럽게 놓고 손톱 광택으로 가장자리를 밀봉합니다. 진행하기 전에 10-15 분 동안 건조하십시오. 이미지를 즉시 이미지하거나 4 °C의 방광 상자에 보관하십시오.
- 등갈 용기를 이미지합니다.
- 형광 현미경을 사용하여 구조 간섭 시스템을 사용하여 등광 용기의 광학 섹션을 생성합니다. 공초점 현미경은 추가 정확도를 제공할 수 있는 대안적으로 사용될 수 있습니다. 20배 목표 및 선호하는 이미징 소프트웨어를 사용하여 등쪽 용기의 Z 스택 이미지를 가져옵니다. 10mm 스케일 막대를 추가하고 이미지를 티프파일(그림 4)또는 원하는 형식으로 적절하게 레이블을 지정하고 저장합니다.
참고: 얻은 Z 스택 이미지의 수는 해부마다 다를 수 있으며 등쪽 용기가 해부된 양과 이미지 간의 원하는 단계 크기에 따라 달라집니다. 여기서, 단계 크기는 0.49 mm로 설정되었다. 이 숫자는 스택당 3~40개의 이미지까지 다양합니다.
- 형광 현미경을 사용하여 구조 간섭 시스템을 사용하여 등광 용기의 광학 섹션을 생성합니다. 공초점 현미경은 추가 정확도를 제공할 수 있는 대안적으로 사용될 수 있습니다. 20배 목표 및 선호하는 이미징 소프트웨어를 사용하여 등쪽 용기의 Z 스택 이미지를 가져옵니다. 10mm 스케일 막대를 추가하고 이미지를 티프파일(그림 4)또는 원하는 형식으로 적절하게 레이블을 지정하고 저장합니다.
7. 이미지 분석
- ImageJ를 사용하여 형광 이벤트를 정량화합니다.
- 이미지를 열고 스택 : 이미지 à 스택 아 이미지를 스택합니다.
- DAPI 양성 핵을 중심으로 한 직경 10mm 내에 있는 ~1mm 크기의 형광 신호만 계산하여, 매립당 최소 10개의 세포에서 각 이벤트를 클릭하여, 입자 유형당 연령당 최소 10개의 파리에서: 플러그인 à 분석 아 셀 카운터 고지(그림 5A). 셀 카운터 통지 도구는 추적된 모든 셀에 다른 색상을 할당하며, 해당 셀 내에서 클릭한 모든 형광 이벤트에 해당하는 유색 점을 지정합니다.
- 각 점과 연관된 카운터 및 스택 위치를 나열하거나, 분석 탭 에서 'm'을 누르거나 측정을 선택하거나 결과 표에 각 셀에 계산된 이벤트 수를 표시하려면 'alt +y'(그림5B)를누릅니다.
- 셀 수를 통계 분석에 사용할 스프레드시트로 전송합니다.
- 통계 분석을 수행합니다.
- 고정 효과 ANOVA 또는 혼합 모델 중첩 ANOVA를 사용하여 phagocytic 이벤트의 차이를 분석합니다. 혼합 모델은 연령및 유전자형의 주요 고정 효과와 각유전자형(17)내에 중첩된 개인의 임의의 효과를 테스트하는 데 사용될 수 있다.
참고: 조사관은 데이터를 분석하는 데 사용되는 통계 적 절차의 가정을 테스트하는 데 엄격해야 합니다.
- 고정 효과 ANOVA 또는 혼합 모델 중첩 ANOVA를 사용하여 phagocytic 이벤트의 차이를 분석합니다. 혼합 모델은 연령및 유전자형의 주요 고정 효과와 각유전자형(17)내에 중첩된 개인의 임의의 효과를 테스트하는 데 사용될 수 있다.
결과
설명된 주입 방법을 설명하기 위해 도 1A는 드로소필라 멜라노가스터상에 대한 주사 부위를 보여주고, 식품 염료가 어떻게 플라이가 주입되었다는 시각적 확인을 허용하는가(도1B). 식품 염료의 첨가는 또한 막힌 바늘의 인식에 도움이됩니다. 주사는 복부에서 수행 될 수 있습니다., 하지만 실험에 걸쳐 일관 된 주입 사이트를 유지. 이렇게 하면 각 실험 간의 가능한 변형을 최소화할 수 있습니다.
등불 혈관을 따라 상주 혈청 내의 형광성 입자를 시각화하기 위해 등불 용기와 부착 된 복부 표피를 해부했습니다. 그림 2A-F는 해부 메서드를 간략하게 설명합니다.
식세포증을 수행하기 위해 젊고 숙성된 파리의 연령별 능력을 평가하기 위해 등류 혈관을 따라 혈청이 형광 현미경을 사용하여 시각화됩니다. 등쪽 혈관을 따라 세포만 계산되도록 하기 위해, 헤메스와 헤몰렉틴, 또는 페리카르딘(도3)과같은 특정 혈액 세포 마커 또는 심장 특이적 콜라겐에 대한 항체 또는 GFP 태그 유전자를 각각22,,23,24로사용할 수 있다., 형광으로 표지된 대장균 입자는 길이가 1mm이고, 혈구는 직경17mm이다. DAPI 양성 핵을 중심으로 10mm 직경 내에 위치한 형광 이벤트만계산됩니다(그림 4). 형광 이벤트를 정량화하기 위해 ImageJ 소프트웨어가 사용됩니다(그림5).

그림 1: 사출 사이트 및 시각적 검증. (A)흉부의 측면은 모세관 바늘로 관통된다. (B)주사는 입자 용액에 녹색 식품 염료를 추가하여 시각적으로 확인됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
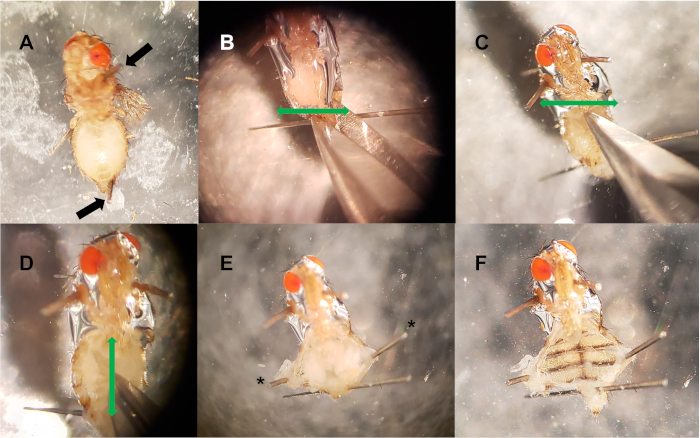
그림 2: 등쪽 용기 해부. (A)핀은 흉부와 후방 복부 (검은 화살)에 배치됩니다. (B-C) 두 개의 수평 절개 (녹색 화살표)는 복부(B)및 전방 끝(C)의후면 끝에서 만들어집니다. (D)수직 절개(녹색 화살표)는 복부의 중간아래로 만들어 두 개의 수평 컷을 연결한다. (E)선택적 핀(*)은 복강을 열어 내부 조직을 노출하는 데 사용됩니다. (F)내부 조직(작물, 창자, 자궁, 난소, 지방체)이 제거되어 등뼈 혈관을 노출시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
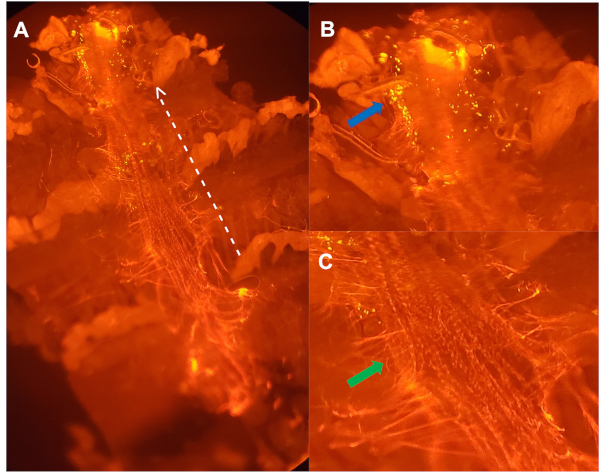
도 3: pH 민감입자를 주입한 5주된 여성으로부터 해부된 등쪽 용기의 복부선보기( A)를대상으로 항체로염색하였다. 점선 흰색 선은 전방 영역을 가리키는 화살표와 함께 등쪽 용기의 측면윤곽을 가리킨다. (B)확대 된 이미지(A)- 동막 용기의 첫 번째 대동맥 챔버 내에서 박테리아를 적극적으로 분해한 혈중 세포 (파란색 화살표)의 클러스터. (C)(A)콜라겐과 같은 단백질인 페리카르딘(Green arrow)의 확대 된 이미지는 등쪽 혈관을 제자리에 고정시키는24. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
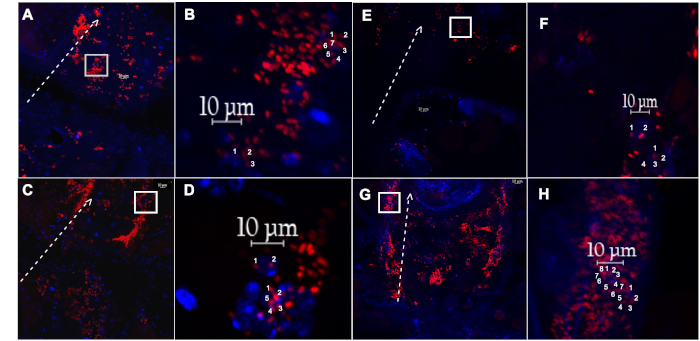
도 4: pH 민감한 입자 또는 불소 입자로 주입된 암컷 플라이로부터 해부된 등쪽 용기 및 관련 혈전. (A)등쪽 용기 및 관련 혈구와 관련된 혈구는 pH 민감 라벨E. 대장균 입자(빨강), 또는(E)불소 라벨이 부착된 대장균 입자(빨강), 1주일B,F된 비행으로부터 분리된 후 60분 동안 회수한후(A)및(E)(흰 상자)의 매율증을 각각 2개나 증식하였다. (C)등쪽 용기 및 관련 혈구와 관련된 혈구는 pH 민감 라벨E. 대장균 입자(빨강), 또는 (G)불소 라벨이 부착된 대장균 입자(빨강), 5주D,H된 비행으로부터 분리된 후 60분 동안 회수한후(C)및(G) 및 (G)개별 적인 매립을 각각 2개( G)로 증식하고 있다. 점선 흰색 선은 전방 영역을 가리키는 화살표와 함께 등쪽 용기의 측면윤곽을 가리킨다. 핵은 DAPI (파란색)로 염색. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
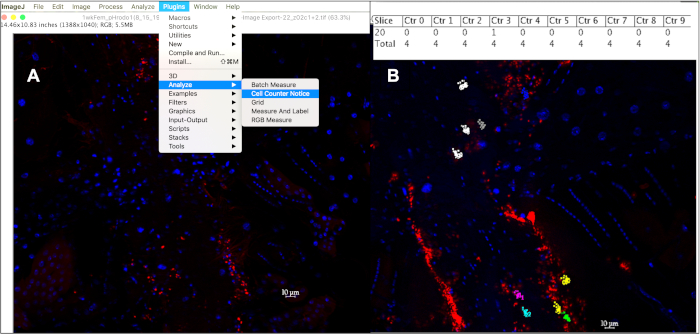
그림 5: ImageJ에서 셀 카운터를 사용하여 10mm 혈구 내에서 식세포 이벤트를 정량화합니다. (A)ImageJ에서 이미지를 열면 셀 카운터 공지 도구를 사용하여 셀당 식세포 이벤트를 추적할 수 있습니다. (B)이 도구는 계산하도록 선택된 각 셀에 다른 색상을 할당하며, 각 점은 해당 셀 내의 형광 이벤트에해당한다. 'alt+y'를 누르면 셀당 계산된 이벤트 수를 보여주는 테이블이 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 설명된 프로토콜은 통제된 실험 조건하에서 phagocytosis의 다른 양상을 정량화하는 신뢰할 수 있는 방법입니다. 우리는 그램 음성 세균 성 입자와 이 절차를 테스트 하 고 결과 그램 긍정적인 세균 성 입자를 사용 하는 경우 다를 수 있습니다. 실제로, 다른 실험 조건에서 그램 음성 및 그램 양성 박테리아모두에 phagocytic 반응을 비교 하는 것이 재미있을 것 이다. 나노 인젝터를 사용하면 사출 량을 정밀하게 제어할 수 있으므로 각 플라이에 동일한 양의 입자가 주입됩니다. 프로토콜에 대한 한 가지 제한은 파티클 준비의 불일치에서 비롯됩니다. 입자가 얼어 나면 집계되므로 희석 볼륨의 작은 변화 또는 소용돌이 부족이 실험 간의 입자 농도에 영향을 줄 수 있습니다. 연령 간 입자 농도의 가능한 변화를 최소화하기 위해 동일한 바늘과 입자 용액을 사용하여 같은 날 1 주 및 5 주 된 파리를 주입하는 것이 좋습니다. 또 다른 잠재적인 단점은 해부 중에 핀을 제대로 처리하지 않으면 등산 용기 및/또는 큐티클이 쉽게 손상될 수 있다는 것입니다. 등대 용기의 방해를 피하기 위해 해부당 사용되는 핀 수를 최소화합니다. 이 해부 방법의 장점은 모든 고정, 세척 및 염색 단계가 해부 플레이트에서 수행 될 수 있다는 것입니다. 큐티클이 고정되어 있기 때문에 단계 사이에 큐티클이 손실되는 것을 방지합니다.
기존방법(18),19,,25,,26,,27,,28, 29에,29비해, 기재된 프로토콜은 그 장점과 한계를 갖는다. 등쪽 용기를 해부함으로써, 우리는 이 위치에서 개별 혈구를 시각화하고 정량화할 수 있습니다. 이것은 실험 단 사이 phagocytic 활동에 있는 미묘한 변이를 검출하는 가능하게 합니다. ,다른 방법은,, 출혈/긁힘 분석19,25, 26,,27,또는 그대로 복부 큐티클(18,19,,1928,29)을통해 혈류세포를 수집하여 형광성 표기28입자를시각화한다.26 그러나, 개별 혈구는 등구 를 통해 시각화될 때 평가될 수 없습니다. 이 프로토콜의 장점은, 출혈/긁힘 방법과 비교할 때 우리의 방법은 우리가 등쪽 용기와 관련된 그 혈구만 평가할 수 있고, 순환 세포 또는 신체 벽을 따라 그 를 고려한다는 것입니다, 이는 기능적으로 다를 수 있습니다. 등쪽 용기를 해부하면 Trypan Blue19,,26과같은 형광 열반이있는 두 번째 주사를 포함 할 필요가 없습니다. 이는 셀에 얽매이지 않거나 셀에 얽매이지 않는 입자가 세척 단계에서 씻겨 나기 때문입니다. 반대로, 대체 메서드는 해부를 필요로 하지 않기 때문에 수행하기 쉬울 수 있습니다. 등쪽 용기를 해부하는 것은 배우기 쉽지만, 이 단계는 일부 실험 설계에서 실현 가능하지 않을 수 있는 복잡성수준을 추가합니다.
생체 내 식세포 분석에서 이의 설명된 사용은 서로 다른 연령 사이의 phagocytic 사건을 평가하고 정량화하는 것이지만, 이 프로토콜은 매우 적응력이 뛰어나며 유전자형, 성별 또는 조직 유형 사이의 phagocytosis의 다른 측면을 분석하는 데 사용할 수 있습니다. phagocytosis대부분의 다세포 동물에 대 한 중앙 중요성되 고, 나이와 함께이 과정 감소 하는 방법을 이해 노화 인구에 대 한 더 나은 치료 치료로 이어질 수 있습니다. 이 접근법은 phagocytosis에 특별한 초점으로 면역 반응에 있는 나이 관련 변경의 양상을 해명하기 위한 장기 적인 잠재력을 제공합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 건강 R03 AG061484-02의 국립 연구소와 자연 및 수학 과학 벡톤 디킨슨 교수 연구 기금의 UMBC 대학에서 보조금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 0.10 mm Insect pins | Fine Science Tools | 26002-10 | Here: pins are cut in half, and the sharp end is used |
| 1 mL sterile syringes | Becton Dickinson | 309602 | Filled with mineral oil to load needle |
| 15% Fetal Bovine Serum (FBS) | Gibco | 16000-044 | for dissection media |
| 16 % Paraformaldehyde | Electron Microscopy Sciences | 15710 | EM-grade, 4% working, diluted in 1X PBS |
| 1x Phosphate buffered saline (PBS) | Sigma | P3813 | |
| 3 mL Trasnfer Pipet | Falcon | 357524 | |
| 3.5" Glass Capillaries | Drummond | 3-000-203-G/X | 1.14mm O.D X 3.5" length X 0.53" I.D |
| 35x10 mm Petri dishes | Becton Dickinson | 351008 | Used as dissection plate, filled half way with Sylgard |
| 6x penicillin/streptomycin | Life Technologies | 15140-122 | for dissection media |
| 70% Glycerol | Sigma | G9012 | |
| Analog Vortex mixer | VWR | 58816-121 | |
| Biological point forceps, Dumont No. 5 | Fine Science Tools | 11295-10 | |
| DAPI (4',6-diamidino-2-phenylindole) | Life Technologies | D1306 | Diluted 1:1000 in 1x PBST |
| Drosophila strain | w[*]; P{w[+mC]=He-GAL4.Z}85, P{w[+mC]=UAS-GFP.nls}8 | ||
| E. coli (K-12 strain) BioParticles™, Alexa Fluor™ 594 conjugate | Life Technologies | E23370 | |
| Glass slides | Premiere | D17026102 | |
| Live cell imaging solution | Life Technologies | A14291DJ | preferred buffer for particle preparation and dilutions |
| Mineral oil | Mpbio | 194836 | |
| Nanoject II automatic nanoliter injector | Drummond | 3-000-204 | |
| Narrow Polystyrene Super Bulk Drosophila Vials | Genesee | 32-116SB | Size: 25 X 95 mm |
| Nutating Mixer | Fisher Scientific | 88-861-043 | Speed used: 20 rpm |
| pHrodo™ Red E. coli BioParticles™ Conjugate for Phagocytosis | Life Technologies | P35361 | |
| Schneider's Drosophila cell culture media (1x) | Gibco | 21720-024 | Dissection media, combine: Schneiders, FBS, and pen/strep; filter sterilize |
| Sodium azide | Sigma-Aldrich | S2002 | 2mM (or 20%) working |
| Spring scissors | Fine Science Tools | 15000-00 | |
| Sylgard 184 Silicone elastomer | Electron Microscopy Sciences | 24236-10 | Prepare according to provided protocol |
| Tween 20 | Sigma | P1379 | For PBS + 0.1% tween |
| Vertical Pipette Puller Model 700C | David Kopf Instruments | 812368 | Heater: 55? Solenoid: 45 |
| Zeiss AxioImager.Z1 fluorescent microscope | Zeiss | Here: Apotome structural interference system with Zeiss Zen imaging software |
참고문헌
- Abhyankar, V., Kaduskar, B., Kamat, S. S., Deobagkar, D., Ratnaparkhi, G. S. Drosophila DNA/RNA methyltransferase contributes to robust host defense in ageing animals by regulating sphingolipid metabolism. The Journal of Experimental Biology. 221, (2018).
- DeVeale, B., Brummel, T., Seroude, L. Immunity and aging: the enemy within. Aging Cell. 3 (4), 195-208 (2004).
- Gomez, C. R., Nomellini, V., Faunce, D. E., Kovacs, E. J. Innate immunity and aging. Experimental Gerontology. 43 (8), 718-728 (2008).
- Panda, A., et al. Human innate immunosenescence: causes and consequences for immunity in old age. Trends in Immunology. 30 (7), 325-333 (2009).
- Aw, D., Silva, A. B., Palmer, D. B. Immunosenescence: emerging challenges for an ageing population. Immunology. 120 (4), 435-446 (2007).
- Min, K. -. J., Tatar, M. Unraveling the molecular mechanism of immunosenescence in Drosophila. International Journal of Molecular Sciences. 19 (9), 2472 (2018).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Hales, K. G., Korey, C. A., Larracuente, A. M., Roberts, D. M. Genetics on the fly: a primer on the Drosophila model system. Genetics. 201 (3), 815-842 (2015).
- Banerjee, U., Girard, J. R., Goins, L. M., Spratford, C. M. Drosophila as a genetic model for hematopoiesis. Genetics. 211 (2), 367-417 (2019).
- Rämet, M., Manfruelli, P., Pearson, A., Mathey-Prevot, B., Ezekowitz, R. A. B. Functional genomic analysis of phagocytosis and identification of a Drosophila receptor for E. coli. Nature. 416 (6881), 644-648 (2002).
- Garschall, K., Flatt, T. The interplay between immunity and aging in Drosophila. F1000Research. 7, (2018).
- Brennan, C. A., Anderson, K. V. Drosophila: The genetics of innate immune recognition and response. Annual Review of Immunology. 22 (1), 457-483 (2004).
- Rosales, C., Uribe-Querol, E. Phagocytosis: a fundamental process in immunity. BioMed Research International. 9042851, (2017).
- Kinchen, J. M., Ravichandran, K. S. Phagosome maturation: going through the acid test. Nature Reviews. Molecular Cell Biology. 9 (10), 781-795 (2008).
- Stuart, L., et al. A systems biology analysis of the Drosophila phagosome. Nature. 445 (7123), 95-101 (2007).
- Mackenzie, D. K., Bussière, L. F., Tinsley, M. C. Senescence of the cellular immune response in Drosophila melanogaster. Experimental Gerontology. 46 (11), 853-859 (2011).
- Horn, L., Leips, J., Starz-Gaiano, M. Phagocytic ability declines with age in adult Drosophila hemocytes. Aging Cell. 13 (4), 719-728 (2014).
- Elrod-Erickson, M., Mishra, S., Schneider, D. Interactions between the cellular and humoral immune responses in Drosophila. Current Biology. 10 (13), 781-784 (2000).
- Garg, A., Wu, L. P. Drosophila Rab14 mediates phagocytosis in the immune response to Staphylococcus aureus. Cellular Microbiology. 16 (2), 296-310 (2014).
- . Bloomington Drosophila Stock Center: Indiana University Bloomington Available from: https://bdsc.indiana.edu/innformation/recipes/molassesfood.html (2019)
- Fellous, S., Lazzaro, B. P. Larval food quality affects adult (but not larval) immune gene expression independent of effects on general condition. Molecular Ecology. 19 (7), 1462-1468 (2010).
- Kurucz, E., et al. Hemese, a hemocyte-specific transmembrane protein, affects the cellular immune response in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 100 (5), 2622-2627 (2003).
- Goto, A., et al. A Drosophila haemocyte-specific protein, hemolectin, similar to human von Willebrand factor. Biochemical Journal. 359, 99-108 (2001).
- Cevik, D., Acker, M., Michalski, C., Jacobs, J. R. Pericardin, a Drosophila collagen, facilitates accumulation of hemocytes at the heart. Developmental Biology. 454 (1), 52-65 (2019).
- Ghosh, S., Mandal, S., Mandal, L. Detecting proliferation of adult hemocytes in Drosophila by BrdU incorporation and PH3 expression in response to bacterial infection. Wellcome Open Research. 3, (2018).
- Hao, Y., Yu, S., Luo, F., Jin, L. H. Jumu is required for circulating hemocyte differentiation and phagocytosis in Drosophila. Cell Communication and Signaling. 16 (1), 95 (2018).
- Petraki, S., Alexander, B., Brückner, K. Assaying blood cell populations of the Drosophila melanogaster larva. Journal of Visualized Experiments. (105), (2015).
- Gyoergy, A., et al. Tools allowing independent visualization and genetic manipulation of Drosophila melanogaster macrophages and surrounding Tissues. G3: Genes, Genomes, Genetics. 8 (3), 845-857 (2018).
- Bosch, P. S., et al. Blood cells of adult Drosophila do not expand, but control survival after bacterial infection by induction of Drosocin around their reservoir at the respiratory epithelia. BioRxiv. 578864, (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유