Method Article
מניפולציה של תאי גזע עצביים יחיד ונוירונים בפרוסות מוח באמצעות Microinjection רובוטי
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מדגים את השימוש בפלטפורמה רובוטית למיקרו-זיקיה לתאי גזע עצביים בודדים ונוירונים בפרוסות מוח. טכניקה זו היא רב-תכליתית ומציעה שיטה למעקב אחר תאים ברקמה ברזולוציה מרחבית גבוהה.
Abstract
שאלה מרכזית בנוירוביולוגיה התפתחותית היא כיצד תאי גזע עצביים ותאי האבות יוצרים את המוח. כדי לענות על שאלה זו, יש לתייג, לתמרן, ולעקוב אחר תאים בודדים ברקמת המוח ברזולוציה גבוהה לאורך זמן. משימה זו היא מאתגרת מאוד בשל המורכבות של רקמות במוח. פיתחנו לאחרונה רובוט, המדריך מחט microinjection לתוך רקמת המוח על ניצול תמונות שנרכשו ממיקרוסקופ כדי לספק נפחי femtoliter של פתרון לתאים בודדים. הפעולה הרובוטית מגדילה את התשואה הכוללת שהיא בסדר גודל גדול יותר ממיקרו-צורך ידני ומאפשרת תיוג מדויק ומניפולציה גמישה של תאים בודדים ברקמה חיה. עם זה, אפשר למיקרו-מיקרוסקופים מאות תאים בתוך פרוסה אורגנוטיפית אחת. מאמר זה מדגים את השימוש ברובוט microinjection עבור microinjection אוטומטי של תאים עצביים ותנוירונים בפרוסות רקמת המוח. באופן רחב יותר, זה יכול לשמש על כל רקמת אפיתל שמציעות משטח שניתן להגיע על ידי פיפטה. לאחר ההגדרה, רובוט microinjection יכול לבצע 15 או יותר microinjections לדקה. רובוט microinjection בשל התפוקה שלה ורסטיליות יעשה microinjection טכניקת מניפולציה תא ביצועים גבוהים פשוטה באופן נרחב לשימוש ביו-הנדסה, ביוטכנולוגיה, וביופיזיקה לביצוע ניתוחים של תא יחיד בפרוסות מוח organotypic.
Introduction
פרוטוקול זה מתאר את השימוש ברובוט כדי למקד ולתמרן תאים בודדים בפרוסות רקמת המוח, התמקדות במיוחד בתאי גזע עצביים יחיד ונוירונים. הרובוט פותח כדי לטפל בשאלה מרכזית בנוירוביולוגיה התפתחותית, כך תאי גזע עצביים וצבי ותאי האבות תורמים למורפוגנזה במוח1,2,3,4,5. כדי לענות על שאלה זו, אחד צריך לתייג ולעקוב אחר תאי גזע עצביים יחיד ולעקוב אחר התקדמות תיור הזמן שלהם לאורך זמן כדי לתאם התנהגות תא יחיד עם מורפוגנזה רקמה. זה יכול להיות מושגת בדרכים שונות, למשל, על ידי אלקטרואידות רקמת המוח ברחם או על ידי תיוג תא יחיד באמצעות מת lipophilic. למרות עוצמה, שיטות אלה חסרות רזולוציה מדויקת של תא יחיד (אלקטרואדות) ו/או את האפשרות לתמרן את החלל התוך תאי (צבע ליפופילי). Microinjection לתאים בודדים פותחה כדי להתגבר על אתגר זה6,7,8. במהלך microinjection, פיפטה מוכנסת לזמן קצר לתוך תא אחד בתוך רקמה שלמה תחת לחץ microinject נפחי femtoliter של reagents9. תיארנו בעבר הליך ידני עבור microinjecting תאי גזע עצביים יחיד ברקמה organotypic (איור 1A)10,11. Microinjection לתוך תאי גזע עצביים מסתמך על השימוש של micropipette כי הוא מוכנס לתוך תאי גזע עצביים יחיד להזריק פתרון המכיל צבע פלורסנט, יחד עם מולקולות אחרות של עניין. פילוח סלקטיבי של תאי גזע עצביים מושגת על ידי התקרבות telencephalon המתפתח דרך פני השטח בחדר (או החדר, לראות קריקטורה איור 1A),שנוצר על ידי קרום פלזמה apical של אבותיים apical (קריקטורה איור 1A). תהליך זה חייב לחזור על עצמו עבור כל תא שהנסוי רוצה להזריק. יתר על כן, ההצלחה של microinjection תלויה בשליטה מדויקת של העומק ומשך של הזרקת micropipette ברקמה. לכן, למרות היתרונות הייחודיים, microinjection ידני הוא מייגע מאוד ודורש תרגול ניכר כדי לבצע בתפוקה סבירה ותשואה, מה שהופך טכניקה זו קשה לשימוש באופן מדרגי. כדי להתגבר על מגבלה זו, פיתחנו לאחרונה רובוט מונחה תמונה, Autoinjector12 (או microinjection רובוט) שיכול לבצע באופן אוטומטי microinjections לתאים בודדים.
הרובוט microinjection עושה שימוש באלגוריתמים מיקרוסקופיים של הדמיה וראייה ממוחשבת כדי למקד במדויק מיקומים ספציפיים בחלל תלת-ממדי בתוך רקמה למיקרו-זיקה (איור 1B). ניתן לבנות את הרובוט microinjection על ידי ביצוע שינויים פשוטים יחסית להגדרת microinjection קיים. השרטוט הכולל של הרובוט microinjection מוצג איור 1C. פיפטה מותקנת במחזיק פיפטה המחובר למניפולטור בעל שלושה צירים. מצלמת מיקרוסקופ משמשת לרכישת תמונות של הרקמה ומחט microinjection. מערכת רגולציה לחץ מותאם אישית משמש כדי לשלוט בלחץ בתוך פיפטה ומיקרו-מאניפולטור הניתן לתכנות משמש כדי לשלוט במיקום של פיפטה microinjector. תמונות המצלמה של הרקמה ופיפטה microinjection משמשים כדי לקבוע את המיקום המרחבי של קצה פיפטה microinjection ואת המיקומים שבהם microinjections צריך להתבצע. לאחר מכן התוכנה מחשבת מסלולים הדרושים כדי להעביר את הפיפטה בתוך הרקמה. כל החומרה נשלטת על ידי התוכנה שפיתחנו בעבר. כל התוכנות נכתבות בשפת קידוד (למשל, פיתון ו-Arduino) ותוכל להוריד https://github.com/bsbrl/Autoinjector הוראות. ממשק המשתמש הגרפי (GUI) מאפשר למשתמש למצוא תמונה של הרקמה והמיקרו-פיפט, ולהתאים אישית את המסלול של מיקרו-ג'ציה. המערכת שלנו יכולה להתבסס באמצעות שינויים פשוטים יחסית למיקרוסקופ הפוך המצויד במסנני ברייטפילד ואפיפלורסנס.
ראשית, אנו מספקים הוראות להכנת פרוסות רקמה אורגנוטיפית במוח עבור microinjection. לאחר מכן הפרוטוקול ממחיש את הפעלת רובוט microinjection ואחריו שלבי הכנה, כגון כיול תנועה פיפטה, כי צריך להיעשות לפני microinjection. לאחר מכן הגדרת הפרמטרים של ההזרקה. לאחר מכן, המשתמש יכול להגדיר את המסלול המשמש את הרובוט microinjection ולהתחיל את הליך ההזרקה. רקמה microinjected (במקרה זה פרוסות רקמה organotypic המוח) ניתן לשמור בתרבות לפרקי זמןשונים בהתאם לעיצוב ניסיוני 10,11. הרקמה יכולה להיות מעובדת כדי לעקוב וללמוד את הזהות והגורל של התאים המוזרקים וצידלהם. לחלופין, ניתן לעקוב אחר התאים microinjected באמצעות הדמיה חיה. במסגרת פרוטוקול זה, אנו מדגימים את השימוש ברובוט כדי microinjection אוטומטי תאים עצביים בפרוסות organotypic של עכבר E14.5 telencephalon גב. הרובוט מסוגל עוד יותר microinjection לתוך נוירונים יילודים בעכבר telencephalon, כמו גם טלנספלון העוברהאנושי 12.
לסיכום, אנו מתארים פלטפורמה רובוטית שניתן להשתמש בה כדי לעקוב אחר תאים בודדים ולתמרן ברקמות. הפלטפורמה עושה שימוש בלחץ וזה, לכן, מאוד תכליתי כמו האופי הכימי של המתחם להזריק. בנוסף, ניתן להתאים אותו לתאי יעד אחרים מאשר תאי גזע. אנו מצפים שהמערכת שלנו תותאם בקלות גם למערכות מודל אחרות.
Protocol
כל המחקרים בבעלי חיים נערכו בהתאם לחקיקה הגרמנית לרווחת בעלי חיים, והרישיונות הדרושים הושגו מהועדה האתית האזורית לניסויים בבעלי חיים בדרזדן, גרמניה (Tierversuchskommission, Landesdirektion דרזדן). פרוסות אורגנוטיפיק הוכנו מ- E14.5 או E16.5 C57BL/6 עכבר עוברי telencephalon (מעבדות Janvier).
1. התקנת תוכנה
- בצע את ההוראות כדי להתקין את התוכנה https://github.com/bsbrl/Autoinjector.
2. הכנת ריאגנטים ופיפטות
- Agarose: להכין 3% agarose על ידי המסה נפרדת 3 גרם של מגוון רחב agarose ו 3 g נקודת התכה נמוכה agarose ב 100 מ"ל של PBS תרבות התא כיתה בשני בקבוקי זכוכית נפרדים 200 מ"ל, בהתאמה. לאחסן בטמפרטורת החדר עד 3 חודשים.
- תמיסת טירוד: להמיס 1 גרם של נתרן ביקרבונט ומלח של טיירוד (להשתמש בתוכן של הבקבוק כולו) ו 13 מ"ל של 1 M HEPES ב 1 L של מים מזוקקים. כוונן את ה-pH ל- 7.4. סנן את הפתרון באמצעות מסנן 0.2 μm בקבוק העליון.
- פרוסת תרבות בינונית (SCM): להוסיף 10 מ"ל של סרום חולדה, 1 מ"ל של 2 מ"מ גלוטמין, 1 מ"ל פניצילין-סטרפטומיצין (100x), 1 מ"ל של N-2 תוספת (100x), 2 מ"ל של B27 תוספת (50x) ו 1 מ"ל של HEPES (pH 7.3) מאגר לתוך 84 מ"ל של נוירובאסל בינוני. Aliquot 5 מ"ל של SCM לתוך צינורות 15 מ"ל. לאחסן ב -20 °C.
- CO2-מיקרו-ג'ינג'י עצמאי בינוני (CIMM): להכין 5x DMEM שונה תמיסת גלוקוז נמוכה (ללא אדום פנול) על ידי המסת האבקה ב 200 מ"ל של מים מזוקקים. פתרון סינון באמצעות מסנן בקבוק 0.2 μm העליון (עבור אבקת DMEM, להשתמש בתוכן של הבקבוק כולו). כדי להכין 100 מ"ל של CIMM, לערבב 20 מ"ל של 5x DMEM שונה פתרון, 1 מ"ל של מאגר HEPES, 1 מ"ל של N2 תוספת (100x), 2 מ"ל של תוספת B27 (50x), 1 מ"ל של פניצילין סטרפטומיצין (100x), 1 מ"ל של 2 mm גלוטמין ו 74 מ"ל של מים מזוקקים. אחסן את הפתרון ב- 4 °C.
- מאגר איסוף מחדש: הכן את מאגר ההשבתה מחדש על-ידי המסת 262 מ"מ NaHCO3, 0.05 N NaOH, 200 מ"ר HEPES במים מזוקקים. לחטא את הפתרון על ידי סינון באמצעות בקבוק העליון 0.22 μm מערכת מסנן לתוך בקבוק זכוכית סטרילית. Aliquot 500 μL של מאגר reconstitution לתוך צינורות מיקרוצנטריפוגה אטומה. לאחסן ב-4°C.
- מלאי צבע microinjection: להמיס את הפלואורסצנט מסומן Dextran במים מזוקקים RNase חינם (ריכוז סופי 10 μg / μL). הכינו 5 μL aliquots ולאחסן ב -20 °C לשימוש.
- משוך את פיפות microinjection מן נימים זכוכית borosilicate (1.2 מ"מ קוטר, 0.94 מ"מ קוטר פנימי) באמצעות מושך micropipette. להגן על הפיפטות מפני אבק. אין לאחסן פיפטות במשך יותר מ- 2-3 ימים. עבור ניסוי זה, הפרמטרים מושך היו חום: טמפרטורת רמפה +1 – 5; משוך: 100; מה-ו11; 110. 100. HEAT ו- VEL הם הפרמטרים המשפיעים על הצורה והגודל הגדולים ביותר של הפיפטה.
הערה: פיפטה microinjection אופטימלי יש קצה ארוך וגמיש, כדי למנוע נזק לתא במהלך microinjection.
3. הכנת פרוסת רקמה
- ממיסים את המגוון הרחב של 3% באמצעות תנור מיקרוגל לפני ניתוח רקמת המוח. אל תיתן agarose להתגבש על ידי שמירה באמבט מים ב 37 מעלות צלזיוס לפני הטבעה. ודא כי הפיפטות מוגנות מפני אבק. אין לאחסן פיפטות במשך יותר מ- 2-3 ימים.
- להפשיר aliquot של SCM וחם 10 – 12 מ"ל CIMM ו 20 מ"ל של הפתרון של Tyrode 37 מעלות צלזיוס באמצעות אמבט מים.
- לערבב את מעקב פלורסנט (Dextran-3000 או Dextran-10000-אלקסה יחד; ריכוז סופי 5 – 10 μg / μL) עם כימיים אחרים להיות מוזרק. צנטריפוגה תמיסת microinjection ב 16, 000 x g עבור 30 דקות ב 4 ° C. לאסוף את supernatant ולהעביר לתוך צינור חדש. שמור את תמיסת microinjection על קרח עד לשימוש.
- השתמש בראשים מ E13.5 – E16.5 עוברי עכבר כדי להכין פרוסות רקמה organotypic של telencephalon. הסר את העור ופתח את הגולגולת באמצעות המפסים, נע לאורך קו האמצע. לנתח את המוח העוברי מהגולגולת הפתוחה ולהסיר את קרום המוח מכסה את רקמת המוח החל מהצד האוורני של המוח. השאר את המוח המקוע בתמיסה של טיירוד על בלוק חימום של 37 מעלות צלזיוס.
הערה: יש לבצע את כל שלבי הפירוק המתוארים ב- 3.4 בפתרון של Tyrode לפני ההחממה. - יוצקים את המגוון הרחב של אגרוז נמס לתוך תבנית הטבעה חד פעמית. כאשר agarose מקורר 38 – 39 ° C, בזהירות להעביר את המוח (מקסימום של 4) לתוכו באמצעות פיפטה פסטר. השתמש תמיד בטיפים חתוכים עבור שלב זה.
- מערבבים את האנגרוז סביב הרקמה באמצעות מרית או זוג מפסים #1 מבלי לגעת ברקמה. תנו לאגרוז לגבש בטמפרטורת החדר. ברגע שהאגרוז התגבש, לקצץ את ההתגה העודפת המקיפה את הרקמה.
- מלא את מגש המאגר ב- PBS. לכוון את המוח עם ציר rostro-caudal של הרקמה ניצב למגש (להשתמש כציון דרך נורות חוש הריח, המייצג את החלק rostral-רוב של המוח). חותכים פרוסות של 250 μm באמצעות ויברטום.
- מלאו צלחת פטרי ב-3.5 ס"מ עם 2 מ"ל של מדיה טרום חחממה. בעזרת פיפטת פסטר מפלסטיק, מעבירים פרוסות (10-15) למנה זו. לאחר מכן, מעבירים את צלחת הפטרי עם הפרוסות לתוך אינקובטור תרבות הפרוסה. שמרו על פרוסות ב-37°C באווירה לחה המכילה 40% O2 / 5% CO2 / 55% N2 עד לשימוש.
4. מיקרו-עין
- הפעל את המחשב, מיקרוסקופ, מצלמת מיקרוסקופ, מניפולטורים, אסדת לחץ, חיישן לחץ. טען את היישום על-ידי לחיצה על הקובץ "launchapp.py" בתיקיה הראשית שהורדה מ- GitHub וציין את הגדרות ההתקן במסך המוקפץ (ראה שלב 1.1 לקבלת הוראות התקנה).
- צור לחץ חיצוני כדי למנוע סתימה לא רצויה לפני ההטת פיפטה לתוך הפתרון. כדי להפעיל לחץ על הפיפטה, החלק את סרגל לחץ הפיצוי ל- 24 – 45% ולחץ על קבע ערכים. לאחר מכן, כוונן את הלחץ ללחץ מספיק על-ידי הפיכת ידית שסתום הלחץ המכני ל- 1 – 2 PSI (69 – 138 mbar) כפי שצוין על-ידי חיישן הלחץ.
- מעבירים את הפרוסות לצלחת פטרי ב-3.5 ס"מ המכילה 2 מ"ל של CIMM מחמם מראש. מניחים את הפרוסות למיקרו-פרוייקט במרכז צלחת פטרי. מעבירים את צלחת פטרי לשלב המיקרו-עיבוי שחומם מראש (37°C).
- טען את פיפטה microinjection עם 1.4 –1.6 μL של פתרון microinjected (מ שלב 3.3) באמצעות פיפטה פלסטיק עם קצה ארוך. הכנס את הפיפטה microinjection על מחזיק פיפטה.
- באמצעות ההגדלה הנמוכה ביותר במיקרוסקופ, הביאו את הפרוסה לפוקוס והדריכו את המיקרו-פיפט לשדה תצוגה זה (FOV) כך שיתמקד באותו מישור של יעד הפרוסה. העבר את הפלט של המיקרוסקופ למצלמה כדי לראות את FOV ביישום.
- לחץ על לחצן הגדלה בצד הימני העליון של הממשק כדי ליזום כיול התקן. חלון יבקש לבחור את ההגדלה. בחר את ההגדלה של 10x, או כל הגדלה שהעדשה מוגדרת ל (לדוגמה, 4x, 10x, 20x, 40x) ולחץ על Ok. התוכנה מניחה עדשת המטרה הפנימית היא 10x (הגדלה העדשה האובייקטיבית הנפוצה ביותר).
- מקוד מחדש את קצה הפיפטה באמצעות הגלגל המיקרוסקופי ולחץ על קצה הפיפטה עם הסמן. לאחר מכן, לחץ על לחצן שלב 1.1 ולחץ על אישור בחלון המוקפץ. הפיפטה תזוז בכיוון Y. לחץ על קצה הפיפטה ולחץ על לחצן שלב 1.2. לבסוף, הזן 45 לתוך התיבה זווית פיפטה ולחץ על זווית הגדר.
- הזן את הפרמטרים הרצויים בחלונית פקדי מיקרו-הזנה אוטומטית. עבור microinjection לתוך רבי חסות apical להגדיר את מרחק ההזרקה 20 – 40 μm ועומק 10 – 15 μm. עבור microinjection לתוך נוירונים להגדיר את מרחק ההזרקה 30 – 40 μm מהצד בסיס, ועומק 10 – 30 μm תלוי מה הוא להיות ממוקד. הגדר תמיד מהירות ל- 100%. לחץ על הגדר ערכים.
הערה: מרחק הגישה הוא המרחק פיפטה שולפת מתוך הרקמה לפני המעבר למרחק ההזרקה הבא, עומק הוא עומק לתוך רקמה microinjection הולך, מרווח הוא המרחק לאורך הקו בין זריקות רציפות, מהירות היא המהירות של פיפטה ב μm / s. - לחץ על לחצן צייר קצה וגרור את הסמן לאורך המסלול הרצוי בחלון המוקפץ כדי להגדיר את מסלול ההזרקה. עבור microinjecting תאי גזע אב אדם, הצד האוורירי של משטח telencephalon ממוקד כפי המוצג איור 2A. הבא את הפיפטה לתחילת השורה ולחץ על קצה הפיפטה. לחץ על הפעל מסלול כדי להתחיל microinjecting. חזור על שלב זה עבור כל מישור של הזרקה ממוקד (בדרך כלל נעשה עבור 3 – 4 מטוסים עם 40 – 75 זריקות לכל מטוס).
5. תרבות רקמות ועיבוד פרוסת רקמות עבור אימונולוסס
- הכן את תערובת הקולגן (1.5 מ"ג/מ"ל): לצינור להוסיף 1.25 מ"ל של פתרון מטריקס, 0.5 מ"ל של מים מזוקקים, 0.5 מ"ל של 5x DMEM-F12 פתרון 0.25 מ"ל של מאגר reconstitution. שמור אותו על קרח עד לשימוש.
- השיגו את צלחת פטרי המכילה את הפרוסות המיקרו-אינטג'יז'ות מתא הדגירה של תרבות הפרוסה וטבולים את הפרוסות בתערובת הקולגן.
- מעבירים את הפרוסות יחד עם 200-300 μL של תערובת קולגן לבאר של 14 מ"מ של צלחת זכוכית-תחתית של 35 מ"מ. ודא כי הפרוסות מכוסות בפחות קולגן. הגדרה זו מאפשרת את התנאים האופטימליים עבור חומרים מזינים וספיגת חמצן.
- כוון את הפרוסות תוך הקפדה על כך שיש מספיק מקום בין הפרוסות באמצעות שני זוגות מפסים. דגירה את צלחת פטרי במשך 5 דקות ב 37 מעלות צלזיוס באמצעות בלוק חימום כדי לאפשר את הקולגן להתגבש. שקול את הזמן הזה כ- t = 0 של תרבות פרוסה.
- מעבירים את צלחת הפטרי בחזרה לאקובטור תרבות הפרוסה למשך 40 דקות נוספות. לאחר מכן הוסף 2 מ"ל של SCM טרום חמם. פרוסות נשמרות בתרבות עד לנקודת הזמן הרצויה.
- להוציא את הפרוסות מתוך אינקובטור תרבות פרוסה ולאסוף את SCM. יש לשטוף את פרוסות הקולגן המשובצות ב-PBS אחד. הוסף 4% (wt /vol) paraformaldehyde (ב 120 mM פוספט מאגר, pH 7.4) ולהשאיר את הרקמה ב RT במשך 30 דקות. לאחר מכן העבר אותו ל- 4 °C כדי לאפשר קיבעון לילה.
- שאף את פתרון paraformaldehyde למחרת ולבצע 1x PBS שטיפה. כדי להסיר את הפרוסות מה קולגן, השתמשו בשני זוגות מפסים כדי לחלץ בעדינות את הפרוסות מתחת לסטריאומיקרוסקופ.
- השתמשו במיקרוגל כדי להמיס את 3% (wt/vol) נקודת התכה נמוכה agarose לעיבוד פרוסות microinjected. יוצקים את האגרוז המומס לתבנית הטבעה חד פעמית ולתת לו להתקרר סביב 38 – 39 מעלות צלזיוס.
- מעבירים את פרוסות הרקמה ממדרגה 5.7 לתבנית זו המכילה אגז נמס נמוך באמצעות פיפטת פסטר מפלסטיק. ודא שהצד הזוויתי של הפרוסה הוא למעלה ופני השטח בחדר עם הפנים כלפי מטה. במידת הצורך אוריינט בהתאם. תן לאגרוז להתקרר עד RT כדי להתגבש.
- חותכים את התוספת המקיפה את הפרוסות. כוון את בלוק agarose כדי להבטיח כי משטח החתך מקביל להב החיתוך של vibratome. באמצעות ויברטום, לחתוך 50 μm מקטעים עבים.
- ממלאים צלחת של 24 בארות ב-1x PBS. מעבירים את המקטעים לצלחת זו באמצעות מכחול עם קצה קצות עדינים. בצע אימונו-לודיזם באופן לפי הפרוטוקולים הסטנדרטיים.
תוצאות
Microinjection משרת את המטרה של מעקב ומניפולציה של תאי גזע עצביים יחיד וצידלהם ברקמה חיה ולעקוב אחר התקדמות נסיון שלהם בסביבה פיזיולוגית. במאמר זה, הוכחנו את השימוש ברובוט microinjection עבור מיקוד ובאופן אוטומטי microinjecting פרוסות organotypic של telecephalon העכבר. איור 2 ממחיש תמונות מייצגות של תאי אב אדם שהוזרקו בהצלחה ואיור 3 ממחיש נוירונים שהוזרקו יילוד. כאשר מוזרק עם Dextran Alexa-488 (או אלקסה-A555) צבע, תאים מופיעים מלאים לחלוטין עם הצבע. באשר לקבוגנים(איור 2)הדמיה קונפוקלית מאפשרת לשחזר ברזולוציה מרחבית גבוהה את המורפולוגיה של התא, את הנוכחות או את ההיעדרות של הקובץ המצורף האפאלי והבזלי, ולשלב את החקירה המורפולוגית עם ביטוי סמן. על-ידי שילוב קריטריונים אלה, המשתמש יכול להקצות גורל תא ספציפי לתאים microinjected וצידלהם. באשר הזרקת הנוירון, המשתמש יכול לשחזר את מורפולוגיה עצבית, כולל המבנה והתכונות של דנדריט ואקסון apical. microinjection אוטומטי יכול לספק תפוקה גבוהה יותר באופן משמעותי בהשוואה microinjection ידני(איור 2B). יתר על כן, תיוג EdU מאשר כי הכדאיות של תאים אינה מושפעת אוטומציה (איור 2C). שמירה על פרוסה organotypic בתרבות מאפשרת בעקבות התקדמות תחכום של תאים microinjected (הצגנו 4 - 24h באות 2D). אם תמיסת microinjection מכיל חומר גנטי (DNA, mRNA, CRISPR-Cas9 מדריכים) או חלבונים רקומביננטיים, אז זה מאפשר ללמוד אם ואיך התקדמות lineage מושפעת המניפולציה.
Microinjection לתוך תאי גזע עצביים יחיד ברקמה מספק רזולוציה מעולה של תא יחיד וסיבה זו הוא שימש לנתח את הביולוגיה התא של התקדמות תאי גזע עצביים ומעבר גורל(איור 3A). Microinjection מאפשר משלוח של תערובת מורכבת של כימיקלים. בעבר עשינו שימוש בתכונה זו כדי ללמוד צימוד צמתים בתאי האבות העצביים על ידי ערבוב gap-junctional חדיר עם צבעי פלורסנט בלתי חדיר צומתי פער12. הארכנו את העבודה הקודמת על ידי לימוד צימוד צמתים בנוירונים שזה עתה נולדו, על ידי הזרקת לוציפר צהוב יחד עם Dextran-A555 (איור 3B). כפי שהראה בדמות 3B, חלק מהנוירונים הפירמידליים שזה עתה נולדו מזוגים דרך צמתים של פער לנוירונים סמוכים. תצפית זו עולה בקנה אחד עם הרעיון כי נוירונים ילדותיים לתקשר דרךצומת פער 13,14. יתר על כן, מיקוד נוירונים מראה כי השימוש ברובוט microinjection יכול להיות כללי למספר סוגי תאים במוח היונקים המתפתחים. התקנה ניסיונית זו תהיה שימושית לנתח את הביולוגיה התא של נוירונים ברקמה, למשל על ידי אספקת אוליגופפטידים ספציפיים כדי להפריע אינטראקציות חלבון-חלבון.
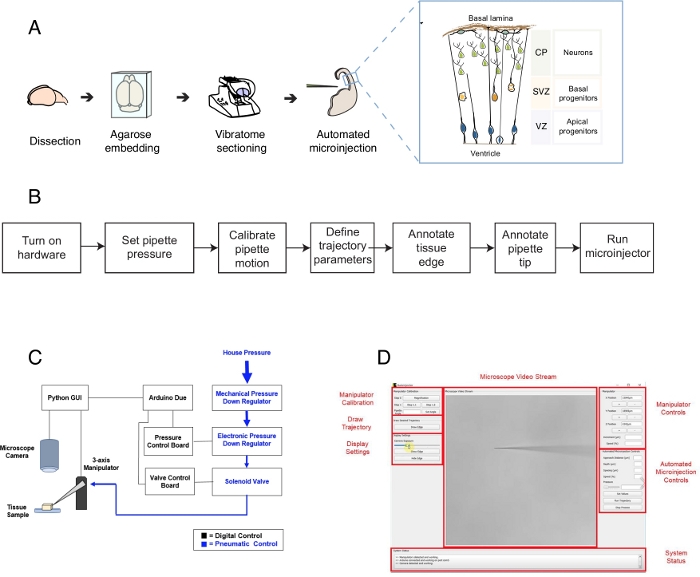
איור 1: התקנה אוטומטית של מיקרו-תחום ונהלים. (א)פרוטוקול כולל להכנת רקמות ומיקרו-הזנות אוטומטיות באמצעות הרובוט microinjection. תחילת ימין: סכמטי קריקטורה של העכבר Telencephalon ממוקד microinjection בפרוטוקול זה. (ב)תרשים זרימה של שלבי microinjection אוטומטיים. (ג)סכמטי של חומרת הרובוט microinjection. (D) ממשק משתמש גרפי (GUI) של התוכנה המשמשת לשליטה ותפעול של רובוט microinjection. נתון זה מותאם מ- Ref.12. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
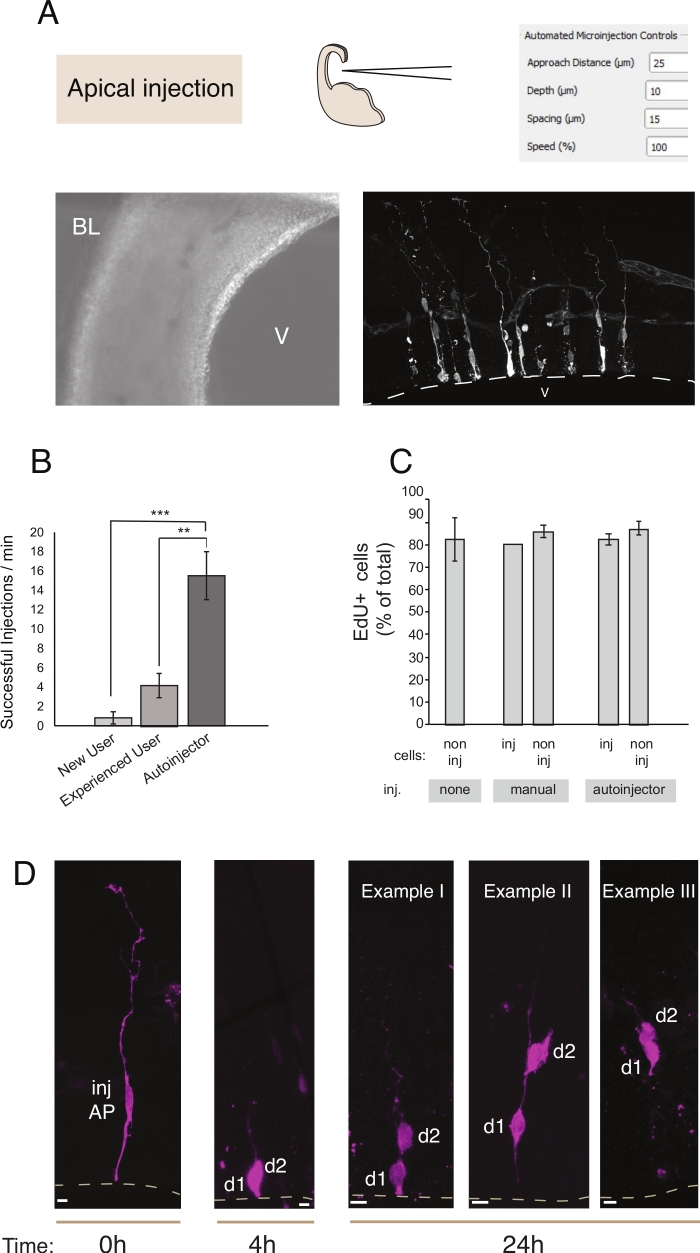
איור 2: מיקרו-ציה רובוטית לתוך אבותיים. תוצאות סכמטיות וצפויות בעת שימוש ברובוט microinjection כדי למקד אבותיים apical (APs) באמצעות פני השטח apical (הזרקה apical). שורהלמעלה. בצד שמאל: סכמטי של התהליך. בצד ימין: GUI עם פרמטרים רלוונטיים עבור הזרקה apical. שורה למטה. בצד שמאל: תמונת ניגודיות שלב שצולמה במהלך הליך ההזרקה (V: חדר; BL: למינה בזל). בצד ימין: תוצאות מייצגות המציגות איי.פי. קו מקווקו מייצג את החדר (V). סרגל קנה מידה: 10 μm. (ב)זריקות מוצלחות לדקה עבור משתמש מתחיל על מערכת microinjection ידנית, משתמש מנוסה על מערכת microinjection ידנית, ואת רובוט microinjection. (ג)התאגדות EDU בתאים microinjected ותאים שאינם מוזרקים באזור המוזרק. פרוסות אורגנוטיפיק של עכבר E14.5 telencephalon הגב היו או (i) לא מוזרק או (ii) נתון microinjection ידני או אוטומטי (פרוסה מוזרק) באמצעות Dextran-A488 (עבור מזרק ידני ואוטוי). פרוסות נשמרו בתרבות בנוכחות EdU במשך 24 שעות, אז הם תוקנו ומוכתמים עבור DAPI ו EdU. תאים מוזרקים ולא מוזרקים באזור המוזרק הובקעו עבור חיוביות EdU. (ד)שימוש במעקב תוחם רובוט microinjection. צבע פלורסנט (Dx3-A555, מגנטה) מוזרק לתא גזע עצבי יחיד (t = 0 h). צבע הפלורסנט מחולק לתאי הבת (d1, d2) במהלך המיטוזה. הדבר מאפשר לעקוב אחר הצטיידות של התא המוזרק (t = 4 שעות ו- 24 שעות) וחושף את התקדמות תחכום הזמן. עבור t = 24 שעות, אנו מראים מספר דוגמאות של צרגיות אחד מצפה למצוא. סולם ברים: 10 μm. גרפים ב B ו- C נלקחים מ- ref.12 אנא לחץכאן כדי להציג גירסה גדולה יותר של דמות זו.
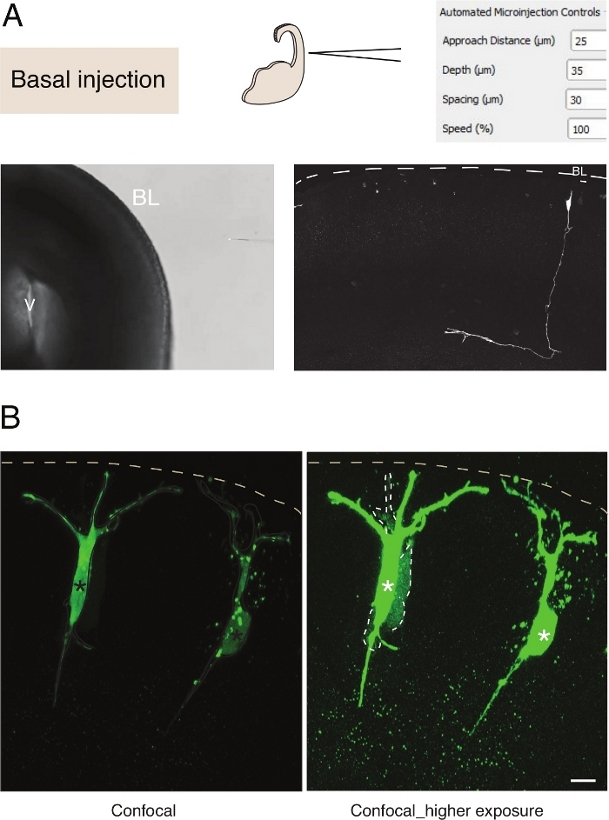
איור 3: מיקרו-ציה רובוטית לנוירונים. תוצאות סכמטיות וצפויות בעת שימוש ברובוט microinjection למקד נוירונים פירמידה (N) באמצעות פני השטח בזל (הזרקת בזל). שורהלמעלה. בצד שמאל: סכמטי של התהליך. בצד ימין: GUI עם פרמטרים רלוונטיים להזרקת בסיס. שורה למטה. בצד שמאל: תמונת ניגודיות שלב שצולמה במהלך הליך ההזרקה (V: חדר; BL: למינה בזל). בצד ימין: תוצאות מייצגות המציגות קו N. Dashed microinjected מייצג את למינה בסיס (BL). סרגל קנה מידה: 10 μm. (ב)שימוש ב- autoinjector כדי ללמוד תקשורת צומתית פער ברקמה. נוירונים פירמידה הוזרקו עם פתרון המכיל שני צבעים: הפער צומתי-חסין Dx-A555 (לא מוצג) ואת הפער-צומתי לוציפר צהוב (ירוק). Dx-A555 מוגבל לתא המיועד (כוכביות), בעוד שה- LY מתפקע לתאים המחוברים באמצעות צומת רווח לתא המיועד (קווים מקווקווים). לוח שמאלי: חשיפה נמוכה, רק התאים המיקרו-אינג'יים גלויים. החלונית הימנית: חשיפה גבוהה מאפשרת הדמיה של התאים המוזרקים, כמו גם את התאים המזוגים (קווים מקווקווים). סרגל קנה מידה: 10 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של דמות זו.
קובץ משלים: פתרון בעיות של מספר שגיאות נפוצות המתעוררות במהלך microinjection. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
Microinjection לתוך תאי גזע עצביים יחיד ברקמה מספק רזולוציה מעולה של תא יחידוסיבהזו הוא שימש לנתח את הביולוגיה התא של התקדמות תאי גזע עצביים ומעבר גורל(איור 2;ראהגם 10,11,12). הליך microinjection אוטומטי יכול להתבצע על סוגים אחרים של תאים בעכברים עובריים ורקמות מוח אנושיות. תוצאות מייצגות של microinjection של נוירונים שזה עתה נולדו על ידי מיקוד פני השטח הבסאלי של telencephalon מוצגים איור 3.
העיקרון שנקבע כאן יכול להיות מיושם כדי למקד מספר סוגי תאים שונים במוח העכבר העוברי ומוח אנושי. הראינו בעבר כי הרובוט microinjection יכול לשמש גם כדי למקד תאים חד-אדם האבות האחוריים בעכבר וtelencephalon ונוירונים שזה עתה נולד בעכבר ואדם פיתוח neocortex12. כדי להשיג את התוצאות הטובות ביותר של הליך ההזרקה, אחד צריך למטב את כל השלבים לפני תחילת ההזרקה. חשוב לשקול בזהירות ולייעל את הכנת פרוסות רקמת אורגנוטיפיק בת קיימא ושמורה היטב מרקמות המוח(איור 1). זה חיוני להיות מהיר בהליך החיתוך וחיתוך מאויר באיור 1. עבור הזרקה apical מיקוד APs, אחד צריך לבחור את הפרוסות המציגות את הכיוון האידיאלי של פני השטח apical. עבור הזרקת APs, הכיוון האידיאלי הוא פני השטח apical ניצב לתחתית צלחת פטרי. כל אוריינטציה אחרת תהיה מתירנית גם כן, עם זאת, פני השטח האפתי ניצב לצלחת פטרי מספק שטח פנים רחב יותר להזרקה, ובכך להגדיל את ההצלחה של הזרקה. עבור הזרקה לתוך נוירונים, הכיוון של הפרוסה משחק מעט עד לא השפעה.
לאחר הבחירה של הפרוסות להזרקה, הליך ההזרקה לכל פרוסה אורך כ-5 דקות. בהתחשב בכך אחד עובד עם רקמה חיה, מומלץ מאוד כדי להאיץ את הליך ההזרקה. לכן אנו ממליצים להגדיר את כל הפרמטרים להזרקה באמצעות GUI(איור 1D)לפני הרקמה מוכנה, כדי להפחית את כל זמן המתנה מיותר. לפתרון בעיות נא עיין בקובץ המשלים.
במקרה של תרבות פרוסה לטווח ארוך, צעדים לאחר הליך microinjection אוטומטי יכול להשפיע על הבריאות של התאים ובכך הניסוי. לכן, מומלץ מאוד להריץ בדיקת בקרת איכות ולמטב את תנאי תרבות הפרוסה. כדי להעריך את הכדאיות של תאים לאחר הליך החיתוך וההזרקה, ביצענו תיוג EdU במהלך התרבות, כימתנו את מספר הגרעין הפיפנוטי (פרוקסי לתאים אפופטוטיים) בתרבויות והזריקנורקמה 12. כימות אלה לא חשפו כל השפעה משמעותית של microinjection על הכדאיות רקמות (איור 2C). אנו ממליצים להפעיל בקרות איכות דומות תוך הקמת חיתוך רקמות אורגנוטיפיקצינור microinjection במעבדה.
בהשוואה למיקרו-ציה ידנית, הרובוט microinjection מספק מספר יתרונות. ראשית, עקומת הלמידה עבור המשתמש היא פחות תלולה בהשוואה להזרקה ידנית: משתמש חדש יגיע למיומנות גבוהה לאחר מספר מוגבל של הפעלות, בדרך כלל 1 או 2. שנית, במקרה של מיקרו-ניסיון ידני, מיומנות דומה דורשת חודשים של אימונים. הליך ההזרקה מהיר ויעיל יותר(איור 2B). כימות פרמטרים אלה ומצאנו כי רובוט microinjection התעלה על משתמש ידני מיומן ביחס להצלחה ההזרקה (% של הזרקה מוצלחת / מספר כולל של זריקות) ובמספר הכולל של זריקות ליחידהזמן 12. התוצאה היא עלייה כוללת של 300% ביעילות ההזרקה (% של הזרקה מוצלחת / דקות) עבור רובוט microinjection בהשוואה למשתמש מיומן. העלייה ביעילות הייתה בולטת עוד יותר כאשר משווים את הרובוט microinjection עם משתמש מתחיל והגיע 700%. אחרון חביב, רובוט microinjection יכול להיות מתוכנת בקלות לחקור באופן שיטתי את כל הפרמטרים המרחביים. זה יתרון במיוחד בעת התאמת רובוט microinjection למקד תאים חדשים או רקמות, או בעת שימוש ברובוט microinjection למטרות הדורשות רזולוציה מרחבית שונה.
בניית רובוט microinjection דורש שינויים מינימליים מיקרוסקופ אפינפרוסנט קיים12. בעבר סיפקנו הוראות לעיבוד זה https://github.com/bsbrl/Autoinjector. לאחר הגדרת החומרה, פרוטוקול זה מספק פרטים מתודולוגיים מרכזיים לביצוע בהצלחה של מיקרו-עיטוריות אוטומטיות. בסך הכל, רובוט microinjection יש קצב הזרקה מוצלח של 15.52 + 2.48 זריקות /min, שהוא 15x גדול יותר מאשר משתמש חסר ניסיון (1.09 ± 0.67 זריקות / דקה), ו 3x גדול יותר מאשר משתמש מומחה (4.95 ± 1.05 זריקות / דקה)12. שיפור זה בקצב הזרקה מוצלח מעצים הן משתמשים מתחילים מומחים להזריק תאים נוספים בפרק זמן קצר יותר אשר חיוני כדי לשמר את הכדאיות רקמות. בנוסף, הרובוט microinjection הוא להתאמה אישית ואת המסלול, עומק הזריקה, מספר זריקות, מרווח בין זריקות ניתן לכוונן כל באמצעות GUI. תכונות אלה מאפשרות לרובוט microinjection לשמש ככלי למיטוב ניסויים מייגעים בעבר, ולחקור ניסויים חדשים מיסודו הדורשים תשואה גבוהה יותר מאשר בעבר אפשרי.
המגבלות העיקריות של הליך microinjection שתיארנו כאן קשורות להכנת פרוסות רקמה, צעד מכריע שזקוק אופטימיזציה נרחבת. בנוסף, microinjection מסתמך על הנוכחות של משטח שניתן לגשת על ידי פיפטה זכוכית. תכונה זו מגבילה את סוג הרקמות ומיקומות רקמות שניתן למקד באמצעות microinjection באמצעות ההתקנה הנוכחית.
הרובוט microinjection משתמש כיום בהדמיית brightfield ונעשה בו שימוש בהכנות לחתיכה מוחית במבחנה. בעתיד, רובוט microinjection יכול להיות משולב עם הדמיה 2-פוטן כדי להגדיל את הספציפיות של תא יחיד מיקוד vivo עבור תיוג מולקולרי או צבע. מאמצים כאלה כבר נעשו עבור אלקטרופיזיולוגיה תא יחיד15,16. ההתקן הנוכחי דורש תצפית ידנית על הליך המיקרו-ציה. גרסאות עתידיות יכולות לכלול אסטרטגיות לניקויפיפטות מיקרו-צורך סתום 17 או שילוב של רובוטיםלטיפול בנוזלים 18 עבור מיקרו-חוזים אוטונומיים מלאים. מכשירים אלה יכולים להגדיל את היקף המיקרו-ציה על ידי הזמנות בסדר גודל. התאמת אלגוריתמים לשליטה מקבילה בפיפטותמיקרו-הריון מרובות 19 יכולה לאפשר משלוח מרובה של עשרות צבעים ותריגנטים מולקולריים לאותם תאים באותם ניסויים. יש לזה פוטנציאל לפתוח דרכים חדשות לסינון מולקולרי ברקמה.
רובוט microinjection יכול לשמש כדי לתייג תאים מזוהים מבחינה פונקציונלית באמצעות ברקודים DNA או RNA. זה יכול להיות משולב בתורו עם טכניקות אחרות ניתוח תא יחיד, כגון רצף RNA תא יחיד (scRNAseq) ומיקרוסקופאלקטרונים. התוצאות הראשוניות שלנו מראות כי תאים microinjected וצולהם ניתן לשחזר ולבודד באמצעות ניתוח רקמות ואחריו מיון FACS (טברנה, תוצאות שלא פורסם). לאחר מכן ניתן להשתמש בתאים המיוין של FACS עבור scRNAseq. יתר על כן, תוצאות ראשוניות מראות כי יכולות רזולוציית תא יחיד של רובוט microinjection יכול לשמש בשילוב עם ניתוח מיקרוסקופי אלקטרונים לחקור את הביולוגיה התא על תאי גזע עצביים ברקמה ברזולוציה מרחבית גבוהה (טברנה וילש-Bräuninger, תוצאות שלא פורסם). נתונים אלה מראים כי רובוט microinjection יכול לשמש ככלי למיקרוסקופ אור ואלקטרונים מתאם ברקמה ובמובן רחב יותר, לניתוח רב מודאלי של זהות התא והתנהגות ברקמה.
Microinjection מסתמך על השימוש בלחץ, אחד יכול להרשות לעצמו הזרקת פתרונות עם מורכבות מולקולרית גבוהה (למשל, תעתיק שלם). תכונה זו של microinjection נוצלה בעבר לבידוד ו שיבוט קולטנים מגודריםליגנד 20. לאורך קו זה, הרובוט microinjection עשוי לשמש מידול וללמוד תכונות רב גנית ברמה התאית. בשילוב עם אסטרטגיית תת-מאגר, הרובוט microinjection עשוי לשמש גם כפלטפורמה לזיהוי קבוצה מינימלית של גנים המניעים תכונה מסוימת / התנהגות תאית. עד כה, רובוט microinjection שימש כדי לתמרן את הביוכימיה של התא באמצעות משלוח של mRNA, DNA או חלבונים רקומביננטי10,21,22. אנו צופים יישום של רובוט microinjection לחקר הביופיזיקה של החלל התוך תאי, למשל, על ידי אספקת ננו-חומרים או ננו-מינכינים המאפשרים חישה ו/או מניפולציה של המאפיינים הביופיזיים של החלל התוך תאי.
Disclosures
לסופרים אין מה לחשוף.
Acknowledgements
המחברים רוצים להכיר בקרן נמיס (ET). SBK מכיר כספים מהמחלקה להנדסת מכונות, המכללה למדעים והנדסה, MnDRIVE RSAM יוזמה של אוניברסיטת מינסוטה, מינסוטה המחלקה להשכלה גבוהה, המכונים הלאומיים לבריאות (NIH) 1R21NS103098-01, 1R01NS111028, 1R34NS11111654, 1R21NS112886 ו 1R01NS11196. GS נתמכה על ידי מלגת המחקר לבוגרים של הקרן הלאומית למדע ומענק הכשרה IGERT NSF.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose, Low Melt | Carl Roth | Cat# 6351.2 | |
| Agarose, Wild Range | Sigma-Aldrich | Cat# A2790 | |
| Best-CA 221 Glue | Best Klebstoffe GmbH & Co.KG | Cat# CA221-10ml | |
| B-27 Supplement | Thermo Fisher Scientific | Cat# 17504044 | |
| Cellmatrix Type-IA (Collagen, Type !) | FUJIFILM Wako Chemicals | Cat# 637-00653 | |
| Distilled Water | |||
| DMEM-F12, CO2 independent (w/o Phenol red) | Sigma-Aldrich | Cat# D2906 | |
| DMEM-F12, CO2 independent (with Phenol red) | Sigma-Aldrich | Cat# D8900 | |
| HEPES-NAOH, pH 7.2, 1M (HEPES buffer) | Carl Roth | Cat# 9105.3 | |
| L-Glutamine, 200 mM | Thermo Fisher Sientific | Cat# 25030024 | |
| Mowiol 4-88 | Sigma-Aldrich | Cat# 81381 | |
| N-2 Supplement | Thermo Fisher Scientific | Cat# 17502048 | |
| Neurobasal Medium | Thermo Fisher Scientific | Cat# 21103049 | |
| Nuclease-free water | Thermo Fisher Scientific | Cat# AM9937 | |
| O2 (40%), CO2 (5%), N2 (55%) Mix, 50 liters | |||
| Paraformaldehyde | Merck | Cat# 818715 | |
| PBS | |||
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | Cat# 15140122 | |
| Rat serum | Charles River Laboratories | ||
| Japan | |||
| Sodium bicarbonate (NaHCO3) | Merck | Cat# 106323 | |
| Sodium hydroxide (NaOH) | Merck | Cat# 106482 | |
| Tyrode’s salt | Sigma | Cat# T2145-10x1L) | |
| Equipment | |||
| Borosilicate glass capillaries, 1.2 mm outer diameter x 0.94 mm inner diameter | Sutter Instruments | Cat# BF-120-94-10 | |
| Bottle-top filter system, 500 mL | Corning | Cat# 430769 | |
| Computer PC | |||
| Custom pressure rig | Custom pressure rig | ||
| Electronic pressure regulator | Parker Hannifin | Cat# 990-005101-002 | |
| Falcon tubes, 15 mL | Corning | Cat# 430791 | |
| Falcon tubes, 50 mL | Corning | Cat# 430829 | |
| Fine-tip paintbrush | |||
| Flaming/ Brown micropipette puller | Sutter Instruments | Cat# P-97 | |
| Forceps, Dumont no. 3 | Fine Science Tools | Cat# 11231-30 | |
| Forceps, Dumont no. 5 | Fine Science Tools | Cat# 11255-20 | |
| Forceps, Dumont no. 55 | Fine Science Tools | Cat# 11252-20 | |
| Heating block | Labtech International | Cat # Dri block Digi2 | |
| Inverted fluorescence microscope | Zeiss | Cat# Axiovert 200 | |
| Light source | Olympus | Cat# Highlight 3100 | |
| Manual pressure regulator | McMaster Carr | Cat# 0-60 PSI 41795K3 | |
| Microloader Tips | Eppendorf | Cat# 5242956.003 | |
| Microcontroller | Arduino | Cat# Arduino Due | |
| Microscope camera Hamamatsu Orca Flash 4.0 V3 | |||
| Motorized stage XY for microscope | |||
| Multiwell plate, 24 wells | Nunc | Cat# 142475 | |
| Pasteur pipettes, plastic | |||
| Petri dish, 60 x 15 mm | Greiner | Cat# 628102 | |
| Petri dish, 35 x 10 mm | Nunc | Cat# 153066 | |
| Petri dish, 34 x 14 mm, including Microwell no. 1.5 cover glass | MatTek | Cat# P35G-1.5-14-C | |
| Pipette holder | Warner Instruments | Cat# 64-2354 MP-s12u | |
| Pipette and tips | |||
| Puller filament, 3.0-mm square box filament | Sutter Instrument | Cat# FB330B | |
| Slice culture incubation box | MPI-CBG | Cat# custom made | |
| Solenoid valve | Cat# LHDA053321H-A | ||
| Stereomicroscope | Olympus | Cat# SZX12 | |
| Tabletop centrifuge | Heraeus | Cat# 5431622 | |
| Thermometer | |||
| Three-axis Manipulator | Sensapex Inc | Cat# tree-axis uMP | |
| Vibratome | Leica | Cat# VT1000s | |
| Whole-embryo-culture-system incubator | Ikemoto Company | Cat# RKI-10-0310 | |
| Waterbath | |||
| Software and Algorithms | |||
| Arduino | Arduino | ||
| Fiji | RRID: SCR_002285 | ||
| Python | Python Software foundation | Python 2.7.12 | |
| ZEN | RRID: SCR_013672 |
References
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Götz, M., Huttner, W. B. The cell biology of neurogenesis. Nature Reviews Molecular Cell Biology. 6 (10), 777-788 (2005).
- Di Lullo, E., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Lancaster, M. A., Knoblich, J. A. Organogenesisin a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Kretzschmar, K., Clevers, H. Organoids: Modeling Development and the Stem Cell Niche in a Dish. Developmental Cell. 38 (6), 590-600 (2016).
- Pepperkok, R. et al. Automatic microinjection system facilitates detection of growth inhibitory mRNA. Proceedings of the National Academy of Sciences of the United States of America. 85 (18), 6748-6752 (1988).
- Pepperkok, R., Lowe, M., Burke, B., Kreis, T. E. Three distinct steps in transport of vesicular stomatitis virus glycoprotein from the ER to the cell surface in vivo with differential sensitivities to GTPγS. Journal of Cell Science. 111 (13), 1877-1888 (1998).
- Pepperkok, R. et al. β-COP is essential for biosynthetic membrane transport from the endoplasmic reticulum to the Golgi complex in vivo. Cell. 74 (1), 71-82 (1993).
- Ansorge, W., Pepperkok, R. Performance of an automated system for capillary microinjection into living cells. Journal of Biochemical and Biophysical Methods. 16 (4), 283-292 (1988).
- Taverna, E., Haffner, C., Pepperkok, R., Huttner, W. B. A new approach to manipulate the fate of single neural stem cells in tissue. Nature Neuroscience. 15 (2), 329-337 (2012).
- Wong, F. K., Haffner, C., Huttner, W. B., Taverna, E. Microinjection of membrane-impermeable molecules into single neural stem cells in brain tissue. Nature Protocols. 9 (5), 1170-1182 (2014).
- Shull, G., Haffner, C., Huttner, W. B., Kodandaramaiah, S. B., Taverna, E. Robotic platform for microinjection into single cells in brain tissue. EMBO Reports. 20 (10), e47880 (2019).
- Jabeen, S., Thirumalai, V. The interplay between electrical and chemical synaptogenesis. Journal of Neurophysiology. 120 (4), 1914-1922 (2018).
- Nagy, J. I., Pereda, A. E., Rash, J. E. Electrical synapses in mammalian CNS: Past eras, present focus and future directions. Biochimica et Biophysica Acta - Biomembranes. 1860 (1), 102-123 (2018).
- Suk, H.J. et al. Closed-loop real-time imaging enables fully automated cell-targeted patch-clamp neural recording in vivo. Neuron. 95 (5), 1037-1047 (2017).
- Annecchino, L. A. et al. Robotic automation of in vivo two-photon targeted whole-cell patch-clamp electrophysiology. Neuron. 95 (5), 1048-1055 (2017).
- Kolb, I. et al. Cleaning patch-clamp pipettes for immediate reuse. Scientific Reports. 6, 35001 (2016).
- Holst, G. L. et al. Autonomous patch-clamp robot for functional characterization of neurons in vivo: development and application to mouse visual cortex. Journal of Neurophysiology. 121 (6), 2341-2357 (2019).
- Kodandaramaiah, S. B. et al. Multi-neuron intracellular recording 1 in vivo via interacting autopatching 2 robots. ELife. 7, 24656 (2018).
- Lubbert, H. et al. cDNA cloning of a serotonin 5-HT1c receptor by electrophysiological assays of mRNA-injected Xenopus oocytes (RNA fractionation/hybrid depletion/hybrid selection/choroid plexus/voltage clamp). Neurobiology. 84 (2) 4332-4336 (1987).
- Florio, M. et al. Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science. 347 (6229), 1465-1470 (2015).
- Kalebic, N. et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO Reports. 17 (3), 338-348 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved