Method Article
Robotik Mikroenjeksiyon Kullanarak Beyin Dilimlerinde Tek Nöral Kök Hücre ve Nöronların Manipülasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, beyin dilimlerinde tek nöral kök hücre ve nöroniçine mikroenjeksiyon için robotik bir platform kullanımını göstermektedir. Bu teknik çok yönlüdür ve yüksek uzamsal çözünürlüğe sahip dokudaki hücreleri izleme yöntemi sunar.
Özet
Gelişimsel nörobiyolojide temel bir soru, nöral kök ve ata hücrelerinin beyni nasıl oluşturduğudur. Bu soruyu cevaplamak için, bir etiketlemek gerekir, işlemek, ve zaman içinde yüksek çözünürlük ile beyin dokusunda tek hücreleri takip. Bu görev son derece beyindeki dokuların karmaşıklığı nedeniyle zordur. Yakın zamanda bir robot geliştirdik, bir mikroskoptan elde edilen görüntüleri kullanarak tek hücrelere femtolitre hacimleri çözüm sağlayan beyin dokusuna mikroenjeksiyon iğnesi gönderen. Robotik operasyon, manuel mikroenjeksiyondan daha büyük bir büyüklük sırası olan ve canlı dokudaki tek hücrelerin hassas etiketlemeve esnek manipülasyonuna olanak tanıyan genel bir verim elde ederek artar. Bununla, tek bir organotipik dilim içinde yüzlerce hücremikroenjekte edebilirsiniz. Bu makale, beyin dokusu dilimlerinde nöral progenitor hücreleri ve nöronların otomatik mikroenjeksiyon için mikroenjeksiyon robot kullanımını göstermektedir. Daha geniş anlamda, pipetle ulaşılabilen bir yüzeye sahip herhangi bir epitel dokusunda kullanılabilir. Kurulduktan sonra, mikroenjeksiyon robotu dakikada 15 veya daha fazla mikroenjeksiyon gerçekleştirebilir. Mikroenjeksiyon robotu, veri metodu ve doğruluğu nedeniyle mikroenjeksiyonu biyomühendislik, biyoteknoloji ve biyofizikte organotipik beyin dilimlerinde tek hücreli analizler yapmak için kullanılacak çok açık, yüksek performanslı bir hücre manipülasyon tekniği haline getirecektir.
Giriş
Bu protokol, özellikle tek nöral kök hücrelere ve nörona odaklanarak, beyin doku dilimlerindeki tek hücreleri hedeflemek ve işlemek için bir robotun kullanımını açıklar. Robot gelişimsel nörobiyoloji merkezi bir soruyu ele almak için geliştirilmiştir, bu nasıl sinirsel kök ve döl hücreleri beyin morfogenez1 katkıdabulunmak ,2,3,4,5. Bu soruyu cevaplamak için tek nöral kök hücreyi etiketlemek ve takip etmek ve doku morfogenezi ile tek hücre davranışını ilişkilendirmek için zaman içinde soy ilerlemesini takip etmek gerekir. Bu farklı şekillerde elde edilebilir, örneğin, rahim içinde beyin dokusu elektroporating veya lipophilic kalıpları kullanarak tek hücre etiketleme ile. Güçlü olmasına rağmen, bu yöntemler kesin tek hücre çözünürlüğü (elektroporasyon) ve / veya hücre içi alanı (lipophilic boya) işlemek için olasılığı yoksundur. Tek hücrelere mikroenjeksiyon bu zorluğu aşmak için geliştirilmiştir6,7,8. Mikroenjeksiyon sırasında, bir pipet kısaca reaktiflerin femtolitre hacimleri mikroenjekte basınç altında bozulmamış doku içinde tek bir hücreiçine yerleştirilir9. Daha önce organotipik dokuda tek nöral kök hücre mikroenjekte için manuel bir prosedür tarif ettik (Şekil 1A)10,11. Nöral kök hücrelere mikroenjeksiyon, floresan boya içeren bir çözelti enjekte etmek için tek sinirsel kök hücrelere yerleştirilen bir mikropipetin kullanımına dayanır. Nöral kök hücrelerin seçici hedefleme ventriküler yüzey (veya ventrikül, Şekil 1Akarikatür bakınız) üzerinden gelişmekte olan telensefalon yaklaşarak elde edilir , apikal atajenlerin apikal plazma membran ı tarafından oluşturulan (Şekil 1Akarikatür). Bu işlem, deneycinin enjekte etmek istediği her hücre için tekrarlanmalıdır. Ayrıca, mikroenjeksiyon başarısı dokuda mikropipet enjeksiyon derinliği ve süresi kesin kontrolü bağlıdır. Böylece, benzersiz avantajlarına rağmen, manuel mikroenjeksiyon son derece sıkıcı ve makul verim ve verim gerçekleştirmek için önemli bir uygulama gerektirir, bu teknik zor ölçeklenebilir bir şekilde kullanmak için yapım. Bu sınırlamayı aşmak için, yakın zamanda otomatik olarak tek hücrelere mikroenjeksiyon lar gerçekleştirebilen bir görüntü güdümlü robot, Autoinjector12 (veya mikroenjeksiyon robotu) geliştirdik.
Mikroenjeksiyon robotu mikroenjeksiyon için doku içinde 3-B alanda belirli yerleri tam olarak hedeflemek için mikroskobik görüntüleme ve bilgisayar görme algoritmaları kullanır(Şekil 1B). Mikroenjeksiyon robotu mevcut bir mikroenjeksiyon kurulumu nda nispeten basit değişiklikler yaparak inşa edilebilir. Mikroenjeksiyon robotunun genel şeması Şekil 1C'degösterilmiştir. Bir pipet üç eksenli manipülatör bağlı bir pipet tutucu monte edilir. Bir mikroskop kamera doku ve mikroenjeksiyon iğne görüntüleri elde etmek için kullanılır. Pipetin içindeki basıncı kontrol etmek için özel bir basınç düzenleme sistemi kullanılır ve mikroenjektör pipetin konumunu kontrol etmek için programlanabilir bir mikromanipülatör kullanılır. Mikroenjeksiyon pipet ucunun mekansal konumunu ve mikroenjeksiyonların yapılması gereken yerleri belirlemek için doku ve mikroenjeksiyon pipetinin kamera görüntüleri kullanılır. Yazılım daha sonra doku içinde pipet taşımak için gerekli yörüngeleri hesaplar. Tüm donanım, daha önce geliştirdiğimiz yazılım tarafından kontrol edilir. Tüm yazılımlar kodlama dilinde yazılmıştır (örneğin, Python ve Arduino) ve https://github.com/bsbrl/Autoinjector'dan talimatlarla indirilebilir. Grafik kullanıcı arayüzü (GUI) kullanıcı doku ve mikropipet görüntü ve mikroenjeksiyon yörüngesini özelleştirmek için izin verir. Sistemimiz brightfield ve epi-floresan filtreleri ile donatılmış bir ters mikroskop nispeten basit değişiklikler kullanılarak kurulabilir.
İlk olarak, mikroenjeksiyon için beyin organotipik doku dilimleri hazırlanması hakkında talimatlar sağlar. Daha sonra protokol, mikroenjeksiyon dan önce yapılması gereken pipet hareket kalibrasyonu gibi hazırlık adımlarını takip eden mikroenjeksiyon robotuna başlamayı göstermektedir. Bunu enjeksiyon parametreleri tanımlayarak takip eder. Bundan sonra, kullanıcı mikroenjeksiyon robotu tarafından kullanılan yörüngeyi tanımlayabilir ve enjeksiyon işlemini başlatabilir. Mikroenjekte doku (bu durumda beyin organotipik doku dilimleri) deneysel tasarım10,11bağlı olarak farklı zaman dilimleri için kültür tutulabilir. Doku takip etmek ve enjekte hücrelerin kimliği ve kaderi ve bunların dölleri çalışma işlenebilir. Alternatif olarak, mikroenjekte edilen hücreler canlı görüntüleme kullanılarak takip edilebilir. Bu protokol kapsamında robotun, e14.5 dorsal telensefalon faresinin organotipik dilimlerinde otomatik olarak mikroenjeksiyon nöral progenitor hücrelerine kullanımını gösteriyoruz. Robot daha fazla fare telencephalon yenidoğan nöronlar içine mikroenjeksiyon yeteneğine sahiptir, yanı sıra insan fetal telencephalon12.
Özetle, dokudaki tek hücreleri takip etmek ve işlemek için kullanılabilecek robotik bir platformu tanımlıyoruz. Platform basınç kullanır ve bu nedenle, enjekte etmek için bileşiğin kimyasal doğası olarak son derece çok yönlüdür. Buna ek olarak, kök hücreler dışındaki hedef hücrelere adapte edilebilir. Sistemimizin diğer model sistemlerine de kolayca adapte olmasını bekliyoruz.
Protokol
Tüm hayvan deneyleri Alman hayvan refahı mevzuatına uygun olarak yürütülmüş ve gerekli lisanslar Dresden, Almanya'daki Bölgesel Hayvan Deneyleri Etik Komisyonu'ndan (Tierversuchskommission, Landesdirektion Dresden) temin edilmiştir. Organotipik dilimler E14.5 veya E16.5 C57BL/6 fare embriyonik telensefalon (Janvier Labs) tarafından hazırlanmıştır.
1. Yazılımın kurulumu
- Yazılımı https://github.com/bsbrl/Autoinjector yüklemek için yönergeleri izleyin.
2. Reaktif ve pipetlerin hazırlanması
- Agarose: Hücre kültürü sınıfı PBS'nin 100 mL'sinde sırasıyla 3 g geniş aralıklı agarose ve 3 g düşük erime noktası agarose'u ayrı ayrı eriterek %3 agarose hazırlayın. 3 aya kadar oda sıcaklığında saklayın.
- Tirrode çözeltisi: 1 g sodyum bikarbonat ve Tyrode tuzu (tüm şişenin içeriğini kullanın) ve 13 mL 1 L distile suda çözün. pH'ı 7.4 olarak ayarlayın. Çözeltiyi 0,2 μm şişe üstü filtreden filtreleyin.
- Dilim kültür ortamı (SCM): 10 mL sıçan serumu, 1 mL 2 mM glutamin, 1 mL penisilin-streptomisin (100x), 1 mL N-2 takviyesi (100x), 2 mL B27 takviyesi (50x) ve 1 mL HEPES (pH 7.3) tamponekleyin 84 mL nörobazal orta tampon. Aliquot 5 mL SCM 15 mL tüpler içine. -20 °C'de saklayın.
- CO2-Bağımsız Mikroenjeksiyon Ortamı (CIMM): 200 mL distile sudaki tozu eriterek 5x DMEM modifiye edilmiş düşük glikoz çözeltisini (fenol kırmızısı olmadan) hazırlayın. Çözümü 0,2 μm şişe üstü filtreden filtreleyin (DMEM tozu için tüm şişenin içeriğini kullanın). 100 mL CIMM hazırlamak için, 20 mL 5x DMEM modifiye çözeltisi, 1 mL HEPES tamponu, 1 mL N2 takviyesi (100x), 2 mL B27 takviyesi (50x), 1 mL penisilin-streptomisin (100x), 1 mL 2 mM glutamin ve 74 mL distile su karıştırın. Çözeltiyi 4 °C'de saklayın.
- Yeniden anayasa tamponu: Distile suda 262 mM NaHCO3, 0,05 N NaOH, 200 mM HEPES eriterek yeniden anayasa tamponhazırlanın. Bir şişe üstü 0.22 μm filtre sistemi ile steril cam şişe içine filtrasyon ile çözelti sterilize. Aliquot 500 μL yeniden yapılanma tamponhava geçirmez mikrosantrifüj tüpler içine. 4 °C'de saklayın.
- Mikroenjeksiyon boya stoku: Floresan etiketli Dextran'ı RNase içermeyen distile suda (son konsantrasyon 10 μg/μL) çözün. 5 μL aliquothazırlayın ve kullanıma kadar -20 °C'de saklayın.
- Mikropipet çekmecesini kullanarak mikroenjeksiyon pipetlerini borosilikat cam kılcal damarlardan (1,2 mm dış çap, 0,94 mm iç çap) çekin. Pipetleri tozdan koruyun. Pipetleri 2-3 günden fazla saklamayın. Bu deney için çekme parametreleri HEAT idi: rampa sıcaklığı +1 - 5; ÇEKME: 100; VEL: 110; DEL: 100. HEAT ve VEL pipetin şekli ve boyutunu en çok etkileyen parametrelerdir.
NOT: Optimum mikroenjeksiyon pipeti, mikroenjeksiyon sırasında hücre hasarını önlemek için uzun ve esnek bir uca sahiptir.
3. Doku dilimi hazırlama
- Beyin dokusu diseksiyonu öncesinde bir mikrodalga fırın kullanarak% 3 geniş menzilli agarose eritin. Gömmeden önce 37 °C'de bir su banyosunda tutarak agarose'un katılaşmasına izin vermeyin. Pipetlerin tozdan korunduğundan emin olun. Pipetleri 2-3 günden fazla saklamayın.
- Bir scm ve sıcak 10 - 12 mL CIMM ve 20 mL Tyrode çözeltisi 37 ° C bir su banyosu kullanarak bir aliquot eritin.
- Floresan izleyiciyi (Dextran-3000 veya Dextran-10000-Alexa konjuge; son konsantrasyon 5 – 10 μg/μL) enjekte edilecek diğer kimyasal(lar) ile karıştırın. Mikroenjeksiyon çözeltisini 16, 000 x g'de 30 dk 4 °C'de santrifüj edin. Supernatant toplamak ve yeni bir tüp içine aktarın. Mikroenjeksiyon çözeltisini kullanıma kadar buzüzerinde tutun.
- E13.5 - E16.5 fare embriyolarının kafalarını kullanarak telensefalonun organotipik doku dilimlerini hazırlayın. Deri çıkarın ve orta hat boyunca hareket, forceps kullanarak kafatası açın. Açık kafatasından embriyonik beyni parçala ve beynin ventral tarafından başlayarak beyin dokusunu kaplayan menenjleri çıkarın. Parçalanmış tüm beyni Tyrode'un çözeltisinde 37 °C'lik bir ısıtma bloğunda bırakın.
NOT: 3.4'te açıklanan tüm diseksiyon adımları önceden ısınmış Tyrode çözeltisinde yapılmalıdır. - Tek kullanımlık bir katıştırma kalıbına geniş bir yelpazede erimiş agarose dökün. Agarose 38 - 39 °C'ye soğutulduğunda, pasteur pipeti kullanarak beyni dikkatlice (en fazla 4) içine aktarın. Her zaman bu adım için kesme ipuçları kullanın.
- Doku ya bir spatula veya Dumont #1 forceps bir çift kullanarak doku etrafında agarose karıştırın doku dokunmadan. Agarose oda sıcaklığında katılaşmaya bırakın. Agarose katıladıktan sonra, dokuyu çevreleyen fazla agarose'u kırpın.
- Arabellek tepsisini PBS ile doldurun. Tepsiye dik dokunun rostro-caudal ekseni ile beyin Orient (koku ampuller dönüm noktası olarak kullanın, beynin rostral-en parçası temsil eden). Vibratom kullanarak 250 μm dilim kesin.
- 3,5 cm Petri kabını 2 mL önceden ısıtılmış ortamla doldurun. Plastik pasteur pipetkullanarak dilimleri (10 - 15) bu tabağa aktarın. Bir kez yapılır, dilimler ile Petri çanak dilim kültür kuluçka içine kaydırın. Kullanım anına kadar dilimleri %40 O2 / %5 CO2 / %55 N2 içeren nemli bir atmosferde 37 °C'de saklayın.
4. Mikroenjeksiyon
- Bilgisayarı, mikroskopu, mikroskop kamerasını, manipülatörleri, basınç teçhizatını ve basınç sensörünü açın. GitHub'dan indirilen ana klasördeki "launchapp.py" dosyasını tıklatarak uygulamayı yükleyin ve açılan ekranda cihaz ayarlarını belirtin (yükleme talimatları için adım 1.1'e bakın).
- Pipeti çözeltiye batırmadan önce istenmeyen tıkanmayı önlemek için dışa doğru bir basınç oluşturun. Pipete basınç uygulamak için, tazminat basınç çubuğunu %24 -%45'e kaydırın ve Değerleri Ayarla'yıtıklatın. Daha sonra, basınç sensöründe belirtildiği gibi mekanik basınç valfi tonuzunu 1 – 2 PSI 'ya (69 – 138 mbar) çevirerek basıncı yeterli bir basınca ayarlayın.
- Dilimleri önceden ısıtılmış 2 mL cimm içeren 3,5 cm Petri kabına aktarın. Dilimleri Petri kabının ortasına mikroenjekte edilecek şekilde yerleştirin. Petri kabını önceden ısıtılmış (37 °C) mikroenjeksiyon aşamasına aktarın.
- Mikroenjeksiyon pipetini uzun uçlu plastik pipet kullanarak 1,4 -1,6 μL mikroenjeksiyonlu çözelti (adım 3,3'ten itibaren) yükleyin. Mikroenjeksiyon pipetini pipet tutucuya takın.
- Mikroskoptaki en düşük büyütmeyi kullanarak, dilimi odak noktası haline getirin ve mikropipeti bu görüş alanına (FOV) yönlendirin, böylece dilim hedefiyle aynı düzleme odaklanın. Uygulamada FOV'u görmek için mikroskobun çıktısını kameraya geçirin.
- Aygıt kalibrasyonını başlatmak için arabirimin sol üst kısmındaki büyütme düğmesini tıklatın. Bir pencere büyütme seçmek ister. 10x büyütmeyi veya lensin ayarlediği büyütmeyi seçin (örn. 4x, 10x, 20x, 40x) ve Oktuşuna basın. Yazılım iç objektif objektif 10x (en yaygın objektif lens büyütme) olduğunu varsayar.
- Mikroskobun mikrometrik tekerleği kullanarak pipet ucunu yeniden odakla ve imleçile pipet ucunu tıklatın. Ardından, adım 1.1 düğmesine basın ve açılır pencerede Tamam'a basın. Pipet Y yönünde hareket edecektir. Pipetin ucunu tıklatın ve adım 1.2 düğmesine basın. Son olarak, Pipet açı kutusuna 45 girin ve Set açısınabasın.
- Otomatik mikroenjeksiyon kontrolleri paneline istenilen parametreleri girin. Mikroenjeksiyon için apikal atalar enjeksiyon mesafesini 20 - 40 μm ve derinliği 10 -15 m olarak ayarlayın. Nöronlar içine mikroenjeksiyon için enjeksiyon mesafesi ayarlamak 30 - 40 bazal taraftan μm, ve derinlik 10 - 30 m hedeflenen ne bağlı olarak. Hızı her zaman %100'e ayarlayın. Değerleri Ayarla'yıtıklatın.
NOT: Yaklaşma mesafesi pipetin bir sonraki enjeksiyon mesafesine geçmeden önce dokudan çektiği mesafedir, derinlik mikroenjeksiyonun gittiği dokuya derinliktir, boşluk sıralı enjeksiyonlar arasındaki çizgi boyunca mesafedir, hız pipetin μm/s'deki hızıdır. - Çekme kenarı düğmesini tıklatın ve enjeksiyon yörüngesini tanımlamak için açılır pencerede istenen yörünge boyunca imleci sürükleyin. Mikroenjeksiyon progenitor kök hücreleri için, telensefalon yüzeyinin ventral tarafı Şekil 2A'dagösterildiği gibi hedeflenmiştir. Pipeti çizginin başlangıcına getirin ve pipetin ucunu tıklatın. Mikro enjekte etmeye başlamak için Koş yörüngesini tıklatın. Hedeflenen her enjeksiyon uçağı için bu adımı tekrarlayın (genellikle uçak başına 40 - 75 enjeksiyonlu 3 - 4 uçak için yapılır).
5. İmmünfloresan için doku kültürü ve doku dilimi işleme
- Kollajen karışımını (1,5 mg/mL) hazırlayın: Bir tüpe matris çözeltisinin 1,25 mL'si, 0,5 mL distile su, 0,5 mL 5x DMEM-F12 çözeltisi ve 0,25 mL reconstitution tampon ekleyin. Kullanıma kadar buzda tutun.
- Dilim kültür kuluçka odasından mikroenjekte dilimleri içeren Petri çanak edinin ve kollajen karışımı içine dilimleri batırın.
- Dilimleri 200 - 300 μL kollajen karışımıyla birlikte 35 mm cam dipli bir tabağa 14 mm kuyuya aktarın. Dilimleriçok daha az kollajen kaplı olduğundan emin olun. Bu kurulum besin ve oksijen alımı için en uygun koşulları sağlar.
- İki çift forceps kullanarak dilimler arasında yeterli boşluk olmasını sağlarken dilimleri yönlendirin. Kollajenin katılabilmesi için bir ısıtma bloğu kullanarak Petri kabını 37 °C'de 5 dakika kuluçkaya yatırın. Bu süreyi dilim kültürünün t = 0 olarak düşünün.
- Petri kabını 40 dakika daha dilim kültür kuluçka makinesine taşıyın. Daha sonra önceden ısıtılmış SCM 2 mL ekleyin. Dilimler istenilen zaman noktasına kadar kültürde tutulur.
- Dilim kültür kuluçka ve SCM aspire dilimleri alın. Kollajen gömülü dilimleri 1x PBS ile yıkayın. %4 (wt/vol) paraformaldehit (120 mM fosfat tamponunda, pH 7.4) ekleyin ve mendoyu 30 dk için RT'de bırakın. Daha sonra gece fiksasyon için izin vermek için 4 °C'ye taşıyın.
- Ertesi gün paraformaldehit çözeltisini aspire edin ve 1x PBS yıkın. Kollajen dilimleri kaldırmak için, yavaşça bir stereomikroskop altında dilimleri ayıklamak için iki çift forceps kullanın.
- Mikro enjekte edilen dilimleri işlemek için %3 (wt/vol) düşük erime noktası agarose'u eritmek için mikrodalga kullanın. Tek kullanımlık bir katıştırma kalıbına eritilmiş agarose dökün ve yaklaşık 38 -39 °C soğumasını bekleyin.
- Doku dilimlerini 5.7 adımdan plastik pasteur pipeti kullanarak düşük erime agarose içeren bu kalıba aktarın. Dilimin pial tarafının yukarı ve ventriküler yüzeyin aşağı dönük olduğundan emin olun. Buna göre orient gerekirse. Agarose katılaşmak için RT soğumasını bekleyin.
- Dilimleri çevreleyen ekstra agarose kırpın. Kesme yüzeyinin vibratomun kesme bıçağına paralel olduğundan emin olmak için agarose bloğunu yönlendirin. Vibratom kullanarak, 50 μm kalınlığında kesin.
- 1x PBS ile 24 iyi çanak doldurun. İnce uçlu bir fırça kullanarak bölümleri bu tabağa aktarın. Standart protokollere göre immünoresans gerçekleştirin.
Sonuçlar
Mikroenjeksiyon, tek nöral kök hücrenin ve bunların canlı dokudaki soylarının izlenmesi ve manipüle edilebisolması ve fizyolojik bir ortamda soy ilerlemesini takip etme amacına hizmet eder. Bu makalede, fare telesefalonunun organotipik dilimlerini hedeflemek ve otomatik olarak mikroenjeksiyon için mikroenjeksiyon robotunun kullanımını gösterdik. Şekil 2 başarıyla enjekte edilen ata hücrelerinin temsili görüntülerini ve Şekil 3 enjekte edilen yenidoğan nöronların göstermektedir. Dextran Alexa-488 (veya Alexa-A555) boya enjekte edildiğinde, hücreler boya ile tamamen dolu görünür. Apikal progenitorlar gelince (Şekil 2) konfokal görüntüleme yüksek uzamsal çözünürlük hücre morfolojisi ile yeniden yapıya izin verir, varlığı -veya yokluğu- apikal ve bazal eki, ve marker ifade ile morfolojik soruşturma birleştirmek için. Bu ölçütleri birleştirerek, kullanıcı mikroenjekte edilen hücrelere ve onların soyundan belirli bir hücre kaderi atayabilir. Nöron enjeksiyonu gelince, kullanıcı nöronal morfolojisi yeniden inşa edebilirsiniz, yapısı ve apikal dendit ve akson özellikleri de dahil olmak üzere. Otomatik mikroenjeksiyon manuel mikroenjeksiyona göre önemli ölçüde daha yüksek iş artışı sağlayabilir(Şekil 2B). Ayrıca, EdU etiketleme hücre canlılığının otomasyondan etkilenmediğini doğrular (Şekil 2C). Organotipik dilimin kültürde tutulması, mikroenjekte edilen hücrelerin soy ilerlemesinin takip edilmesine olanak sağlar (Şekil 2D'de4 - 24 h) gösterilmiştir. Mikroenjeksiyon çözeltisi genetik materyal (DNA, mRNA, CRISPR-Cas9 kılavuzları) veya rekombinant proteinler içeriyorsa, bu durum soy ilerlemesinin manipülasyondan etkilenip etkilenmediğinin araştırılmasına olanak sağlar.
Dokudaki tek nöral kök hücrelere mikroenjeksiyon mükemmel tek hücre çözünürlüğü sağlar ve bu nedenle nöral kök hücre ilerlemesi ve kader geçişinin hücre biyolojisini incelemek için kullanılmıştır(Şekil 3A). Mikroenjeksiyon kimyasalların karmaşık karışımı teslim sağlar. Daha önce bu özelliği kullanarak nöral progenitor hücrelerinde kavşak bağlantılarını gap junctional impermeable floresan boyalar12ile karıştırarak kullandık. Biz yenidoğan nöronlarda junctional kaplin inceleyerek önceki çalışma uzattı, Dextran-A555 ile birlikte Lucifer Sarı enjekte ederek(Şekil 3B). Şekil 3B'degösterildiği gibi, yenidoğan piramidal nöronların bir kısmı komşu nöronlar için boşluk kavşakları ile birleştiğinde. Bu gözlem, olgunlaşmamış nöronların boşluk bağlantısı13,14üzerinden iletişim kurduğu fikriyle tutarlıdır. Ayrıca, nöronların hedef alınması mikroenjeksiyon robotunun kullanımının gelişmekte olan memeli beyninde çeşitli hücre tiplerine genelleştirilebilen olduğunu göstermektedir. Bu deneysel kurulum dokudaki nöronların hücre biyolojisini incelemek için yararlı olacaktır, örneğin protein-protein etkileşimlerini engelleyen spesifik oligopeptidler sunarak.
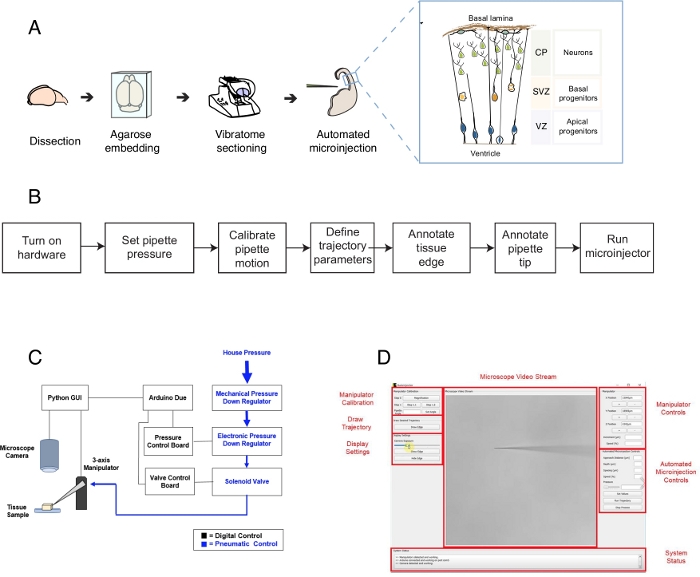
Şekil 1: Otomatik mikroenjeksiyon kurulumu ve protokolü. (A) Mikroenjeksiyon robotu kullanılarak doku hazırlama ve otomatik mikroenjeksiyonlar için genel protokol. Sağ inset: Bu protokolde mikroenjeksiyon için hedeflenen fare Telencephalon karikatür şeması. (B) Otomatik mikroenjeksiyon adımlarının akış şeması. (C) Mikroenjeksiyon robot donanımının şeması. (D) Mikroenjeksiyon robotunun kontrolü ve işletilmesi için kullanılan yazılımın grafik kullanıcı arabirimi (GUI). Bu rakam ref.12'denuyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
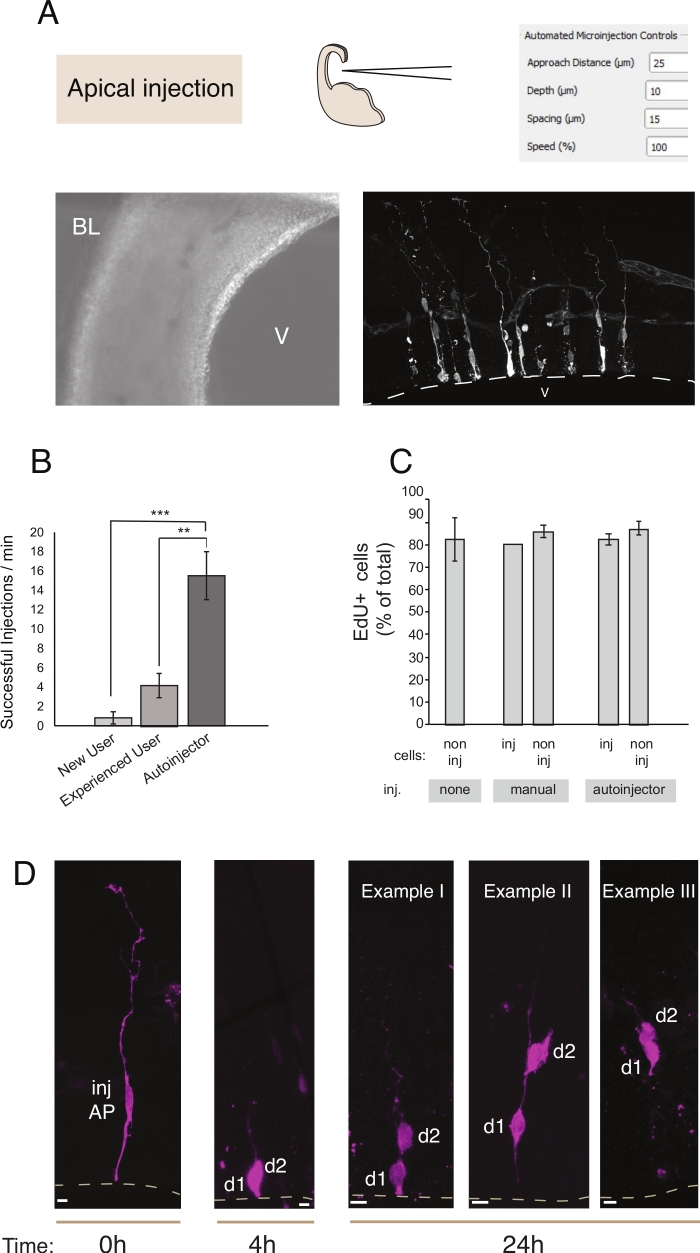
Şekil 2: Apikal atalara robotik mikroenjeksiyon. Mikroenjeksiyon robotu kullanılarak apikal yüzey (apikenjeksiyon) üzerinden apikal ataları (AP'ler) hedeflemek için şematik ve beklenen sonuçlar. (A) Üst satır. Solda: sürecin şeması. Sağda: Apikal enjeksiyon için ilgili parametreleri ile GUI. Alt sıra. Solda: enjeksiyon işlemi sırasında alınan faz kontrast görüntüsü (V: ventrikül; BL: bazal lamina). Sağda: mikroenjekte edilmiş AP'leri gösteren temsili sonuçlar. Kesik çizgi ventrikül (V) temsil eder. Ölçek çubuğu: 10 μm. (B) Manuel mikroenjeksiyon sistemi üzerinde acemi bir kullanıcı için dakikada başarılı enjeksiyonlar, manuel mikroenjeksiyon sistemi deneyimli bir kullanıcı, ve mikroenjeksiyon robot. (C) EdU mikroenjekte edilmiş hücrelere ve enjekte edilen bölgedeki enjekte edilmeyen hücrelere dahil olur. Fare E14.5 dorsal telencephalon organotipik dilimleri ya (i) enjekte edilmeyen veya (ii) Dextran-A488 (manuel ve otoenjektör için) kullanılarak manuel veya otomatik mikroenjeksiyon (enjekte dilim) tabi idi. Dilimler EdU varlığında kültür de 24 saat tutuldu, sonra sabit ve DAPI ve EdU için lekeli edildi. EdU pozitifliği için enjekte edilen ve enjekte edilmeyen hücreler etüt edildi. (D) Mikroenjeksiyon robotu Soy takibinin kullanımı. Floresan boya (Dx3-A555, macenta) tek nöral kök hücreye enjekte edilir (t = 0 h). Floresan boya mitoz sırasında kız hücrelerine (d1, d2) bölümlenir. Bu enjekte hücrenin soyundan (t = 4 h ve 24 saat) ve zaman içinde soy ilerlemesini ortaya koyarak sağlar. t = 24 saat için, bir bulmak için bekliyor soyundan birkaç örnek gösterir. Ölçek çubukları: 10 μm. B ve C'deki grafikler ref.12'denalınmıştır.
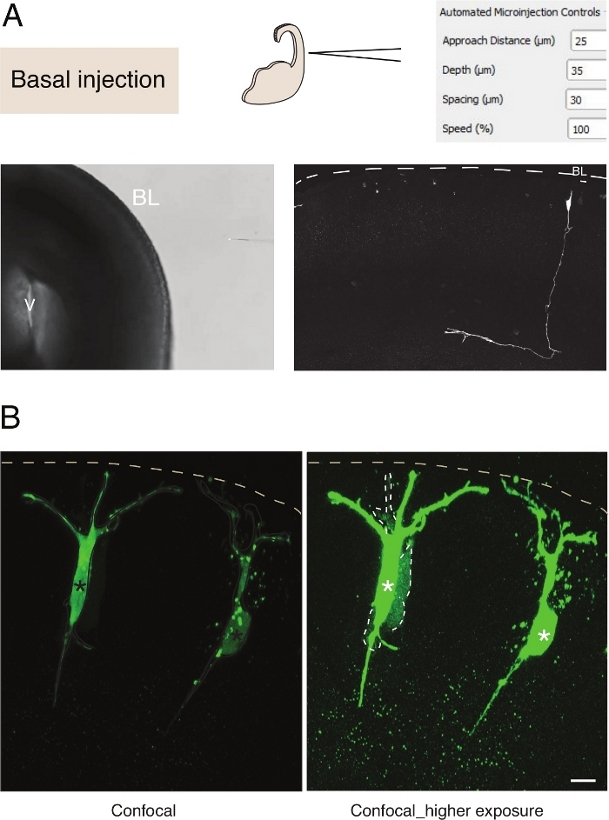
Şekil 3: Nöronlara robotik mikroenjeksiyon. Mikroenjeksiyon robotu kullanılarak piramidal nöronların (N) bazal yüzey (bazal enjeksiyon) üzerinden hedef alınarak şematik ve beklenen sonuçlar. (A) Üst satır. Solda: sürecin şeması. Sağda: BAZAL ENJEKSIYON için ilgili parametreleri ile GUI. Alt sıra. Solda: enjeksiyon işlemi sırasında alınan faz kontrast görüntüsü (V: ventrikül; BL: bazal lamina). Sağda: mikroenjekte edilmiş N. Dashed çizgisini gösteren temsili sonuçlar bazal laminayı (BL) temsil eder. Ölçek çubuğu: 10 μm. (B) Dokudaki boşluk kavşak iletişimini incelemek için otoenjektörün kullanımı. Piramidal nöronlar iki boya içeren bir çözelti ile enjekte edildi: gap junctional-impermeable Dx-A555 (gösterilmez) ve boşluk-junctional geçirgen Lucifer Sarı (yeşil). Dx-A555 hedeflenen hücreyle (yıldız işareti) sınırlı yken, LY hedeflenen hücreye (kesik çizgiler) boşluk bağlantısı ile bağlanan hücrelere yayılır. Sol panel: Düşük pozlama, sadece mikroenjekte hücreleri görülebilir. Sağ panel: Yüksek pozlama enjekte edilen hücrelerin yanı sıra birleştirilmiş hücrelerin (kesik çizgiler) görselleştirilmesini sağlar. Ölçek çubuğu: 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Dosya: Mikroenjeksiyon sırasında ortaya çıkan birkaç yaygın hatagiderme. Bu dosyayı indirmek için lütfen buraya tıklayınız.
Tartışmalar
Dokuda tek nöral kök hücrelere mikroenjeksiyon mükemmel tek hücre çözünürlüğü sağlar ve bu nedenle nöral kök hücre ilerlemesi ve kader geçişi hücre biyolojisi incelemek için kullanılmıştır(Şekil 2; ayrıca bakınız10,11,12). Otomatik mikroenjeksiyon işlemi hem embriyonik farelerde hem de insan beyin dokusundaki diğer hücre türlerine yapılabilir. Telensefalon bazal yüzeyini hedef alarak yenidoğan nöronların mikroenjeksiyonunun temsili sonuçları Şekil 3'tegösterilmiştir.
Burada kurulan ilke embriyonik fare beyinleri ve insan beyinlerinde birkaç farklı hücre tipini hedeflemek için uygulanabilir. Daha önce mikroenjeksiyon robotu da fare arka beyin ve telencephalon ve fare ve insan gelişmekte olan neokorteks 12 yenidoğan nöronlarda tek progenitor hücreleri hedef için kullanılabilir göstermiştir12. Enjeksiyon prosedürüen iyi sonuçları elde etmek için, bir enjeksiyon başlamadan önce tüm adımları optimize etmelidir. Beyin dokusundan canlı ve iyi korunmuş organotipik doku dilimlerinin hazırlanmasını dikkatle değerlendirmek ve optimize etmek önemlidir(Şekil 1). Şekil 1'degösterilen diseksiyon ve dilimleme işleminde hızlı olmak çok önemlidir. APEtik enjeksiyon apetik yüzey hedefleyen için, bir apikal yüzeyin ideal yönünü gösteren dilimleri almak gerekir. AP enjeksiyonu için ideal oryantasyon Petri kabının dibine dik apikal yüzeydir. Başka bir oryantasyon da izin verici olacaktır, ancak Petri kabına dik apikal yüzey enjeksiyon için daha geniş bir yüzey alanı sağlar, böylece enjeksiyon başarısını artırır. Nöronlar içine enjeksiyon için, dilimin yönünü hiçbir etkisi çok az oynar.
Enjekte edilecek dilimler seçildikten sonra, dilim başına enjeksiyon işlemi yaklaşık 5 dakika sürer. Kişinin canlı doku ile çalıştığı düşünülürse, enjeksiyon işleminin hızlandırilmesi şiddetle tavsiye edilir. Bu amaçla, gereksiz bekleme süresini azaltmak için doku hazır olmadan önce GUI(Şekil 1D)üzerinden enjeksiyon için tüm parametrelerin ayarlanması tavsiye edilir. Sorun giderme için lütfen Ek dosyaya bakın.
Uzun süreli dilim kültürü söz konusu olduğunda, otomatik mikroenjeksiyon işleminden sonraki adımlar hücrelerin sağlığını ve deneyi etkileyebilir. Bu nedenle, bir kalite kontrol testi çalıştırmak ve dilim kültür koşullarını optimize etmek için şiddetle tavsiye edilir. Dilimleme ve enjeksiyon işleminden sonra hücre canlılığını değerlendirmek için kültür sırasında EdU etiketleme uyguladık ve kültürlerde ve enjekte edilendoku12'dekipyknotic çekirdeklerin (apoptotik hücreler için bir proxy) sayısını ölçtük. Bu nicelemeler mikroenjeksiyonun doku canlılığı üzerinde önemli bir etkisi olmadığını ortaya çıkarmıyordu(Şekil 2C). Laboratuvarda organotipik doku dilimleme ve mikroenjeksiyon boru hattı kurarken benzer kalite kontrolleri yapmanızı öneririz.
Manuel mikroenjeksiyon ile karşılaştırıldığında, mikroenjeksiyon robotu çeşitli avantajlar sağlar. İlk olarak, kullanıcı için öğrenme eğrisi manuel enjeksiyona kıyasla daha az diktir: yeni bir kullanıcı, genellikle 1 veya 2 olmak üzere sınırlı sayıda seanstan sonra yüksek bir yeterliliğe ulaşacaktır. İkinci olarak, manuel mikroenjeksiyon durumunda, karşılaştırılabilir bir yeterlilik eğitim ay gerektirir. Enjeksiyon işlemi daha hızlı ve daha verimlidir(Şekil 2B). Bu parametreleri ölçtük ve mikroenjeksiyon robotunun enjeksiyon başarısı (başarılı enjeksiyon/toplam enjeksiyon sayısı) ve birim zaman başına enjeksiyon sayısı12ile ilgili olarak yetenekli bir manuel kullanımdan daha iyi performans gösterdiğini gördük. Bu, mikroenjeksiyon robotu için yetenekli bir kullanıcıya kıyasla enjeksiyon veriminin %300 oranında artmasıyla sonuçlanır. Mikroenjeksiyon robotu yeni başlayan bir kullanıcıyla karşılaştırıldığında verimlilikteki artış daha da belirgindi ve %700'e ulaştı. Son olarak, mikroenjeksiyon robotu tüm mekansal parametreleri sistematik olarak keşfetmek için kolayca programlanabilir. Bu, mikroenjeksiyon robotu yeni hücreleri veya dokuları hedeflemeye adapte ederken veya mikroenjeksiyon robotu farklı uzamsal çözünürlük gerektiren amaçlar için kullanırken özellikle avantajlıdır.
Mikroenjeksiyon robotu oluşturmak için mevcut epi-floresan mikroskobunda minimum değişiklikler gerektirir12. Daha önce https://github.com/bsbrl/Autoinjector bu adaptasyon için talimatlar verdik. Donanım kurulduktan sonra, bu protokol otomatik mikroenjeksiyonları başarıyla üstlenmek için önemli metodolojik ayrıntılar sağlar. Genel olarak, mikroenjeksiyon robotu 15,52 + 2,48 enjeksiyon/dk, deneyimsiz bir kullanıcı (1,09 ± 0,67 enjeksiyon/dk) daha büyük ve 3kat uzman bir kullanıcı (4,95 ± 1,05 enjeksiyon/dk)12daha büyük başarılı bir enjeksiyon oranına sahiptir. Başarılı enjeksiyon hızındaki bu gelişme, hem acemi hem de uzman kullanıcıların doku canlılığını korumak için gerekli olan daha kısa sürede daha fazla hücre enjekte etmesini sağlar. Ayrıca, mikroenjeksiyon robotözelleştirilebilir ve yörünge, enjeksiyon derinliği, enjeksiyon sayısı, enjeksiyonlar arasında boşluk tüm GUI kullanılarak ayarlanabilir. Bu özellikler, mikroenjeksiyon robotun daha önce zahmetli deneyleri optimize etmek ve daha önce mümkün olandan daha yüksek verim gerektiren temelde yeni deneyleri keşfetmek için bir araç olarak kullanılmasını sağlar.
Burada açıklanan mikroenjeksiyon prosedürünün temel sınırlamaları, geniş optimizasyon gerektiren önemli bir adım olan doku dilimlerinin hazırlanmasıile ilgilidir. Buna ek olarak, mikroenjeksiyon cam pipet ile yaklaşılabilir bir yüzeyin varlığı dayanır. Bu özellik, mevcut kurulum kullanılarak mikroenjeksiyon ile hedeflenebilen doku ve doku konumlarının türünü sınırlar.
Mikroenjeksiyon robotu şu anda brightfield görüntüleme kullanır ve in vitro beyin dilimi preparatları kullanılmıştır. Gelecekte, mikroenjeksiyon robotu moleküler veya boya etiketleme için in vivo tek hücre hedefleme özgüllüğünü artırmak için 2-foton görüntüleme ile kombine edilebilir. Bu tür çabalar zaten tek hücreli elektrofizyoloji15,16için yapılmıştır. Mevcut cihaz mikroenjeksiyon prosedürümanuel gözlem gerektirir. Gelecekteki sürümler tıkanmış mikroenjeksiyon pipetleri temizleme stratejileri içerebilir17 veya çok katlı, tamamen otonom mikroenjeksiyonlar için sıvı işleme robotlar18 entegrasyonu. Bu cihazlar büyüklük siparişleri ile mikroenjeksiyon ölçeğini artırabilir. Birden fazla mikroenjeksiyon pipet19 paralel kontrol için algoritmalar adapte aynı deneyler içinde aynı hücrelere boyalar ve moleküler reaktifler düzinelerce çok katlı teslim sağlayabilir. Bu dokumoleküler tarama için yeni yollar açmak için potansiyele sahiptir.
Mikroenjeksiyon robotu DNA veya RNA barkodları kullanarak işlevsel olarak tanımlanmış hücreleri etiketlemek için kullanılabilir. Bu da tek hücreli RNA sekanslama (scRNAseq) ve elektron mikroskobu gibi diğer tek hücre analizi teknikleri ile kombine edilebilir. İlk sonuçlarımız, mikroenjekte edilen hücrelerin ve bunların soyundan gelen hücrelerin, facs ayrışması (Taverna, yayınlanmamış sonuçlar) ile takip eden doku ayrışması kullanılarak kurtarılabilen ve izole edilebilen bir hücre olduğunu göstermektedir. FACS sıralanmış hücreler daha sonra scRNAseq için kullanılabilir. Ayrıca, ilk sonuçlar mikroenjeksiyon robotunun tek hücre çözünürlüğü yeteneklerinin elektron mikroskobik analizi ile birlikte yüksek uzamsal çözünürlükte (Taverna ve Wilsch-Bräuninger, yayınlanmamış sonuçlar) dokudaki nöral kök hücreler üzerindeki hücre biyolojisini keşfetmek için kullanılabileceğini göstermektedir. Bu veriler, mikroenjeksiyon robotunun dokuda ve daha geniş anlamda dokuda ışık ve elektron mikroskobu için bir araç olarak kullanılabileceğini, hücre kimliğinin ve dokudaki davranışın multimodal analizi için kullanılabileceğini göstermektedir.
Mikroenjeksiyon basınç kullanımına dayanır ve yüksek moleküler karmaşıklık (örneğin, tüm bir transkripsiyon) ile enjekte çözümleri gelemez. Mikroenjeksiyonun bu özelliği geçmişte ligand kapılı reseptörleri izole etmek ve klonlamak için kullanılmıştır20. Bu doğrultuda, mikroenjeksiyon robotu modelleme ve hücresel düzeyde çok jenik özellikleri çalışma için kullanılabilir. Bir alt havuzlama stratejisi ile birlikte, mikroenjeksiyon robotu da belirli bir özellik / hücresel davranış sürüş genlerin minimum kümesini tanımlamak için bir platform olarak kullanılabilir. Şimdiye kadar, mikroenjeksiyon robotmRNA, DNA veya rekombinantproteinler10,21,22teslim yoluyla hücrenin biyokimya işlemek için kullanılmıştır. Mikroenjeksiyon robotunun hücre içi uzayın biyofiziğinin araştırılmasında, örneğin, hücre içi uzayın biyofiziksel özelliklerini algılamaya ve/veya manipüle etmesine olanak tanıyan nanomalzemeler veya nanomakineler sunarak uygulanmasını öngörüyoruz.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar Nomis Vakfı (ET) kabul etmek istiyorum. SBK, Makine Mühendisliği bölümünden fon kabul Bilim ve Mühendislik Koleji, Minnesota Üniversitesi, Minnesota yüksek öğretim bölümü MnDRIVE RSAM girişimi, Ulusal Sağlık Enstitüleri (NIH) 1R21NS103098-01, 1R01NS1111028, 1R34NS1111654, 1R21NS112886 ve 1R21 NS1111966. GS, National Science Foundation Graduate Research Fellowship ve NSF IGERT eğitim bursu ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose, Low Melt | Carl Roth | Cat# 6351.2 | |
| Agarose, Wild Range | Sigma-Aldrich | Cat# A2790 | |
| Best-CA 221 Glue | Best Klebstoffe GmbH & Co.KG | Cat# CA221-10ml | |
| B-27 Supplement | Thermo Fisher Scientific | Cat# 17504044 | |
| Cellmatrix Type-IA (Collagen, Type !) | FUJIFILM Wako Chemicals | Cat# 637-00653 | |
| Distilled Water | |||
| DMEM-F12, CO2 independent (w/o Phenol red) | Sigma-Aldrich | Cat# D2906 | |
| DMEM-F12, CO2 independent (with Phenol red) | Sigma-Aldrich | Cat# D8900 | |
| HEPES-NAOH, pH 7.2, 1M (HEPES buffer) | Carl Roth | Cat# 9105.3 | |
| L-Glutamine, 200 mM | Thermo Fisher Sientific | Cat# 25030024 | |
| Mowiol 4-88 | Sigma-Aldrich | Cat# 81381 | |
| N-2 Supplement | Thermo Fisher Scientific | Cat# 17502048 | |
| Neurobasal Medium | Thermo Fisher Scientific | Cat# 21103049 | |
| Nuclease-free water | Thermo Fisher Scientific | Cat# AM9937 | |
| O2 (40%), CO2 (5%), N2 (55%) Mix, 50 liters | |||
| Paraformaldehyde | Merck | Cat# 818715 | |
| PBS | |||
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | Cat# 15140122 | |
| Rat serum | Charles River Laboratories | ||
| Japan | |||
| Sodium bicarbonate (NaHCO3) | Merck | Cat# 106323 | |
| Sodium hydroxide (NaOH) | Merck | Cat# 106482 | |
| Tyrode’s salt | Sigma | Cat# T2145-10x1L) | |
| Equipment | |||
| Borosilicate glass capillaries, 1.2 mm outer diameter x 0.94 mm inner diameter | Sutter Instruments | Cat# BF-120-94-10 | |
| Bottle-top filter system, 500 mL | Corning | Cat# 430769 | |
| Computer PC | |||
| Custom pressure rig | Custom pressure rig | ||
| Electronic pressure regulator | Parker Hannifin | Cat# 990-005101-002 | |
| Falcon tubes, 15 mL | Corning | Cat# 430791 | |
| Falcon tubes, 50 mL | Corning | Cat# 430829 | |
| Fine-tip paintbrush | |||
| Flaming/ Brown micropipette puller | Sutter Instruments | Cat# P-97 | |
| Forceps, Dumont no. 3 | Fine Science Tools | Cat# 11231-30 | |
| Forceps, Dumont no. 5 | Fine Science Tools | Cat# 11255-20 | |
| Forceps, Dumont no. 55 | Fine Science Tools | Cat# 11252-20 | |
| Heating block | Labtech International | Cat # Dri block Digi2 | |
| Inverted fluorescence microscope | Zeiss | Cat# Axiovert 200 | |
| Light source | Olympus | Cat# Highlight 3100 | |
| Manual pressure regulator | McMaster Carr | Cat# 0-60 PSI 41795K3 | |
| Microloader Tips | Eppendorf | Cat# 5242956.003 | |
| Microcontroller | Arduino | Cat# Arduino Due | |
| Microscope camera Hamamatsu Orca Flash 4.0 V3 | |||
| Motorized stage XY for microscope | |||
| Multiwell plate, 24 wells | Nunc | Cat# 142475 | |
| Pasteur pipettes, plastic | |||
| Petri dish, 60 x 15 mm | Greiner | Cat# 628102 | |
| Petri dish, 35 x 10 mm | Nunc | Cat# 153066 | |
| Petri dish, 34 x 14 mm, including Microwell no. 1.5 cover glass | MatTek | Cat# P35G-1.5-14-C | |
| Pipette holder | Warner Instruments | Cat# 64-2354 MP-s12u | |
| Pipette and tips | |||
| Puller filament, 3.0-mm square box filament | Sutter Instrument | Cat# FB330B | |
| Slice culture incubation box | MPI-CBG | Cat# custom made | |
| Solenoid valve | Cat# LHDA053321H-A | ||
| Stereomicroscope | Olympus | Cat# SZX12 | |
| Tabletop centrifuge | Heraeus | Cat# 5431622 | |
| Thermometer | |||
| Three-axis Manipulator | Sensapex Inc | Cat# tree-axis uMP | |
| Vibratome | Leica | Cat# VT1000s | |
| Whole-embryo-culture-system incubator | Ikemoto Company | Cat# RKI-10-0310 | |
| Waterbath | |||
| Software and Algorithms | |||
| Arduino | Arduino | ||
| Fiji | RRID: SCR_002285 | ||
| Python | Python Software foundation | Python 2.7.12 | |
| ZEN | RRID: SCR_013672 |
Referanslar
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Götz, M., Huttner, W. B. The cell biology of neurogenesis. Nature Reviews Molecular Cell Biology. 6 (10), 777-788 (2005).
- Di Lullo, E., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Lancaster, M. A., Knoblich, J. A. Organogenesisin a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Kretzschmar, K., Clevers, H. Organoids: Modeling Development and the Stem Cell Niche in a Dish. Developmental Cell. 38 (6), 590-600 (2016).
- Pepperkok, R. et al. Automatic microinjection system facilitates detection of growth inhibitory mRNA. Proceedings of the National Academy of Sciences of the United States of America. 85 (18), 6748-6752 (1988).
- Pepperkok, R., Lowe, M., Burke, B., Kreis, T. E. Three distinct steps in transport of vesicular stomatitis virus glycoprotein from the ER to the cell surface in vivo with differential sensitivities to GTPγS. Journal of Cell Science. 111 (13), 1877-1888 (1998).
- Pepperkok, R. et al. β-COP is essential for biosynthetic membrane transport from the endoplasmic reticulum to the Golgi complex in vivo. Cell. 74 (1), 71-82 (1993).
- Ansorge, W., Pepperkok, R. Performance of an automated system for capillary microinjection into living cells. Journal of Biochemical and Biophysical Methods. 16 (4), 283-292 (1988).
- Taverna, E., Haffner, C., Pepperkok, R., Huttner, W. B. A new approach to manipulate the fate of single neural stem cells in tissue. Nature Neuroscience. 15 (2), 329-337 (2012).
- Wong, F. K., Haffner, C., Huttner, W. B., Taverna, E. Microinjection of membrane-impermeable molecules into single neural stem cells in brain tissue. Nature Protocols. 9 (5), 1170-1182 (2014).
- Shull, G., Haffner, C., Huttner, W. B., Kodandaramaiah, S. B., Taverna, E. Robotic platform for microinjection into single cells in brain tissue. EMBO Reports. 20 (10), e47880 (2019).
- Jabeen, S., Thirumalai, V. The interplay between electrical and chemical synaptogenesis. Journal of Neurophysiology. 120 (4), 1914-1922 (2018).
- Nagy, J. I., Pereda, A. E., Rash, J. E. Electrical synapses in mammalian CNS: Past eras, present focus and future directions. Biochimica et Biophysica Acta - Biomembranes. 1860 (1), 102-123 (2018).
- Suk, H.J. et al. Closed-loop real-time imaging enables fully automated cell-targeted patch-clamp neural recording in vivo. Neuron. 95 (5), 1037-1047 (2017).
- Annecchino, L. A. et al. Robotic automation of in vivo two-photon targeted whole-cell patch-clamp electrophysiology. Neuron. 95 (5), 1048-1055 (2017).
- Kolb, I. et al. Cleaning patch-clamp pipettes for immediate reuse. Scientific Reports. 6, 35001 (2016).
- Holst, G. L. et al. Autonomous patch-clamp robot for functional characterization of neurons in vivo: development and application to mouse visual cortex. Journal of Neurophysiology. 121 (6), 2341-2357 (2019).
- Kodandaramaiah, S. B. et al. Multi-neuron intracellular recording 1 in vivo via interacting autopatching 2 robots. ELife. 7, 24656 (2018).
- Lubbert, H. et al. cDNA cloning of a serotonin 5-HT1c receptor by electrophysiological assays of mRNA-injected Xenopus oocytes (RNA fractionation/hybrid depletion/hybrid selection/choroid plexus/voltage clamp). Neurobiology. 84 (2) 4332-4336 (1987).
- Florio, M. et al. Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science. 347 (6229), 1465-1470 (2015).
- Kalebic, N. et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO Reports. 17 (3), 338-348 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır