Method Article
אופטימיזציה של הצמיחה של גבישי אנדותיאפפסין לניסויי קריסטלוגרפיה סדרתיים
In This Article
Summary
מטרת מאמר זה היא לתת לצופה הבנה מוצקה כיצד להפוך את פרוטוקול פיזור האדים הקטן שלהם, לגידול גבישי חלבון גדולים ובודדים, לשיטת מיקרו-קריסטליזציה של אצווה בנפח גדול לקריסטלוגרפיה סדרתית.
Abstract
כאן, פרוטוקול מוצג כדי להקל על יצירת כמויות גדולות (> 100 μL) של slurries מיקרו-גבישי מתאים לניסויים קריסטלוגרפיה סדרתית הן בסינכרוטרונים והן ב- XFELs. השיטה מבוססת על הבנה של דיאגרמת הפאזה הגבישית החלבונית, וכיצד ניתן לנצל ידע זה. השיטה מחולקת לשלושה שלבים: (1) אופטימיזציה של מורפולוגיה גבישית, (2) מעבר לאצווה, ו-(3) קנה מידה. שלב 1 כולל מציאת גבישים בודדים מתפצלים היטב, בתקווה אך לא בהכרח, המוצגים במורפולוגיה דמוית קובייה. בשלב 2, מצב שלב 1 ממוטב על ידי זמן גדילת גביש. אסטרטגיה זו יכולה להפוך גבישים הגדלים על ידי דיפוזיה אדים לאצווה. ברגע שצמיחת הגביש יכולה להתרחש תוך כ-24 שעות, ניתן לשרטט מורפוגרמה של תערובת החלבונים והמשקעים ולהשתמש בה כבסיס לאסטרטגיית קנה מידה (שלב 3). כאשר ניתן לגדל גבישים באצווה, ניתן לנסות שינוי קנה מידה, ולמטב את גודל הגביש וריכוזו ככל שהנפח גדל. אנדותיאפפסין שימש כחלבון הדגמה לפרוטוקול זה. חלק מההחלטות המוצגות הן ספציפיות לאנדותיאפפסין. עם זאת, יש לקוות כי הדרך שבה הם יושמו יעורר דרך לחשוב על הליך זה כי אחרים יכולים להסתגל לפרויקטים שלהם.
Introduction
קריסטלוגרפיה מקרומולקולרית בטמפרטורת החדר (RT) פופולרית שוב בקרב קהילת הביולוגיה המבנית. הפיתוח של מקורות אור לייזר אלקטרונים חופשיים מקרני רנטגן (XFEL) דרבן את הפיתוח של גישות העברת דגימות RT 1,2,3,4, ושיטות אלה יושמו כעת על סינכרוטרונים 5,6,7,8. לא רק ששיטות RT פותחות את האפשרות של תחבולות ניסוימשאבה 9,10,11,12, אלא שיש גם ראיות מצטברות לכך שהן מקדמות מצבי קונפורמציה חלופיים בתוך חלבונים 13,14,15,16,17.
עם זאת, הסיבה העיקרית לכך ששיטות ההקפאה צברו תאוצה על פני גישות RT בסוף שנות התשעים הייתה האטת נזקי הקרינה על ידי טמפרטורות גבישים מתחת לאפס18. שיטותCryo-19 החלו לאפשר איסוף של מערך נתונים שלם מגביש חלבון יחיד. שיטות RT מודרניות ב-XFELs ובסינכרוטרונים פתרו את בעיית נזקי הקרינה החד-גבישית על ידי פיתוח אסטרטגיות העברת גבישים מהירות (> 100 הרץ) 1,2,3,4. שיטות אלה מאפשרות איסוף מערך נתונים שלם מאלפי גבישים שנחשפו בנפרד. גישות העברת RT אלה דורשות אפוא ייצור כמויות גדולות של תמיסות המכילות מיקרו-גבישים הומוגניים (> 100 מיקרוליטר של גבישי < 50 מיקרומטר). עם זאת, מאחר ששיטות הקפאה נוטות לדרוש גבישים בודדים בלבד, שיטות ליצירת תרחיפים מיקרו-גבישיים כאלה אינן נפוצות כיום במעבדות קריסטלוגרפיה של חלבונים.
ישנן דוגמאות בספרות כיצד לבצע חלקים מהליך אופטימיזציה של מיקרו-התגבשות עבור דגימות קריסטלוגרפיה סדרתיות. כאן, יש להבחין בין ממברנה לבין חלבונים מסיסים. פרוטוקולים לאופטימיזציה של הצמיחה של גבישי חלבון מיקרו-ממברניים הגדלים במונולאין (או שומנים אחרים), עבור שלב מעוקב ליפידי (LCP), תוארו היטב20,21,22. עם זאת, שיטות למיקרו-התגבשות של חלבונים מסיסים, כולל חלבוני ממברנה הגדלים בתנאים שאינם LCP, חסרות בדרך כלל. מחקרים קודמים התמקדו בחלקים ספציפיים של התהליך, כגון סינון מיקרו-גבישי 23,24, שיפור נוקלציה 24, וקנה מידה באמצעות דיפוזיה של ממשק חופשי 25, אך לא שיטה שלמה.
עם זאת, לאחרונה תוארה שיטה26 המנסה להציע פרוטוקול מלא. כמו היבטים רבים של קריסטלוגרפיה של חלבונים, היא אינה חדשה. רבים מהרעיונות המוצעים תוארו כבר על ידי Rayment (2002)27. השיטה נועדה להראות לקריסטלוגרפים כיצד לבצע את ההמרה מגביש יחיד שגדל באמצעות דיפוזיה של אדים, למתודולוגיית אצווה לגידול אלפי מיקרו-גבישים. השיטה מתמקדת בדיפוזיית אדים כנקודת מוצא משותפת, שכן 95% מכל שקיעי בנק נתוני החלבונים (PDB) מגיעים מגבישים הגדלים בלוחות דיפוזיהשל אדים 26. עם זאת, דיפוזיית אדים אינה השיטה האידיאלית למיקרו-התגבשות26, ולכן מתוארת מתודולוגיה להמרת דיפוזיית אדים להתגבשות אצווה. ברגע שניתן לגדל גבישים באצווה, נתיבי קנה מידה לנפחים גדולים יותר הופכים מעשיים יותר. בהתחשב בגחמות של התגבשות חלבונים, המחברים ידגישו כי שיטה זו אינה חסינה מפני תקלות. עם זאת, הפרוטוקול צריך, לכל הפחות, לספק תובנה לגבי "מרחב ההתגבשות" של חלבון.
שיטה זו מסתמכת על דיאגרמת שלב התגבשות החלבונים וכיצד הבנה של דיאגרמה זו יכולה לשמש כמדריך במהלך אופטימיזציה של מיקרו-קריסטליזציה. דיאגרמת פאזת חלבון מתוארת בדרך כלל כתרשים x/y עם ריכוזי משקעים וחלבונים על צירי x ו-y, בהתאמה (איור 1A). מנקודת המים הטהורים (בפינה השמאלית התחתונה - איור 1A), ריכוז החלבון והמשקע עולה עד שמגיעים לקו המסיסות. קו המסיסות מסמן את נקודת רוויית העל (קו סגול - איור 1A). כאשר חלבון הוא סופר-רווי, התמיסה הופכת לבלתי יציבה מבחינה תרמודינמית ותתחיל להיפרד לשני שלבים: "עשיר בחלבון" ותמיסה רוויה יציבה. הפרדה זו יכולה להתרחש בכל מקום מעבר לקו המסיסות והקינטיקה שלה תלויה בתכונות החלבון ובמרכיבי התמיסה.
כאשר ריכוזי החלבון והמשקעים גדולים מדי, החלבון יתפרק בצורה לא יציבה מחוץ לתמיסה והתוצאה תהיה משקע אמורפי (האזור הוורוד - איור 1A). אולם הפרדת פאזה מסודרת יכולה להתרחש באזור הנוקלציה [ראו Garcia-Ruiz (2003)28 לתיאור מפורט] ולנוקלינטים גבישיים יש נטייה להיווצר (אזור ירוק - איור 1A). גרעין וגדילה מסירים חלבון מהתמיסה ומעבירים את הטיפה לאזור המטא-יציב שבו הצמיחה יכולה להימשך עד שמגיעים לקו המסיסות [ראו McPherson and Kuznetsov (2014)29 לדיון מפורט]. התרשים הוא, ברוב המכריע של תנאי ההתגבשות, פישוט יתר גס30. עם זאת, ללא קשר לכך, הדיאגרמה עדיין שימושית מאוד עבור מיקרו-קריסטלוגרפים מכיוון שהמיפוי של הדיאגרמה מאפשר לקבוע את קו המסיסות ואת הקינטיקה של הנוקלאציה.
במונחים של יצירת מיקרו-גבישים, שני הגורמים במהלך ההתגבשות שצריכים להיות אופטימליים הם מספר הגבישים (Xn) והממד הממוצע והארוך ביותר שלהם (Xs). X n יהיה פרופורציונלי למספר אירועי הגרעין (n ) (Eq. 1).
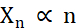 Eq. 1
Eq. 1
X s פרופורציונלי לריכוז החלבון החופשי מעל קו המסיסות (Ps) חלקי Xn (Eq. 2).
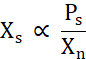 פרק 2
פרק 2
במצב מושלם, כל אירוע גרעין יניב גביש אפשרי ולכל אחד מהגבישים הללו, תהיה גישה שווה לחלבון הזמין בתמיסה. איור 2 הוא ייצוג גרפי מתרחיש אידיאלי של הקשר בין Xn ו-Xs. מעשית, השליטה העיקרית שיש לקריסטלוגרף על Xn ו-Xs היא על ידי השפעה על כמות הגרעין או על ידי הוספת גבישי זרעים. על המיקרו-קריסטלוגרף לשפוט כיצד להגדיל את Xn כך שניתן יהיה ליצור ריכוז גבישי מתאים וגודל גבישי מתאים.
רוב טכניקות ההתגבשות דורשות "תקופת מעבר" (איור 1B). לדוגמה, בניסוי דיפוזיה של אדים, בעת ערבוב החלבונים והתמיסות המזרזות, הריכוזים של כל אחד מהם ישתנו ככל שהטיפה תשתווה לתמיסת הבאר. יש לקוות ששינויים אלה יעבירו בהדרגה את הטיפה לאזור הגרעין שבו תגבר הנטייה להתגבשות. כאשר גבישים מתחילים להתגרעין ולגדול, כמות החלבון בתמיסה תתחיל לרדת, מה שמקטין את ההסתברות לגרעין נוסף. הכמות הסופית של הנוקלציה תהיה ספציפית לחלבון ולמצב, וגם תלויה בעומק החדירה של אזור הגרעין. בהינתן החדירה המוגבלת לאזור הנוקלציה של שיטות הדורשות שלב מעבר, רמת הנוקלציה תוגבל בסופו של דבר לקצב הנוקלציה בגבול אזור הנוקלציה המטא-יציבה.
בשל החשיבות של היכולת לשפר את רמת הנוקלציה עבור מיקרו-קריסטלוגרף, חשוב לעבור למתודולוגיית התגבשות אצווה. אצווה יכולה לנצל טוב יותר את כל אזור הנוקלציה (איור 1C). בשיטות אצווה, הרעיון הוא לערבב את החלבון והמשקע יחד כך שתיווצר תמיסה סופר-רוויה ללא צורך בשינויים בריכוזי הרכיבים. נוקלציה צריכה להיות אפשרית מיד עם הערבוב. שיטות אצווה מאפשרות אפוא להגיע באופן תיאורטי לכל אזור הנוקלציה. לאחר מכן ניתן לנצל כל עלייה בקינטיקה של נוקלציה מעבר לגבול המטא-נוקלציה.
אם הרמה הבסיסית של נוקלציית הגביש אינה מספיקה כדי ליצור Xn גדול, ניתן להשתמש בשיטות זריעה זעירות. במיקרו-זריעה, גבישים שגדלו מראש מפורקים כדי ליצור תרחיף של שברים גבישיים שיכולים לשמש כפיגום לצמיחת גבישים טריים31,32. מיקרו-זריעה נמצאת בשימוש נרחב בהכנת דגימות קריסטלוגרפיות סדרתיות כדרך להגדיל את Xn ללא צורך בהגדלת הגרעין הגבישי (איור 1C).
ניתן להמחיש את המעבר מדיפוזיית אדים לאצווה בדיאגרמת פאזה כהעברת נקודת ההתחלה של הניסוי מהאזורים הלא רוויים או המטא-יציבים לאזור הנוקלציה. ניתן לעשות זאת על-ידי הגדלת ריכוזי החלבונים ו/או המשקעים, ו/או היחס בין השניים בתוך הטיפה (איור 1D), והתבוננות באילו תנאים נוצרים גבישים המופיעים במהירות (< 24 שעות)26. שיווי משקל מלא של נפילת אדים יכול להימשך ימים או שבועות33. לכן, על ידי חיפוש תנאים המראים גבישים המופיעים במהירות, ניתן למצוא תנאי אצווה ללא צורך לעבור לתבניות סינון התגבשות חלופיות כגון מיקרו-אצווה 34,35,36,37.
לאחר מציאת אזור הגרעין, נמצא מצב אצווה וניתן ליצור מורפוגרמה - כאן, דיאגרמת פאזה גסה. המורפוגרמה מועילה מאוד כאשר שוקלים אם להשתמש בפרוטוקול אצווה של זרעים או אצווה ישרה. על ידי שרטוט ה-Xn כפונקציה של החלבון וריכוז המשקעים, ניתן לבצע הערכה של קינטיקה של הנוקלציה26. אם X n נשאר נמוך בכל אזור הנוקלציה, ייתכן שיהיה צורך באצוות זרעים כדי להפוך את Xn לגדול מספיק כדי להגביל את צמיחת הגביש. הערכה זו היא הצעד הראשון בתהליך קנה המידה לנפחים גדולים יותר (> 100 μL).
שיטה זו תוכננה כך שניתן יהיה לבצע אותה ברוב מעבדות ההתגבשות באמצעות ציוד סטנדרטי להתגבשות דיפוזיה של אדים. מחקרים רבים נערכו גם המתארים טכניקות כדי להקל על חלקים רבים של תהליך זה, אם הציוד יהיה זמין. אלה כוללים, אך אינם מוגבלים לפיזור אור דינמי (DLS) 25,27, הדמיה לא ליניארית 20,24,25, עקיפה אבקה 20,24,27 ומיקרוסקופ אלקטרונים 26 [ראו Cheng et al. (2020)40 לסקירה נחמדה].
מטרת עבודה זו היא לספק הדגמה חזותית של השיטה למעבר מהתגבשות דיפוזיה של אדים בנפח קטן (< 500 nL) להתגבשות אצווה בנפח גדול (> 100 μL). Endothiapepsin מ Cryphonectria parasitica שימש כמערכת לדוגמה להדגמת תרגום זה. סוג הניסוי ושיטת מסירת הדגימות שהמיקרו-גבישים נדרשים להם ישפיעו על פלט Xs האידיאלי26. עבור ניסויי ערבוב הדורשים רזולוציית זמן של אלפית שנייה41 או חרירי גז וירטואלייםדינמיים 42, Xs סופי של < 5 מיקרומטר עשוי להיות רצוי. במקרה זה, המטרה הייתה לייצר גבישי חלבון המתפצלים לכ-1.5 Å, לצורך ניסוי משאבה-גשושית המופעלת באמצעות פוטון, ושימוש בגישת העברת מטרה קבועה.
כדי להמחיש את דרישות הדגימה של ניסוי קריסטלוגרפיה סדרתי כזה באמצעות אנדותיאפפסין, טבלה 1 מציגה את הפרמטרים הניסיוניים של ניסוי היפותטי. המידע לדוגמה התבסס על הפרוטוקול המתואר להלן. בהתחשב בכמה הערכות שמרניות לגבי שיעורי פגיעה ודרישות איסוף נתונים, 50 מ"ג הוא אומדן צריכת המדגם הכולל של הניסוי כולו.
איור 3 מציג תרשים זרימה של תהליך האופטימיזציה המלא מהתגבשות ראשונית של דיפוזיית אדים בנפח קטן ועד אצווה בקנה מידה גדול. עבור רוב פרויקטי הקריסטלוגרפיה הסדרתית, פרוטוקול זה יתחיל בשלב 2: "מעבר לאצווה", מכיוון שחלבון המטרה כבר התגבש. עם זאת, שלב 1 נכלל כדי להשלים ולהזכיר לקוראים את חשיבותו. מציאת מצב המוליד גביש יחיד וגדול המתפצל היטב היא נקודת ההתחלה הטובה ביותר לאופטימיזציה של מיקרו-גבישים. בשלב 2, ניתן למטב מצב זה מדיפוזיית אדים לאצווה, וניתן לשרטט מורפוגרמה של אזורי הנוקלציה והמטא-יציבות. לאחר ביצוע פעולה זו, ניתן לשנות את קנה המידה של מצב האצווה לנפחים גדולים יותר בשלב 3. עד סוף תרשים הזרימה, קריסטלוגרף ייצור פרוטוקול חוזר בנפח גדול (> 100 μL), מיקרו-התגבשות, פרוטוקול אצווה עבור אנדותיאפפסין. שיטה זו יכולה להיות מיושמת על חלבון מסוים של עניין.
Protocol
הערה: כל ניסויי ההתגבשות של 96 בארות ישיבה וטיפה הוגדרו באמצעות לוחות של 2 או 3 טיפות. רובוט לטיפול בנוזלים והדמיה / מלון התגבשות שימשו כדי להקל על ההכנה והניטור של כל מסכי 96 הבארות. כל ריכוזי הריאגנט לניסויי התגבשות ניתנים בריכוזי ההתחלה שלהם לפני הערבוב.
1. אופטימיזציה של מורפולוגיה גבישית
הערה: שלבים 1.1.1. ו-1.1.6. תאר כיצד נמצאו תנאי התגבשות של אנדותיאפפסין, וכיצד תנאים אלה עברו אופטימיזציה כדי למצוא מצב יחיד שהניב גבישים בודדים בעלי דיפרציה טובה.
- אופטימיזציה של מטריצה דלילה
- הכינו תמיסת אנדותיאפפסין טרייה.
הערה: אנדותיאפפסין, כאשר הוא נרכש כסופראן 600, חייב להיות מועבר במאגר מתמיסת האחסון שלו ומרוכז.- הכינו 3 ליטר של 0.1 מ 'Na אצטט pH 4.6 ב 4 °C.
- חותכים 20 ס"מ של צינורות דיאליזה ושוטפים לזמן קצר בחיץ. אוטמים קצה אחד של הצינור באמצעות קליפס, מניחים 50 מ"ל של תמיסת אנדותיאפפסין לתוך הצינור ולאחר מכן אוטמים את הקצה השני.
- השאירו את התמיסה לדיאליזה לפחות 4 שעות (או לילה) ב 4 °C ב 1 L של חיץ Na אצטט. בשל רכיבי מאגר האחסון, התמיסה בשקית הדיאליזה תהיה כעת כ-100 מ"ל.
- מעבירים את שקית הדיאליזה המכילה את האנדותיאפפסין לליטר טרי של 4 מעלות צלזיוס, 0.1 מ 'Na אצטט pH 4.6. חזור על שלב זה פעם נוספת כך שהמאגר המקורי דולל פי 2000 כנגד ה-Na Acetate.
- האנדותיאפפסין יהיה כעת בערך 10 מ"ג / מ"ל. יש להתרכז עד 100 מ"ג/מ"ל באמצעות רכז צנטריפוגלי 10 kDa וצנטריפוגה.
- הבזק לקרר את תמיסת endothiapepsin בחנקן נוזלי ב 50 μL aliquots ולאחסן ב -80 ° C.
- הכן מסך מטריצה דלילה PACT Premier 96 באר.
- באמצעות רובוט לטיפול בנוזלים, יש לפזר 100 nL של 70 מ"ג/מ"ל אנדותיאפפסין ו-100 nL של תמיסת באר לתוך תת-באר אחת לכל באר. מערבבים את החלבונים ותמיסת הבאר 3 פעמים עם הוספת חיץ ההתגבשות.
- אטמו את הצלחת והשאירו למשך 28 ימים בטמפרטורה של 20 מעלות צלזיוס, וצילמו תמונות כל יום בשבוע הראשון ולאחר מכן כל שבוע לאחר מכן במשך 4 שבועות.
- ניתוח מטריצה דלילה
- זהה פגיעות המייצרות גבישי אנדותיאפפסין בודדים. ממסך PACT, התנאים שהכילו MgCl2 גדלו כסינגלטונים ולא כאשכולות מחט.
- אופטימיזציה של מטריצה דלילה
- מתוך MgCl2 המכיל תנאים שזוהו בשלב 1.1.3.1, צור מסך 96 בארות המשלב ומשנה באופן אקראי את רכיבי הבאר השונים.
- באמצעות רובוט לטיפול בנוזלים, יש לפזר 100 nL של 70 מ"ג/מ"ל אנדותיאפפסין ו-100 nL של תמיסת באר לתוך תת-באר אחת לכל באר. מערבבים את החלבונים ותמיסת הבאר 3 פעמים עם הוספת חיץ ההתגבשות.
- אטמו את הצלחת והשאירו למשך 28 ימים בטמפרטורה של 20 מעלות צלזיוס, וצילמו תמונות כל יום בשבוע הראשון ולאחר מכן כל שבוע לאחר מכן במשך 4 שבועות.
- ניתוח אופטימיזציה
- באמצעות תוכנת גיליונות אלקטרוניים מתאימה, דרג את תנאי ההתגבשות היוצרים גבישים בהתבסס על איכות הגביש ורמת המשקעים, ללא גבישים (0) לאידיאלי (5) ונמוך (0) לגבוה (5), בהתאמה. ביחס לאיכות הגביש, הקריטריונים הרחבים הם גבישים בודדים בעלי מורפולוגיה דמוית קופסה.
- בצע ניתוח מתאם של פירסון בין תכולת תנאי ההתגבשות לבין כמות הגביש ורמת המשקעים.
- שרטט נתונים אלה כמפת חום. חפש רכיבים ותנאים שהיו מתואמים עם התוצאות המועדפות.
- ניתוח עקיפה.
- ודא שהגבישים שגדלו מהתנאים שזוהו בשלב 1.1.5 מתאימים לקריסטלוגרפיה טורית על ידי ביצוע ניסוי עקיפה של קרני רנטגן.
- טען דגימה של גבישי אנדותיאפפסין מכל אחד מהתנאים שזוהו על תמיכות המאפשרות איסוף נתונים במהירות של 100 או 293 K ובצע ניסוי עקיפה של קרני רנטגן. אם אתה עובד תחת קריו, השתמש ב-25% אתילן גליקול כמגן קריו.
- עבד נתונים אלה באמצעות חבילת תוכנה מתאימה. גבישי אנדותיאפפסין צריכים להתפשט מעבר ל -1.5 Å. בדוק אם יש תאומים, מכיוון שגבישים תאומים יכולים לסבך באופן משמעותי את עיבוד הנתונים הקריסטלוגרפיים הטוריים.
- אם הגבישים הם סינגלטונים ודיפרקט ל-1.5 Å, המשך לשלב 2. אם לא, חזור לשלב 1.1.2 ונסה מסכים דלילים יותר כדי לזהות תנאים מבטיחים. לאחר הניתוחים שנערכו בשלבים 1.1.5. ו-1.1.6., מצב התגבשות של 25% (w/v) PEG 6,000, 0.1 M Tris-HCl pH 7.0 ו-0.15 M MgCl2 היה צריך להימצא כאידיאל המשוער.
- הכינו תמיסת אנדותיאפפסין טרייה.
2. מעבר לאצווה
- ניסוי מורפוגרמה
- צור ציר זרעי מיקרו-קריסטל.
הערה: מומלץ בעת הכנת מלאי זרעים, להכין את הזרעים מגבישים שגודלו במיוחד למשימה. זה מאוד עוזר עם שחזור. רעיונות אחרים שהוצגו בשלבים 2.1.1.1 עד 2.1.1.11 הם להשתמש תמיד בגבישים שגדלו ממספר סטנדרטי של בארות - כאן 5 - ולהשתמש במלאי ברגע שהם עשויים כדי לשלול מחזורי הקפאה-הפשרה.- הכינו לוח התגבשות של 96 בארות עם בארות המכילות את חיץ ההתגבשות: 25% (w/v) PEG 6,000, 0.1 M Tris-HCl pH 7.0 ו- 0.15 M MgCl2.
- באמצעות רובוט לטיפול בנוזלים, יש לפזר 200 nL של 70 מ"ג/מ"ל אנדותיאפפסין מופשר ו-200 nL של תמיסת באר לתוך תת-באר אחת לכל באר. מערבבים את החלבונים ותמיסת הבאר 3 פעמים עם הוספת חיץ ההתגבשות.
- אוטמים את הצלחת ומשאירים למשך 24 שעות.
- ממלאים צינור צנטריפוגה 1.5 מ"ל בחיץ התגבשות 250 מיקרוליטר וחרוזי זכוכית 10-15 מ"מ. השאירו את צינור הצנטריפוגה על קרח להתקרר במשך 5-10 דקות.
- בחר 5 בארות עם קריסטלים, לפתוח את הבארות עם אזמל, באמצעות קצה פיפטה, למחוץ את הגבישים בבארות.
- יש לשאוף 1 μL של חיץ מצינור הצנטריפוגה הקר ולהשתמש בו כדי ליצור הומוגניות של תמיסת הקריסטל המרוסק. לאחר הומוגני, לשאוף את כל slurry ולאסוף בצינור צנטריפוגה מקורר.
- חזור על שלב 2.1.2.6 עבור כל אחת מ-5 בארות המשנה.
- מערבלים את צינור הצנטריפוגה המכיל את החיץ, מאגדים תרחיפים וחרוזים ב-1000 סל"ד למשך 30 שניות.
- מחזירים את צינור הצנטריפוגה לקרח למשך 30 שניות.
- חזור על שלבים 2.1.2.8 ו- 2.1.2.9 פעמיים נוספות.
- מלאי הזרעים מוכן כעת וניתן לחלק אותו לאצוות של 10 μL ולאחסן ב -20 מעלות צלזיוס.
- ביצוע ניסוי מורפוגרמה.
- הכינו מסך רשת של 2 טיפות עם 96 בארות. שנו את ריכוז ה-PEG 6,000 מ-5% ל-40% (w/v) לאורך עמודי הלוחות, תוך שמירה על החיץ והמלח ב-0.1 M Tris-HCl pH 7.0 ו-0.15 M MgCl2, בהתאמה.
- הכינו דילול רציף של אנדותיאפפסין ב 0.1 M Na אצטט pH 4.6 מ 100 ל 12.5 מ"ג / מ"ל על פני 8 שלבים. ריכוז שונה של endothiapepsin ישמש עבור כל שורה של הצלחת.
- באמצעות רובוט לטיפול בנוזלים, יש לפזר 150 nL של אנדותיאפפסין לבארות משנה 1 ו-2. בתת-באר 1, מחלקים 150 nL של תמיסת הבאר. בתת-באר 2, multi-aspirate 50 nL של מלאי זרעים מופשר ו 100 nL של תמיסת באר, ולאחר מכן לחלק את שניהם לתוך תמיסת החלבון. מערבבים את התמיסות 3 פעמים עם הוספת חיץ ההתגבשות.
- אטמו את הצלחת והשאירו בטמפרטורה של 20°C וצלמו תמונות כל 0, 3, 6, 12, 18, 24 שעות, ואז כל יום בשבוע הראשון, ובכל שבוע במשך ארבעת הבאים. אם הדמיה אוטומטית אינה אפשרית, אל תדאג לגבי הדמיה שעתית ביום הראשון.
- צור ציר זרעי מיקרו-קריסטל.
- ניתוח מורפוגרמה
- התבוננות בתמונות שצולמו לאחר 24 שעות, להעריך את מספר הגבישים הנמצאים בכל באר ולתעד הערכות אלה בגליון העבודה "מחולל מורפוגרמה" שסופק. הערכות אלה אינן חייבות להיות מדויקות; ספירה פרטנית של אלפי מיקרו-גבישים, אם קיימים, אינה מעשית או הכרחית. בעיקר נסו לוודא שההערכות עקביות על פני כל הצלחת.
הערה: כלל 24 השעות התבסס על התצפיות שנעשו ב- Beale et al . (2019)26. תנאי התגבשות דיפוזיה של אדים יכולים להימשך ימים או שבועות כדי לאזן. גבישים המופיעים במהירות נוטים יותר לגדול בתהליך אצווה ולא על ידי שיווי משקל הדרגתי של רכיבי הטיפה. קריטריון 24 השעות הוא, אם כן, שרירותי במקצת, וזמן חיתוך מדויק בין אצווה לניסוי דיפוזיה של אדים יהיה תלוי בתערובת הספציפית של המצב [ראו Beale et al. (2019) 26 לפרטים מלאים]. - הזן את הריכוזים ההתחלתיים של אנדותיאפפסין ו- PEG 6,000 בקופסאות שצוינו.
- גליון העבודה יתווה באופן אוטומטי את התוצאות בתבנית דיאגרמת הפאזה המסורתית עם ריכוז משקעים וחלבון על צירי x ו - y , בהתאמה. ובכן, תנאים שרק מולידים גבישים בטיפות הזרעים שלהם מציינים את האזור המטא-יציב של הדיאגרמה (כחול שקוף), בעוד שתנאים שיש בהם גבישים הן בטיפות הזרעים והן בטיפות שאינן זרעים מציינים את אזור הגרעין (ירוק מוצק).
הערה: באופן אידיאלי, רוב אזור הנוקלציה צריך להיות נוכח בתרשים (כלומר, יש כמה בארות שקופות בתחתית הדיאגרמה וכמה משקעים צריכים להיות גלויים בריכוזי חלבון ומשקעים גבוהים). אם זה לא המקרה, אולי, לחזור על הניסוי אבל להגדיל את ריכוז החלבון ו / או מזרז (אם אפשר). - אם הגביש הופיע תוך פחות מ-24 שעות, המשך לשלב 2.3.1. אם לא, המשך לשלב 2.4 והמשך במיטוב לקראת אצווה.
- התבוננות בתמונות שצולמו לאחר 24 שעות, להעריך את מספר הגבישים הנמצאים בכל באר ולתעד הערכות אלה בגליון העבודה "מחולל מורפוגרמה" שסופק. הערכות אלה אינן חייבות להיות מדויקות; ספירה פרטנית של אלפי מיקרו-גבישים, אם קיימים, אינה מעשית או הכרחית. בעיקר נסו לוודא שההערכות עקביות על פני כל הצלחת.
- אנליזת קריסטלים
- כפי שנאמר בסוף שלב 1, לפני המעבר לשלב הבא, ודא שלגבישים אלה יש את המורפולוגיה הרצויה ואיכות העקיפה. באשר למורפולוגיה, האם ניתן לראות את הגבישים כבלתי תאומים ונוצרים כסינגלטונים ולא כמבנים דמויי כדור מחט או מניפה? לגבי עקיפה, לאסוף נתוני עקיפה מן הגבישים אם אפשר. אם גבישים אלה אינם נשברים, אין זה סביר שהגבישים הגדלים בנפח גדול יותר יישברו.
- טען דגימה של גבישי אנדותיאפפסין מניסוי המורפוגרמה על תמיכות המאפשרות איסוף נתונים במהירות של 100 או 293 K ובצע ניסוי עקיפה של קרני רנטגן. אם אתה עובד תחת קריו, השתמש ב-25% אתילן גליקול כמגן קריו.
- עבד נתונים אלה באמצעות חבילת תוכנה מתאימה. גבישי אנדותיאפפסין צריכים להתפשט מעבר ל -1.5 Å. על פני דגימת הגבישים, התבוננו בגודל התא, במספר הכולל של התצפיות ובפסיפס; אמצעים אלה יתנו אינדיקציה לגבי ההומוגניות של גבישי הדיפרקציה.
- אם המורפולוגיה הגבישית ואיכות העקיפה מספיקות, המשך לשלב 3.
- מטב את זמן צמיחת הגבישים.
הערה: ניתוח המורפוגרמה (שלב 2.2) ייתן אינדיקציה לנקודת ההתחלה של ההתגבשות (כלומר, האזור בדיאגרמת הפאזה שבו ממוקמת הטיפה כאשר המשקע ותמיסות החלבונים היו מעורבבים). האם הירידה היא באזור המטא-יציב או מתחת לקו המסיסות? התגבשות אצווה מתחילה באזור הנוקלציה (איור 1C). מטרת השלב הזה היא להעביר את נקודת ההתחלה הזו מתחת לקו המסיסות או מאזור מטא-יציב, לאזור הגרעין (איור 1D). אם הזרע יורד משלב 2.2. הניבו גבישים במהירות, זוהי אינדיקציה לכך שתערובת הטיפות כבר נמצאת באזור המטא-יציב, אם לא, אז סביר להניח שהטיפה אינה רוויה.- אופטימיזציה של זמן צמיחת הגבישים.
- באמצעות אותו מסך כמו בשלב 2.1.3, הכינו ניסוי התגבשות דיפוזיה של 96 בארות בצלחת של 3 טיפות.
- להגדיל את ריכוז החלבון ההתחלתי של endothiapepsin על ציר y (כלומר, לרכז את החלבון עוד יותר, אולי 120 מ"ג / מ"ל עבור endothiapepsin).
- בצע דילול סדרתי, כמו בשלב 2.1.3.2, כך שכל שורה של הצלחת תכיל ריכוז חלבון נמוך יותר ברצף.
- השתמש ביחסי נפילה שונים בכל אחת משלוש הטיפות על הצלחת: 1:1, 1:2 ו- 2:1, חלבון:משקע.
- הצג או צייר את הצלחת ביום הראשון בשעה 0, 3, 6, 12, 18, 24 שעות ולאחר מכן כל יום בשבוע הראשון, ובכל שבוע עבור ארבעת הבאים. אם הדמיה אוטומטית אינה אפשרית, אל תדאג לגבי הדמיה שעתית ביום הראשון.
- זהה טיפות המייצרות את הגבישים המופיעים במהירות הרבה ביותר והופך אותם לנקודות ההתחלה של אופטימיזציות חוזרות ונשנות עד לצמיחת הגביש תוך 24 שעות.
- כאשר זוהה מצב גבישי המופיע במהירות, חזור לשלב 2.1 כדי לשרטט מחדש את המורפוגרמה כהקדמה לתחילת קנה המידה.
- אופטימיזציה של זמן צמיחת הגבישים.
3. קנה מידה
- דרג מסלולי קנה מידה. בשלב זה, אין צורך להחליט על מסלול קנה מידה יחיד, אלא רק לזהות ולדרג את האפשרויות כך שניתן יהיה לבחון אותן בתורו. ככל שנפח תערובת האצווה גדל במהלך תהליך קנה המידה, יחולו שינויים בקצב הנוקלציה ובטווח גדלי הגביש. עם זאת, ניתן להתגבר על אלה על ידי כוונון זהיר של ריכוזי רכיבים ככל שהנפח המוגדל גדל.
הערה: שלבים 3.1.1 ו- 3.1.2 מתארים כיצד להבחין, מתוך המורפוגרמה, אם פרוטוקול אצווה או אצווה של זרעים מתאים יותר.- פרוטוקול אצווה ישר
- האם ה-Xn באזור הנוקלציה פרופורציונלי לריכוז החלבון ו/או המשקע? כלומר, האם Xn גדל כפונקציה של ריכוז המשקע ו / או החלבון? -כן? עבור לשלב 3.1.1.2. לא? עבור לשלב 3.1.2.
- אתר תנאים המניבים גבישים בגודל הנדרש ועבור לשלב 3.2.
- פרוטוקול אצווה של זרעים
- האם Xn שטוח על פני אזור הגרעין? כלומר, Xn אינו עולה כפונקציה של ריכוז המשקע ו / או החלבון.
- אתר תנאי זרעים המניבים גבישים בגודל הנדרש ועבור לשלב 3.2. אם כל הגבישים גדולים מדי - עבור לשלב 3.1.2.3.
- חזור על ניסוי המורפוגרמה (שלב 2.1) אך הפעם הגדל את ריכוז מלאי הזרעים המשמש בבארות הזרעים. ניתן להגדיל את מלאי הזרעים על ידי שימוש ביותר גבישים ביצירתו. לדוגמה, במקום 5 בארות בשלב 2.1.1.5, השתמש ב- 10 בארות.
- הצג או צייר את הלוח מעל 0, 3, 6, 12, 18, 24 השעות הראשונות.
- ה-Xn היה צריך לגדול וה-Xs ירד בטיפות הזרעים. חזור על מחזור זה אם יש צורך בגבישים קטנים יותר ולאחר מכן עקוב אחר פרוטוקול אצוות זרעים.
- פרוטוקול אצווה ישר
- קנה מידה הדרגתי
- קנה מידה בצלחות 96 בארות. מתוך מורפוגרמת אנדותיאפפסין, נבחרה בתחילה שיטת אצווה ישרה המשתמשת בתנאי התגבשות 0.1 M Tris-HCl pH 7.0, 0.15 M MgCl2 ו- 30% (w/v) PEG 6,000. 100 מ"ג/מ"ל אנדותיאפפסין מעורבב עם חיץ ההתגבשות ביחס של 1:1.
- הכינו 2-3 בארות בצלחת ישיבה בת 2 בארות 96 בארות עם 100 μL של 0.1 M Tris-HCl pH 7.0, 0.15 M MgCl2 ו-30% (w/v) PEG 6,000.
- באמצעות תמיסת אנדותיאפפסין 100 מ"ג/מ"ל שהופרזה טרייה, יש להוציא 0.5 מיקרוליטר חלבון ו-0.5 מיקרוליטר משקע לכל באר, לאטום ולאחסן בטמפרטורה של 20 מעלות צלזיוס.
- הצג או צייר את הלוח מעל 0, 3, 6, 12, 18, 24 השעות הראשונות. שים לב לכל שינוי בטווח של Xs ו- Xn.
- אם חלו שינויים, חזור על שלבים 3.2.1.1 עד 3.2.1.2 אך הגדל או הקטן את ריכוז החלבון, המשקע ו/או הזרעים כדי לשחזר שינויים בטווח של Xs ו- Xn.
- כאשר הטווח של Xs ו- Xn מקובלים, המשך לשלב 3.2.2.
- קנה מידה בצלחות תלויות 24 היטב
- הכינו באר אחת של צלחת תלויה 24 בארות על ידי שימון שולי הבאר בשומן ואקום.
- הכינו 0.5 מ"ל של 0.1 M Tris-HCl pH 7.0, 0.15 M MgCl2 ו-30% (w/v) PEG 6,000 ומלאו היטב את המשומן.
- באמצעות תמיסת אנדותיאפפסין שזה עתה הופשרה, פיפטה 1 מיקרוליטר של חלבון על פני השטח של כיסוי זכוכית. פיפטה 1 μL של חיץ התגבשות על טיפת החלבון ומערבבים באמצעות פיפטה.
- הצג או צייר את הלוח מעל 0, 3, 6, 12, 24 השעות הראשונות. שים לב לכל שינוי בטווח של Xs ו- Xn.
- אם חלו שינויים, חזור על שלבים 3.2.2.1 עד 3.2.2.4 אך הגדל או הקטן את ריכוז החלבון, המשקע ו/או הזרעים כדי לשחזר שינויים בטווח של Xs ו- Xn.
- כאשר/אם הטווח של Xs ו- Xn מקובל, המשך לשלב 3.2.2.7.
- חזור על שלבים 3.2.2.1 עד 3.2.2.5, והגדל את הנפח הכולל של הניסוי בהדרגה ל -10 μL.
- פעם אחת בנפח של 10 μL או יותר, להמשיך צינורות צנטריפוגות בשלב 3.2.3.
- קנה מידה בצינורות צנטריפוגות
הערה: העידון של מצב אצווה endothiapepsin התרחש בעיקר בנקודה של 200 μL נפחים (ראה תוצאות, קנה מידה). התהליך החל במצב התגבשות של 0.1 M Tris-HCl pH 7.0, 0.15 M MgCl2 ו-30% (w/v) PEG 6,000. עם זאת, ריכוז ה-PEG השתנה בסופו של דבר ל-40% (w/v). זרעים נדרשו גם כדי לשלוט ב-Xn, וכדי למנוע מגבישים לגדול יותר מדי, היה צורך להרוות את צמיחת הגבישים. שלבים 3.2.3.1 עד 3.2.3.7 מפרטים את תהליך מיטוב התנאים. שלב 3.2.4. תאר את פרוטוקול האצווה הסופי.- הכינו חיץ התגבשות של 1 מ"ל: 0.1 M Tris-HCl pH 7.0, 0.15 M MgCl2 ו-30% (w/v) PEG 6,000.
- באמצעות אנדותיאפפסין טרי שהופשר 100 מ"ג/מ"ל יש להוסיף 25 מיקרוליטר חלבון לצינור צנטריפוגה בנפח 1.5 מ"ל.
- ערבבו היטב את חיץ ההתגבשות עם תמיסת החלבון ביחס של 1:1 עם קצה פיפטה. מניחים את הצינור באקדח/מסובב עם תסיסה גבוהה ב-20°C.
- קח רגיל (5, 10, 30, 60 דקות, 2, 5, 10, 24 שעות) 2.5 μL aliquots ולהציג בהמוציטומטר. הקלט את הטווח Xn ואת טווחX s .
- אם חלו שינויים, חזור על שלבים 3.2.3.1. עד 3.2.3.4. אך להגדיל או להקטין את ריכוז החלבון, המשקע ו / או הזרעים כדי לשחזר כל שינוי בטווח של Xs ו- Xn
- כאשר הטווח של Xs ו- Xn מקובל, המשך לשלב 3.2.3.7.
- חזור על שלבים 3.2.2.1 עד 3.2.2.5, והגדל את הנפח הכולל של הניסוי בהדרגה ל- 200 μL או יותר, לפי הצורך.
- פרוטוקול סופי של אצווה זרעים
- הכינו ציר זרעים.
- הכינו 2 מ"ל של חיץ התגבשות: 0.1 M Tris-HCl pH 7.0, 0.15 M MgCl2 ו-40% (w/v) PEG 6,000.
- באמצעות אנדותיאפפסין מופשר טרי של 100 מ"ג/מ"ל יש להוסיף 100 מיקרוליטר חלבון לצינור צנטריפוגה בנפח 1.5 מ"ל.
- ערבבו היטב את חיץ ההתגבשות עם תמיסת החלבון ביחס של 1:1 עם קצה פיפטה. הניחו את הצינור באקדח/מסובב עם תסיסה גבוהה ב-20°C למשך 24 שעות כדי לאפשר לגבישים של 50 מיקרומטר לגדול.
- הוסף 10-15 חרוזי זכוכית 1 מ"מ לתרחיף קריסטל 50 מיקרומטר.
- מערבלים את צינור הצנטריפוגה המכיל את הבוצה והחרוזים ב-1000 סל"ד למשך 30 שניות.
- מחזירים את צינור הצנטריפוגה לקרח למשך 30 שניות.
- חזור על שלבים 3.2.4.1.5 ו- 3.2.4.1.6 10 פעמים נוספות.
- זה עכשיו 200 μL של 1x זרע מלאי. לדלל את מלאי הזרעים פי 10 על ידי תוספת של 1.8 מ"ל של חיץ התגבשות. Aliquot את מלאי הזרעים 10x באצוות 50 μL ולאחסן ב -20 ° C.
- פרוטוקול אצווה זרעים.
- הכינו חיץ התגבשות: 0.1 M Tris-HCl pH 7.0, 0.15 M MgCl2 ו-40% (w/v) PEG 6,000.
- בצינור צנטריפוגה, ערבבו 100 μL של חיץ התגבשות עם 50 μL של מלאי זרעים 10x שזה עתה הופשר.
- באמצעות אנדותיאפפסין מופשר טרי של 100 מ"ג/מ"ל, הוסף 150 מיקרוליטר חלבון לצינור צנטריפוגה של 1.5 מ"ל.
- ערבבו היטב את חיץ ההתגבשות/תערובת הזרעים עם תמיסת אנדותיאפפסין עם קצה פיפטה והניחו את הצינור באקדח/מסובב עם תסיסה גבוהה ב-20°C.
- עקוב אחר ההתגבשות על ידי לקיחת אליציטוטים רגילים של 2.5 μL והצג את הגבישים בהמוציטומטר. הקלט את הטווח Xn ואת טווחX s .
- לאחר כ-80 דקות, כאשר הגבישים הגיעו ל-Xs של 15 מיקרומטר, יש להרוות את התגובה על ידי תוספת של 150 μL של 0.05 M Na אצטט pH 4.6, 0.05 M Tris-HCl pH 7.0, 0.075 M MgCl2 ו-20% (w/v) PEG 6,000 (תמיסה המורכבת מחיץ אנדותיאפפסין וחיץ התגבשות, מעורב 1:1).
- אחסנו את הגבישים בטמפרטורה של 20°C.
- האם הפרוטוקול יצר טווח גודל גבישי מקובל ומספר עבור הניסוי המיועד? כן - בוצע - לא - חזור לשלב 3.1. ונסה אפשרות שינוי קנה מידה חלופית. לדוגמה, יחס חלבון:משקעים שונה עשוי להיות אפשרי או הוספת זרעים אם זה לא נעשה בעבר. כאשר כל אלה מוצו, ייתכן שיהיה צורך למצוא מצב חדש בשלב 1.
- הכינו ציר זרעים.
- קנה מידה בצלחות 96 בארות. מתוך מורפוגרמת אנדותיאפפסין, נבחרה בתחילה שיטת אצווה ישרה המשתמשת בתנאי התגבשות 0.1 M Tris-HCl pH 7.0, 0.15 M MgCl2 ו- 30% (w/v) PEG 6,000. 100 מ"ג/מ"ל אנדותיאפפסין מעורבב עם חיץ ההתגבשות ביחס של 1:1.
תוצאות
אופטימיזציה של מורפולוגיה גבישית
שלב 1, אופטימיזציה של מורפולוגיה גבישית, נכלל כדי להזכיר לקורא את חשיבותו. ייתכן שניתן יהיה ליצור מיקרו-גבישים מושלמים מכדורי מחט עקיפה גרועים; עם זאת, המחברים היו מציעים כי עדיף לייעל את השניים בנפרד. ראשית, מצאו תנאים שיוצרים גביש יחיד מפוזר היטב באמצעות דיפוזיה של אדים, ולאחר מכן המירו את התנאים האלה לאצווה במקום לנסות לשלב את שני השלבים יחד. גילוי תנאי גרעין גבוהים, בשלב זה, אינו הכרחי; מורפולוגיה ואיכות עקיפה הן המטרות העיקריות.
לפני תחילת מיקרו-התגבשות של endothiapepsin, ניתוח של תנאי התגבשות מבנה מופקד מן PDB נערך. ניתן היה להשיג תנאי התגבשות ופרוטוקולים משוערים עבור 47 מתוך 48 התצהירים של אנתוטיאפסין. כל אלה התבססו באופן כללי על ההתגבשות הראשונה של אנדותיאפפסין שנערכה על ידי Moews and Bunn (1970)46. בהתחשב בדמיון בין תנאים אלה ומקורם ה"קלאסי", בוצע מסך 96 בארות, דיפוזיית אדים ומטריקס דליל כדי לחקור מגוון רחב יותר של תנאי התגבשות. אנדותיאפפסין היה מרוכז ל 70 מ"ג / מ"ל ומסך מטריצה דלילהPACT 47 בוצע בצלחת ישיבה 96 באר ב 20 מעלות צלזיוס ערבוב 100 nL של חלבון עם 100 nL של תמיסת באר. כל תנאי מהניסוי הזה אחרי 36 שעות הוליד גבישים. עם זאת, ניתוח של המורפולוגיה הגבישית הצביע על כך שתנאים מסוימים עשויים להיות טובים יותר עבור אופטימיזציה של מיקרו-התגבשות.
איור 4A מראה ירידה ממסך PACT שהיה מייצג באופן כללי את אלה שנצפו ברוב הצלחת. במבט ראשון, זה עשוי להיות מפתה לחשוב כי גבישים אלה עשויים להיות שווים אופטימיזציה נוספת עבור מיקרו-התגבשות. הגבישים גדולים ונראה שיש גרעין משמעותי. עם זאת, המורפולוגיה הגבישית הכוללת אינה אידיאלית. ראשית, הגבישים אינם סינגלטונים נצפים מכיוון שנראה כי גבישים מרובים גדלים מנקודות גרעין בודדות. שנית, גודל הגביש הוא מאוד לא סימטרי עם צמיחה המתרחשת בעיקר במורד ציר יחיד. גבישים כאלה נוטים יותר תיאורטית להתיישר כאשר הם מועברים לקרן הרנטגן. שני המאפיינים מציגים בעיות במהלך איסוף ועיבוד של נתונים קריסטלוגרפיים טוריים.
איור 4B, לעומת זאת, מראה גבישי אנדותיאפפסין שגדלו בנוכחות MgCl2. מורפולוגיה זו הייתה עקבית בכל התנאים שהכילו את MgCl 2 ולכן הציעו כי המורפולוגיה שלהם נובעת מ-MgCl2. תנאי MgCl2 יצרו גבישים בודדים, דמויי קופסה יותר, שייצגו מטרה טובה יותר לניסויים הסדרתיים האולטימטיביים.
היו ארבעה תנאים במסך PACT שהכילו את MgCl2. כדי להבין טוב יותר את ההשפעה של כל המרכיבים השונים של תנאים אלה על התגבשות אנדותיאפפסין, בוצעה אופטימיזציה אקראית. נוצר מסך המכיל שילוב אקראי של החוצצים והמשקעים במגוון ריכוזים ו- pHs. ריכוז MgCl2 היה גם הוא משתנה ואז הטיפות שהתקבלו דורגו באופן שרירותי מ-0-5 (0 הן ללא גבישים או משקעים) מבחינת איכות הגביש החזותי ורמת המשקעים.
איור 5A מציג מפת חום של התוצאות מניתוח המתאם של פירסון בין רמת המשקעים ואיכות הגביש לבין משתני המסך (דוגמאות לטיפות מהניסוי הזה מוצגות באיור 5B, C ו-D). התוצאות הצביעו על כך שה- pH של התמיסה היה מתואם מאוד לרמת המשקעים, עם מאגרי אלקליין שהביאו ליותר משקעים. ריכוז MgCl2 היה מתואם מעט לרמת המשקעים, כמו גם ה- pH וריכוז המשקע לאיכות הגביש.
בהתבסס על תוצאות אלה, התקבלה ההחלטה לקחת את הגבישים שגדלו ב 0.1 M Tris-HCl pH 7.0, 0.15 M MgCl2, 20% (w/v) PEG 6,000 לשלב הבא של הפרוטוקול - מעבר לאצווה. המורפולוגיה של גבישים הייתה מקובלת, וניתוח של עקיפת קרני רנטגן ומדדי איכות הנתונים מגבישים אלה העלה כי לא היה הבדל משמעותי בין הגבישים שגדלו בתוך ומחוץ לנוכחות של Mg2+ (איור 9).
מעבר לאצווה
עבור אופטימיזציות רבות של מיקרו-קריסטלוגרפיה טורית, שלב 2 יהיה נקודת ההתחלה. החלבון המעניין כבר התגבש עבור קריו-קריסטלוגרפיה ופרוטוקול ההתגבשות יצטרך כעת להשתנות כדי ליצור תרחיפים מיקרו-גבישיים. פרוטוקול זה השתמש רק בלוחות דיפוזיה של 96 בארות כדי לבצע את הטרנספורמציה לאצווה, מכיוון שפיזור אדים הוא שיטת ההתגבשות המשמשת 95% מערכי PDB26. הפרוטוקול נמנע מלעבור למיקרו-אצווה34,35,37 מכיוון שמעבר זה עדיין עשוי לגרום לאופטימיזציה דומה. זה לא אומר כי פרוטוקול זה יכול להיעשות רק לוחות דיפוזיה אדים. כל השלבים שהוצגו, יעבדו גם במיקרו-אצווה אם זו הייתה שיטת ההתגבשות המקורית.
כדי להעריך את התגבשות אנדותיאפפסין במצב הנבחר, נוצרה מורפוגרמה - או דיאגרמת שלב גס. מטרת ניסוי המורוגרמה היא משולשת. ראשית, ניתוח של מורפוגרמה הוא בעל תועלת רבה בעת הערכת מסלולי קנה מידה בשלב 3 - קנה מידה. שנית, המורפוגרמה פועלת ככלי אופטימיזציה, ומסייעת לגלות תנאי דיפוזיה של אדים היוצרים גבישים באמצעות אצווה [כלומר, גבישים המופיעים במהירות (< 24 שעות)]. שלישית, אם גבישים לא הופיעו במהירות, ניתוח של טיפות הזרעים יכול לתת לקריסטלוגרף מושג על המיקום המשוער של המצב הנוכחי בדיאגרמת הפאזה. לדוגמה, אם תנאי הזרע נותנים גבישים אבל הלא-זרעים לא, סביר להניח שתנאים אלה נמצאים באזור המטא-יציב.
ניסוי המורפוגרמה של אנדותיאפפסין בוצע על בסיס 0.1 M Tris-HCl pH 7.0, 0.15 M MgCl2, 20% (w/v) PEG 6,000. ריכוזי החלבון וה-PEG נעו בין 100 ל-12.5 מ"ג/מ"ל ובין 5% ל-40% (w/v), בהתאמה. הטיפות נותחו והתוצאות שורטטו באמצעות דף העבודה שסופק (איור 6A).
כמו כן, כבר בשלב האופטימיזציה של המורפולוגיה הגבישית היה ברור כי גדילת גבישי אנדותיאפפסין במצב זה, ובריכוזי חלבונים אלה, תביא לגידול גבישים תוך פחות מ-24 שעות. זה הצביע על כך שההתגבשות התרחשה באמצעות אצווה ולא באמצעות תהליך מונע דיפוזיה של אדים. הגביש שגדל בתנאים אלה היה, אם כן, מתאים לקנה מידה לנפחים גדולים יותר.
אם גבישים לא היו נראים בטיפות ללא זרעים לאחר 24 שעות, סביר להניח שההתגבשות עדיין הייתה תלויה במעבר (איור 1B), ולכן לא באצווה. במקרה זה, התוצאות מניסוי המורוגרמה עדיין מעניינות. הם נותנים אינדיקציה לנקודת ההתחלה הסבירה להתגבשות בדיאגרמת הפאזה ומכאן, כיצד האופטימיזציה הבאה צריכה להתקדם. תסתכל על טיפות הזרעים. הזרעים יאפשרו צמיחה גבישית באזור המטא-יציב ללא קשר לגרעין. לדוגמה, אם גבישים מופיעים תוך 24 שעות בטיפות הזרעים אך לא בטיפות שלא נזרעו, הדבר מצביע על כך שניתן לצפות בחלק מהאזור המטא-יציב. אם לא נצפים גבישים בטיפות הזרעים או הלא זרעים, כל הבארות נשארות לא רוויות.
שינוי גודל
בהתבוננות במורפוגרמה (איור 6A) ניתן לבצע מספר תצפיות. נראה כי כמות הנוקלציה הושפעה הן מריכוז החלבון והן מריכוזי המשקעים. היה גם תיחום ברור מאוד של טיפות שמובילות למשקעים חלבוניים, כאשר טיפות מכילות: כלום, גבישים או משקעים (איור 6B). הוספת זרעים (איור 6D) גם הגדילה מאוד את Xn בהשוואה לטיפות ללא זרעים (איור 6C). אם ניקח את כל התוצאות הללו יחד, הוחלט לנסות להגדיל הן פרוטוקול אצווה והן פרוטוקול אצווה זרעים ב 30% (w/v) PEG 6,000 ו 100 מ"ג / מ"ל אנדותיאפפסין.
קנה המידה הראשוני של הבדיקה נעשה בלוחות טיפה תלויים של 24 בארות. נפחי הירידה גדלו בהדרגה כך שניתן היה להבחין בשינויים בהתנהגות ההתגבשות (איור 7). כפי שניתן לראות, הן בטיפות ללא זרעים והן בטיפות זרעים התרחשה צמיחה גבישית. כל הטיפות שלא נזרעו גדלו במגוון גדלים גבישיים, אך בעיקר גבישים גדולים (100-200 מיקרומטר - הממד הארוך ביותר). טיפות הזרעים, לעומת זאת, יצרו גבישים קטנים יותר (5 - 50 מיקרומטר - הממד הארוך ביותר). בדיקות ראשוניות אלה הציעו כי זרעים יידרשו להקטין Xs, אבל גם, כי מצב זה צריך להיות מתאים לכמויות גדולות יותר.
כאשר הנפח הוגדל ב -200 μL, נפח ההתגבשות היה נסער ללא הרף במהלך גדילת הגביש. הסיבה העיקרית לסערה זו הייתה להבטיח שתמיסת ההתגבשות תישאר הומוגנית ושגבישים גדלים לא ישקעו בתחתית או בצידי הצינורות. שקיעה של גבישים יכולה להוביל לאוכלוסיית גבישים הטרוגנית עם גבישים גדולים מאוד וקטנים כאחד. תסיסה של תמיסת התגבשות יכולה גם לקדם נוקלציה44,45.
לרוע המזל, 30% (w/v) PEG 6,000 שלא נזרעו לא הפיקו גבישים, ולכן ריכוז ה-PEG הועלה ל-35% (w/v). עלייה זו שיפרה את ההתגבשות במידה ניכרת, עם טווח סופי של Xn ו- Xs של 3.6 ± 1.2 x 106 גבישים ·mL-1 ו- 42 ± 4.1 מיקרומטר, בהתאמה (איור 8A ו- B - שחור). למרות שיפור משמעותי וריכוז גבישי מקובל, הגבישים הסופיים היו גדולים מדי עבור הניסוי המתוכנן, ולכן בוצעו אופטימיזציות נוספות. כדי להקטין את גודל הגבישים הסופיים נבדקו שתי דרכים (איור 1E): הפחתת ריכוז החלבון כדי לנסות להגביל את גדילת הגביש הסופי (איור 8A ו-B - ורוד חם), והגדלת ריכוז ה-PEG כדי לנסות ולהגביר את הגרעין (איור 8A ו-B - ירוק ).
למרבה הצער, הפחתת ריכוז החלבון הפחיתה באופן דרמטי גם את ה-Xn, שבסופו של דבר יצר גבישים גדולים עוד יותר. הגדלת ריכוז ה-PEG ל-40% הניבה טווח סופי של Xn ו-Xs של 3.1 ± 0.7 x 106 גבישים ·mL-1 ו-39 ± 2.3 מיקרומטר, בהתאמה. אלה לא היו שונים באופן משמעותי מה-35%, אך מכיוון שגודל הגביש הסופי צומצם, מצב זה נמשך עם אופטימיזציות נוספות.
כדי להגדיל את Xn, זרעים נוספו. זה הגדיל באופן דרמטי את Xn (1.1 ± 1.8 x 108 גבישים ·mL-1) והוביל ל-Xs קטן יותר (4.2 ± 4.0 מיקרומטר) (איור 8A ו-B - סגול מקווקו). גבישים אלה, למרות שהתאימו מאוד לכמה ניסויים בקריסטלוגרפיה סדרתית, נחשבו קטנים מדי ולכן ריכוז הזרעים שנוספו השתנה.
עם זאת, כוונון זה של מלאי הזרעים הנוסף התברר כקשה לחזרה אמינה; לכן, נעשה ניסיון להרוות. לאחר הוספת מלאי זרעים, בוצע מעקב אחר גודל הגביש ולאחר שהושג גודל גביש מתאים (בערך 10-20 מיקרומטר), התגבשות האצווה רוותה (איור 8C ו-D). הרוויה הוצעה, ביחס למיקרו-התגבשות, ב- Kupitz et al. (2014)25. למרות שאולי לא שיטה אידיאלית, מכיוון שתמיסת חלבונים בסופו של דבר תתבזבז26 , הטכניקה הייתה שימושית מאוד במצב זה מכיוון שהיה קשה לשלוט בגידול גבישים. הרעיון מאחורי המרווה הוא להחזיר במהירות את תערובת ההתגבשות לנקודה ממש מעל קו המסיסות (איור 1F). לאחר שהתמיסה חזרה לקו המסיסות, התמיסה חזרה לתמיסה רוויה יציבה ולא תתרחש צמיחה גבישית נוספת.
הניסיון להרוות תגובת התגבשות אינו נטול סיכון. אם מוסיפים תמיסה מרווה גדולה מדי, החלבון בתמיסה עלול להיות מדולל עד כדי כך שקו המסיסות עובר. במקרה זה, הפתרון יהפוך undersaturated ואת הגבישים יתחילו להתמוסס. כדי למנוע זאת, ניתן להעריך את כמות פתרון המרווה הנדרש על סמך תוצאות המורפוגרמה. בנקודת המרווה יש ליטול את ריכוז תמיסת החלבון. על ידי השוואת ריכוז החלבון בקו המסיסות וריכוז החלבון בתמיסה, ניתן לבצע הערכה של הדילול הנדרש.
הגרסה המרווה של ניסוי הזרעים המדוללים PEG 6,000 (w/v) 40% (w/v) נתנה ריכוז גבישי סופי וטווח גודל של 2.6 ± 3.1 x 106 גבישים ·mL-1 ו- 15 ± 3.9 מיקרומטר, בהתאמה.
לאורך כל התהליך, נאספו אוספי נתוני רנטגן של גבישי אנדותיאפפסין בקו הקרן PXII של מקור האור השוויצרי באמצעות מיקוד של 10 x 30 מיקרומטר, אנרגיה של 12.4 keV מוחלשת ב -80%, ובתנאי הקפאה. הנתונים עובדו באמצעות חוגות ובאיור 9 ניתן לראות השוואה של CC1/2. לא נצפה שינוי דרמטי ב-CC1/2 במהלך האופטימיזציה.
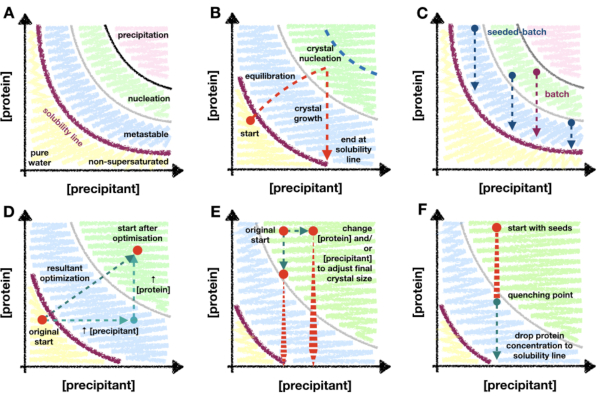
איור 1: סקירה כללית של התגבשות מעבר והתגבשות אצווה, ושיטות קנה מידה שמופו בדיאגרמת פאזה. א. האזורים והגבולות של דיאגרמת שלב התגבשות החלבונים הארכיטיפית. ריכוזי המשקע והחלבון משורטטים על צירי x ו-y, בהתאמה, כאשר נקודת המים הטהורים נמצאת במקור. הקו הסגול מציין את גבול רוויית העל של החלבון, ואזורי המטא-יציבות, הנוקלציה והמשקעים מוצגים בכחול, ירוק וורוד, בהתאמה. ב. דוגמה לגבולות החדירה לאזור הגרעין של שיטת התגבשות 'שלב מעבר', כגון דיפוזיית אדים. בניסוי תיאורטי זה, ריכוזי המשקע והחלבון מתחילים ממש מתחת לקו המסיסות - עדיין לא סופר-רוויים. בעוד הטיפה מתאזנת, ריכוזי רכיבי הטיפה גדלים כך שהטיפה הופכת לסופר-רוויה, וממשיכה לנוע - או לעבור - לאזור הגרעין. עם התגרענות גבישית, ריכוז החלבון בתמיסה מתחיל לרדת. הריכוז ממשיך לרדת ככל שהגבישים גדלים עד שלבסוף נעצר בקו המסיסות. הקו הכחול המקווקו מסמן גבול תיאורטי של המעבר לאזור הגרעין. ברגע שמתחיל הגרעין, ריכוז החלבון יורד, מה שימנע חדירה נוספת. ג. מסלולי התגבשות לדוגמה של אצווה ושל אצוות זרעים. באצווה, הערבוב של החלבון והמשקע חייב ליצור תמיסה סופר-רוויה בתוך אזור הנוקלציה, כך שצמיחת הגביש תוכל להתרחש. בקבוצת זרעים, אין צורך בהחלט להיות באזור הנוקלציה עקב תוספת של מיקרו-זרעים, כך שניתן לחקור גם מיקומים באזור המטא-יציב. ד. אופטימיזציה היפותטית של ניסוי ההתגבשות המוצג ב-B מדיפוזיה של אדים לאצווה. נקודת ההתחלה המקורית של דיפוזיית אדים עברה, באמצעות וקטור האופטימיזציה המתקבל, לעמדת ההתחלה החדשה; בתוך אזור הנוקלציה. הווקטור המתקבל הוא תוצר של שתי אופטימיזציות: עלייה הן בריכוזי החלבון והן בריכוזי המשקעים. ה. מיטובים לדוגמה בשעת שינוי קנה מידה של תנאי אצווה להתאמה אישית של Xn ו- Xs הסופיים. ו. המרווה את ניסוי ההתגבשות על ידי הוספת חיץ התגבשות. זה חיוני כי מרווה לא לקחת את ריכוז החלבון מתוך האזור metatable, ולכן, מתחת לנקודה של supersaturation חלבון. אחרת, גבישים יתחילו להתמוסס בחזרה לתמיסה. ב. ו-C. עובדו מתוך Beale et al. (2019)26 באישור המחברים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
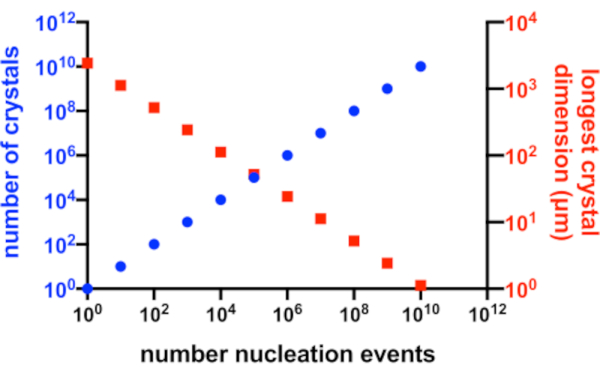
איור 2: הגדלת Xn והקטנת Xs. הקשר האידיאלי בין מספר הגבישים שנוצרו מניסוי התגבשות לבין הממד הארוך הממוצע שלהם. כדי ליצור את הגרף הזה, נעשה שימוש בהתגבשות של חלבון מודל היפותטי של 10 kDa. החלבון התגבש בריכוז של 10 מ"ג/מ"ל והניב P2 1 21 21גבישים בממדים של 49x50x51 Å. כל אירוע נוקלציה הניב גביש. ההנחה הייתה שצמיחת הקריסטלים הומוגנית מכל פנים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
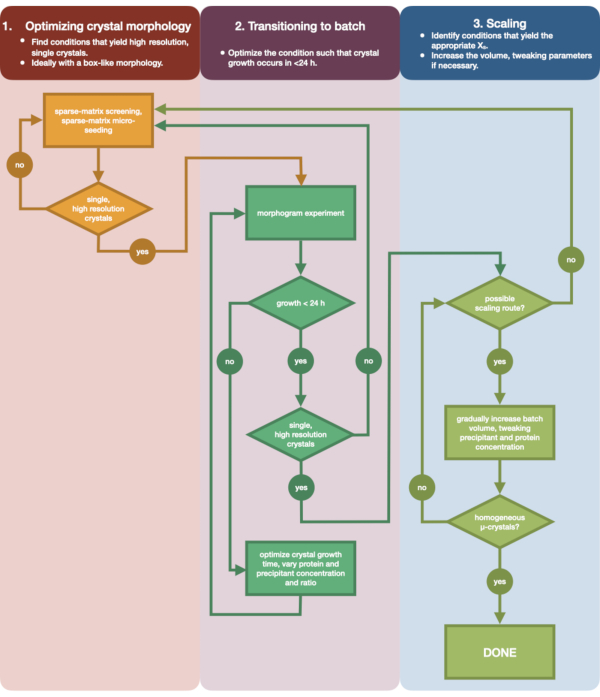
איור 3: תרשים זרימה שמראה את השלבים למיטוב גביש שגדל בניסוי פיזור אדים בנפח קטן (<500 nL) לניסוי אצווה בנפח גדול (> 100 μL). אופטימיזציה של גבישים נחלקת לשלושה שלבים: (1) אופטימיזציה של מורפולוגיה גבישית. (2) מעבר לאצווה. (3) קנה מידה. בשלב 1 חשוב לזהות גבישים מתאימים למיקרו-התגבשות. חלבונים מסוימים נמצאים רק במורפולוגיה גבישית אחת ללא קשר למצב ההתגבשות. עם זאת, כדאי לחפש תנאים שיוצרים גבישים בודדים, דמויי קובייה, או קרובים אליהם ככל האפשר מבחינה אנושית. גבישים בודדים, דמויי קובייה, באופן היפותטי ואנקדוטלי, יניבו בדרך כלל תוצאות טובות יותר מניסויי קריסטלוגרפיה סדרתיים. לאחר שנבחרה מורפולוגיית גבישים ואושרה העקיפה, יש צורך להעביר את ניסוי ההתגבשות מדיפוזיית אדים לאצווה (שלב 2). כאן, גבישים צריכים להיות אופטימליים על ידי זמן הנוקלציה שלהם. המטרה היא למצוא תנאים המניבים גבישים המופיעים במהירות (> 24 שעות) מכיוון שתנאים אלה עשויים לפגוע באזור הגרעין באופן מיידי, ולכן הם אצווה. לאחר שנמצא תנאי באזור הנוקלציה, ניתן ליצור מורפוגרמה. המורפוגרמה מאפשרת את רוב אזור הנוקלציה למיפוי ומסלולי קנה מידה פוטנציאליים שזוהו עבור שלב 3. לאחר מכן ניתן לשנות את הנפח של מצב אצווה מזוהה בהדרגה או במהירות כדי להניב נפח סופי של >100 μL. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: ניתוח של תנאי התגבשות אנדותיאפפסין ממסך מטריצה דלילה של PACT. A . ו-B. הן תמונות לאחר 24 שעות של בארות A4 ו-C10, בהתאמה ממסך PACT . רכיבי חיץ ההתגבשות מודגשים על האיור. חיץ SPG הוא חומצה סוקצינית, נתרן דימימן פוספט וגליצין מעורבבים ביחס מולארי של 2:7:7. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
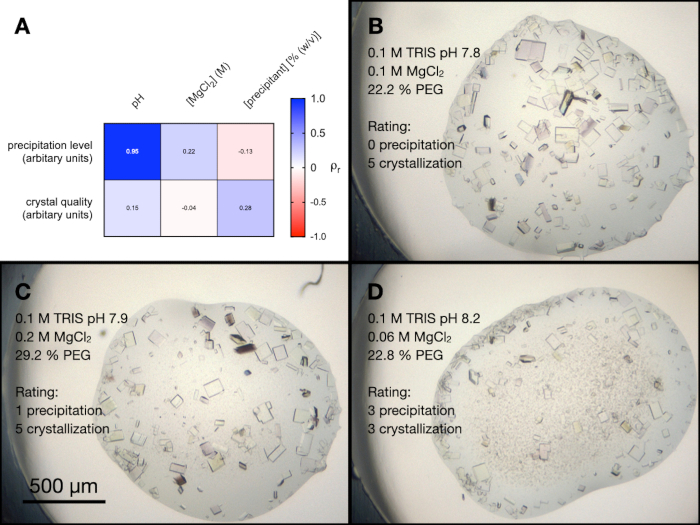
איור 5: ניתוח של אופטימיזציית התגבשות אנדותיאפפסין מתנאי PACT MgCl2. א. מפת חום של התוצאות מניתוח מתאם פירסון בין pH חיץ, ריכוז MgCl2 וריכוז משקעים לבין רמת המשקעים ואיכות הגביש. רמת המשקעים ואיכות הגביש הוערכו שניהם באופן שרירותי בסולם של 0-5 (כאשר 0 הם ללא גבישים או משקעים) לאחר 24 שעות לפני הספירה. וד' מראים דוגמאות של התגבשות ומשקעים בשלוש טיפות שונות. כמו כן מוצגים תנאי ההתגבשות והערכות של רמת המשקעים ואיכות הגבישים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
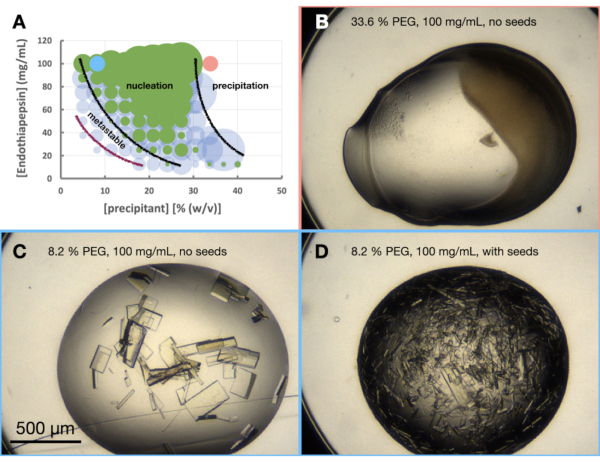
איור 6: מורפוגרמת אנדותיאפפסין כאשר התגבשה ב-0.1 M Tris-HCl pH 7.0, 0.15 M MgCl2 ו-PEG 6,000. א. מורפוגרמה שנוצרה מהגיליון האלקטרוני "פאזה-דיאגרמה-מחולל" שסופקה. המספר היחסי של גבישים בכל טיפה מסומן בגודל העיגולים, והתוצאות של טיפה 1 (חלבון ומשקע) וטיפה 2 (חלבון, משקע וזרעים) מודגשות בירוק ובכחול, בהתאמה. ערכי החלבון וריכוזי המשקעים, על ציר x וציר y, בהתאמה, מציינים ערכים מעורבים מראש של כל אחד מהם ולא נפחים סופיים. בהתבסס על התוצאות, שורטטו קווים שחורים וקו סגול כדי להראות את גבולות אזור הנוקלציה והאזור המטא-יציב, בהתאמה. ב. ג. וד' מראה כמה תוצאות לדוגמה מהניסוי. הנקודות האדומות והכחולות המסומנות על א' מציינות את מיקומם של ב' ו-ג'. וד', בהתאמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 7: ניסויי קנה מידה ראשוניים של אנדותיאפפסין בלוחות טיפה תלויים של 24 בארות. אותם ריכוזי חלבון ומשקעים שימשו לכל השבילים: 100 מ"ג/מ"ל אנדותיאפפסין ב-0.1 M Na אצטט pH 4.6 ו-0.1 M Tris-HCl pH 7.0, 0.15 M MgCl2 ו-30% (w/v) PEG 6,000, בהתאמה. כל התמונות המוצגות צולמו לאחר 24 שעות ונפחי הטיפה הסופיים מסומנים על כל תמונה. הלוח השמאלי (A, D ו-G) הוא תערובת של 1:1 של חלבון ומשקע, הלוח האמצעי (B, E ו-H) הוא תערובת של 1:2:3 של זרעים, משקע וחלבון, והלוח הימני (C, F ו-I) הם תמונות מוגדלות של הלוח האמצעי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
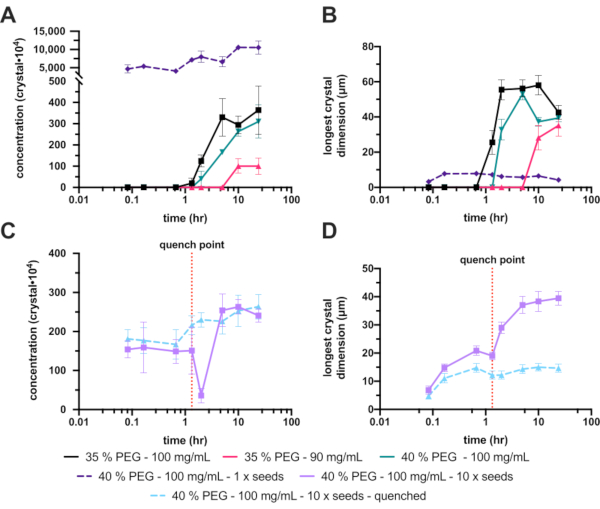
איור 8: ניתוח מיקרו-התגבשות של אנדותיאפפסין בנפחים של 200-300 מיקרוליטר. A. ו-C. מראים כיצד Xn השתנה במהלך זמן הניסוי. ב. ו-D. מראים כיצד Xs (הממד הארוך ביותר) השתנה עם הזמן. תוצאות הניסויים הופרדו לשם הבהרה. הקו המקווקו האדום ב-C וב-D מראה את הנקודה שבה בוצעה הרוויה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
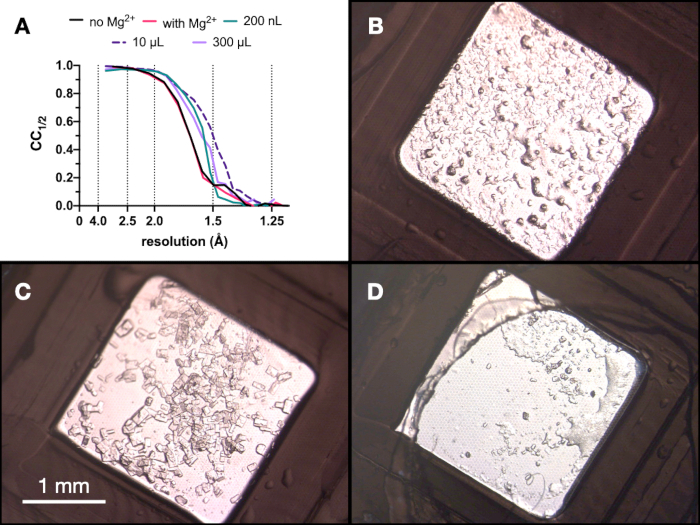
איור 9: תוצאות CC1/2 ותמונות של גבישים שהתקבלו בכל שלב של תהליך המיקרו-התגבשות כדי להעריך את איכות העקיפה. A. CC1/2 התווה כנגד רזולוציה מנתונים שנאספו מגבישים שגדלו: עם ובלי Mg - חלק מאופטימיזציה שלב 1, בנפח 200 nL, נפח 10 μL ונפח 300 μL הסופי. B.C. ו-D. מראים את הגבישים מנפח 200 nL, 10 μL ו-300 μL, בהתאמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| מידע על חלבונים | |
| חלבון | אנדותיאפפסין |
| משקל מולקולרי (kDa) | 33.8 |
| קבוצת חלל | עמ' 1211 |
| a, b, c (Å) | 45.2, 73.3, 52.7 |
| α, β, ɣ (°) | 90.0, 109.2, 90.0 |
| פרמטרים של יעד קבוע | |
| נפח טעון לכל שבב (μL) | 150 |
| אפרטורות לכל שבב | 25,600 |
| ריכוז גבישי נדרש (גבישים/מ"ל) | 500,000 |
| מידע לדוגמה | |
| מסת חלבון המשמשת לייצור 200 מיקרוליטר של דגימה (מ"ג) | 10 |
| הממד הקריסטלי הארוך ביותר (מיקרומטר) | 15 |
| ריכוז גבישים (קריסטלים/מ"ל) | 2,500,000 |
| משתני ניסוי | |
| מספר נקודות הזמן הנדרשות | 5 |
| מספר התמונות הדרושות לנקודת זמן | 50,000 |
| שיעור כניסות (דפוסים/תמונות משולבים שנאספו) | 0.3 |
| יעדים קבועים נדרשים לכל נקודת זמן (מעוגל כלפי מעלה) | 7 |
| דרישות לדוגמה | |
| נפח הדגימה נדרש לכל נקודת זמן (μL) | 1,050 |
| נפח הדגימה הכולל הדרוש לניסוי (מ"ל) | 5.25 |
| המסה הכוללת של חלבון נדרש (מ"ג) | 52.5 |
טבלה 1: דוגמה לדרישות הדגימה לניסוי היפותטי של משאבה-גשושית אופטית המבוצע באמצעות מטרות קבועות. החלבון ששימש בניסוי תיאורטי זה היה אנדותיאפפסין. פרמטרי המטרה הקבועה התבססו על ניסויים שדווחו ב- Ebrahim et al. (2019)48 ו- Davy et al. (2019)49. המידע לדוגמה הגיע מהפרוטוקול שדווח במאמר וידאו זה והמשתנים הניסיוניים היו הערכות שמרניות המבוססות על ניסיון חיים. דרישות המדגם הבאות חושבו לאחר מכן בהתחשב בהנחות הקודמות.
Discussion
השיטה שהוצגה מראה כיצד לייעל את ההתגבשות של אנדותיאפפסין מגבישים גדולים (≥ 100 מיקרומטר הממד הארוך ביותר), הגדלים במסכים דלילים של 96 בארות, למיקרו-גבישים, הגדלים בצינורות צנטריפוגות (נפח 300 מיקרוליטר) באמצעות אצווה. הרעיון מאחורי הפרוטוקול הוא כי הצעדים שננקטו כדי לייעל endothiapepsin יכול לשמש גם עבור חלבונים אחרים. בסופו של דבר, מענה לבעיה של יצירת נפחים גדולים (>100 μL) של מיקרו-גבישים (10-20 מיקרומטר) עבור ניסויי קריסטלוגרפיה סדרתיים ב-XFELs ובסינכרוטרונים.
הפרוטוקול מחלק את המשימה של מיקרו-התגבשות בנפח גדול לשלושה שלבים: (1) אופטימיזציה של מורפולוגיה גבישית, (2) מעבר לאצווה, ו-(3) קנה מידה. בשלב 1, יש לבחון את טווח צורות הגביש שחלבון יכול ליצור בלוחות דיפוזיה של אדים. תנאים היוצרים גבישים בודדים, דמויי קופסה, המתפצלים לרזולוציה הנדרשת צריכים להיות המטרה. בשלב 2, התנאים שנבחרו יכולים להפוך מדיפוזיית אדים לאצווה. כאן, קריטריון האופטימיזציה הוא זמן גדילת הגביש ומציאת תנאים היוצרים גבישי חלבון תוך 24 שעות. ניתן גם לשרטט מורפוגרמה הנותנת לנסיין מושג על מיקום קו המסיסות וגבולות אזור הגרעין. מורפוגרמה זו מועילה מאוד בשלב 3, קנה מידה. המורפוגרמה תיתן אינדיקציה האם נוקלציה לבדה יכולה להגדיל את Xn ולהוריד את Xs. ככל שנפח הניסוי גדל, ניתן להעריך ללא הרף את Xn ו- Xs כקריטריון המפתח להצלחה בקנה מידה.
במקרה של אנדותיאפפסין, שלב 1 חשף את מה שעשוי להיות מורפולוגיה גבישית שלא הייתה ידועה קודם לכן עבור אנדותיאפפסין. למורפולוגיה זו הייתה אותה קבוצת מרחב כמו אלה שדווחו קודם לכן, אך חשוב עבור קריסטלוגרפיה סדרתית, צורה דמוית קופסה יותר. נראה שגם גבישים בודדים צומחים מנקודות גרעין בודדות, בניגוד למניפות שנוצרו מתנאים אחרים (איור 4). עבור המצב שנבחר, שלב 2 כבר היה מרוצה חלקית כאשר צמיחת הגביש התרחשה < 24 שעות. המורפוגרמה הצביעה על כך שגם פרוטוקול ישר וגם פרוטוקול אצוות זרעים עשוי להצליח בעת שינוי קנה מידה בשלב 3. קנה מידה ראשוני באצווה ישרה, יצר מצב שיצר גבישים בטווחX n ו- X s של 3.6 ± 1.2 x 106 גבישים ·mL-1 ו- 42 ± 4.1 מיקרומטר, בהתאמה. גבישים אלה, למרות שהיו מקובלים בכמה ניסויים בקריסטלוגרפיה סדרתית, נחשבו גדולים מדי. אז בוצעו אופטימיזציות נוספות. הפרוטוקול הסופי ייצר גבישים בעלי טווח ריכוז וגודל של 3.1 x 106 גבישים ·mL-1 ו- 15 ± 3.9 מיקרומטר, בהתאמה. זה היה יותר מאידיאלי עבור הניסויים המתוכננים.
השיטה מתמקדת בטרנספורמציה של גבישי חלבון "מסיסים" הגדלים בלוחות דיפוזיה של אדים לאצווה. הסיבה להתמקדות זו היא שהרוב המכריע של גבישי החלבונים המסיסים גדלים באמצעות דיפוזיה של אדים26. עם זאת, המושגים שהוצגו יכולים להיות מיושמים גם על גבישי חלבון מסיסים שגודלו בשיטות אחרות, כגון מיקרו-אצווה. המושגים עשויים להיות ישימים גם לגבישי חלבון ממברנות הגדלים ב- LCP; מכיוון שגם זה תהליך התגבשות אצווה.
היבט מרכזי של הפרוטוקול הוא תהליך שינוי התנאים של גבישים הגדלים בלוחות דיפוזיה של אדים כך שניתן יהיה לגדל אותם באצווה. עבור טרנספורמציה זו, השיטה משתמשת בקריטריון המוצע על ידי Beale et al. (2019)26. גבישים הגדלים בתהליך אצווה, אפילו בלוחות דיפוזיה של אדים, ייווצרו במהירות (< 24 שעות). קריטריון זה הוא קירוב המבוסס על מהירות שיווי משקל נפילת דיפוזיה של אדים, והוא נכון ביותר עבור תנאי משקעים מבוססי PEG. עם זאת, תנאי התגבשות יכילו מגוון רחב של תרכובות שישפיעו על זמן שיווי המשקל. שיווי המשקל של תנאי התגבשות מבוססי מלח, למשל אמוניום כלורי מרוכז מאוד, יכול להתרחש תוך 1-2 ימים. לכן, קריטריון 24 שעות עשוי שלא להיות נכון עבור תנאים מבוססי מלח. תנאים מבוססי מלח יכולים גם להכיל דיאגרמות פאזה מורכבות יותר26,30 שעשויות שלא להתאים לארכיטיפ המוצג בפרוטוקול זה. הפחתה בקריטריון הזמן לתנאים מבוססי מלח ל -12 או 6 שעות עשויה להיות נחוצה אם קנה מידה לנפחים גדולים יותר יתברר כבלתי אפשרי.
מגבלה נוספת של שיטה זו היא המורכבות לכאורה שלה. הפרוטוקול שבוצע כדי לייעל את המיקרו-התגבשות של אנדותיאפפסין שינה למעשה את המצב המקורי ממסך המטריצה הדלילה יחסית מעט. הפגיעה הראשונה שנצפתה במסך PACT הייתה 0.1 HEPES pH 7.0, 0.2 M MgCl2 ו-20% (w/v) PEG 6,000. חיץ ההתגבשות הסופי היה 0.1 Tris-HCl pH 7.0, 0.15 M MgCl2 ו-40% (w/v) PEG 6,000. ייתכן מאוד גם שהשינוי בחיץ מ-HEPES ל-Tris-HCl, ובריכוז MgCl2 , תרמו מעט להצלחת התהליך. השארת העלייה בריכוז PEG 6,000 היא האופטימיזציה היחידה, וכזו שניתן היה להשיג בפשטות.
אולם גם הערכה זו פשטנית מדי. זה לא רק מזלזל בבעיות שנתקלו בהן במהלך קנה המידה (כלומר, השימוש בזרעים ומרווה), אלא גם את העובדה שרק בגלל שהחלבון הזה הוכח כפשוט, אין ערובה שגם הבא אחריו יוכיח את עצמו. הצעדים המומלצים בפרוטוקול, תוכננו מכיוון שאופטימיזציה של קנה המידה של נפחי התגבשות החלבונים יכולה להיות יקרה מאוד לחלבון. במהלך שבעת הניסויים בקנה מידה של אנדותיאפפסין שהוצגו, נצרכו 100 מ"ג חלבון. אמנם, חלק מהצעדים הללו בוצעו כדי להראות את השלכותיהם לאור פרוטוקול זה. אף על פי כן, 100 מ"ג חלבון, בתוספת 50 מ"ג נוספים לחלבון הנצרך במהלך ניסוי (טבלה 1), יכולים להיות השקעה משמעותית בזמן או בכסף.
למרבה המזל, לא ברור שהמסה הזו של הדגימה הנדרשת נמצאת בכל החלבונים. אנדותיאפפסין היה מסיס מאוד, ולכן דרש ריכוז חלבון גדול כדי להגיע לרוויה. באחרים (כרגע תחת אופטימיזציה), supersaturation ניתן להגיע ב 10 או אפילו 5 מ"ג / מ"ל. משתנים כאלה הם ספציפיים לחלבון ויש לאמץ אותם כאשר הם מופיעים.
מגבלות אחרות של השיטה כוללות את הסתמכותה על ציוד מורכב כגון רובוטים לטיפול בנוזלים ליצירת מסך וצלחות, ומכשירי הדמיה לצילום אוטומטי של לוחות בעת הצורך. שגרות חלופיות הוצעו כדי להגביל את הצורך בחלק מפריטי ציוד אלה, אך הפרוטוקול ייקח זמן רב יותר לעקוב בלעדיהם. הפרוטוקול מציע גם לבדוק את העקיפה של גבישים אופטימליים. עבור קריסטלוגרפים ללא גישה סדירה לסינכרוטרון, בדיקות אלה עשויות להיות מאתגרות. ייתכן שלא יהיה צורך בבקרות בכל שלב, אך בדיקות אלה מומלצות בחום לאחר זיהוי הפגיעה, ולפני ואחרי קנה המידה. גבישים לא עקיפים ב-XFEL הם, למרבה הצער, לא תופעה נדירה. בהתחשב בכך, עדיף לטעות בצד הזהירות לגבי הנחות לגבי עקיפה גבישית.
בסופו של דבר, פרוטוקול זה והתוצאות המוצגות כאן יציעו מדריך, רעיונות ודוגמה לאלה המתקשים בהפקת דגימות לניסויי קריסטלוגרפיה סדרתיים. יש לקוות שככל שהקריסטלוגרפיה הסדרתית תתפתח יותר, דרישות הדגימה של הטכניקה יצטמצמו כך שהצורך בפרוטוקולים כאלה יצטמצם. עם זאת, גם במקרה זה, האסטרטגיות המוצגות כאן עדיין יהיו שימושיות למי שרוצה לחקור את מרחב ההתגבשות של החלבון שלהם.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
פרויקט זה קיבל מימון מתוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי במסגרת הסכם המענק מס' 701647 ע"ש מארי סקלודובסקה-קירי. תודה רבה על הסיוע והתמיכה של מדעני אלומות ב- Swiss Light Source beamline X10SA-PXII.
Materials
| Name | Company | Catalog Number | Comments |
| Swissci 96-well 2-Drop plates | Molecular Dimensions | MD11-002 | 96-well 2-drop crystallisation plate |
| Swissci 96-well 3-Drop plates | Molecular Dimensions | MD11-003 | 96-well 3-drop crystallisation plate |
| mosquito LCP liquid handling robot | sptlabtech | mosquito LCP | Crystallisation robot |
| ClearVue Sheets | Molecular Dimensions | MD6-015 | 96-well crystallization plate seals |
| Safe-Tube 1.5 mL | Eppendorf | 30120086 | 1.5 mL centrifuge tubes |
| Scaple | Swan and Morton | No. 3 scalple and No. 3 handle | Scalple for cutting open plate seals |
| MS 3 Vortex | IKA | 3319000 | Vortex for mixing solution and making seed stocks |
| 24-well XRL Plate | Molecular Dimensions | MD3-11 | 24-well hanging-drop plates |
| Tube revolver/rotator | Thermo Fischer Scientific | 88881001 | Tube revolver for mixing solution during scaling |
| Eppendorf Research plus pipettes | Eppendorf | Range of manual pipettes, 0.5-10, 1-20, 10-100, 100-1000 µL | |
| Eppendorf pipette tips | Eppendorf | Range of tip sizes for manual pipettes | |
| Suparen 600 | Prochem AG | Suparen 600 | Endothiapepsin solution |
| Sodium Acetate | Sigma-Aldrich | 241245-1KG | Sodium Acetate |
| Tris | Merck | 8382T014 | Tris |
| Magnesium Chloride | Sigma-Aldrich | M2670-1kg | Magnesium Chloride |
| PEG 6,000 | Sigma-Aldrich | 81255-1kg | PEG 6,000 |
| Ethelyene glycol | Sigma-Aldrich | 324558-1L | Ethelyene glycol for cyro-protecting the crystals |
| PACT Premier HT screen | Molecular Dimensions | MD1-36 | PACT Premier 96-well crystal screen |
| DOW CORNING high vacuum grease | Molecular Dimensions | MD6-02 | Grease for sealing 24-well plates |
| Hirschmann 22 x 22 mm glaser cover slides | Hirschmann | 8000104 | Cover slides for sealing 24-well sitting drop plates |
| Crystal pins | PSI | Manufactured inhouse | Thin-film supports for micro-crystals. |
| 1-1.3 mm SiLibeads Type S | Faust | 6239547 | Glass beads for making mico-seed stocks |
| Macbook Pro | Apple | Macbook Pro | Computer for performing data analysis |
| CCP4 software suite | CCP4 | Diffraction pattern data processing software | |
| Excel | Microsoft | Microsoft Office | Plotting tool for phase diagram |
| Hausser Scientific Bright-Line counting chamber | Thermo Fischer Scientific | 02-671-51B | Tool to calculate crystal concentration |
| PACT Premier | Molecular Dimensions | MD1-29-ECO | Sparse-matrix crystallization screen |
| Rock Imager | Formulatrix | Rock Imager | Temperature controlled crystal plate storage and imager |
| Rock MakerWeb | Formulatrix | Rock MakerWeb | Crystal plate creation and image storage stoftware |
| Formulator | Formulatrix | Formulator | 96-well crystal screen creation liquid handling robot |
| Leica MZ16 Microscope | Leica | Leica MZ16 | Light microscope |
| LAS V4.6 | Leica | LAS V4.6 | Software for Leica microscopes |
| Spectra/Por 3.5 kDa dialysis tubing | Spectrumlabs | Spectra/Por 3 Dialysis Membrane | 3.5 kDa dialysis membrane |
| Dialysis tubing closures | Spectrumlabs | Spectra/Por 3 Duniversal Closures | Clips to seal the dialysis tubing ends |
| Amicon 10 kDa centrifugal concentrator | Merck-Millipore | Amicon Ultra-15 10 kDa centrifugal concentrator | 10 kDa centrifugal filter |
| 5810 R swing bucket centrifuge | Eppendorf | 5810 R Centrifuge | Swing bucket centrifuge |
References
- DePonte, D. P., et al. Gas dynamic virtual nozzle for generation of microscopic droplet streams. Journal of Physics D: Applied Physics. 41 (19), 195505 (2008).
- Hunter, M. S., et al. Fixed-target protein serial microcrystallography with an x-ray free electron laser. Scientific Reports. 4 (1), 6026 (2014).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nature Communications. 5 (1), 1-6 (2014).
- Roessler, C. G. G., et al. Acoustic Injectors for Drop-On-Demand Serial Femtosecond Crystallography. Structure. 24 (4), 631-640 (2016).
- Sherrell, D. A., et al. A modular and compact portable mini-endstation for high-precision, high-speed fixed target serial crystallography at FEL and synchrotron sources. Journal of Synchrotron Radiation. 22 (6), 1372-1378 (2015).
- Roedig, P., et al. A micro-patterned silicon chip as sample holder for macromolecular crystallography experiments with minimal background scattering. Scientific Reports. 5 (1), 1-11 (2015).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallographica Section D Biological Crystallography. 71 (2), 387-397 (2015).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature Communications. 8 (1), 542 (2017).
- Tenboer, J., et al. Time-resolved serial crystallography captures high-resolution intermediates of photoactive yellow protein. Science. 346 (6214), 1242-1246 (2014).
- Nango, E., et al. A three-dimensionalmovie of structural changes in bacteriorhodopsin. Science. 354 (6319), 1552-1557 (2016).
- Suga, M., et al. Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL. Nature. 543 (7643), 131-135 (2017).
- Mehrabi, P., et al. Liquid application method for time-resolved analyses by serial synchrotron crystallography. Nature Methods. 16 (10), 979-982 (2019).
- Halle, B. Biomolecular cryocrystallography: structural changes during flash-cooling. Proceedings of the National Academy of Sciences of the United States of America. 101 (14), 4793-4798 (2004).
- Fraser, J. S., et al. Hidden alternative structures of proline isomerase essential for catalysis. Nature. 462 (7273), 669-673 (2009).
- Fenwick, R. B., van den Bedem, H., Fraser, J. S., Wright, P. E. Integrated description of protein dynamics from room-temperature X-ray crystallography and NMR. Proceedings of the National Academy of Sciences of the United States of America. 111 (4), 445-454 (2014).
- Keedy, D. A., et al. Mapping the conformational landscape of a dynamic enzyme by multitemperature and XFEL crystallography. Elife. 4, (2015).
- Thomaston, J. L., et al. XFEL structures of the influenza M2 proton channel: Room temperature water networks and insights into proton conduction. Proceedings of the National Academy of Sciences of the United States of America. 114 (51), 13357-13362 (2017).
- Haas, D. J., Rossmann, M. G. Crystallographic studies on lactate dehydrogenase at -75 °C. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 26 (7), 998-1004 (1970).
- Hope, H. Cryocrystallography of biological macromolecules: a generally applicable method. Acta Crystallographica Section B Structural Science. 44 (1), 22-26 (1988).
- Wu, W., et al. Batch crystallization of rhodopsin for structural dynamics using an X-ray free-electron laser. Acta Crystallographica Section:F Structural Biology Communications. 71 (7), 856-860 (2015).
- Ishchenko, A., Cherezov, V., Liu, W. Preparation and delivery of protein microcrystals in lipidic cubic phase for serial femtosecond crystallography. Journal of Visualized Experiments. (115), e54463 (2016).
- Andersson, R., et al. Well-based crystallization of lipidic cubic phase microcrystals for serial X-ray crystallography experiments. Acta Crystallographica Section D: Structural Biology. 75 (10), 937-946 (2019).
- Luft, J. R., et al. The detection and subsequent volume optimization of biological nanocrystals. Structural Dynamics. 2 (4), 041710 (2015).
- Lee, D. B., et al. Supersaturation-controlled microcrystallization and visualization analysis for serial femtosecond crystallography. Scientific Reports. 8 (1), 1-10 (2018).
- Kupitz, C., et al. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcus elongatus as a model system. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1647), 20130316 (2014).
- Beale, J. H., et al. Successful sample preparation for serial crystallography experiments. Journal of Applied Crystallography. 52, 1385-1396 (2019).
- Rayment, I. Small-scale batch crystallization of proteins revisited: An underutilized way to grow large protein crystals. Structure. 10 (2), 147-151 (2002).
- García-Ruiz, J. M. Nucleation of protein crystals. Journal of Structural Biology. 142 (1), 22-31 (2003).
- McPherson, A., Kuznetsov, Y. G. Mechanisms, kinetics, impurities and defects: Consequences in macromolecular crystallization. Acta Crystallographica Section F:Structural Biology Communications. 70 (4), 384-403 (2014).
- Rupp, B. Origin and use of crystallization phase diagrams. Acta crystallographica. Section F, Structural biology communications. 71, 247-260 (2015).
- Luft, J. R., DeTitta, G. T. A method to produce microseed stock for use in the crystallization of biological macromolecules. Acta Crystallographica Section D Biological Crystallography. 55 (5), 988-993 (1999).
- Ireton, G. C., Stoddard, B. L. Microseed matrix screening to improve crystals of yeast cytosine deaminase. Acta crystallographica. Section D, Biological crystallography. 60 (3), 601-605 (2004).
- Forsythe, E. L., Maxwell, D. L., Pusey, M. Vapor diffusion, nucleation rates and the reservoir to crystallization volume ratio. Acta Crystallographica Section D Biological Crystallography. 58 (10), 1601-1605 (2002).
- Chayen, N. E., Shaw Stewart, P. D., Maeder, D. L., Blow, D. M. IUCr An automated system for micro-batch protein crystallization and screening. Journal of Applied Crystallography. 23 (4), 297-302 (1990).
- Chayen, N. E., Shaw Stewart, P. D., Blow, D. M. Microbatch crystallization under oil - a new technique allowing many small-volume crystallization trials. Journal of Crystal Growth. 122 (1-4), 176-180 (1992).
- Chayen, N. E. Comparative studies of protein crystallization by vapour-diffusion and microbatch techniques. Acta Crystallographica Section D: Biological Crystallography. 54 (1), 8-15 (1998).
- D'Arcy, A., Mac Sweeney, A., Stihle, M., Haber, A. The advantages of using a modified microbatch method for rapid screening of protein crystallization conditions. Acta Crystallographica - Section D Biological Crystallography. 59 (2), 396-399 (2003).
- Darmanin, C., et al. Protein crystal screening and characterization for serial femtosecond nanocrystallography. Scientific Reports. 6, 25345 (2016).
- Gati, C., et al. Atomic structure of granulin determined from native nanocrystalline granulovirus using an X-ray free-electron laser. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2247-2252 (2017).
- Cheng, R. K. Y. Towards an optimal sample delivery method for serial crystallography at XFEL. Crystals. 10 (3), 215 (2020).
- Schmidt, M. Mix and Inject: Reaction Initiation by Diffusion for Time-Resolved Macromolecular Crystallography. Advances in Condensed Matter Physics. 2013, 1-10 (2013).
- Oberthuer, D., et al. Double-flow focused liquid injector for efficient serial femtosecond crystallography. Scientific Reports. 7 (1), 44628 (2017).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta crystallographica. Section F, Structural biology communications. 70, 2-20 (2014).
- Yaoi, M., et al. Effect of stirring method on protein crystallization. Japanese Journal of Applied Physics, Part 2: Letters. 43 (10), 1318 (2004).
- Castro, F., Ferreira, A., Teixeira, J. J., Rocha, F. Influence of Mixing Intensity on Lysozyme Crystallization in a Meso Oscillatory Flow Reactor. Crystal Growth & Design. 18 (10), 5940-5946 (2018).
- Moews, P. C., Bunn, C. W. An X-ray crystallographic study of the rennin-like enzyme of Endothia parasitica. Journal of Molecular Biology. 54 (2), 395-397 (1970).
- Newman, J., et al. Towards rationalization of crystallization screening for small- to medium-sized academic laboratories: the PACT/JCSG+ strategy. Acta crystallographica. Section D, Biological. 61, 1426-1431 (2005).
- Ebrahim, A., et al. Resolving polymorphs and radiation-driven effects in microcrystals using fixed-target serial synchrotron crystallography. Acta Crystallographica Section D Structural Biology. 75, 151-159 (2019).
- Davy, B., et al. Reducing sample consumption for serial crystallography using acoustic drop ejection. Journal of Synchrotron Radiation. 26 (5), (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved