Method Article
Оптимизация роста кристаллов эндотиапепсина для серийных кристаллографических экспериментов
В этой статье
Резюме
Цель этой статьи - дать зрителю четкое представление о том, как преобразовать их протокол диффузии пара небольшого объема для выращивания крупных монокристаллов белка в метод периодической микрокристаллизации большого объема для серийной кристаллографии.
Аннотация
Здесь представлен протокол, облегчающий создание больших объемов (> 100 мкл) микрокристаллических суспензий, пригодных для серийных кристаллографических экспериментов как на синхротронах, так и на XFEL. Метод основан на понимании фазовой диаграммы кристаллов белка и того, как эти знания могут быть использованы. Метод разделен на три этапа: (1) оптимизация морфологии кристаллов, (2) переход к пакетированию и (3) масштабирование. Стадия 1 включает в себя поиск хорошо дифрирующих монокристаллов, надеюсь, но не обязательно, представленных в виде куба. На этапе 2 условие этапа 1 оптимизируется по времени роста кристаллов. Эта стратегия может преобразовывать кристаллы, выращенные путем диффузии пара, в порцию. Как только рост кристаллов может произойти в течение примерно 24 часов, морфограмма смеси белка и осадителя может быть построена и использована в качестве основы для стратегии масштабирования (стадия 3). Когда кристаллы можно выращивать партиями, можно попробовать масштабирование, а размер и концентрацию кристаллов оптимизировать по мере увеличения объема. Эндотиапепсин использовался в качестве демонстрационного белка для этого протокола. Некоторые из представленных решений специфичны для эндотиапепсина. Тем не менее, есть надежда, что то, как они были применены, вдохновит на размышления об этой процедуре, которую другие смогут адаптировать к своим собственным проектам.
Введение
Макромолекулярная кристаллография при комнатной температуре (RT) снова популярна в сообществе структурной биологии. Разработка источников света рентгеновского лазера на свободных электронах (XFEL) стимулировала разработку подходов к доставке образцовRT 1,2,3,4, и эти методы теперь применяются к синхротронам 5,6,7,8. Мало того, что методы RT открывают возможность экспериментальных страгетов 9,10,11,12, но также появляется все больше доказательств того, что они способствуют альтернативным конформационным состояниям в белках 13,14,15,16,17.
Однако основной причиной, по которой криометоды получили распространение по сравнению с подходами RT в конце 1990-х годов, было замедление радиационного повреждения при минусовых температурахкристаллов 18. Криометоды19 начали позволять собирать полный набор данных из одного кристалла белка. Современные методы ЛТ на XFEL и синхротронах решили проблему повреждения монокристаллическим излучением путем разработки быстрых (> 100 Гц) стратегий доставки кристаллов 1,2,3,4. Эти методы позволяют собрать полный набор данных из тысяч индивидуально экспонированных кристаллов. Таким образом, эти подходы к доставке RT требуют производства больших количеств растворов, содержащих однородные микрокристаллы (> 100 мкл < 50 мкм кристаллов). Однако, поскольку криометоды, как правило, требуют только монокристаллов, методы создания таких микрокристаллических суспензий в настоящее время не повсеместно распространены в лабораториях кристаллографии белков.
В литературе есть примеры того, как выполнять части процедуры оптимизации микрокристаллизации для серийных кристаллографических образцов. Здесь следует проводить различие между мембранными и растворимыми белками. Протоколы оптимизации роста микромембранных белковых кристаллов, выращенных в моноолеине (или каком-либо другом липиде), для липидной кубической фазы (LCP), были хорошо описаны20,21,22. Однако методы микрокристаллизации растворимых белков, включая мембранные белки, выращенные в условиях, отличных от LCP, как правило, отсутствуют. Предыдущие исследования были сосредоточены на конкретных частях процесса, таких как микрокристаллический скрининг23,24, усиление зародышеобразования24 и масштабирование с использованием диффузии25 со свободным интерфейсом, но не полный метод.
Тем не менее, недавно был описан метод26 , который пытается предложить полный протокол. Как и многие аспекты кристаллографии белков, она не нова. Многие из предложенных идей уже были описаны Rayment (2002)27. Метод направлен на то, чтобы показать кристаллографам, как выполнить преобразование от одного кристалла, выращенного с использованием диффузии пара, к пакетной методологии для выращивания тысяч микрокристаллов. Метод фокусируется на диффузии пара в качестве общей отправной точки, поскольку 95% всех осаждений банка данных белка (PDB) происходит из кристаллов, выращенных в паровых диффузионных пластинах26. Однако диффузия пара не является идеальным методом микрокристаллизации26, поэтому описана методология преобразования диффузии пара в периодическую кристаллизацию. Как только кристаллы можно выращивать партиями, масштабирование до больших объемов становится более практичным. Учитывая капризы кристаллизации белка, авторы подчеркивают, что этот метод не является безотказным. Тем не менее, протокол должен, по крайней мере, дать представление о «пространстве кристаллизации» белка.
Этот метод основан на фазовой диаграмме кристаллизации белка и на том, как понимание этой диаграммы может служить руководством во время оптимизации микрокристаллизации. Фазовая диаграмма белка обычно изображается в виде графика x/y с концентрациями осадителя и белка по осям x и y соответственно (рис. 1A). От точки чистой воды (нижний левый угол - рис. 1А) концентрация как белка, так и осадителя увеличивается до тех пор, пока не будет достигнута линия растворимости. Линия растворимости отмечает точку пересыщения (фиолетовая линия - рис. 1А). Когда белок пересыщен, раствор становится термодинамически нестабильным и начинает разделяться на две фазы: «богатый белком» и стабильный насыщенный раствор. Это разделение может происходить в любом месте за пределами линии растворимости, и его кинетика зависит от свойств белка и компонентов раствора.
Когда концентрация белка и осаждителя слишком велика, белок будет нестабильно разлагаться из раствора и приведет к образованию аморфного осадка (розовая область - рис. 1А). Однако упорядоченное разделение фаз может происходить в области зародышеобразования [см. Гарсия-Руис (2003)28 для подробного описания], и кристаллические ядра имеют склонность к образованию (зеленая область - рис. 1А). Зарождение и рост удаляют белок из раствора и перемещают каплю в метастабильную область, где рост может продолжаться до тех пор, пока не будет достигнута линия растворимости [см. McPherson and Kuznetsov (2014)29 для подробного обсуждения]. Диаграмма для подавляющего большинства условий кристаллизации является грубым упрощением30. Однако, несмотря на это, диаграмма по-прежнему очень полезна для микрокристаллографов, поскольку отображение диаграммы позволяет определить линию растворимости и кинетику зародышеобразования.
С точки зрения создания микрокристаллов, двумя факторами во время кристаллизации, которые необходимо оптимизировать, являются количество кристаллов (Xn) и их среднее, самое длинное измерение (Xs). X n будет пропорционален числу событий зародышеобразования (n ) (уравнение 1).
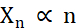 Уравнение 1
Уравнение 1
X s пропорционален концентрации свободного белка выше линии растворимости (Ps), деленной на Xn (уравнение 2).
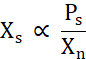 Уравнение 2
Уравнение 2
В идеальной ситуации каждое событие зарождения дало бы возможный кристалл, и каждый из этих кристаллов имел бы равный доступ к доступному белку в растворе. На рисунке 2 показано графическое представление идеального сценария взаимосвязи между Xn и Xs. На практике основной контроль, который имеет кристаллограф над Xn и Xs , заключается в том, чтобы влиять на величину зародышеобразования или добавлять затравочные кристаллы. Микрокристаллограф должен решить, как увеличить Xn таким образом, чтобы можно было создать подходящую концентрацию кристаллов и размер кристаллов.
Большинство методов кристаллизации требуют «переходного периода» (рис. 1B). Например, в эксперименте по диффузии пара при смешивании белкового и осадительного растворов концентрации каждого из них будут изменяться по мере уравновешивания капли с луночным раствором. Можно надеяться, что эти изменения постепенно переведут падение в зону зародышеобразования, где склонность к кристаллизации возрастет. По мере того, как кристаллы начинают зарождаться и расти, количество белка в растворе начнет падать, уменьшая вероятность дальнейшего зародышеобразования. Конечная величина зародышеобразования будет зависеть от белка и условия, а также от глубины проникновения в зону зародышеобразования. Учитывая ограниченное проникновение в зону нуклеации методов, требующих переходного этапа, уровень зародышеобразования в конечном итоге будет ограничен скоростью зародышеобразования на границе метастабильной области зародышеобразования.
Из-за важности возможности повышения уровня зародышеобразования для микрокристаллографа важно перейти к методологии периодической кристаллизации. Партия может в большей степени использовать всю область зародышеобразования (рис. 1C). В периодических методах идея состоит в том, чтобы смешать белок и осадитель вместе таким образом, чтобы создать пересыщенный раствор без необходимости каких-либо изменений концентраций компонентов. Зародышеобразование должно быть возможно сразу после смешивания. Таким образом, пакетные методы теоретически позволяют достичь всей зоны зародышеобразования. Любое увеличение кинетики зародышеобразования за пределами границы метастабильного зародышеобразования может быть использовано.
Если базального уровня зарождения кристаллов недостаточно для получения большого Xn, можно использовать методы микропосева. При микропосеве предварительно выращенные кристаллы разбиваются с образованием суспензии кристаллических фрагментов, которая может действовать как каркас для роста свежих кристаллов31,32. Микропосев широко используется при серийной кристаллографической пробоподготовке как способ увеличения Xn без необходимости увеличения зарождения кристаллов (рис. 1C).
Переход от диффузии пара к периодической может быть визуализирован на фазовой диаграмме как перемещение экспериментальной начальной точки из непересыщенных или метастабильных областей в зону зародышеобразования. Это может быть сделано путем увеличения концентрации белка и/или осадителя и/или их соотношения в капле (рис. 1D) и наблюдения за тем, при каких условиях кристаллы быстро появляются (< 24 ч)26. Полное уравновешивание капель диффузии пара может занять33 дня или недели. Таким образом, при поиске условий, которые показывают быстро появляющиеся кристаллы, можно найти условия партии без необходимости перехода к альтернативным форматам кристаллизационного скрининга, таким как микропартия34,35,36,37.
После того, как зона зародышеобразования найдена, было найдено условие партии и можно создать морфограмму - в данном случае грубую фазовую диаграмму. Морфограмма очень полезна при рассмотрении вопроса о том, следует ли использовать протокол посевной партии или прямой партии. Построив график Xn в зависимости от концентрации белка и осадителя, можно оценить кинетику зародышеобразования26. Если X n остается низким по всей области зародышеобразования, может потребоваться засеивающая партия, чтобы сделать Xn достаточно большим, чтобы ограничить рост кристаллов. Эта оценка является первым шагом в процессе масштабирования до больших объемов (> 100 мкл).
Этот метод был разработан таким образом, чтобы его можно было проводить в большинстве кристаллизационных лабораторий с использованием стандартного оборудования для диффузионной кристаллизации пара. Также было проведено много исследований, в которых описываются методы, облегчающие многие части этого процесса, если оборудование будет доступно. К ним относятся, помимо прочего, динамическое рассеяние света (DLS)25,27, нелинейная визуализация 20,24,25, порошковая дифракция 20,24,27 и электронная микроскопия 26 [см. Cheng et al. (2020)40 для хорошего обзора].
Целью данной работы является наглядная демонстрация способа перехода от малообъемной (< 500 нл) диффузионной кристаллизации паров к крупнообъемной (> 100 мкл) периодической кристаллизации. Эндотиапепсин из Cryphonectria parasitica был использован в качестве примера системы для демонстрации этого перевода. Тип эксперимента и метод доставки образца, для которого требуются микрокристаллы, будут влиять на идеальный выходX s 26. Для экспериментов по смешиванию, требующих миллисекундного временного разрешения41 или газодинамических виртуальных сопел42, может быть желательным конечный Xs < 5 мкм. В этом случае цель состояла в том, чтобы получить белковые кристаллы, которые дифрагируют примерно до 1,5 Å, для эксперимента с фотонной накачкой-зондом и с использованием подхода доставки с фиксированной целью.
Чтобы проиллюстрировать требования к образцу такого серийного кристаллографического эксперимента с использованием эндотиапепсина, в таблице 1 показаны экспериментальные параметры гипотетического эксперимента. Выборочная информация была основана на протоколе, описанном ниже. Учитывая некоторые консервативные оценки частоты попаданий и требований к сбору данных, 50 мг - это оценка общего потребления образца для всего эксперимента.
На рисунке 3 показана блок-схема всего процесса оптимизации от начальной диффузионной кристаллизации пара в малом объеме до крупномасштабной партии. Для большинства серийных проектов кристаллографии этот протокол будет начинаться с шага 2: «переход к партии», поскольку целевой белок уже будет кристаллизован. Тем не менее, Шаг 1 был включен для полноты картины и для того, чтобы напомнить читателям о его важности. Нахождение условия, которое приводит к образованию хорошо дифракционного, одиночного, большого кристалла, является лучшей отправной точкой для оптимизации микрокристаллов. На этапе 2 это состояние может быть оптимизировано от диффузии пара до партии, и может быть построена морфограмма зародышеобразования и метастабильных областей. Как только это будет сделано, на шаге 3 можно выполнить масштабирование условия пакета до больших томов. К концу блок-схемы кристаллограф создаст повторяемый протокол микрокристаллизации эндотиапепсина большого объема (> 100 мкл). Затем этот метод может быть применен к их конкретному интересующему белку.
протокол
ПРИМЕЧАНИЕ: Все 96-луночные эксперименты по кристаллизации сидячей капли проводились с использованием 2 или 3 капельных пластин. Робот для работы с жидкостями и кристаллизационный тепловизор/гостиница были использованы для облегчения подготовки и мониторинга всех 96-луночных экранов. Все концентрации реагентов для экспериментов по кристаллизации указываются в их начальных концентрациях перед смешиванием.
1. Оптимизация морфологии кристаллов
ПРИМЕЧАНИЕ: Шаги 1.1.1. и 1.1.6. Опишите, как были найдены условия кристаллизации эндотиапепсина и как эти условия были оптимизированы для нахождения единственного условия, которое дало одиночные, хорошо дифракционные кристаллы.
- Оптимизация разреженной матрицы
- Приготовьте свежий раствор эндотиапепсина.
ПРИМЕЧАНИЕ: Эндотиапепсин, когда он закупается в виде Superan 600, должен быть буферно перенесен из раствора для хранения и сконцентрирован.- Приготовьте 3 л 0,1 М натрия ацетата с pH 4,6 при 4 °C.
- Отрежьте 20 см диализной трубки и ненадолго промойте в буфере. Запечатайте один конец трубки с помощью зажима, поместите 50 мл раствора эндотиапепсина в трубку, а затем запечатайте другой конец.
- Оставьте раствор для диализа не менее 4 ч (или на ночь) при 4 °C в 1 л буфера Na Acetate. Из-за компонентов буфера хранения раствор в диализном мешке теперь будет составлять примерно 100 мл.
- Переведите диализный мешок, содержащий эндотиапепсин, в свежий литр с температурой 4 °C, pH 0,1 M Na ацетата 4,6. Повторите этот шаг еще раз, чтобы исходный буфер был разбавлен в 2000 раз по сравнению с ацетатом Na.
- Эндотиапепсин теперь будет составлять примерно 10 мг / мл. Сконцентрируйте до 100 мг/мл с помощью центробежного концентратора 10 кДа и центрифуги.
- Мгновенно охладите раствор эндотиапепсина в жидком азоте в аликвотах 50 мкл и храните при -80 °C.
- Подготовьте 96-луночный сито PACT Premier с разреженной матрицей.
- Используя робота для работы с жидкостями, распределите 100 нл 70 мг/мл эндотиапепсина и 100 нл луночного раствора в одну подлунку на лунку. Перемешайте белок и хорошо раствор 3 раза после добавления кристаллизационного буфера.
- Запечатайте пластину и оставьте на 28 дней при температуре 20 °C, делая снимки каждый день в течение первой недели, а затем каждую неделю в течение 4 недель.
- Анализ разреженной матрицы
- Определите попадания, которые продуцируют одиночные кристаллы эндотиапепсина. С экрана PACT условия, содержащие MgCl2 , росли как синглтоны, а не игольчатые кластеры.
- Оптимизация разреженной матрицы
- Из MgCl2 , содержащего условия, определенные на шаге 1.1.3.1, создайте 96-луночный экран, случайным образом комбинируя и варьируя различные компоненты скважины.
- Используя робота для работы с жидкостями, распределите 100 нл 70 мг/мл эндотиапепсина и 100 нл луночного раствора в одну подлунку на лунку. Перемешайте белок и хорошо раствор 3 раза после добавления кристаллизационного буфера.
- Запечатайте пластину и оставьте на 28 дней при температуре 20 °C, делая снимки каждый день в течение первой недели, а затем каждую неделю в течение 4 недель.
- Оптимизационный анализ
- Используя подходящее программное обеспечение для работы с электронными таблицами, ранжируйте условия кристаллизации, которые приводят к образованию кристаллов, на основе качества кристаллов и уровня осаждения, от отсутствия кристаллов (0) до идеального (5) и от низкого (0) до высокого (5) соответственно. Что касается качества кристаллов, то широкими критериями являются монокристаллы с коробчатой морфологией.
- Проведите корреляционный анализ Пирсона между содержанием условий кристаллизации и количеством кристаллов и уровнем осаждения.
- Отобразите эти данные в виде тепловой карты. Ищите компоненты и условия, которые коррелировали с предпочтительными результатами.
- Дифракционный анализ.
- Подтвердите, что кристаллы, выращенные из идентифицированных условий на шаге 1.1.5, пригодны для серийной кристаллографии, выполнив эксперимент по рентгеновской дифракции.
- Загрузите образец кристаллов эндотиапепсина из каждого из идентифицированных условий на подложки, которые позволяют собирать данные при 100 или 293 К, и проведите эксперимент по дифракции рентгеновских лучей. При работе под крио используйте 25% этиленгликоля в качестве криопротектора.
- Обработайте эти данные с помощью соответствующего пакета программного обеспечения. Кристаллы эндотиапепсина должны дифрагировать до уровня, превышающего 1,5 Å. Проверьте наличие двойников, так как сдвоенные кристаллы могут существенно усложнить последовательную кристаллографическую обработку данных.
- Если кристаллы являются синглтонами и дифрагируют до 1,5 Å, перейдите к шагу 2. Если нет, вернитесь к шагу 1.1.2 и попробуйте больше экранов с разреженной матрицей, чтобы определить перспективные условия. После анализа, проведенного на шагах 1.1.5. и 1.1.6., в качестве приблизительного идеала должны были быть найдены условия кристаллизации 25% (мас./об.) ПЭГ 6 000, 0,1 М трис-HCl рН 7,0 и 0,15 М MgCl2 .
- Приготовьте свежий раствор эндотиапепсина.
2. Переход к пакетной обработке
- Эксперимент с морфограммой
- Создайте микрокристаллический семенной материал.
ПРИМЕЧАНИЕ: При изготовлении семенного материала лучше всего делать семена из кристаллов, специально выращенных для этой задачи. Это очень помогает с воспроизводимостью. Другие идеи, представленные на этапах 2.1.1.1 - 2.1.1.11, заключаются в том, чтобы всегда использовать кристаллы, выращенные из стандартного количества скважин - здесь 5 - и аликвотировать запасы после их изготовления, чтобы свести на нет циклы замораживания-оттаивания.- Подготовьте 96-луночную кристаллизационную пластину с лунками, содержащими кристаллизационный буфер: 25% (мас./об.) ПЭГ 6,000, 0,1 М трис-HCl рН 7,0 и 0,15 М MgCl2.
- С помощью робота-манипулятора для жидкостей распределите 200 нл размороженного 70 мг/мл эндотиапепсина и 200 нл луночного раствора в одну подлунку на лунку. Перемешайте белок и хорошо раствор 3 раза после добавления кристаллизационного буфера.
- Запечатайте пластину и оставьте на 24 часа.
- Заполните центрифужную пробирку объемом 1,5 мл кристаллизационным буфером объемом 250 мкл и 10-15 стеклянными шариками диаметром 1 мм. Оставьте пробирку центрифуги на льду остывать на 5-10 минут.
- Выберите 5 лунок с кристаллами, откройте лунки скальпелем и, используя наконечник пипетки, раздавите кристаллы в лунках.
- Аспирируйте 1 мкл буфера из ледяной центрифужной пробирки и используйте для гомогенизации измельченной кристаллической суспензии. После получения однородной массы аспирируйте всю суспензию и соберите в охлажденную центрифужную пробирку.
- Повторите этап 2.1.2.6 для каждой из 5 подскважин.
- Вихревая центрифужная трубка, содержащая буфер, объединенные суспензии и шарики при 1000 об/мин в течение 30 с.
- Верните пробирку центрифуги в лед на 30 с.
- Повторите шаги 2.1.2.8 и 2.1.2.9 еще два раза.
- Семенной материал готов и может быть аликвотирован на партии по 10 мкл и храниться при -20 °C.
- Проведите эксперимент с морфограммой.
- Подготовьте сетку с 2 каплями и 96 лунками. Варьируйте концентрацию ПЭГ 6,000 от 5 до 40% (мас./об.) вдоль колонн пластины, сохраняя буфер и соль на уровне 0,1 М Tris-HCl pH 7,0 и 0,15 M MgCl2 соответственно.
- Приготовьте последовательное разведение эндотиапепсина в 0,1 М ацетата натрия pH 4,6 от 100 до 12,5 мг / мл в течение 8 шагов. Для каждого ряда пластины будет использоваться разная концентрация эндотиапепсина.
- Используя робота для работы с жидкостями, распределите 150 нл эндотиапепсина в обе подлунки 1 и 2. В подскважине 1 дозируйте 150 нл раствора скважины. В подлунке 2 мультиаспиратируют 50 нл размороженного семенного материала и 100 нл луночного раствора, а затем распределяют оба в белковый раствор. Смешайте растворы 3 раза после добавления кристаллизационного буфера.
- Запечатайте пластину и оставьте при температуре 20 °C, делая снимки каждые 0, 3, 6, 12, 18, 24 часа, затем каждый день в течение первой недели и каждую неделю в течение следующих четырех. Если автоматическая визуализация невозможна, не беспокойтесь о почасовой визуализации в 1-й день.
- Создайте микрокристаллический семенной материал.
- Анализ морфограммы
- Глядя на изображения, сделанные через 24 часа, оцените количество кристаллов, присутствующих в каждой скважине, и запишите эти оценки в предоставленный рабочий лист «генератора морфограмм». Эти оценки не обязательно должны быть точными; Индивидуальный подсчет тысяч микрокристаллов, если они присутствуют, нецелесообразен и не нужен. В принципе, постарайтесь, чтобы оценки были согласованы по всей тарелке.
ПРИМЕЧАНИЕ: Правило 24 часов было основано на наблюдениях, сделанных в Beale et al . (2019)26. Для уравновешивания условий диффузионной кристаллизации пара могут потребоваться дни или недели. Кристаллы, которые появляются быстро, скорее всего, выросли с помощью периодического процесса, а не путем постепенного уравновешивания компонентов капли. Таким образом, критерий 24 ч несколько условен, и точное время отсечения между периодическим экспериментом и экспериментом по диффузии пара будет зависеть от конкретной смеси условий [см. Beale et al. (2019) 26 для получения полной информации]. - Введите начальные концентрации эндотиапепсина и ПЭГ 6,000 в указанные поля.
- Рабочий лист автоматически отобразит результаты в традиционном формате фазовой диаграммы с осадком и концентрацией белка по осям x и y соответственно. Условия, в которых кристаллы образуются только в засеянных каплях, указывают на метастабильную область диаграммы (прозрачный синий), тогда как условия, в которых есть кристаллы как в засеянных, так и в незасеянных каплях, указывают на зону зародышеобразования (сплошной зеленый).
ПРИМЕЧАНИЕ: В идеале большая часть зоны зародышеобразования должна присутствовать на диаграмме (т.е. в нижней части диаграммы должно быть несколько прозрачных лунок, и некоторый осадок должен быть виден при высоких концентрациях белка и осадителя). Если это не так, возможно, повторите эксперимент, но увеличьте концентрацию белка и/или осадка (если это возможно). - Если кристалл появился менее чем за 24 часа, переходите к шагу 2.3.1. Если нет, перейдите к шагу 2.4 и продолжите оптимизацию в сторону пакетной обработки.
- Глядя на изображения, сделанные через 24 часа, оцените количество кристаллов, присутствующих в каждой скважине, и запишите эти оценки в предоставленный рабочий лист «генератора морфограмм». Эти оценки не обязательно должны быть точными; Индивидуальный подсчет тысяч микрокристаллов, если они присутствуют, нецелесообразен и не нужен. В принципе, постарайтесь, чтобы оценки были согласованы по всей тарелке.
- Кристаллический анализ
- Как было сказано в конце шага 1, прежде чем переходить к следующему шагу, убедитесь, что эти кристаллы имеют желаемую морфологию и качество дифракции. Что касается морфологии, являются ли кристаллы наблюдаемо недвойными и образуются как синглтоны, а не как игольчатые или веерообразные структуры? Что касается дифракции, по возможности соберите дифракционные данные из кристаллов. Если эти кристаллы не дифрагируют, маловероятно, что кристаллы, выращенные в большем объеме, будут дифрагировать.
- Загрузите образец кристаллов эндотиапепсина из эксперимента по морфограмме на подложки, которые позволяют собирать данные при 100 или 293 К, и проведите эксперимент по дифракции рентгеновских лучей. При работе под крио используйте 25% этиленгликоля в качестве криопротектора.
- Обработайте эти данные с помощью соответствующего пакета программного обеспечения. Кристаллы эндотиапепсина должны дифрагировать до уровня, превышающего 1,5 Å. По всему образцу кристаллов наблюдайте за размером клетки, общим количеством наблюдений и мозаичностью; Эти измерения дадут представление об однородности дифракционных кристаллов.
- Если морфология кристалла и качество дифракции достаточны, перейдите к шагу 3.
- Оптимизируйте время роста кристаллов.
ПРИМЕЧАНИЕ: Анализ морфограммы (этап 2.2) даст указание на начальную точку кристаллизации (т.е. область фазовой диаграммы, где находится капля при смешивании осадителя и белковых растворов). Падение в метастабильной области или ниже линии растворимости? Периодическая кристаллизация начинается в зоне зародышеобразования (рис. 1С). Цель этого шага состоит в том, чтобы переместить эту отправную точку либо из-под линии растворимости, либо из метастабильной области в зону зародышеобразования (рис. 1D). Если семя выпадает из шага 2.2. быстро дали кристаллы, это признак того, что смесь капель уже находится в метастабильной области, если нет, то, вероятно, капля не пересыщена.- Оптимизация времени роста кристаллов.
- Используя тот же экран, что и на шаге 2.1.3, подготовьте 96-луночный эксперимент по диффузионной кристаллизации пара в пластине с 3 каплями.
- Увеличьте начальную концентрацию белка эндотиапепсина по оси y (т.е. сконцентрируйте белок дальше, возможно, 120 мг / мл для эндотиапепсина).
- Выполняйте последовательное разведение, как показано на этапе 2.1.3.2, таким образом, чтобы каждый ряд пластины содержал последовательно меньшую концентрацию белка.
- Используйте разные соотношения капель в каждой из трех капель на тарелке: 1:1, 1:2 и 2:1, белок: осадитель.
- Просматривайте или изображайте тарелку в первый день в 0, 3, 6, 12, 18, 24 часа, а затем каждый день в течение первой недели и каждую неделю в течение следующих четырех. Если автоматическая визуализация невозможна, не беспокойтесь о почасовой визуализации в 1-й день.
- Определите капли, которые производят наиболее быстро появляющиеся кристаллы, и сделайте их отправными точками для повторных оптимизаций до тех пор, пока рост кристаллов не произойдет в течение 24 часов.
- Когда быстро появляющееся кристаллическое состояние будет идентифицировано, вернитесь к шагу 2.1, чтобы перестроить морфограмму в качестве прелюдии к началу масштабирования.
- Оптимизация времени роста кристаллов.
3. Масштабирование
- Ранжирование маршрутов масштабирования. На этом этапе нет необходимости принимать решение о едином маршруте масштабирования, только определить и ранжировать варианты, чтобы их можно было изучить по очереди. По мере увеличения объема порционной смеси во время процедуры масштабирования будут происходить изменения скорости зародышеобразования и диапазона размеров кристаллов. Однако они могут быть преодолены путем тщательной настройки концентраций компонентов по мере увеличения масштабированного объема.
ПРИМЕЧАНИЕ: Шаги 3.1.1 и 3.1.2 описывают, как определить по морфограмме, что является более подходящим для пакетного или засеянного протокола.- Прямой пакетный протокол
- Пропорционален ли Xn в зоне зародышеобразования концентрации белка и/или осадителя? Т.е. увеличивается ли Xn в зависимости от осадителя и/или концентрации белка? -Да? Перейдите к этапу 3.1.1.2. Нет? Перейдите к шагу 3.1.2.
- Найдите условия, которые дают кристаллы нужного размера, и перейдите к шагу 3.2.
- Протокол Seeded-batch
- Является ли Xn плоским в зоне зародышеобразования? То есть. Xn не увеличивается в зависимости от концентрации осадителя и/или белка.
- Найдите засеянные условия, которые дают кристаллы нужного размера, и перейдите к шагу 3.2. Если все кристаллы слишком большие - переходим к Шагу 3.1.2.3.
- Повторите эксперимент с морфограммой (шаг 2.1), но на этот раз увеличьте концентрацию семенного материала, используемого в засеянных лунках. Семенной запас можно увеличить, используя больше кристаллов при его создании. Например, вместо 5 скважин на шаге 2.1.1.5 используйте 10 скважин.
- Просмотрите или сфотографируйте тарелку за первые 0, 3, 6, 12, 18, 24 часа.
- Xn должен был увеличиться, а Xs уменьшиться в посевных каплях. Повторите этот цикл, если требуются кристаллы меньшего размера, а затем следуйте протоколу засеивания партии.
- Прямой пакетный протокол
- Постепенное масштабирование
- Окалина в 96-луночных планшетах. На основе морфограммы эндотиапепсина для масштабирования был первоначально выбран прямолинейный периодический метод с использованием условия кристаллизации 0,1 М трис-HCl рН 7,0, 0,15 М MgCl2 и 30% (мас./об.) ПЭГ 6000. 100 мг/мл эндотиапепсина, смешанного с кристаллизационным буфером в соотношении 1:1.
- Подготовьте 2-3 лунки в 2-луночном 96-луночном сидячем планшете со 100 мкл 0,1 М Tris-HCl pH 7,0, 0,15 M MgCl2 и 30% (мас./об.) ПЭГ 6,000.
- Используя свежеразмороженный раствор эндотиапепсина 100 мг/мл, распределите 0,5 мкл белка и 0,5 мкл осадителя на лунку, запечатайте и храните при температуре 20 ° C.
- Просмотрите или сфотографируйте тарелку за первые 0, 3, 6, 12, 18, 24 часа. Обратите внимание на любые изменения в диапазоне Xs и Xn.
- Если изменения произошли, повторите этапы 3.2.1.1 - 3.2.1.2, но увеличьте или уменьшите концентрацию белка, осадителя и/или семян, чтобы восстановить любые изменения в диапазоне Xs и Xn.
- Когда диапазон Xs и Xn будет приемлемым, перейдите к этапу 3.2.2.
- Накипь в 24-луночных подвесных пластинах
- Подготовьте одну лунку из 24-луночной подвесной пластины, смазав края колодца вакуумной смазкой.
- Приготовьте 0,5 мл 0,1 М Tris-HCl pH 7,0, 0,15 M MgCl2 и 30% (мас./об.) PEG 6,000 и хорошо залейте смазанную маслом.
- Используя только что размороженный раствор эндотиапепсина, нанесите пипеткой 1 мкл белка на поверхность стеклянного покровного стекла. Пипеткой нанесите 1 мкл кристаллизационного буфера на белковую каплю и перемешайте с помощью пипетки.
- Просмотрите или сфотографируйте тарелку за первые 0, 3, 6, 12, 24 часа. Обратите внимание на любые изменения в диапазоне Xs и Xn.
- Если изменения произошли, повторите шаги 3.2.2.1 - 3.2.2.4, но увеличьте или уменьшите концентрацию белка, осадителя и/или семян, чтобы восстановить любые изменения в диапазоне Xs и Xn.
- Когда/если диапазон Xs и Xn приемлем, перейдите к этапу 3.2.2.7.
- Повторите шаги с 3.2.2.1 по 3.2.2.5, постепенно увеличивая общий объем эксперимента до 10 мкл.
- Достигнув объема 10 мкл или более, приступайте к центрифужным пробиркам на этапе 3.2.3.
- Удаление накипи в центрифужных пробирках
ПРИМЕЧАНИЕ: Уточнение состояния партии эндотиапепсина в основном происходило в точке объема 200 мкл (см. Результаты, Масштабирование). Процесс начинался с условий кристаллизации 0,1 М трис-HCl рН 7,0, 0,15 М MgCl2 и 30% (мас./об.) ПЭГ 6000. Однако концентрация ПЭГ в конечном итоге изменилась до 40% (мас./об.). Семена также должны были контролировать Xn, и чтобы предотвратить слишком большой рост кристаллов, рост кристаллов должен был быть закален. Шаги с 3.2.3.1 по 3.2.3.7 подробно описывают процесс оптимизации условий. Этап 3.2.4. Опишите протокол окончательной партии.- Приготовьте 1 мл кристаллизационного буфера: 0,1 М трис-HCl рН 7,0, 0,15 М MgCl2 и 30% (мас./об.) ПЭГ 6,000.
- Используя только что размороженный эндотиапепсин 100 мг/мл, добавьте 25 мкл белка в центрифужную пробирку объемом 1,5 мл.
- Тщательно перемешайте кристаллизационный буфер с белковым раствором в соотношении 1:1 наконечником пипетки. Поместите трубку в револьвер/ротатор при сильном перемешивании при 20 °C.
- Принимают регулярные (5, 10, 30, 60 мин, 2, 5, 10, 24 ч) аликвоты по 2,5 мкл и просматривают в гемоцитометре. Запишите диапазоны Xn и Xs .
- Если изменения произошли, повторите шаги 3.2.3.1. к пункту 3.2.3.4. но увеличивать или уменьшать концентрацию белка, осадителя и/или семян, чтобы восстановить любые изменения в диапазоне Xs и Xn
- Когда диапазон Xs и Xn будет приемлемым, перейдите к этапу 3.2.3.7.
- Повторите шаги 3.2.2.1 - 3.2.2.5, постепенно увеличивая общий объем эксперимента до 200 мкл или больше, по мере необходимости.
- Протокол окончательной посевной партии
- Подготовьте семенной материал.
- Приготовьте 2 мл кристаллизационного буфера: 0,1 М Tris-HCl pH 7,0, 0,15 M MgCl2 и 40% (мас./об.) PEG 6,000.
- Используя только что размороженный 100 мг / мл эндотиапепсина, добавьте 100 мкл белка в центрифужную пробирку объемом 1,5 мл.
- Тщательно перемешайте кристаллизационный буфер с белковым раствором в соотношении 1:1 наконечником пипетки. Поместите трубку в револьвер/ротатор с высокой температурой перемешивания при 20 °C на 24 часа, чтобы кристаллы размером 50 мкм могли вырасти.
- Добавьте 10-15 стеклянных шариков диаметром 1 мм в кристаллическую суспензию размером 50 мкм.
- Вихревая центрифужная трубка, содержащая суспензию и шарики, со скоростью 1000 об/мин в течение 30 с.
- Верните пробирку центрифуги в лед на 30 с.
- Повторите шаги 3.2.4.1.5 и 3.2.4.1.6 еще 10 раз.
- Теперь это 200 мкл 1x семенного материала. Разбавьте семенное сырье в 10 раз добавлением 1,8 мл кристаллизационного буфера. Аликвотируйте 10-кратный семенной материал партиями по 50 мкл и храните при -20 °C.
- Засеянно-пакетный протокол.
- Приготовьте кристаллизационный буфер: 0,1 М Tris-HCl pH 7,0, 0,15 MMgCl2 и 40% (мас./об.) ПЭГ 6,000.
- В центрифужной пробирке смешайте 100 мкл кристаллизационного буфера с 50 мкл свежеразмороженного 10-кратного семенного материала.
- Используя только что размороженный 100 мг / мл эндотиапепсина, добавьте 150 мкл белка в центрифужную пробирку объемом 1,5 мл.
- Тщательно перемешайте кристаллизационный буфер/затравочную смесь с раствором эндотиапепсина наконечником пипетки и поместите пробирку в револьвер/ротатор с высоким перемешиванием при 20 °C.
- Контролируйте кристаллизацию, регулярно принимая аликвоты 2,5 мкл и просматривая кристаллы в гемоцитометре. Запишите диапазоны Xn и Xs .
- Примерно через 80 мин, когда кристаллы достигнут Xs 15 мкм, гасят реакцию добавлением 150 мкл 0,05 М ацетата натрия рН 4,6, 0,05 М Tris-HCl рН 7,0, 0,075 М MgCl2 и 20% (мас./об.) ПЭГ 6000 (раствор, состоящий из эндотиапепсинового буфера и кристаллизационного буфера, смешанного 1:1).
- Храните кристаллы при температуре 20 °C.
- Произвел ли протокол приемлемый диапазон размеров и количество кристаллов для предполагаемого эксперимента? Да - ГОТОВО - Нет - вернитесь к шагу 3.1. и попробуйте альтернативный вариант масштабирования. Например, может быть возможно другое соотношение белка и осадителя или добавление семян, если это не было сделано ранее. Когда все они исчерпаны, может потребоваться найти новое условие на шаге 1.
- Подготовьте семенной материал.
- Окалина в 96-луночных планшетах. На основе морфограммы эндотиапепсина для масштабирования был первоначально выбран прямолинейный периодический метод с использованием условия кристаллизации 0,1 М трис-HCl рН 7,0, 0,15 М MgCl2 и 30% (мас./об.) ПЭГ 6000. 100 мг/мл эндотиапепсина, смешанного с кристаллизационным буфером в соотношении 1:1.
Результаты
Оптимизация морфологии кристаллов
Шаг 1, оптимизация морфологии кристаллов, был включен, чтобы напомнить читателю о его важности. Возможно, удастся создать идеальные микрокристаллы из плохо дифракционных игольчатых шариков; Тем не менее, авторы предполагают, что лучше оптимизировать их по отдельности. Во-первых, найдите условия, которые приводят к хорошо дифрагирующему монокристаллу посредством диффузии пара, а затем преобразуйте эти условия в пакетные, а не пытайтесь объединить два этапа вместе. На данном этапе нет необходимости обнаруживать высокозародышеобразующие условия; Морфология и качество дифракции являются основными целями.
Перед началом микрокристаллизации эндотиапепсина был проведен анализ условий кристаллизации осажденной структуры из PDB. Условия кристаллизации и приблизительные протоколы могут быть получены для 47 из 48 осаждений энтотиапепсина. В целом все они были основаны на первой кристаллизации эндотиапепсина, проведенной Moews and Bunn (1970)46. Учитывая сходство этих условий и их «классическое» происхождение, был выполнен 96-луночный диффузионный экран с разреженной матрицей для изучения более широкого спектра условий кристаллизации. Эндотиапепсин концентрировали до 70 мг/мл, искрининг 47 разреженной матрицы PACT проводили в 96-луночной сидячей капельнице при 20 °C, смешивая 100 нл белка со 100 нл луночного раствора. Каждое условие этого эксперимента через 36 ч привело к образованию кристаллов. Однако анализ морфологии кристаллов показал, что некоторые условия могут оказаться лучше для оптимизации микрокристаллизации.
На рисунке 4А показано падение по сравнению с экраном PACT, которое было в целом репрезентативным для тех, которые наблюдались на большей части тарелки. На первый взгляд может возникнуть соблазн подумать, что эти кристаллы, возможно, стоит оптимизировать для дальнейшей микрокристаллизации. Кристаллы большие, и, по-видимому, наблюдается значительное зародышеобразование. Однако общая морфология кристаллов не идеальна. Во-первых, кристаллы не являются наблюдаемыми синглтонами, поскольку кажется, что множественные кристаллы растут из одиночных точек зародышеобразования. Во-вторых, размер кристаллов очень асимметричен, и рост в основном происходит вниз по одной оси. Такие кристаллы теоретически с большей вероятностью будут предпочтительно выравниваться при доставке в рентгеновский луч. Обе характеристики создают проблемы при сборе и обработке серийных кристаллографических данных.
Однако на рисунке 4B показаны кристаллы эндотиапепсина, выращенные в присутствии MgCl2. Эта морфология была согласована во всех условиях, которые содержали MgCl 2, и, следовательно, предполагала, что их морфология была обусловлена MgCl2. Условия MgCl2 произвели одиночные, более коробчатые кристаллы, которые представляли собой лучшую мишень для окончательных серийных экспериментов.
В скрининге PACT было четыре условия, которые содержали MgCl2. Чтобы лучше понять влияние всех различных компонентов этих состояний на кристаллизацию эндотиапепсина, была проведена случайная оптимизация. Был создан экран, содержащий случайную комбинацию буферов и осадителей в диапазоне концентраций и рН. Концентрация MgCl2 также варьировалась, а затем полученные капли произвольно оценивались от 0 до 5 (0 - отсутствие кристаллов или осаждений) с точки зрения качества их визуального качества кристаллов и уровня осаждения.
На рисунке 5A показана тепловая карта результатов корреляционного анализа Пирсона между уровнем осадков и качеством кристаллов, а также переменными экрана (примеры капель из этого эксперимента показаны на рисунках 5B, C и D). Результаты показали, что рН раствора сильно коррелирует с уровнем осаждения, при этом щелочные буферы приводят к большему количеству осадков. Концентрация MgCl2 слабо коррелировала с уровнем осадков, равно как и рН и концентрация осадителя в зависимости от качества кристаллов.
На основании этих результатов было принято решение перенести кристаллы, выращенные в 0,1 М Tris-HCl рН 7,0, 0,15 М MgCl2, 20% (мас./об.) ПЭГ 6 000, на следующий этап протокола - переход к партии. Морфология кристаллов была приемлемой, и анализ рентгеновской дифракции и показателей качества данных из этих кристаллов показал, что не было существенной разницы между кристаллами, выращенными в присутствии Mg2+ и вне его (рис. 9).
Переход на пакетный режим
Для многих оптимизаций микрокристаллизации серийной кристаллографии отправной точкой будет шаг 2. Интересующий белок уже будет кристаллизован для криокристаллографии, и протокол кристаллизации теперь потребуется трансформировать для создания микрокристаллических суспензий. В этом протоколе использовались только 96-луночные пластины для диффузии пара для выполнения преобразования в партию, поскольку диффузия пара является методом кристаллизации, используемым в 95% записейPDB 26. Протокол избежал перехода на микропартию34,35,37, поскольку этот переход все еще может повлечь за собой аналогичную оптимизацию. Это не означает, что этот протокол может быть выполнен только в диффузионных пластинах пара. Все представленные этапы также работали бы в микропартиях, если бы это был оригинальный метод кристаллизации.
Для оценки кристаллизации эндотиапепсина в выбранном состоянии была создана морфограмма - или грубая фазовая диаграмма. Эксперимент с морфограммой преследует три цели. Во-первых, анализ морфограммы очень полезен при оценке маршрутов масштабирования на шаге 3 - Масштабирование. Во-вторых, морфограмма действует как инструмент оптимизации, помогая обнаружить условия диффузии пара, которые приводят к образованию кристаллов через партию [т.е . быстро появляющиеся кристаллы (< 24 ч)]. В-третьих, если кристаллы не появились быстро, анализ засеянных капель может дать кристаллографу представление о приблизительном расположении текущего состояния на фазовой диаграмме. Например, если засеянные условия дают кристаллы, а незасеянные - нет, эти условия, вероятно, находятся в метастабильной области.
Эксперимент по морфограмме эндотиапепсина проводили на основе 0,1 М трис-HCl рН 7,0, 0,15 М MgCl2, 20% (мас./об.) ПЭГ 6,000. Концентрации белка и ПЭГ варьировали от 100 до 12,5 мг/мл и от 5 до 40% (мас./об.) соответственно. Капли были проанализированы, и результаты были нанесены на график с использованием предоставленного рабочего листа (рис. 6A).
Кроме того, уже на этапе оптимизации морфологии кристаллов было ясно, что рост кристаллов эндотиапепсина в этом состоянии и при этих концентрациях белка приведет к росту кристаллов менее чем за 24 часа. Это указывало на то, что кристаллизация происходила периодически , а не с помощью процесса диффузии пара. Таким образом, кристалл, выращенный в этих условиях, был пригоден для масштабирования до больших объемов.
Если бы кристаллы не были видны в незасеянных каплях через 24 часа, то было бы вероятно, что кристаллизация все еще зависела от перехода (рис. 1B) и, следовательно, не от партии. При этом результаты эксперимента по морфограмме по-прежнему представляют интерес. Они дают представление о вероятной отправной точке кристаллизации на фазовой диаграмме и, следовательно, о том, как должна протекать последующая оптимизация. Посмотрите на посеянные капли. Семена позволят расти кристаллам в метастабильной области независимо от зародышеобразования. Например, если кристаллы появляются в течение 24 часов в засеянных каплях, но не в незасеянных каплях, это указывает на то, что можно наблюдать часть метастабильной области. Если кристаллы не наблюдаются ни в засеянных, ни в незасеянных каплях, все лунки остаются недонасыщенными.
Масштабирование
Глядя на морфограмму (рис. 6А), можно сделать ряд наблюдений. На величину зародышеобразования, по-видимому, влияли как концентрации белка, так и концентрации осадителя. Также было очень четкое разграничение капель, которые приводят к осаждению белка, причем капли либо не содержат: ничего, либо кристаллов, либо осадка (рис. 6B). Добавление семян (рис. 6D) также значительно увеличило Xn по сравнению с каплями без семян (рис. 6C). Взяв все эти результаты вместе, было решено попытаться масштабировать как пакетный, так и посевной протокол на 30% (мас./об.) ПЭГ 6000 и 100 мг/мл эндотиапепсина.
Первоначальное тестовое масштабирование проводилось в 24-луночных подвесных пластинах. Объемы капель постепенно увеличивались, чтобы можно было наблюдать любые изменения в поведении кристаллизации (рис. 7). Как видно, как в незасеянных, так и в засеянных каплях происходил рост кристаллов. На всех незасеянных каплях выросли кристаллы разного размера, но преимущественно крупные кристаллы (100-200 мкм - самое длинное измерение). Засеянные капли, однако, произвели более мелкие кристаллы (5 - 50 мкм - самое длинное измерение). Эти первоначальные тесты показали, что семена потребуются для уменьшения X s, но также и то, что это условие должно подходить для большихобъемов.
Когда объем увеличивался на 200 мкл, объем кристаллизации постоянно перемешивался во время роста кристаллов. Основная причина этого перемешивания заключалась в том, чтобы кристаллизационный раствор оставался однородным и чтобы растущие кристаллы не оседали на дне или по бокам трубок. Оседание кристаллов может привести к гетерогенной популяции кристаллов как с очень большими, так и с мелкими кристаллами. Перемешивание кристаллизационного раствора также может способствовать зародышеобразованию44,45.
К сожалению, незасеянные 30% (мас./об.) ПЭГ 6000 не давали кристаллов, поэтому концентрация ПЭГ была увеличена до 35% (мас./об.). Это увеличение заметно улучшило кристаллизацию, с конечным диапазоном Xn и Xs 3,6 ± 1,2 x 106 кристаллов·мл-1 и 42 ± 4,1 мкм соответственно (рис. 8A и B - черный). Несмотря на значительное улучшение и приемлемую концентрацию кристаллов, конечные кристаллы были слишком велики для запланированного эксперимента, поэтому были предприняты дальнейшие оптимизации. Чтобы уменьшить размер конечных кристаллов, были исследованы два пути (рис. 1E): уменьшение концентрации белка, чтобы попытаться ограничить окончательный рост кристаллов (рис. 8A и B - ярко-розовый), и увеличение концентрации PEG, чтобы попытаться увеличить зародышеобразование (рис. 8A и B - зеленый).
Снижение концентрации белка, к сожалению, также резко уменьшило Xn, что в конечном итоге привело к еще более крупным кристаллам. Увеличение концентрации ПЭГ до 40% дало конечный диапазон Xn и Xs 3,1 ± 0,7 x 10 6 кристаллов · мл-1 и 39 ± 2,3 мкм соответственно. Они существенно не отличались от 35%, но, поскольку окончательный размер кристалла был уменьшен, это условие было продолжено с дальнейшими оптимизациями.
Для увеличения Xn были добавлены семена. Это резко увеличило Xn (1,1 ± 1,8 x 108 кристаллов·мл-1) и привело к уменьшению Xs (4,2 ± 4,0 мкм) (рис. 8A и B - пунктир фиолетового цвета). Эти кристаллы, хотя и очень подходящие для некоторых серийных кристаллографических экспериментов, были сочтены слишком маленькими, поэтому концентрация добавленных семян была изменена.
Однако эту настройку добавленного семенного материала оказалось трудно надежно повторить; Поэтому была предпринята попытка закалки. После добавления затравочного материала контролировали размер кристаллов, и как только был достигнут подходящий размер кристаллов (приблизительно 10 - 20 мкм), периодическую кристаллизацию гасили (рис. 8C и D). Тушение было предложено в отношении микрокристаллизации в Kupitz et al. (2014)25. Хотя, возможно, это не идеальный метод, так как белковый раствор в конечном итоге будет потраченвпустую 26, этот метод был очень полезен в этой ситуации, поскольку рост кристаллов было трудно контролировать. Идея закалки состоит в том, чтобы быстро вернуть кристаллизационную смесь в точку, находящуюся чуть выше линии растворимости (рис. 1F). Как только раствор возвращается к линии растворимости, раствор возвращается в стабильный насыщенный раствор, и дальнейшего роста кристаллов не происходит.
Попытка погасить реакцию кристаллизации сопряжена с риском. Если добавить слишком большой гасящий раствор, белок в растворе может быть разбавлен настолько, что линия растворимости будет пройдена. В этом случае раствор станет недонасыщенным и кристаллы начнут растворяться. Чтобы этого не допустить, можно оценить количество необходимого закалочного раствора по результатам морфограммы. В момент тушения берут концентрацию белкового раствора. Сравнивая концентрацию белка на линии растворимости и концентрацию белка в растворе, можно сделать оценку требуемого разведения.
Закаленная версия эксперимента с 40% (мас./об.) ПЭГ 6000, 10 раз разбавленными затравками дала конечную концентрацию кристаллов и диапазон размеров 2,6 ± 3,1 x 10,6 кристаллов·мл-1 и 15 ± 3,9 мкм соответственно.
На протяжении всего процесса тестовые рентгеновские данные кристаллов эндотиапепсина собирались на линии пучка Swiss Light Source PXII с использованием фокуса 10 x 30 мкм, энергии 12,4 кэВ, ослабленной на 80%, и в криоусловиях. Данные были обработаны с помощью циферблатов, и на рисунке 9 показано сравнение CC1/2. В ходе оптимизации не наблюдалось резких изменений в CC1/2 .
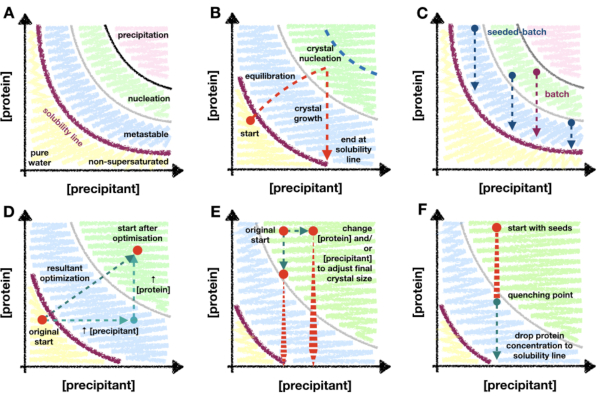
Рисунок 1: Обзор переходной и периодической кристаллизации, а также методов масштабирования, отображенных на фазовой диаграмме. Ответ. Зоны и пределы архетипической фазовой диаграммы кристаллизации белка. Концентрации осадителя и белка нанесены на оси x и y соответственно с точкой чистой воды в начале координат. Фиолетовая линия обозначает границу пересыщения белка, а зоны метастабильного образования, зарождения и осаждения показаны синим, зеленым и розовым цветами соответственно. В. Пример пределов проникновения в зону зародышеобразования метода кристаллизации «переходной фазы», такого как диффузия пара. В этом теоретическом эксперименте осадок капель и концентрация белка начинаются чуть ниже линии растворимости - еще не пересыщены. В то время как капля уравновешивается, концентрации компонентов капли увеличиваются настолько, что капля становится пересыщенной и продолжает перемещаться - или переходить - в зону зародышеобразования. При зарождении кристаллов концентрация белка в растворе начинает падать. Концентрация продолжает падать по мере роста кристаллов, пока, наконец, не остановится на линии растворимости. Синей пунктирной линией обозначен теоретический предел перехода в зону зародышеобразования. Как только начнется зарождение, концентрация белка упадет, препятствуя дальнейшему проникновению. С. Пример траекторий периодической и затравочной кристаллизации. В партии смешивание белка и осадителя должно создать пересыщенный раствор в зоне зародышеобразования, чтобы мог произойти рост кристаллов. В семенной партии нет строгой необходимости находиться в зоне зародышеобразования из-за добавления микросемян, поэтому также можно исследовать места в метастабильной области. Д. Гипотетическая оптимизация эксперимента по кристаллизации, показанного в B , от диффузии пара к партии. Исходная начальная точка диффузии пара перешла через результирующий вектор оптимизации в новое начальное положение; внутри зоны зародышеобразования. Результирующий вектор является продуктом двух оптимизаций: увеличения концентрации белка и осаждающего вещества. Е. Примеры оптимизаций при масштабировании пакетных условий для адаптации конечных Xn и Xs. Ф. Эксперимент по тушению кристаллизации добавлением кристаллизационного буфера. Важно, чтобы закалка не выводила концентрацию белка из метастабильной области и, следовательно, ниже точки пересыщения белка. В противном случае кристаллы начнут растворяться обратно в растворе. В. и C . были адаптированы из Beale et al. (2019)26 с разрешения авторов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
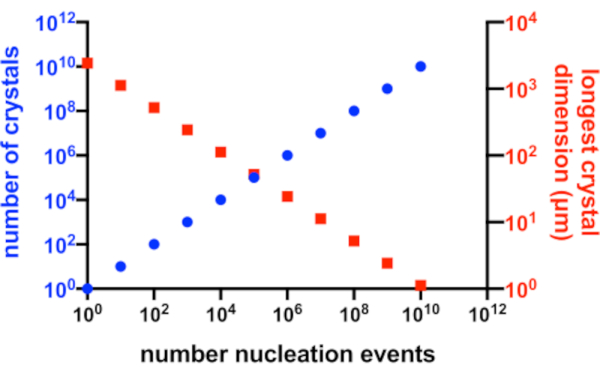
Рисунок 2: Увеличение Xn и уменьшение Xs. Идеализированная зависимость между числом кристаллов, полученных в результате эксперимента по кристаллизации, и их средним наибольшим размером. Для создания этого графика использовалась кристаллизация гипотетического модельного белка 10 кДа. Белок кристаллизовался в концентрации 10 мг/мл и дал кристаллы P212 1 21 с размерами49x50x51 Å. Предполагалось, что каждое событие зарождения дает кристалл. Предполагалось, что рост кристаллов будет однородным с каждой грани. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
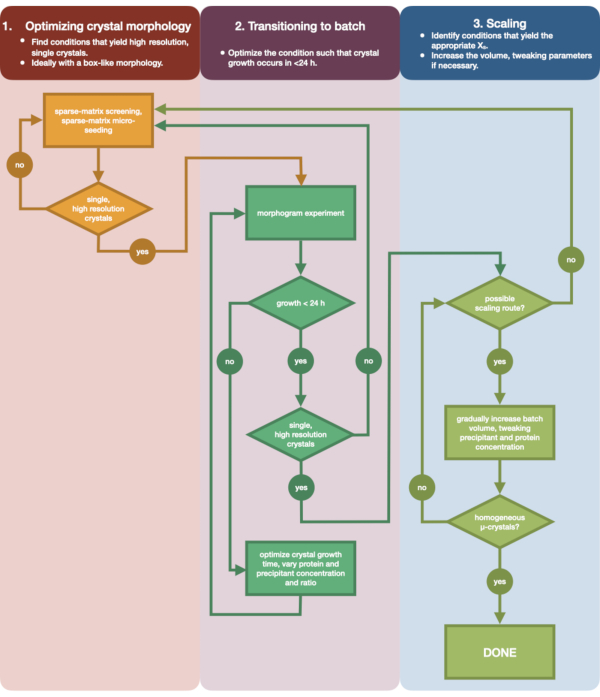
Рисунок 3: Блок-схема, показывающая этапы оптимизации кристалла, выращенного в эксперименте по диффузии пара малого объема (<500 нл), в периодический эксперимент большого объема (> 100 мкл). Оптимизация кристаллов делится на три этапа: (1) Оптимизация морфологии кристаллов. (2) Переход на пакетную обработку. (3) Масштабирование. На стадии 1 важно определить подходящие кристаллы для микрокристаллизации. Некоторые белки присутствуют только в морфологии одного кристалла, независимо от условий кристаллизации. Тем не менее, стоит искать условия, которые приводят к появлению одиночных, кубических кристаллов или как можно ближе к ним. Одиночные, кубообразные кристаллы, гипотетически и анекдотично, как правило, приводят к лучшим результатам серийных кристаллографических экспериментов. После того, как морфология кристалла выбрана и дифракция подтверждена, необходимо перенести эксперимент по кристаллизации с диффузии пара на партию (этап 2). Здесь кристаллы должны быть оптимизированы по времени их зародышеобразования. Цель состоит в том, чтобы найти условия, при которых образуются быстро появляющиеся кристаллы (> 24 ч), поскольку эти условия, вероятно, немедленно попадут в зону зародышеобразования и, следовательно, будут периодическими. После того, как условие в зоне зародышеобразования найдено, может быть создана морфограмма. Морфограмма позволяет картировать большую часть зоны зародышеобразования и определять потенциальные пути масштабирования для стадии 3. Затем объем идентифицированного состояния партии может быть либо постепенно, либо быстро увеличен в размере, чтобы получить конечный объем >100 мкл. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Анализ условий кристаллизации эндотиапепсина с помощью экрана разреженной матрицы PACT. А. и Б. - фотографии скважин А4 и С10 через 24 ч соответственно с экрана PACT . Компоненты кристаллизационного буфера выделены на рисунке. Буфер SPG представляет собой янтарную кислоту, дигидрофосфат натрия и глицин, смешанные в молярном соотношении 2:7:7. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
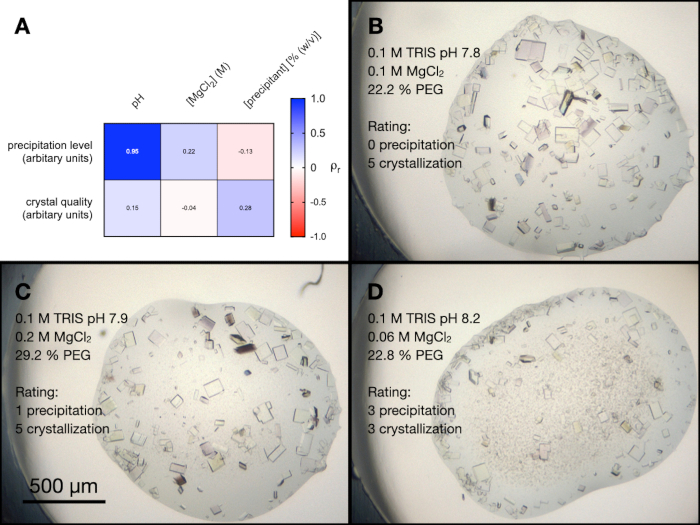
Рисунок 5: Анализ оптимизации кристаллизации эндотиапепсина в условиях PACT MgCl2 . Ответ. Тепловая карта результатов корреляционного анализа Пирсона между рН буфера, концентрацией MgCl2 и концентрацией осадителя, а также уровнем осаждения и качеством кристаллов. Уровень осаждения и качество кристаллов оценивались произвольно по шкале от 0 до 5 (где 0 означает отсутствие кристаллов или осадков) через 24 часа до нашей эры. и Д . показывают примеры кристаллизации и осаждения в трех разных каплях. Также показаны условия кристаллизации и оценки уровня осаждения и качества кристаллов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
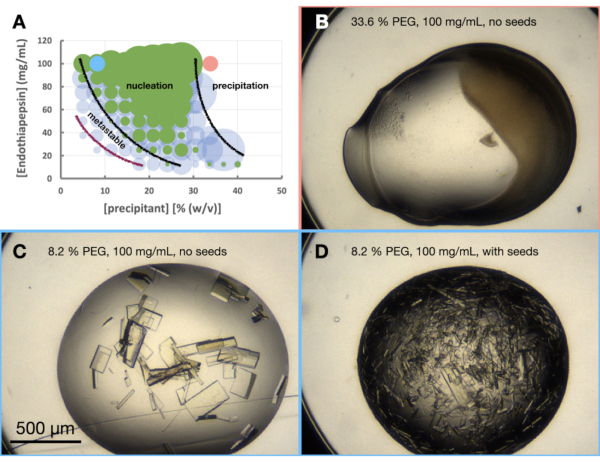
Рисунок 6: Морфограмма эндотиапепсина при кристаллизации в 0,1 М трис-HCl рН 7,0, 0,15 М MgCl2 и ПЭГ 6,000. Ответ. Морфограмма, созданная на основе предоставленной электронной таблицы «генератор фазовых диаграмм». Относительное количество кристаллов в каждой капле обозначается размером кругов, а результаты капель 1 (белок и осадитель) и капель 2 (белок, осадитель и семена) выделены зеленым и синим цветом соответственно. Значения концентраций белка и осадителя по осям x и y, соответственно, обозначают предварительно смешанные значения каждого из них, а не конечные объемы. На основании полученных результатов были проведены черные линии и фиолетовая линия, показывающие границы зоны зародышеобразования и метастабильной зоны соответственно. до н. э. и Д. показывают некоторые примеры результатов эксперимента. Красные и синие точки, отмеченные на А., указывают на местонахождение В. и В. и Д., соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7: Первоначальные испытания эндотиапепсина в 24-луночных подвесных планшетах. Для всех исследований использовались одни и те же концентрации белка и осадителя: 100 мг/мл эндотиапепсина в 0,1 М ацетата натрия рН 4,6 и 0,1 М трис-HCl рН 7,0, 0,15 М MgCl2 и 30% (мас./об.) ПЭГ 6000 соответственно. Все отображаемые изображения были сделаны через 24 часа, и окончательные объемы дропа помечены на каждом изображении. Левая панель (A, D и G) представляет собой смесь белка и осадителя в соотношении 1:1, средняя панель (B, E и H) представляет собой смесь семян, осадителя и белка в соотношении 1:2:3, а правая панель (C, F и I) представляет собой увеличенные изображения средней панели. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
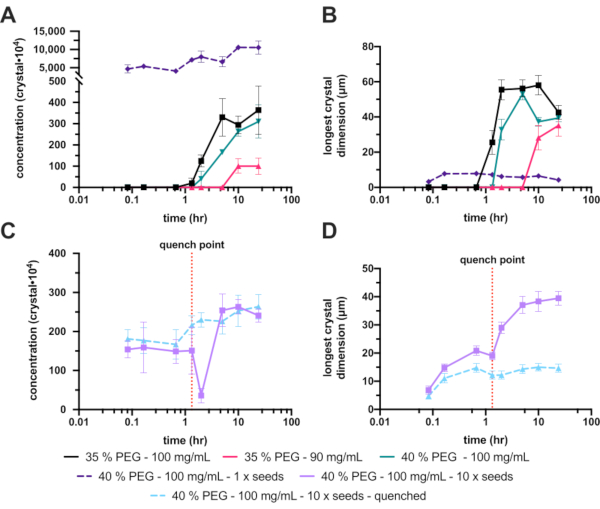
Рисунок 8: Анализ микрокристаллизации эндотиапепсина в объемах 200-300 мкл. А. и С. показывают, как Xn изменялся за время эксперимента. В. и D. показывают, как Xs (самое длинное измерение) изменялось с течением времени. Результаты экспериментов были разделены для ясности. Красная пунктирная линия на С. и Д. показывает точку, в которой производилась закалка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
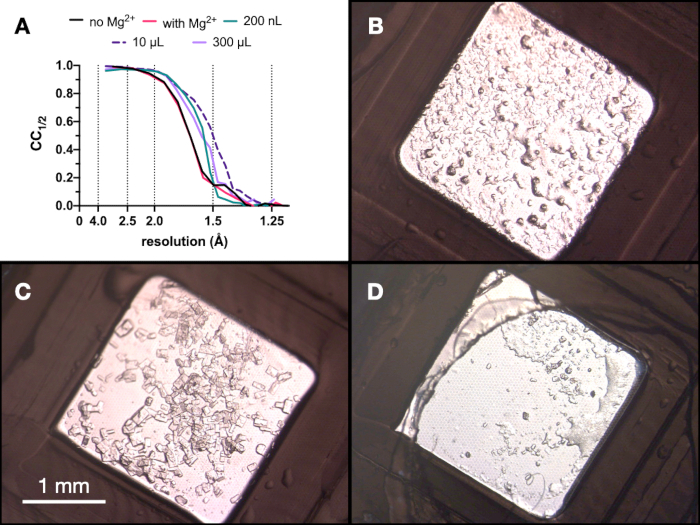
Рисунок 9: Результаты CC1/2 и изображения кристаллов, полученные на каждой стадии процесса микрокристаллизации для оценки качества дифракции. Ответ. CC1/2 построен в зависимости от разрешения данных, собранных из выращенных кристаллов: с Mg и без него - часть оптимизации Stage 1, в объеме 200 нл, объеме 10 мкл и конечном объеме 300 мкл. BC и D. показывают кристаллы из объема 200 нл, 10 мкл и 300 мкл соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Информация о белке | |
| Белок | Эндотиапепсин |
| Молекулярная масса (кДа) | 33.8 |
| Космическая группа | П12 11 |
| a, b, c (Å) | 45.2, 73.3, 52.7 |
| α, β, ɣ (°) | 90.0, 109.2, 90.0 |
| Параметры с фиксированной целью | |
| Объем, загружаемый на чип (мкл) | 150 |
| Апературы на чип | 25,600 |
| Требуемая концентрация кристаллов (кристаллы/мл) | 500,000 |
| Информация об образце | |
| Белковая масса, используемая для получения образца 200 мкл (мг) | 10 |
| Самый длинный размер кристалла (мкм) | 15 |
| Концентрация кристаллов (кристаллы/мл) | 2,500,000 |
| Экспериментальные переменные | |
| Требуемое количество временных точек | 5 |
| Количество изображений, необходимых для каждого момента времени | 50,000 |
| Процент попаданий (собранные интегрированные шаблоны/изображения) | 0.3 |
| Фиксированные целевые показатели, требуемые для каждого момента времени (округлены в большую сторону) | 7 |
| Требования к образцам | |
| Требуемый объем образца на момент времени (мкл) | 1,050 |
| Общий объем образца, необходимый для эксперимента (мл) | 5.25 |
| Общая масса необходимого белка (мг) | 52.5 |
Таблица 1: Пример требований к образцу для гипотетического эксперимента с оптическим зондом накачки, выполненного с использованием фиксированных мишеней. Белком, использованным в этом теоретическом эксперименте, был эндотиапепсин. Параметры с фиксированной целью были основаны на экспериментах, о которых сообщалось в Ebrahim et al. (2019)48 и Davy et al. (2019)49. Информация о выборке была взята из протокола, представленного в этой видеостатье, а экспериментальные переменные были консервативными оценками, основанными на жизненном опыте. Следующие требования к выборке были впоследствии рассчитаны с учетом предыдущих допущений.
Обсуждение
Представленный метод показывает, как оптимизировать кристаллизацию эндотиапепсина от крупных кристаллов (≥ наибольшего размера 100 мкм), выращенных в 96-луночных экранах с разреженной матрицей, до микрокристаллов, выращенных в центрифужных пробирках (объемом 300 мкл) партиями . Идея, лежащая в основе протокола, заключается в том, что шаги, предпринятые для оптимизации эндотиапепсина, также могут быть использованы для других белков. В конечном счете, решая задачу создания больших объемов (>100 мкл) микрокристаллов (10-20 мкм) для серийных кристаллографических экспериментов на XFEL и синхротронах.
Протокол делит задачу микрокристаллизации большого объема на три этапа: (1) оптимизация морфологии кристаллов, (2) переход к пакетированию и (3) масштабирование. На шаге 1 следует исследовать диапазон кристаллических форм, которые может создавать белок, в диффузионных пластинах пара. Целью должны быть условия, которые приводят к образованию одиночных, коробчатых кристаллов, которые дифрагируют с требуемым разрешением. На этапе 2 выбранные условия могут быть преобразованы из диффузии пара в периодическое производство. Здесь критерием оптимизации является время роста кристаллов и поиск условий, которые приводят к образованию кристаллов белка в течение 24 часов. Также может быть построена морфограмма, дающая экспериментатору представление о расположении линии растворимости и границах зон зародышеобразования. Эта морфограмма очень полезна на шаге 3 «Масштабирование». Морфограмма даст представление о том, может ли зародышеобразование само по себе увеличить Xn и снизить Xs. По мере увеличения объема эксперимента Xn и Xs могут постоянно оцениваться как ключевые критерии успеха масштабирования.
В случае с эндотиапепсином Шаг 1 обнаружил то, что потенциально было ранее неизвестной морфологией кристаллов эндотиапепсина. Эта морфология имела ту же пространственную группу, что и те, о которых сообщалось ранее, но, что важно для серийной кристаллографии, более коробчатую форму. Монокристаллы также, по-видимому, росли из одиночных точек зародышеобразования, в отличие от вееров, созданных в других условиях (рис. 4). Для выбранного условия шаг 2 уже был частично выполнен, так как рост кристаллов происходил через < 24 часа. Морфограмма показала, что как прямой, так и засеянный пакетный протокол может быть успешным при масштабировании на шаге 3. Первоначальное масштабирование в прямой партии создало условия, в результате которых получались кристаллы с диапазоном Xn и Xs 3,6 ± 1,2 x 10,6 кристаллов·мл-1 и 42 ± 4,1 мкм соответственно. Эти кристаллы, хотя и приемлемые для некоторых серийных кристаллографических экспериментов, были сочтены слишком большими. Поэтому были проведены дополнительные оптимизации. Окончательный протокол произвел кристаллы с диапазоном концентраций и размеров 3,1 x10,6 кристаллов·мл-1 и 15 ± 3,9 мкм соответственно. Это было более чем идеально для запланированных экспериментов.
Метод фокусируется на превращении «растворимых» кристаллов белка, выращенных в пластинах для диффузии пара, в периодическое производство. Причина такого фокуса заключается в том, что подавляющее большинство растворимых кристаллов белка выращивается путем диффузиипаров 26. Однако представленные концепции могут быть также применены к растворимым кристаллам белка, выращенным с использованием других методов, таких как микропартия. Эти концепции также могут быть применимы к мембранным белковым кристаллам, выращенным в LCP; так как это тоже процесс периодической кристаллизации.
Ключевым аспектом протокола является процесс преобразования условий кристаллов, выращенных в диффузионных пластинах пара, таким образом, чтобы их можно было выращивать партиями. Для этого преобразования метод использует критерий, предложенный Beale et al. (2019)26. Кристаллы, выращенные с помощью периодического процесса, даже в пластинах для диффузии пара, будут образовываться быстро (< 24 часа). Этот критерий является приближением, основанным на скорости уравновешивания капель диффузии пара, и наиболее верен для условий осаждения на основе ПЭГ. Однако условия кристаллизации будут содержать широкий спектр соединений, которые будут влиять на время равновесия. Уравновешивание условий кристаллизации на основе солей, например, высококонцентрированного хлорида аммония, может произойти через 1-2 дня. Следовательно, критерий 24 ч может быть неверным для условий, основанных на соли. Условия, основанные на соли, также могут иметь более сложные фазовые диаграммы26,30, которые могут не соответствовать архетипу, представленному в этом протоколе. Сокращение временного критерия для условий на основе соли до 12 или 6 часов может потребоваться, если масштабирование в большие объемы окажется невозможным.
Еще одним ограничением этого метода является его кажущаяся сложность. Протокол, который был использован для оптимизации микрокристаллизации эндотиапепсина, фактически относительно мало изменил исходное состояние скрининга с разреженной матрицей. Первое попадание, наблюдаемое в скрининге PACT, было 0,1 pH HEPES 7,0, 0,2 M MgCl2 и 20% (мас./об.) ПЭГ 6,000. Окончательный масштабированный кристаллизационный буфер составлял 0,1 Tris-HCl pH 7,0, 0,15 M MgCl2 и 40% (мас./об.) PEG 6,000. Также вполне возможно, что изменение буфера с HEPES на Tris-HCl и концентрацию MgCl2 мало способствовало успеху процесса. Оставив увеличение концентрации PEG 6,000 единственной оптимизацией, и это могло быть достигнуто довольно просто.
Эта оценка, однако, также слишком упрощена. Это не только не учитывает проблемы, возникающие во время удаления зубного камня (т. е . использование семян и тушение), но и тот факт, что только потому, что этот белок оказался простым, нет никакой гарантии, что следующий также окажется таковым. Шаги, рекомендованные в протоколе, были разработаны, потому что оптимизация масштабирования объемов кристаллизации белка может быть очень дорогостоящей для белка. В семи исследованиях эндотиапепсина, которые показаны, было потреблено 100 мг белка. По общему признанию, некоторые из этих шагов были предприняты, чтобы показать их последствия в свете этого протокола. Тем не менее, 100 мг белка плюс потенциально еще 50 мг белка, потребляемого во время эксперимента (таблица 1), могут быть значительными инвестициями во время или деньги.
К счастью, неясно, является ли эта масса требуемого образца повсеместно распространена во всех белках. Эндотиапепсин был хорошо растворим, и поэтому для достижения пересыщения требовалась большая концентрация белка. В других (в настоящее время находящихся в стадии оптимизации) пересыщение может быть достигнуто при 10 или даже 5 мг / мл. Такие переменные являются специфическими для белка и должны быть приняты, когда они появляются.
Другие ограничения метода включают его зависимость от сложного оборудования, такого как роботы для обработки жидкостей для создания экранов и пластин, а также тепловизоры для автоматического изображения пластин, когда это необходимо. Были предложены альтернативные процедуры, чтобы ограничить потребность в некоторых из этих единиц оборудования, но без них соблюдение протокола займет больше времени. Протокол также предлагает проверить дифракцию оптимизированных кристаллов. Для кристаллографов, не имеющих регулярного доступа к синхротрону, эти тесты могут оказаться сложными. Контроль на каждом этапе может не понадобиться, но эти тесты настоятельно рекомендуются после того, как попадание было идентифицировано, а также до и после масштабирования. Недифракционные кристаллы в XFEL, к сожалению, не редкость. Учитывая это, лучше проявить осторожность в отношении предположений о дифракции кристаллов.
В конечном счете, этот протокол и результаты, представленные здесь, предложат руководство, идеи и пример для тех, кто борется с производством образцов для серийных экспериментов по кристаллографии. Будем надеяться, что по мере дальнейшего развития серийной кристаллографии требования к образцам этого метода будут снижены настолько, что потребность в подобных протоколах будет снижена. Однако даже в этом случае представленные здесь стратегии все равно будут полезны тем, кто хочет исследовать пространство кристаллизации своего белка.
Раскрытие информации
У авторов нет конфликтов интересов, которые необходимо раскрывать.
Благодарности
Этот проект получил финансирование от исследовательской и инновационной программы Европейского Союза «Горизонт 2020» в рамках грантового соглашения No 701647 имени Марии Склодовской-Кюри. Большое спасибо за помощь и поддержку ученых на линии луча Swiss Light Source X10SA-PXII.
Материалы
| Name | Company | Catalog Number | Comments |
| Swissci 96-well 2-Drop plates | Molecular Dimensions | MD11-002 | 96-well 2-drop crystallisation plate |
| Swissci 96-well 3-Drop plates | Molecular Dimensions | MD11-003 | 96-well 3-drop crystallisation plate |
| mosquito LCP liquid handling robot | sptlabtech | mosquito LCP | Crystallisation robot |
| ClearVue Sheets | Molecular Dimensions | MD6-015 | 96-well crystallization plate seals |
| Safe-Tube 1.5 mL | Eppendorf | 30120086 | 1.5 mL centrifuge tubes |
| Scaple | Swan and Morton | No. 3 scalple and No. 3 handle | Scalple for cutting open plate seals |
| MS 3 Vortex | IKA | 3319000 | Vortex for mixing solution and making seed stocks |
| 24-well XRL Plate | Molecular Dimensions | MD3-11 | 24-well hanging-drop plates |
| Tube revolver/rotator | Thermo Fischer Scientific | 88881001 | Tube revolver for mixing solution during scaling |
| Eppendorf Research plus pipettes | Eppendorf | Range of manual pipettes, 0.5-10, 1-20, 10-100, 100-1000 µL | |
| Eppendorf pipette tips | Eppendorf | Range of tip sizes for manual pipettes | |
| Suparen 600 | Prochem AG | Suparen 600 | Endothiapepsin solution |
| Sodium Acetate | Sigma-Aldrich | 241245-1KG | Sodium Acetate |
| Tris | Merck | 8382T014 | Tris |
| Magnesium Chloride | Sigma-Aldrich | M2670-1kg | Magnesium Chloride |
| PEG 6,000 | Sigma-Aldrich | 81255-1kg | PEG 6,000 |
| Ethelyene glycol | Sigma-Aldrich | 324558-1L | Ethelyene glycol for cyro-protecting the crystals |
| PACT Premier HT screen | Molecular Dimensions | MD1-36 | PACT Premier 96-well crystal screen |
| DOW CORNING high vacuum grease | Molecular Dimensions | MD6-02 | Grease for sealing 24-well plates |
| Hirschmann 22 x 22 mm glaser cover slides | Hirschmann | 8000104 | Cover slides for sealing 24-well sitting drop plates |
| Crystal pins | PSI | Manufactured inhouse | Thin-film supports for micro-crystals. |
| 1-1.3 mm SiLibeads Type S | Faust | 6239547 | Glass beads for making mico-seed stocks |
| Macbook Pro | Apple | Macbook Pro | Computer for performing data analysis |
| CCP4 software suite | CCP4 | Diffraction pattern data processing software | |
| Excel | Microsoft | Microsoft Office | Plotting tool for phase diagram |
| Hausser Scientific Bright-Line counting chamber | Thermo Fischer Scientific | 02-671-51B | Tool to calculate crystal concentration |
| PACT Premier | Molecular Dimensions | MD1-29-ECO | Sparse-matrix crystallization screen |
| Rock Imager | Formulatrix | Rock Imager | Temperature controlled crystal plate storage and imager |
| Rock MakerWeb | Formulatrix | Rock MakerWeb | Crystal plate creation and image storage stoftware |
| Formulator | Formulatrix | Formulator | 96-well crystal screen creation liquid handling robot |
| Leica MZ16 Microscope | Leica | Leica MZ16 | Light microscope |
| LAS V4.6 | Leica | LAS V4.6 | Software for Leica microscopes |
| Spectra/Por 3.5 kDa dialysis tubing | Spectrumlabs | Spectra/Por 3 Dialysis Membrane | 3.5 kDa dialysis membrane |
| Dialysis tubing closures | Spectrumlabs | Spectra/Por 3 Duniversal Closures | Clips to seal the dialysis tubing ends |
| Amicon 10 kDa centrifugal concentrator | Merck-Millipore | Amicon Ultra-15 10 kDa centrifugal concentrator | 10 kDa centrifugal filter |
| 5810 R swing bucket centrifuge | Eppendorf | 5810 R Centrifuge | Swing bucket centrifuge |
Ссылки
- DePonte, D. P., et al. Gas dynamic virtual nozzle for generation of microscopic droplet streams. Journal of Physics D: Applied Physics. 41 (19), 195505 (2008).
- Hunter, M. S., et al. Fixed-target protein serial microcrystallography with an x-ray free electron laser. Scientific Reports. 4 (1), 6026 (2014).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nature Communications. 5 (1), 1-6 (2014).
- Roessler, C. G. G., et al. Acoustic Injectors for Drop-On-Demand Serial Femtosecond Crystallography. Structure. 24 (4), 631-640 (2016).
- Sherrell, D. A., et al. A modular and compact portable mini-endstation for high-precision, high-speed fixed target serial crystallography at FEL and synchrotron sources. Journal of Synchrotron Radiation. 22 (6), 1372-1378 (2015).
- Roedig, P., et al. A micro-patterned silicon chip as sample holder for macromolecular crystallography experiments with minimal background scattering. Scientific Reports. 5 (1), 1-11 (2015).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallographica Section D Biological Crystallography. 71 (2), 387-397 (2015).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature Communications. 8 (1), 542 (2017).
- Tenboer, J., et al. Time-resolved serial crystallography captures high-resolution intermediates of photoactive yellow protein. Science. 346 (6214), 1242-1246 (2014).
- Nango, E., et al. A three-dimensionalmovie of structural changes in bacteriorhodopsin. Science. 354 (6319), 1552-1557 (2016).
- Suga, M., et al. Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL. Nature. 543 (7643), 131-135 (2017).
- Mehrabi, P., et al. Liquid application method for time-resolved analyses by serial synchrotron crystallography. Nature Methods. 16 (10), 979-982 (2019).
- Halle, B. Biomolecular cryocrystallography: structural changes during flash-cooling. Proceedings of the National Academy of Sciences of the United States of America. 101 (14), 4793-4798 (2004).
- Fraser, J. S., et al. Hidden alternative structures of proline isomerase essential for catalysis. Nature. 462 (7273), 669-673 (2009).
- Fenwick, R. B., van den Bedem, H., Fraser, J. S., Wright, P. E. Integrated description of protein dynamics from room-temperature X-ray crystallography and NMR. Proceedings of the National Academy of Sciences of the United States of America. 111 (4), 445-454 (2014).
- Keedy, D. A., et al. Mapping the conformational landscape of a dynamic enzyme by multitemperature and XFEL crystallography. Elife. 4, (2015).
- Thomaston, J. L., et al. XFEL structures of the influenza M2 proton channel: Room temperature water networks and insights into proton conduction. Proceedings of the National Academy of Sciences of the United States of America. 114 (51), 13357-13362 (2017).
- Haas, D. J., Rossmann, M. G. Crystallographic studies on lactate dehydrogenase at -75 °C. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 26 (7), 998-1004 (1970).
- Hope, H. Cryocrystallography of biological macromolecules: a generally applicable method. Acta Crystallographica Section B Structural Science. 44 (1), 22-26 (1988).
- Wu, W., et al. Batch crystallization of rhodopsin for structural dynamics using an X-ray free-electron laser. Acta Crystallographica Section:F Structural Biology Communications. 71 (7), 856-860 (2015).
- Ishchenko, A., Cherezov, V., Liu, W. Preparation and delivery of protein microcrystals in lipidic cubic phase for serial femtosecond crystallography. Journal of Visualized Experiments. (115), e54463 (2016).
- Andersson, R., et al. Well-based crystallization of lipidic cubic phase microcrystals for serial X-ray crystallography experiments. Acta Crystallographica Section D: Structural Biology. 75 (10), 937-946 (2019).
- Luft, J. R., et al. The detection and subsequent volume optimization of biological nanocrystals. Structural Dynamics. 2 (4), 041710 (2015).
- Lee, D. B., et al. Supersaturation-controlled microcrystallization and visualization analysis for serial femtosecond crystallography. Scientific Reports. 8 (1), 1-10 (2018).
- Kupitz, C., et al. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcus elongatus as a model system. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1647), 20130316 (2014).
- Beale, J. H., et al. Successful sample preparation for serial crystallography experiments. Journal of Applied Crystallography. 52, 1385-1396 (2019).
- Rayment, I. Small-scale batch crystallization of proteins revisited: An underutilized way to grow large protein crystals. Structure. 10 (2), 147-151 (2002).
- García-Ruiz, J. M. Nucleation of protein crystals. Journal of Structural Biology. 142 (1), 22-31 (2003).
- McPherson, A., Kuznetsov, Y. G. Mechanisms, kinetics, impurities and defects: Consequences in macromolecular crystallization. Acta Crystallographica Section F:Structural Biology Communications. 70 (4), 384-403 (2014).
- Rupp, B. Origin and use of crystallization phase diagrams. Acta crystallographica. Section F, Structural biology communications. 71, 247-260 (2015).
- Luft, J. R., DeTitta, G. T. A method to produce microseed stock for use in the crystallization of biological macromolecules. Acta Crystallographica Section D Biological Crystallography. 55 (5), 988-993 (1999).
- Ireton, G. C., Stoddard, B. L. Microseed matrix screening to improve crystals of yeast cytosine deaminase. Acta crystallographica. Section D, Biological crystallography. 60 (3), 601-605 (2004).
- Forsythe, E. L., Maxwell, D. L., Pusey, M. Vapor diffusion, nucleation rates and the reservoir to crystallization volume ratio. Acta Crystallographica Section D Biological Crystallography. 58 (10), 1601-1605 (2002).
- Chayen, N. E., Shaw Stewart, P. D., Maeder, D. L., Blow, D. M. IUCr An automated system for micro-batch protein crystallization and screening. Journal of Applied Crystallography. 23 (4), 297-302 (1990).
- Chayen, N. E., Shaw Stewart, P. D., Blow, D. M. Microbatch crystallization under oil - a new technique allowing many small-volume crystallization trials. Journal of Crystal Growth. 122 (1-4), 176-180 (1992).
- Chayen, N. E. Comparative studies of protein crystallization by vapour-diffusion and microbatch techniques. Acta Crystallographica Section D: Biological Crystallography. 54 (1), 8-15 (1998).
- D'Arcy, A., Mac Sweeney, A., Stihle, M., Haber, A. The advantages of using a modified microbatch method for rapid screening of protein crystallization conditions. Acta Crystallographica - Section D Biological Crystallography. 59 (2), 396-399 (2003).
- Darmanin, C., et al. Protein crystal screening and characterization for serial femtosecond nanocrystallography. Scientific Reports. 6, 25345 (2016).
- Gati, C., et al. Atomic structure of granulin determined from native nanocrystalline granulovirus using an X-ray free-electron laser. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2247-2252 (2017).
- Cheng, R. K. Y. Towards an optimal sample delivery method for serial crystallography at XFEL. Crystals. 10 (3), 215 (2020).
- Schmidt, M. Mix and Inject: Reaction Initiation by Diffusion for Time-Resolved Macromolecular Crystallography. Advances in Condensed Matter Physics. 2013, 1-10 (2013).
- Oberthuer, D., et al. Double-flow focused liquid injector for efficient serial femtosecond crystallography. Scientific Reports. 7 (1), 44628 (2017).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta crystallographica. Section F, Structural biology communications. 70, 2-20 (2014).
- Yaoi, M., et al. Effect of stirring method on protein crystallization. Japanese Journal of Applied Physics, Part 2: Letters. 43 (10), 1318 (2004).
- Castro, F., Ferreira, A., Teixeira, J. J., Rocha, F. Influence of Mixing Intensity on Lysozyme Crystallization in a Meso Oscillatory Flow Reactor. Crystal Growth & Design. 18 (10), 5940-5946 (2018).
- Moews, P. C., Bunn, C. W. An X-ray crystallographic study of the rennin-like enzyme of Endothia parasitica. Journal of Molecular Biology. 54 (2), 395-397 (1970).
- Newman, J., et al. Towards rationalization of crystallization screening for small- to medium-sized academic laboratories: the PACT/JCSG+ strategy. Acta crystallographica. Section D, Biological. 61, 1426-1431 (2005).
- Ebrahim, A., et al. Resolving polymorphs and radiation-driven effects in microcrystals using fixed-target serial synchrotron crystallography. Acta Crystallographica Section D Structural Biology. 75, 151-159 (2019).
- Davy, B., et al. Reducing sample consumption for serial crystallography using acoustic drop ejection. Journal of Synchrotron Radiation. 26 (5), (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены