Method Article
בידוד של נויטרופילים אנושיים מדמם שלם ומעילי באפי
In This Article
Summary
פרוטוקול זה מפרט שיטה לבידוד של נויטרופילים מדם שלם, מעילי באפי או ממברנות לויקפרזיס, השגת תשואה טובה, טוהר גבוה, והפעלת תאים מינימלית. אנו משתמשים טיהור הדרגתי, משקעים בתאי דם אדומים (RBC), ותסיסת RBC כדי לקבל הכנה נויטרופיל באיכות גבוהה / טוהר.
Abstract
נויטרופילים (PMNs) הם הלויקוציטים הנפוצים ביותר במחזור הדם האנושי, החל מ 40 עד 70% מכלל לויקוציטים בדם. הם התאים הראשונים שגויסו באתר של דלקת באמצעות זרים מהירים דרך כלי. שם, נויטרופילים מבצעים מערך של פונקציות כדי להרוג פתוגנים פולשים ולתווך איתות חיסוני. נויטרופילים מטוהרים טריים מדם אנושי הם המודל המועדף למחקר, שכן אף קו תאים אינו משכפל באופן מלא פונקציות PMN וביולוגיה. עם זאת, נויטרופילים הם תאים קצרי מועד, מובחנים סופניים והם רגישים מאוד להפעלה בתגובה לגירויים פיזיים (טמפרטורה, צנטריפוגה) וגירויים ביולוגיים (אנדוטוקסין, כימותרפיה וציטוקינים). לכן, חיוני לפעול על פי שיטה סטנדרטית, אמינה ומהירה להשגת תאים טהורים ולא מופעלים. פרוטוקול זה מציג פרוטוקול מעודכן המשלב צנטריפוגה הדרגתית של צפיפות, משקעים של תאי דם אדומים (RBC) ותסיסת RBC כדי להשיג טוהר PMN גבוה ולמזער את הפעלת התא. יתר על כן, שיטות להערכת איכות בידוד נויטרופילים, הכדאיות והטוהר נדונים גם הם.
Introduction
מערכת החיסון המולדת מורכבת מסוגי תאים רבים השומרים על הומאוסטזיס חיסוני וסילוק פתוגן יחד עם פונקציות פיזיולוגיות רבות אחרות. נויטרופילים מהווים את הבריכה הגדולה ביותר של תאי דם לבנים במחזור האנושי1. רוב הנויטרופילים הבוגרים מאוחסנים במח העצם, שהוא אתר הדור לנויטרופילים חדשים, הנקראים גם גרנולופוליסיס. במח העצם, אבות גרנולוציט יוצאים ממעגל התא ומבדילים באופן סופני, רוכשים את הגרעינים והגרגרים המפולחים האופייניים שלהם2. בתנאים דלקתיים, בתגובה לכימותרפיה, ציטוקינים ודפוסים מולקולריים הקשורים לנזקים ופתוגן, נויטרופילים מגויסים ממחזור הדם ומחוץ למח העצם כדי לבצע מגוון רחב של פונקציות. אלה כוללים הפרשת ציטוקינים, פאגוציטוזיס ישיר של הפתוגן, שחרור של מינים חמצן תגובתי, degranulation של חלבונים מיקרוביאליים, ויצירת מלכודות חוץ תאיות נויטרופילים.
המולקולות המשמשות נויטרופילים למאבק בזיהום רעילות למיקרואורגניזמים ולפונדיקאים. לכן, תוחלת החיים והסרה נכונה של נויטרופילים מזדקנים /גוססים מוסדרים מאוד, ויש להם תוחלת חיים מוגבלת במחזור הדם (<48 שעות)3. בשל הישרדות קצרה זו, גוף האדם מייצר בממוצע 100 מיליארד נויטרופילים חדשים מדי יום כדי לשמור על הומאוסטזיס האוכלוסייה4. גרנולופוליס חירום יכול להגדיל עוד יותר את שחרורו של נויטרופילים, בוגרים ולא בוגרים, בדם במהלך דלקת וזיהום5. החשיבות של נויטרופילים בתגובה החיסונית המולדת מודגשת על ידי חולים עם נויטרופניה נרכשת או מולדת, אשר רגישים לזיהומים חיידקיים ופטריות6.
אתגרים רבים מתעוררים כאשר לומדים ביולוגיה נויטרופילים ותפקידם בתגובה החיסונית בשל טבעם, כולל הישרדותם הקצרה ותכולתם הציטוטוקסית. קווי תאים דמויי נויטרופיל נבדלו בדרך כלל מתאי לוקמיה פרומיאלציטית אנושית HL-60 ותאי PLB-9857,8. למרות שהם יכולים להציג מורפולוגיה דמוית נויטרופיל ולבצע כימוטקסיס, קווי תאים אלה אינם יכולים לשחזר באופן מלא את הביולוגיה של נויטרופילים. במבחנה באמצעות קווי תאים אלה אינם מסוגלים גם לשחזר בניסויי vivo. יתר על כן, ההבחנה של תאים אלה צריך להיות מושרה והוא יכול להיות מושפע לרעה על ידי מניפולציה גנים לפני בידול.
לאחרונה, פותחו שיטות לעקוף בעיות אלה באמצעות מקדמים לא מושרים כדי לווסת את ביטוי הגנים לאחר בידול בתאי HL-609. אפילו עם כלים כאלה, PMNs אנושי ראשוני נדרשים לאמת מטרות באמצעות גישות פרמקולוגיות. לכן, זה הכרחי כדי לקבל נויטרופילים טהורים וחסרי חיים מבודדים מהדם כדי לאמת את הממצאים של קו התא ומודלים בעלי חיים. מאמר זה מציג פרוטוקול בידוד PMN מתוקן שבו היתרונות והחסרונות של השיטות הנוכחיות הוערכו10. שילוב הומצא המורכב צנטריפוגה הדרגתית כדי להפריד PMNs מתאי חיסון אחרים, משקעים קצרים מבוססי דקסטרן כדי להסיר את רוב RBCs, תמוגת RBC שיורית מהירה באמצעות לחץ אוסמוטי, וצנטריפוגה במהירות נמוכה כדי להסיר זיהום טסיות דם.
Protocol
הערה: נויטרופילים אנושיים היו מבודדים מדם ורידים ממסנני תאי דם לבנים שהושלכו ממעבדת בנק הדם בבית החולים לילדים בבוסטון. תורמי הדם היו בלתי מזוהים, ולא הייתה כל אינטראקציה עם אנשים חיים או ידע במידע אישי המאפשר זיהוי. לכן, עבודה זו אינה מסווגת כמחקר בנושאים אנושיים על פי תקנות הנבדקים האנושיים של HHS (45 CFR Part 46). ועדת הביקורת המוסדית של בית החולים לילדים בבוסטון (IRB) אישרה את הפרוטוקול.
1. שכבות מעבר הצבע
- לאחר עיקור מעיל באפי או אריזת דם שלם ואת מכסה המנוע למינאר, לחלק את הדם לתוך צינורות 50 מ"ל עם 10 מ"ל של דם בכל צינור.
- העלה את הנפח עד 35 מ"ל עם סרום בקר עוברי של 5% (FBS)/פתרון המלח המאוזן של האנק (HBSS) כדי לדלל את הדם לקבלת שיפוע נקי יותר.
הערה: בעת שימוש בקרום leukapheresis, תאים ניתן לשטוף החוצה באמצעות מזרק 60 מ"ל ו 30 מ"ל של 5% FBS / HBSS לכל מסנן. דילול הוא מיותר בעת עבודה עם דם שלם נמשך טרי. - סגור את מכסה צינור 50 מ"ל, מערבבים אותו מספר פעמים על ידי היפוך, ולשמור אותו הפוך כדי לקבל את התחתון נטול RBCs.
- הוסף 10 מ"ל של מדיום הדרגתי צפיפות (ראה את טבלת החומרים) ישירות מתחת לדם. ודאו שהמדיום והדם לא מתערבבים ושהממשק חד(איור 1A).
הערה: צעד זה הוא קריטי. ודאו שתמיסת מעבר הצבע הצפיפות נמצאת בטמפרטורת החדר (RT) ומעורבבת היטב לפני כל מעבר צבע. המיליליטר הראשון של המדיום ההדרגתי של הצפיפות צריך להיות בזהירות ובהתמדה שכבה לאט ככל האפשר. מומלץ להגדיר את מהירות הפיפטה האלקטרונית לנמוך. - מניחים בעדינות את הצינור בצנטריפוגה מבלי להפריע לשיפוע ומסתובבים ב-400 × גרם למשך 30 דקות ב-RT, תוך הקפדה לנטרל את הבלם. שים לב כיצד שיפוע הסובב נפרד לשכבת סרום/פלזמה עליונה, טבעת לבנה אמצעית של תאים חד-גרעיניים של דם היקפי (PBMCs), שכבה בינונית הדרגתית הדרגתית בצפיפות מעוננת, וכדור תחתון המורכב מפס נויטרופילים לבן ודק מעל ה- RBCs (איור 1B).
הערה: צד מעונן או אטום של הצינור לאחר צנטריפוגה יכול להציע כי התאים (נויטרופילים) מופעלים וייתכן שאינם מתאימים לשימוש. - הסר תחילה את מחשבי ה-PBMCs על-ידי הגיחה של פיפטת היניקה ישירות לשכבת ה-PBMC. הקפד לשאוף אותו לחלוטין בזמן ששכבת הסרום/פלזמה פוחתת ככל שהטבעת מוסרת. לגרד את הצד של הצינור שבו תאים גלם עם pipette יניקה כדי למקסם את הסרת PMBC. הסר בזהירות את השכבה הבינונית העכורה של הצפיפות המוענת בין טבעת PBMC לכדור הנויטרופיל/RBC.
הערה: גירוד התאים המנודים בצד הצינור מגביר את טוהר הבידוד במידה ניכרת. היזהר לא לשאוף את הכדור, כמו רוב נויטרופילים יושבים ישירות על גבי RBCs.
2. משקעים של אריתרוציטים (RBCs)
- באמצעות פיפטה של 10 מ"ל, מעבירים את כדורי הנויטרופיל/RBC לצינור נקי. אין להזרים למעלה ולמטה. הוסף 5% FBS / HBSS לנפח סופי של 25 מ"ל. מערבבים בעדינות על ידי היפוך.
הערה: ביצוע משקעים RBC לאחר הסרת PBMC משפר את התשואה ומקטין את ההפעלה10. - הוסף ישירות 25 מ"ל של התחממות מוקדמת (37 °C) 3% Dextran /0.9% NaCl /H2O לתוך הצינור המכיל את כדורי נויטרופיל /RBC מדולל ומערבבים בעדינות על ידי היפוך. מניחים את הצינור על משטח מאוזן ולא רוטט למשך 15 דקות(איור 1C).
הערה: משקעים ארוכים יותר מפחיתים את זיהום RBC אך גם מקטין את התשואה. יתר על כן, חשיפה ממושכת לדקסטרן עלולה להוביל להפעלת נויטרופילים או למוות תאי11. - מחזירים בעדינות את הצינור למכסה המנוע (לבידוד סטרילי). על ידי טבילה קלה בלבד של הפיפטה בנוזל, אסוף את השכבה העליונה (~ 30 מ"ל) בעקבות פני השטח הנוזליים כלפי מטה.
הערה: אם המשקעים מייצרים ממשק חד בין המדיום לבין ה- RBCs, גלולה RBC קטנה יותר, או אם נדרשת תשואה גבוהה יותר, לאסוף עד 35 מ"ל. - לסובב את הצינור (400 × גרם, 10 דקות, RT, באמצעות בלם נמוך (3)), וכתוצאה מכך גלולה אדומה ללא חלקיקים צפים במדיה.
3. תמיסת שאריות RBCs
- שאפו בעדינות את הסופר-טבעי מבלי לשבש את הכדור.
- הוסיפו 25 מ"ל של מים סטריליים אולטרה-סבר ישירות לתוך הצינור וערבבו בעדינות על ידי היפוך של 28 מ"ל כדי ללקק את ה-RBCs. אין להשתמש בצנרת כדי להזרים מחדש את הכדור.
הערה: לא יעלה על 30 s כמו תנאים היפוטוניים ממושכים יכול להפעיל ולהוביל למוות נויטרופיל12. - מיד להוסיף 25 מ"ל של סטרילי 1.8% NaCl / H2O לתוך הצינור ומערבבים בעדינות על ידי היפוך כדי להחזיר את הפתרון לתנאים איזוטוניים.
הערה: הפתרון צריך להיות אדום אך ללא עגמומיות. - ספין למטה ב 200 × g במשך 3-5 דקות עם בלם נמוך (רמה 3) כדי למזער RBCs משקעים טסיות יחד עם נויטרופילים (איור 1D ואיור 2)13,14.
הערה: הכדור צריך להיות לבן עם שכבת RBC מינימלית למעלה, אשר ניתן להסיר בעדינות בזמן supernatant הוא שאיפה. - נויטרופילים resuspend על ידי צנרת מדיום התרבות (10% FBS / RPMI1640) ישירות על הכדור, אבל לא pipette למעלה ולמטה. רוק הצינור אופקית מצד לצד כדי למזער את הפעלת התא.
הערה: תאים צריכים להישמר בריכוז של ~ 2 × 10 6 תאים / מ"ל, כמוצפיפות גבוהה יותר יוביל הפעלת תאים מוגברת / מוות15. מאותה סיבה, כדור התא צריך להיות resuspended בהקדם האפשרי. - אם נצפתה צבירה או גוש של תאים, סנן את ההשעיה של התא באמצעות רשת של 70 מיקרומטר כדי להשליך נויטרופילים מגושמים.
4. קביעת איכות בידוד נויטרופילים
- הכתימו את התאים בסמנים ספציפיים לנויטרופילים (CD66b, CD11b), אאוזינופילים (CD193) (איור 3)וסמן הפעלה כגון CD62L (איור 4). לרכוש 20,000 תאים על ידי ציטומטריית זרימה. נתחו את טוהר התאים ואת ההפעלה באמצעות אסטרטגיות הגטינג המוצעות באיור 3 ובאיור 4.
הערה: ניתן להעריך את איכות הכנת הנויטרופילים באמצעות פתרון כחול חומצה-מתילן 3% אצטית כדי לדמיין את גרעין הלובי הייחודי של נויטרופילים. - קבעו את הכדאיות של התא באמצעות נספח V/propidium יודיד (PI)(איור 5).
הערה: ניתן להשתמש בהכתמה כחולה של טריפן כדי להעריך את הכדאיות של התא.
תוצאות
בעת שימוש בשיפוע צפיפות כדי לטהר נויטרופילים, זה קריטי עבור הממשק בין הדם לבין המדיום הדרגתי צפיפות להיות חד ככל האפשר, וכי הפרדת שכבה נפרדת נשארת לאחר צנטריפוגה (שלב 1.4). לאחר תמה RBC, המאגר צריך להיות אדום ברור ולא עכוז (שלב 3.3). אם ההכנה מעוננת, ייתכן שיידרש סבב תמה שני (שלב 3), אם כי הדבר עשוי להשפיע על הישרדות הנויטרופילים (איור 1). לאחר תמוגה, צנטריפוגה במהירות נמוכה (200 × גרם)מומלץ כאשר טוהר הוא עדיפות, כפי שהוא מפחית זיהום טסיות דם במידה ניכרת. עם זאת, צנטריפוגה במהירות גבוהה (400 × גרם)מגדילה את התשואה על חשבון הטוהר (שלב 3.4, איור 2). לאחר בידוד נויטרופילים, מיון תאים המופעל על ידי פלואורסצנטיות יכול לשמש להערכת טוהר הבידוד (שלב 4.1) ויש לבחור אותו על פני מיקרוסקופיה. למרות שהתפלגות התאים FSC/SSC בלבד מספקת הערכה של איכות בידוד התאים (איור 3A),יש להעדיף את השימוש בסמני תאים ספציפיים. במקרה זה, אוכלוסיות התאים המזהמים הנפוצים ביותר מוכתמים בנוגדנים ספציפיים יחד עם CD66b, המתבטאים במיוחד בגרנולוציטים. כתמי CD45 משמשים להבחנה בין לויקוציטים (CD45+) ותאי דם אדומים וטסיות דם (CD45-).
מזהמים אחרים כוללים לימפוציטים (CD3+ או CD19+, איור 3F), מונוציטים (CD14+, איור 3D)ואאוזינופילים (CD193+, איור 3G). CD11b הוא אינתגרינית המתבטאת בשושלת מיאלואידית; נויטרופילים ומונוציטים הם CD11b+, ואילו לימפוציטים הם CD11b- (איור 3C). כמו הפעלת נויטרופילים יכול להשפיע על ניסויים במורד הזרם, הביטוי של CD62L יש להעריך; נויטרופילים הופכים ל-CD62L- לאחר הפעלתם (שלב 4.1). הפפטיד fMLP יכול לשמש כשליטה חיובית עבור שפיכת CD62L(איור 4). חשוב גם להעריך את הבריאות של נויטרופילים לפני ביצוע מבחנים; לנויטרופילים יש מחצית חיים קצרה יחסית, וההפעלה יכולה לקצר אותו עוד יותר (שלב 4.2). כתמי נספח V ו-PI סטנדרטיים יכולים לתת מידע על המצב החי/מת של תרבות הנויטרופילים בזמנים המיועדים לכך(איור 5).

איור 1:הפרדה בינונית הדרגתית הדרגתית של גרנולוציטים. (A) לפני ו-(B)לאחר צנטריפוגה. שימו לב לממשק החד בין הדם לשכבות הבינוניות המדרגיות של הצפיפות. (ג)משקעים של הכדור ב B resuspended (1:1) ב 5% FBS / HBSS ו 3% Dextran-0.9% NaCl. (D)גלולה PMN לאחר תמוגה של RBCs שיורית בסופרנטנט של (C) עם H2O. קיצורים: PBMC = תא מונונוקלארי דם היקפי; PMN = נויטרופיל; RBC = תא דם אדום; FBS = סרום בקר עוברי; HBSS = פתרון המלח המאוזן של האנק. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: ספינינג במהירויות נמוכות יותר לאחר תמיסת RBC ירד זיהום טסיות דם. לאחר תמותה של RBCs עם H2O, תאים היו סובבו למטה ב 200 × ( A) או 400 × גרם (B). נויטרופילים היו מוכתמים, וניתוח ציטומטריית זרימה בוצע, כמתואר באיור 3, בתוספת של אנטי CD41 כדי לתייג את טסיות הדם. קיצורים: RBC = תא דם אדום; CD41 = אשכול של בידול 41; SSC-A = אזור פיזור צדדי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
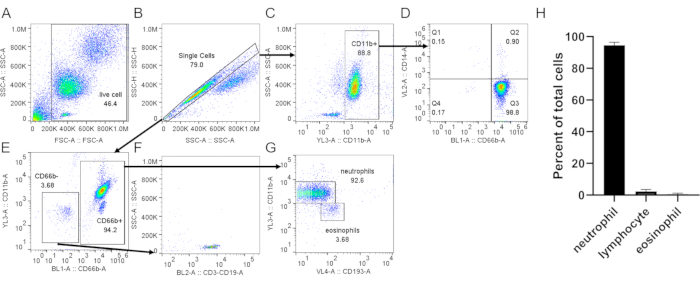
איור 3: הערכת נויטרופילים מבודדים ממעיל באפי. נויטרופילים מבודדים הוכתמו באנטי-CD66b, נגד CD11b, נגד CD14 ואנטי-CD193 בעקבות פרוטוקול סטנדרטי. תאים בודדים (B) היו מגודרים מתוך סך התאים (A). (C)CD11b+ תאים היו מגודרים מתאים בודדים. (D)עלילת נקודות המציגה נויטרופילים (CD66b+, CD14 נמוך/-) וזיהום מונוציט נמוך מאוד (CD66b-, CD14+, Q1). (ה)CD66b- ו- CD66b+ תאים היו מגודרים. (ו)CD66b- תאים היו חיוביים עבור סמני לימפוציטים (CD3, CD19). (G)ביטוי של CD11b ו- CD193 ב- CD66b+ תאים, המציגים אוכלוסיות נויטרופיל נפרד (CD66b+, CD11b+, CD193-) ואאוזינופיל (CD66b+, CD11b-, CD193+) . בתוצאה הייצוגית המוצגת כאן, טוהר נויטרופילים הוא ~ 93% עם ~ 3.7% לימפוציט ו ~ 3.7% זיהום אאוזינופיל. (ח)כימות טוהר הנויטרופילים לאחר הטיהור. הנתונים נאספים מ-5 ניסויים בודדים ומוצגים כממוצע ± SD. קיצורים: CD = אשכול של בידול; SSC-A = SSC-A = אזור פיזור צדדי; FSC-A = אזור פיזור קדימה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: טיהור הדרגתי לא גרם להשיל CD62L. (A-B) בקרה (A) או נויטרופילים מגורה fMLP (B) (1 mM fMLP במשך 15 דקות ב 37 °C) היו מוכתמים בסמני נויטרופילים ו- CD62L. (C)עוצמת הממוצעת פלואורסצנטית עבור CD62L יורדת בתאים שטופלו ב- fMLP, מה שמצביע על שפיכת CD62L והפעלת נויטרופילים. קיצורים: CD26L = L-selectin; fMLP = N-פורמילמתיניל-לאוסיל-פנילאלנין; SSC-A = SSC-A = אזור פיזור צדדי; FSC-A = אזור פיזור קדימה; PE = פיקוריתרין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: מוות ספונטני של נויטרופילים מטוהרים על ידי שיפוע צפיפות או ערכת בידוד נויטרופילים. נויטרופילים טוהרו בשיפוע צפיפות (A ו- B) או חיידקים מסחריים (C ו- D) ותרבו במשך 0 שעות (A ו- C) או 24 שעות (B ו- D) ב- RPMI-10% FCS. תאים הוכתמו באמצעות Annexin V ו- PI בנקודות זמן בהתאמה בעקבות פרוטוקול סטנדרטי. (ה)כימות מוות ספונטני נויטרופילים מטוהרים. n =5, ממוצע ± SD. קיצורים: SSC-A = SSC-A = אזור פיזור צדדי; FSC-A = אזור פיזור קדימה; PI = פרופידיום יודיד; FCS = סרום עגל עוברי; FITC = פלואורסצין איזוטיווציאינט; AV5 = Annexin V. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
בשל תוחלת החיים הקצרה, מצב ההבחנה הסופית והתוכן הטיק של נויטרופילים, לימוד תאים אלה תמיד היה אתגר. מלבד שימוש במודלים של עכבר או תאים מחולים, קווי תאים הם כלים שימושיים כדי לעזור ללמוד ביולוגיה נויטרופיל16. עם זאת, קווי תאים דמויי נויטרופילים אינם יכולים לחזור לחלוטין על כל ההיבטים של ביולוגיה נויטרופילית, הוספת שכבה נוספת של קושי בחקר תאים אלה. מודל במבחנה הנפוץ ביותר הוא קו התא HL-60, אשר ניתן להבדיל לתוך תאים דמויי נויטרופיל על ידי טיפול עם דימתילסולפוקסיד או חומצה רתינואית17,18. למרות תאים אלה שימושיים בחקר הגירה ופרץ נשימתי, הם אינם מתאימים לחקר הפעילות המיקרוביוציטלית של נויטרופילים. קווי תאים אחרים קיימים (PLB-98, NB4), והם קשורים גם עם מערכת המגבלות שלהם19.
זה חיוני כדי לאמת עם תצפיות נויטרופילים אנושיים ראשוניים שנעשו עם מודלים מחלת עכבר וקווי תאים. נויטרופילים לא ניתן להקיע ביעילות ולכן הם לעתים קרובות מבודדים טריים מן הדם שלם או מעילי באפי המתקבלים מתורמים ומעובדים מיד. לאחר בידוד, התאים מתחילים לעבור צורה מורכבת של מוות ספונטני, מוסדר על ידי חמצון, קפסות ציטופלסמיות, ופרוטאזים שנמצאו גרגרי נויטרופילים20,21. שיטות בידוד לא נאותות או טכניקות יכולות להוביל להפעלה של נויטרופילים, רק להאיץ את מות התא. זה הכרחי יש שיטה אמינה ועקבית כדי לקבל נויטרופילים טהורים ואיכותיים מתורמים.
היו שיטות רבות שפורסמו על בידוד נויטרופיליםאנושיים 10,22. הם מתחלקים בעיקר לשתי קטגוריות, עם כמה אסטרטגיות משותפות. הקטגוריה הראשונה היא מבוססת נוגדנים, להיות באמצעות בחירה חיובית או שלילית. בחירה חיובית תסמן נויטרופילים ישירות, ולכן מתן אוכלוסיית תאים טהורה מאוד, אם כי זה גם מוביל להפעלה מהירה של תאים, מוות תאים, כמו גם תיוג לא רצוי של נויטרופילים23. בחירה שלילית, אם כי השארת התאים ללא תווית ונותנת לאוכלוסייה טהורה מאוד, מואצת מוות נויטרופילי, אם כי המנגנון המדויק אינו ידוע (איור 5). אם ביטוי גנים או חלבון משתנה גם לאחר בחירה חיובית או שלילית צריך להיחקר עוד יותר. יתר על כן, בשל כמות הנוגדנים הדרושה כדי לרוקן את סוגי התאים האחרים, שיטות אלה אינן יכולות להפיק כמויות גדולות של נויטרופילים. עם זאת, בדיקות מבוססות נוגדנים עדיין יכולות לשמש לתרבות וניסויים לטווח קצר בקנה מידה קטן יותר והן שיטות בחירה לניסויים הדורשים טוהר תאים גבוה מאוד, כגון מחקרי ביטוי גנים וחלבון.
הסוג השני של שיטת הבידוד הוא מעבר צבע ומבוסס על צפיפות. זה בדרך כלל כרוך פרקול, פיקול-Paque, או אחרים פוליסכריד / רכיבי polyvinylpyrrolidone ומשתמש כוח צנטריפוגה להפריד סוגים שונים של תאי דם בהתבסס על צפיפות התא. שיטות אלה לעתים קרובות משלימות עם משקעים של תאי דם אדומים על ידי dextran. שיטות אלה יכולות להתמודד עם סולמות גדולים יותר של חומר התחלתי ויכולות להשיג גם טוהר גבוה. אזהרה אחת של בידוד מבוסס צפיפות היא הפרדה לא יעילה של גרנולוציטים אחרים הרבה פחות שופעים (בעיקר אאוזינופילים) מנויטרופילים, ולכן, המגבלה העיקרית של הפרוטוקול המוצג, כמו אפילו נוכחות של זיהום תאים קטנים יכול להשפיע על תגובת נויטרופילים24.
מוצג כאן היא שיטה מסוכמת המבוססת על בידוד הדרגתי, עידון שיטות קודמות10,22. אנו משתמשים בלשון המעטה הנוכחית של הספציפיות של נויטרופילים כדי לבודד באופן אמין נויטרופילים אנושיים טהורים עם טסיות דם ו- RBCs שיורית מוגבלים, מניעת הפעלת נויטרופילים ומוות מואץ. השלב המכריע ביותר הוא שכבות של השיפוע, אשר מתקבל הרבה יותר ביעילות על ידי הוספת מדיום שיפוע צפיפות מתחת לדם כדי לקבל ממשק חד. בחינה מהירה של טבעת PBMC והשיפוע לאחר הצנטריפוגה יכולים לחשוף זיהום אפשרי, הפעלה ותשואות נמוכות. כאשר עובדים עם קרום לויקפרזיס או מעיל באפי, דילול הדם חשוב כמו צפיפות תאים מוגזמת יוביל צבירת תאים, המוביל זיהומים והפעלת התא.
פרוטוקול זה צריך להסתיים בתוך 2 שעות כדי להבטיח את טריות התא, וצעדים הכוללים את הצפיפות הדרגתי בינוני, dextran, תמיסת להיעשות באופן מיידי, כמו חשיפה לפתרונות אלה יכול לשנות נויטרופילים. עם פרוטוקול זה, התשואה הצפויה של נויטרופילים היא לפחות ~ 10 מיליון / 10 מ"ל של דם שלם ולפחות ~ 60 מיליון / 10 מ"ל של מעיל באפי. הערכת איכות הבידוד צריכה להיעשות כדלקמן: נויטרופילים מופעלים צריכים להיות פחות מ -10%, זיהום לימפוציטים נמוך מ -5%, אאוזינופיל מינימלי (פיזור צד זהה אך אוכלוסיית פיזור קדמי נמוכה יותר), וכדאיות התא צריכה להיות מעל 90%. טוהר נמוך יותר יכול לנבוע משכבות לא נאותות או אחסון של המדיום המפודמי בצפיפות או בשל האיכות והטריות של מוצר הדם ההתחלתי.
Disclosures
המחברים מצהירים כי המחקר נערך בהיעדר כל ניגוד עניינים.
Acknowledgements
פרויקט זה נתמך על-ידי P01HL095489. A.Y.H נתמך על ידי T32HL066987.
Materials
| Name | Company | Catalog Number | Comments |
| 3% Acetic Acid with Methylene Blue | Stemcell technologies | #07060 | |
| Attune NxT | invitrogen | A24858 | FACS analyzer |
| Cd11b-PE | biolegend | 301305 | |
| CD14-BV421 | biolegend | 367144 | |
| CD193-BV605 | biolegend | 310716 | |
| CD19-PerCP | biolegend | 302228 | |
| CD3-PerCP | biolegend | 300326 | |
| CD41-APC | biolegend | 303710 | |
| Cd45-APC | biolegend | 103111 | |
| CD62L-PE | biolegend | 304802 | |
| CD66b-FITC | biolegend | 305103 | |
| Centrifuge 5810R | Eppendorf | 22625101 | Centrifuge |
| Dextran | Fisher | BP1580 | |
| Fetal Bovine Serum (FBS) | R&D systems | S11150H | complement inactivation of FBS is recommended |
| FITC Annexin V Apoptosis Detection Kit I | BD | 556547 | |
| Hanks balanced salt solution (-CaCl2), (-MgCl2) (-MgSO4) | Gibco | 14175-095 | HBSS without Ca2+/Mg2+ is advised as they have been shown to lead to neutrohpil activation |
| Lymphoprep | Stemcell technologies | #07801 | density gradient medium |
| MACSxpress Whole Blood Neutrophil Isolation Kit, human | Miltenyi | 130-104-434 | |
| RPMI-1640 | Gibco | 11875093 | |
| Sodium chloride | sigma | 71376 | |
| Trypan Blue Solution, 0.4% | Thermofisher | 15250061 | |
| ultrapure water | KD medical | RGF-3410 |
References
- Rosales, C. Neutrophil: A cell with many roles in inflammation or several cell types. Frontiers in Physiology. 9, 113 (2018).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Stoller, J. K. Murray & Nadel's textbook of respiratory medicine, 6th edition. Annals of the American Thoracic Society. 12 (8), 1257-1258 (2015).
- Dancey, J. T., Deubelbeiss, K. A., Harker, L. A., Finch, C. A. Neutrophil kinetics in man. Journal of Clinical Investigation. 58 (3), 705-715 (1976).
- Manz, M. G., Boettcher, S. Emergency granulopoiesis. Nature Reviews. Immunology. 14 (5), 302-314 (2014).
- Summers, C., et al. Neutrophil kinetics in health and disease. Trends in Immunology. 31 (8), 318-324 (2010).
- Pedruzzi, E., Fay, M., Elbim, C., Gaudry, M., Gougerot-Pocidalo, M. A. Differentiation of PLB-985 myeloid cells into mature neutrophils, shown by degranulation of terminally differentiated compartments in response to N-formyl peptide and priming of superoxide anion production by granulocyte-macrophage colony-stimulating factor. British Journal of Haematology. 117 (3), 719-726 (2002).
- Tucker, K. A., Lilly, M. B., Heck, L., Rado, T. A. Characterization of a new human-diploid myeloid-leukemia cell-line (Plb-985) with granulocytic and monocytic differentiating capacity. Blood. 70 (2), 372-378 (1987).
- Hsu, A. Y., et al. Inducible overexpression of zebrafish microRNA-722 suppresses chemotaxis of human neutrophil like cells. Molecular Immunology. 112, 206-214 (2019).
- Kremserova, S., Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 2087, 33-42 (2020).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunological Research. 2017, 1254792 (2017).
- Thorson, L. M., Turkalj, A., Hung, J. C. In vitro evaluation of neutrophil viability after exposure to a hypotonic medium. Nuclear Medicine Communications. 16 (7), 615-620 (1995).
- Dhurat, R., Sukesh, M. Principles and methods of preparation of platelet-rich plasma: a review and author's perspective. Journal of Cutaneous and Aesthetetic Surgery. 7 (4), 189-197 (2014).
- Etulain, J., et al. An optimised protocol for platelet-rich plasma preparation to improve its angiogenic and regenerative properties. Scientific Reports. 8 (1), 1513 (2018).
- Hannah, S., et al. Constitutive neutrophil apoptosis in culture is modulated by cell density independently of beta2 integrin-mediated adhesion. FEBS Letters. 421 (2), 141-146 (1998).
- Hsu, A. Y., et al. Phenotypical microRNA screen reveals a noncanonical role of CDK2 in regulating neutrophil migration. Proceedings of the National Acadermy of Sciences of the United States of America. 116 (37), 18561-18570 (2019).
- Martin, S. J., Bradley, J. G., Cotter, T. G. HL-60 cells induced to differentiate towards neutrophils subsequently die via apoptosis. Clinical and Experimental Immunology. 79 (3), 448-453 (1990).
- Hauert, A. B., Martinelli, S., Marone, C., Niggli, V. Differentiated HL-60 cells are a valid model system for the analysis of human neutrophil migration and chemotaxis. International Journal of Biochemistry and Cell Biology. 34 (7), 838-854 (2002).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: Cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Kambara, H., et al. Gasdermin D exerts anti-inflammatory effects by promoting neutrophil death. Cell Reports. 22 (11), 2924-2936 (2018).
- Loison, F., et al. Proteinase 3-dependent caspase-3 cleavage modulates neutrophil death and inflammation. Journal of Clinical Investigation. 124 (10), 4445-4458 (2014).
- Siemsen, D. W., et al. Neutrophil isolation from nonhuman species. Methods in Molecular Biology. 1124, 19-37 (2014).
- Hasenberg, M., et al. Rapid immunomagnetic negative enrichment of neutrophil granulocytes from murine bone marrow for functional studies in vitro and in vivo. PLoS One. 6 (2), 17314 (2011).
- Calzetti, F., Tamassia, N., Arruda-Silva, F., Gasperini, S., Cassatella, M. A. The importance of being "pure" neutrophils. Journal of Allergy and Clinical Immunology. 139 (1), 352-355 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved