Method Article
전신 혈액과 버피 코트에서 인간의 호중구의 격리
요약
이 프로토콜은 전혈, 버피 코트 또는 백혈구 막에서 호중구를 분리하여 좋은 수율, 높은 순도 및 최소한의 세포 활성화를 달성하는 방법을 자세히 설명합니다. 그라데이션 정제, 적혈구(RBC) 퇴적물 및 RBC 용액을 활용하여 고품질/순도 호중구 제제를 획득합니다.
초록
중성구 (PMN)는 전체 혈액 백혈구의 40에서 70 %에 이르는 인간의 순환에서 가장 풍부한 백혈구입니다. 그(것)들은 혈관을 통해 급속한 사치를 통해 염증의 사이트에 모집된 첫번째 세포입니다. 그곳에서 호중구는 침입하는 병원체를 죽이고 면역 신호를 중재하는 일련의 기능을 수행합니다. 인간의 혈액에서 갓 정제 된 호중구는 연구 선택의 모델입니다, 어떤 세포주 완전히 PMN 기능 및 생물학을 복제로. 그러나, 호중구는 단명하고, 말단 분화세포이고 물리적(온도, 원심분리 속도) 및 생물학적(내독신, 화학요법 및 사이토카인) 자극에 반응하여 활성화에 매우 취약하다. 따라서 순수하고 활성화되지 않은 세포를 얻기 위해 표준화되고 신뢰할 수 있으며 빠른 방법을 따르는 것이 중요합니다. 이 프로토콜은 높은 PMN 순도를 얻고 세포 활성화를 최소화하기 위해 밀도 그라데이션 원심 분리, 적혈구 (RBC) 침전 및 RBC 용액을 결합한 업데이트 된 프로토콜을 제시합니다. 또한 호중구 절연 품질, 생존 가능성 및 순도를 평가하는 방법도 논의됩니다.
서문
타고난 면역 계통은 많은 그밖 생리적인 기능과 더불어 면역 항상성 및 병원체 정리를 유지하는 많은 세포 모형으로 이루어져 있습니다. 호중구는 인간 순환1에서백혈구의 가장 큰 풀을 포함한다. 대부분의 성숙한 호중구는 골수에 저장됩니다, 이는 새로운 호중구에 대한 세대의 사이트입니다, 또한 과립이라고. 골수에서, 과립구 전구는 세포 주기를 종료하고 말단 분화, 그들의 특징적인 분할된 핵및 과립2를취득합니다. 염증 성 조건하에서, 화학, 사이토카인 및 손상 관련 및 병원체 관련 분자 패턴에 반응하여, 호중구는 혈류량에서 골수 밖으로 동원되어 다양한 기능을 수행합니다. 이들은 세포사포인 분비, 병원체의 직접 phagocytosis, 반응성 산소 종의 방출, 항균 단백질의 분해, 호중구 세포 외 함정의 형성을 포함합니다.
감염을 싸우기 위하여 호중구에 의해 이용된 분자는 세균및 호스트에 유독합니다. 따라서, 수명과 노화/죽어가는 호중구의 적절한 제거는 매우 조절되며, 순환(<48h)3에서수명이 제한되어 있다. 이 짧은 생존으로 인해 인체는 인구 항상성을 유지하기 위해 매일 평균 1,000 억 개의 새로운 호중구를 생산합니다4. 응급 과립은 염증 및 감염 중 혈액에서 성숙하고 미숙한 호중구의 방출을 더욱 증가시킬 수있습니다 5. 타고난 면역 반응에서 호중구의 중요성은 세균성 및 곰팡이 감염에 영향을 받기 쉬운 획득 또는 선천성 호중구 감소증 환자에 의해 강조된다6.
호중구 생물학을 공부할 때 많은 도전이 발생하고 그들의 짧은 생존과 세포 독성 콘텐츠를 포함하여 그들의 성격 때문에 면역 반응에 있는 그들의 역할. 호중구와 같은 세포주들은 일반적으로 인간 대골세포 백혈병 HL-60 세포 및 PLB-985 세포7,8로부터분화되었다. 호중구와 같은 형태를 보이고 화학 요법을 수행 할 수 있지만, 이러한 세포주는 호중구의 생물학을 완전히 재구성 할 수 없습니다. 이러한 세포주를 이용한 체외 분석체는 생체 내 실험을 재구성할 수 없습니다. 더욱이, 이 세포의 분화는 유도될 필요가 있고 분화의 앞에 유전자 조작에 의해 불리하게 영향을 받을 수 있었습니다.
최근에는 HL-60세포에서유전자 발현 후 분화를 조절하기 위해 유도성 프로모터를 사용하여 이러한 문제를 회피하는 방법이 개발되었다. 이러한 도구에서도 1차 인간 PMN은 약리학적 접근법을 사용하여 표적을 검증해야 합니다. 따라서, 세포주 및 동물 모델의 결과를 검증하기 위해 혈액으로부터 분리된 순수하고 불활성화된 호중구를 얻는 것이 필수적이다. 이 백서는 현재 방법의 장단점을 평가한 개정된 PMN 격리 프로토콜을10을제시한다. 조합은 다른 면역 세포로부터 PMN을 분리하기 위해 그라데이션 원심분리, RbC의 대량을 제거하기 위한 짧은 디엑스트라른 기반 침전, 삼투압을 통한 급속한 잔류 RBC 용해, 혈소판 오염을 제거하기 위한 저속 원심분리로 구성된 조합으로 고안되었다.
프로토콜
참고: 인간 호중구는 보스턴 아동 병원의 혈액 은행 연구소에서 얻은 버려진 백혈구 필터에서 정맥 혈액에서 격리되었습니다. 혈액 기증자는 식별할 수 없었고, 살아있는 개인과의 상호 작용이나 식별 할 수없는 개인 정보에 대한 지식이 없었습니다. 따라서, 이 작품은 HHS 인간 과목 규정 (45 CFR Part 46)에 따라 인간 과목 연구로 분류되지 않습니다. 보스턴 아동 병원 기관 검토 위원회 (IRB) 프로토콜을 승인.
1. 그라데이션 레이어링
- 버피 코트 또는 전혈 포장 및 라미나르 후드를 살균 한 후 혈액을 각 튜브에 10 mL의 혈액으로 50 mL 튜브로 나눕니다.
- 5% 태아 소 세럼(FBS)/행크의 균형 잡힌 소금 용액(HBSS)으로 최대 35mL의 부피를 가져와 더 깨끗한 그라데이션의 혈액을 희석시 보세요.
참고: 백혈구막을 사용하는 경우, 세포는 필터 당 60mL 주사기와 30mL의 5% FBS/HBSS를 사용하여 플러시될 수 있다. 희석은 갓 그려진 전혈으로 작업 할 때 불필요합니다. - 50mL 튜브 뚜껑을 닫고 반전으로 여러 번 섞어 거꾸로 하여 RBC가 없는 바닥을 유지합니다.
- 혈액 바로 아래에 밀도 그라데이션 배지 10mL를 추가합니다(재료 표참조). 매체와 혈액이 섞이지 않고 인터페이스가 선명한지 확인합니다(도1A).
참고: 이 단계는 매우 중요합니다. 밀도 그라데이션 솔루션이 실온(RT)에 있고 각 그라데이션 전에 잘 혼합되어 있는지 확인합니다. 밀도 그라데이션 매체의 첫 번째 밀리리터는 가능한 한 천천히 신중하게 꾸준히 계층화되어야 합니다. 전자 파이펫 속도를 낮게 설정하는 것이 좋습니다. - 튜브를 원심분리기에 부드럽게 놓고 그라데이션을 방해하지 않고 400 × g에서 30분 동안 회전하여 브레이크를 비활성화합니다. 스펀 그라데이션이 상부 혈청/플라즈마 층, 말초 혈액 단일핵 세포의 중간 백색 고리(PBMC), 흐린 밀도 그라데이션 중간 층 및 RbC 의 상단에 흰색, 얇은 호중구 대역으로 구성된 바닥 펠릿(도1B)으로분리되는 방법을 관찰한다.
참고: 원심분리 후 튜브의 흐리거나 불투명한 면은 세포(neutrophils)가 활성화되어 있고 사용하기에 적합하지 않을 수 있음을 시사할 수 있다. - 흡입 파이펫을 PBMC 층으로 직접 등장하여 먼저 PBMC를 제거하십시오. 링이 제거될 때 혈청/플라즈마 층이 감소하는 동안 완전히 흡인하십시오. PMBC의 제거를 최대화하기 위해 흡입 파이펫으로 흡입된 세포가 있는 튜브의 측면을 긁어냅니다. PBMC 링과 호중구/RBC 펠릿 사이의 흐린 밀도 그라데이션 중간 층을 조심스럽게 제거합니다.
참고: 튜브 측면에 있는 펠릿 세포를 긁어내어 격리의 순도가 상당히 증가합니다. 대부분의 호중구가 RbC 의 상단에 직접 앉아 있기 때문에 펠릿을 흡인하지 않도록주의하십시오.
2. 적혈구의 퇴적물 (RbC)
- 10mL 파이펫을 사용하여 호중구/RBC 펠릿을 깨끗한 튜브로 옮킨다. 위아래로 파이펫하지 마십시오. 25mL의 최종 볼륨에 5 %의 FBS / HBSS를 추가합니다. 반전으로 부드럽게 섞으세요.
참고: PBMC 제거 후 RBC 침전을 수행하면 수율이 향상되고 활성화10이감소합니다. - 직접 25mL의 예열(37°C) 3% Dextran/0.9% NaCl/H2O를 희석된 호중구/RBC 펠릿을 함유한 튜브에 넣고 반전으로 부드럽게 섞는다. 튜브를 15분 동안 진동하지 않는 표면에 놓습니다(그림1C).
참고: 퇴적량이 길어지면 RBC 오염이 감소하지만 수율도 감소합니다. 더욱이, 장기간 의 노출은 호중구 활성화 또는 세포사멸(11)으로이어질 수 있다. - 튜브를 후드에 부드럽게 다시 넣습니다(멸균 격리용). 액체에 피펫을 약간 담그면 액체 표면 을 아래쪽으로 따라 상단 층 (~30 mL)을 수집합니다.
참고: 퇴적물시 매체와 RBC 사이의 날카로운 인터페이스를 생성하는 경우 RBC 펠릿은 작거나 더 높은 수율이 원하는 경우 최대 35mL를 수집합니다. - 튜브(400 × g,10분, RT를 낮은 브레이크(3)를 사용하여 회전하면 미디어에 입자가 없는 빨간 펠릿이 생성됩니다.
3. 잔류 RBC의 라이시스
- 펠릿을 방해하지 않고 슈퍼네티드를 부드럽게 흡인시합니다.
- 25mL의 멸균 초순수물을 튜브에 직접 넣고 28초로 반칭하여 반각물을 반초로 가볍게 섞는다. 페펫을 사용하여 펠릿을 다시 사용하지 마십시오.
참고: 장기간 된 저혈압 조건이 활성화되어 호중구사망12로이어질 수 있기 때문에 30 을 초과하지 마십시오. - 즉시 멸균 1.8 % NaCl / H2O의 25 mL을 튜브에 넣고 용액을 동상 상태로 되돌리면 부드럽게 섞습니다.
참고: 솔루션은 빨간색이어야 하지만 탁도가 없어야 합니다. - 200 × g에서 3-5분 동안 낮은 브레이크(레벨 3)로 스핀다운하여 호중구(그림1D 및 도 2)13,14와함께 RBC 및 혈소판 침전을 최소화한다.
참고: 펠릿은 상단에 최소한의 RBC 층이 있는 흰색이어야 하며, 이는 슈퍼나탄이 흡인되는 동안 부드럽게 제거할 수 있습니다. - 배양 배지(10% FBS/RPMI1640)를 펠릿에 직접 파이펫팅하여 호중구를 재차 중단하지만, 위아래로 파이펫을 하지는 않는다. 튜브를 좌우로 가로로 흔들어 세포 활성화를 최소화합니다.
참고: 세포는 106 세포/mL ×의 농도에서 유지되어야 하며, 이는 더 높은 밀도로 세포 활성화/사망15로이어질 것이다. 같은 이유로, 세포 펠릿 가능한 한 빨리 다시 중단 해야. - 세포 응집 또는 응집이 관찰되는 경우, 70 μm 메쉬를 사용하여 세포 현탁액을 필터링하여 응집된 호중구를 폐기한다.
4. 호중구 절연 품질 결정
- 호중구(CD66b, CD11b), 호산구(CD193)(도 3)및 CD62L(도4)과같은 활성화 마커에 특이적인 마커를 가진 세포를 염색한다. 유동 세포측정에 의해 20,000개의 세포를 획득한다. 도 3 및 도 4에 제안된 게이팅 전략을 사용하여 세포 순도 및 활성화를 분석한다.
참고: 호중구 제제의 품질은 호중구의 독특한 로브 핵을 시각화하기 위해 3% 아세트산 메틸렌 블루 용액을 사용하여 평가할 수 있습니다. - 부속서 V/프로피듐 요오드(PI)를 사용하여 세포 생존가능성을 결정한다(도5).
참고: 트라이판 블루 염색을 사용하여 셀 생존 가능성을 평가할 수 있습니다.
결과
밀도 그라데이션을 사용하여 호중구를 정화할 때, 혈액과 밀도 그라데이션 배지 사이의 인터페이스가 가능한 한 날카롭고, 원심 분리 후 뚜렷한 층 분리가 남아 있는 것이 중요합니다(단계 1.4). RBC lysis에 따라 버퍼는 탁선이 아닌 선명한 빨간색이어야 합니다(3.3단계). 준비가 흐린 경우, 두 번째 리시스(3단계)가 필요할 수 있지만 호중구 생존에 영향을 미칠 수있다(도 1). 용해에 이어, 저속 원심분리(200 × g)는혈소판 오염을 상당히 감소시키기 때문에 순도가 우선순위를 정할 때 권장됩니다. 그러나 고속 원심분리(400×g)는 순도(3.4, 도 2)를희생하여 수율을 증가시킨다. 호중구 절연 후, 형광 활성화 세포 분류는 절연 순도 (단계 4.1)를 평가하는 데 사용할 수 있으며 현미경 검사법을 통해 선택되어야합니다. 세포의 FSC/SSC 분포만으로는 세포 격리품질(도 3A)의추정을 제공하지만, 특정 세포 마커의 사용이 바람직하다. 이 경우, 가장 흔한 오염 세포 집단은 특히 과립구에 표현된 CD66b와 함께 특정 항체로 염색된다. CD45 염색은 백혈구(CD45+) 및 적혈구 및 혈소판(CD45-)을 구별하는 데 사용됩니다.
다른 오염 물질에는 림프구 (CD3+ 또는 CD19 +, 그림 3F),단핵구 (CD14+, 그림 3D),호산구 (CD193+, 그림 3G)가포함됩니다. CD11b는 골수성 계보상계에 발현된 통합체계; 호중구와 단핵구는 CD11b+이고 림프구는 CD11b-(도3C)이다. 호중구 활성화가 다운스트림 실험에 영향을 줄 수 있기 때문에 CD62L의 발현을 평가해야 합니다. 호중구는 CD62L이 된다- 한 번 활성화 (단계 4.1). 펩타이드 fMLP는 CD62L 흘리기(도4)에대한 양수 제어로 사용될 수 있다. 또한 에세이를 수행하기 전에 호중구의 건강을 평가하는 것이 중요합니다. 호중구는 비교적 짧은 반감기를 가지고 있으며, 활성화는 더 단축 할 수 있습니다 (단계 4.2). 표준 부속서 V 및 PI 염색은 지정된 시간에 호중구 문화의 라이브 /죽은 상태에 대한 정보를 제공 할 수 있습니다(도 5).

그림 1: 밀도 그라데이션 중간 계 분리와 과립구. (A)원심 분리 후(B) 혈액과 밀도 그라데이션 중간 층 사이의 선명한 인터페이스를 유의하십시오. (C) B에서 펠릿의 퇴적물 (1:1) 5% FBS/HBSS 및 3% Dextran-0.9% NaCl. (D)PmN 펠릿의 잔류 RbC의 용액 후(C)의 상체에 H2O. 약어: PBMC = 말초 혈액 단핵 세포; PMN = 호중구; RBC = 적혈구; FBS = 태아 소 혈청; HBSS = 행크의 균형 잡힌 소금 솔루션. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: RBC 리시스가 혈소판 오염을 감소 한 후 낮은 속도로 회전. H2O를 가진 RbC의 용해 후, 세포는 200 × g (A)또는 400 × g (B)로아래로 분사하였다. 호중구는 염색되었고, 혈소판에 라벨을 붙이는 항 CD41을 첨가하여 도 3에설명된 바와 같이, 유동 세포측정 분석을 수행했다. 약어: RBC = 적혈구; CD41 = 분화(41)의 클러스터; SSC-A = 측면 분산 영역. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
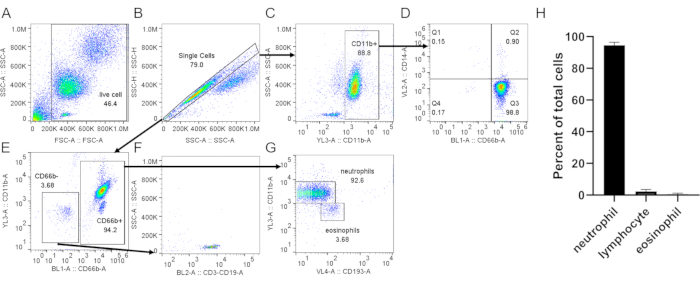
그림 3: 버피 코트에서 분리 된 호중구의 평가. 격리된 호중구는 표준 프로토콜에 따라 안티 CD66b, 안티 CD11b, 안티 CD14 및 안티 CD193로 염색되었다. 단일세포(B)는총세포(A)로부터문이 되었다. (C)CD11b+ 세포는 단일 세포로부터 문이 되었다. (D)호중구 (CD66b+, CD14 로우 /-) 및 매우 낮은 단세포 오염 (CD66b-,CD14+, Q1)을 보여주는 도트 플롯. (E)CD66b- 및 CD66b+ 세포가 문이 있었다. (F)CD66b- 세포는 림프구 마커(CD3, CD19)에 대해 양성이었다. (G)CD66b+ 세포에서 CD11b 및 CD193의 발현, 뚜렷한 호중구(CD66b+,CD11b+CD193-)및 호산구(CD66b+CD111b-CD193+)집단을 나타냈다. 여기에 나타난 대표적인 결과에서 호중구 순도는 ~3.7% 림프구와 ~3.7%의 호산구 오염으로 ~93%이다. (H)정화 후 호중구 순도의 정량화. 데이터는 5개의 개별 시험에서 컴파일되고 평균 ± SD. 약어로 제시됩니다: CD = 차별화 클러스터; SSC-A = SSC-A = 측면 분산 영역; FSC-A = 전방 분산 영역. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: 그라데이션 정제는 CD62L 흘리기를 일으키지 않았다. (A-B)제어(A)또는 fMLP 자극 호중구(B)(1 mMM fMLP 37 °C에서 15 분) 호중구 마커 및 CD62L로 염색하였다. (C)CD62L에 대한 형광 평균 강도는 fMLP 처리 된 세포에서 감소하며 CD62L 흘리기 및 호중구 활성화를 나타냅니다. 약어: CD26L = L-셀렉틴; fMLP = N-Formylmethionyl-leucyl-phenylanine; SSC-A = SSC-A = 측면 분산 영역; FSC-A = 전방 산란 영역; PE = 피코에리스린. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 밀도 그라데이션 또는 호중구 격리 키트에 의해 정제 된 호중구의 자발적인 죽음. 호중구는 밀도 그라데이션(A 및 B)또는 상업용 마이크로비드(C 및 D)로정제되었고 RPMI-10% FCS에서 0h(A 및 C)또는 24h(B 및 D)를배양하였다. 세포는 표준 프로토콜에 따라 각 시점에서 부속서 V 및 PI를 사용하여 염색하였다. (E)정화된 호중구 자발적 사망의 정량화. n=5, 평균 ± SD. 약어: SSC-A = SSC-A = 측면 산란 영역; FSC-A = 전방 산란 영역; PI = 요오드 프로피듐; FCS = 태아 종아리 혈청; FITC = 형광석 이소토시아네이트; AV5 = 부속서 V. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
짧은 수명, 말기 분화 상태 및 호중구의 lytic 내용으로 인해 이러한 세포를 공부하는 것은 항상 도전이었습니다. 환자 코호트에서 마우스 모델 이나 세포를 활용 에서 떨어져, 세포주 호중구 생물학 을 연구 하는 데 도움이 유용한도구(16). 그러나, 호중구 같이 세포주 완전히 호중구 생물학의 모든 양상을 반복할 수 없습니다, 이 세포를 공부에 있는 어려움의 추가 층을 추가합니다. 시험관 내 가장 일반적으로 사용되는 것은 HL-60 세포주이며, 이는 디메틸설프리산 또는 망막산(17,18)을사용한 처리에 의해 호중구와 같은 세포로 분화될 수 있다. 이 세포는 이주와 호흡 버스트의 연구 결과에 유용하더라도, 호중구의 미생물 활성을 공부하기에 적합하지 않습니다. 다른 세포주 존재 (PLB-98, NB4), 그들은 또한 제한의 그들의 세트와 연관19.
마우스 질병 모델 및 세포주로 만든 1 차적인 인간 호중구 관측으로 검증하는 것은 중추적인 입니다. 호중구는 효율적으로 냉동 보존 될 수 없으므로 기증자로부터 얻은 전혈 이나 버피 코트에서 갓 분리되어 즉시 처리됩니다. 일단 고립되면, 세포는 호중구 과립20,21에서찾아낸 산화, 세포질 카스파스 및 프로테아제에 의해 통제되는 자발적인 죽음의 복잡한 양식을 겪기 시작합니다. 부적절한 격리 방법 이나 기술은 호중구의 활성화로 이어질 수 있습니다., 만 세포 죽음을 가속화. 기증자로부터 순수하고 고품질의 호중구를 얻기 위해 신뢰할 수 있고 일관된 방법을 갖는 것이 필수적입니다.
인간 호중구 절연10,22에간행된 많은 방법이 있었습니다. 그들은 주로 몇 가지 공유 전략과 두 가지 범주로 나뉩니다. 첫 번째 범주는 항체 기반이며 긍정적 이거나 부정적인 선택을 통해 서 있습니다. 긍정적인 선택은 호중구를 직접 표지할 것이고, 따라서 고도로 순수한 세포 집단을 제공하겠지만, 또한 급속한 세포 활성화, 세포 사멸, 뿐만 아니라 호중구의 원치 않는태깅(23)로이어진다. 음의 선택은, 세포표지를 남기지 않고 아주 순수한 인구를 주는 그러나, 정확한 기계장치가 알려지지 않더라도, 가속한 호중구 죽음(그림 5). 유전자 또는 단백질 발현이 또한 긍정적 또는 부정적인 선택 후에 변경되는지 여부는 추가 조사될 필요가 있습니다. 더욱이, 세포의 다른 모형을 고갈하는 데 필요한 항체의 양 때문에, 이 방법은 호중구의 다량을 출력할 수 없습니다. 그러나, 항체 기반 의 소법은 여전히 더 작은 규모에 단기 배양 및 실험에 사용될 수 있고 유전자 및 단백질 발현 연구와 같은 매우 높은 세포 순도를 요구하는 실험을 위한 선택의 방법입니다.
두 번째 유형의 격리 방법은 그라데이션 및 밀도 기반입니다. 그것은 일반적으로 퍼콜을 포함, Ficoll-Paque, 또는 다른 polysaccharide/polyvinylpyrrolidone 구성 요소를 포함 하 고 세포 밀도에 따라 혈액 세포의 다른 유형을 분리 하는 원심 분리 힘을 활용. 이 방법은 수시로 dextran에 의하여 적혈구의 퇴적물로 보완됩니다. 이러한 방법은 시작 재료의 더 큰 스케일을 처리할 수 있으며 높은 순도를 달성할 수 있습니다. 밀도 기반 절연의 한 주의 사항은 호중구로부터 다른 훨씬 덜 풍부한 과립구(주로 호산구)의 비효율적인 분리이며, 따라서, 작은 세포 오염의 존재도 호중구반응(24)에영향을 미칠 수 있기 때문에 제시된 프로토콜의 주요 한계이다.
여기에 제시된 그라데이션 격리를 기반으로 한 요약된 메서드로, 이전메서드(10,22)를정제한다. 우리는 호중구 특이성의 현재 과소 평가하여 제한된 잔류 혈소판 및 RBC로 순수 한 인간 호중구를 안정적으로 분리하여 호중구 활성화 및 가속 된 사망을 방지합니다. 가장 중요한 단계는 기울기의 층화이며, 이는 날카로운 인터페이스를 얻기 위해 혈액 아래에 밀도 그라데이션 배지를 추가하여 훨씬 더 효과적으로 얻을 수 있습니다. PBMC 링과 원심분리 후그라데이션을 신속하게 검사하면 오염, 활성화 및 낮은 수율을 나타낼 수 있습니다. 백혈구 막 또는 버피 코트로 작업할 때 과도한 세포 밀도가 세포 응집으로 이어지어 불순물 및 세포 활성화로 이어질 수 있기 때문에 혈액희석이 중요합니다.
이 프로토콜은 세포 신선도를 보장하기 위해 2시간 이내에 완료되어야 하며, 이러한 솔루션에 노출되면 호중구를 변경할 수 있기 때문에 밀도 그라데이션 배지, dextran 및 lysis와 관련된 단계가 즉시 수행되어야 합니다. 이 프로토콜을 사용하면 호중구의 예상 수율은 적어도 ~ 1,000만/10mL의 전혈과 버피 코트의 최소 ~6,000만/10mL입니다. 격리 품질의 평가는 다음과 같이 수행해야합니다 : 활성화 된 호중구는 10 % 미만이어야하며, 림프구 오염은 5 % 미만이어야하며, 최소 호산구 (같은 측면 산란하지만 전방 산란 인구가 낮음), 세포 생존 가능성은 90 % 이상이어야합니다. 순도가 낮으면 밀도 그라데이션 매체의 부적절한 층동이나 저장 또는 시작 혈액 제품의 품질 및 신선도로 인해 발생할 수 있습니다.
공개
저자는 연구가 이해 상충이없는 상태에서 수행되었다고 선언합니다.
감사의 말
이 프로젝트는 P01HL095489에 의해 지원되었습니다. A.Y.H는 T32HL066987의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 3% Acetic Acid with Methylene Blue | Stemcell technologies | #07060 | |
| Attune NxT | invitrogen | A24858 | FACS analyzer |
| Cd11b-PE | biolegend | 301305 | |
| CD14-BV421 | biolegend | 367144 | |
| CD193-BV605 | biolegend | 310716 | |
| CD19-PerCP | biolegend | 302228 | |
| CD3-PerCP | biolegend | 300326 | |
| CD41-APC | biolegend | 303710 | |
| Cd45-APC | biolegend | 103111 | |
| CD62L-PE | biolegend | 304802 | |
| CD66b-FITC | biolegend | 305103 | |
| Centrifuge 5810R | Eppendorf | 22625101 | Centrifuge |
| Dextran | Fisher | BP1580 | |
| Fetal Bovine Serum (FBS) | R&D systems | S11150H | complement inactivation of FBS is recommended |
| FITC Annexin V Apoptosis Detection Kit I | BD | 556547 | |
| Hanks balanced salt solution (-CaCl2), (-MgCl2) (-MgSO4) | Gibco | 14175-095 | HBSS without Ca2+/Mg2+ is advised as they have been shown to lead to neutrohpil activation |
| Lymphoprep | Stemcell technologies | #07801 | density gradient medium |
| MACSxpress Whole Blood Neutrophil Isolation Kit, human | Miltenyi | 130-104-434 | |
| RPMI-1640 | Gibco | 11875093 | |
| Sodium chloride | sigma | 71376 | |
| Trypan Blue Solution, 0.4% | Thermofisher | 15250061 | |
| ultrapure water | KD medical | RGF-3410 |
참고문헌
- Rosales, C. Neutrophil: A cell with many roles in inflammation or several cell types. Frontiers in Physiology. 9, 113 (2018).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Stoller, J. K. Murray & Nadel's textbook of respiratory medicine, 6th edition. Annals of the American Thoracic Society. 12 (8), 1257-1258 (2015).
- Dancey, J. T., Deubelbeiss, K. A., Harker, L. A., Finch, C. A. Neutrophil kinetics in man. Journal of Clinical Investigation. 58 (3), 705-715 (1976).
- Manz, M. G., Boettcher, S. Emergency granulopoiesis. Nature Reviews. Immunology. 14 (5), 302-314 (2014).
- Summers, C., et al. Neutrophil kinetics in health and disease. Trends in Immunology. 31 (8), 318-324 (2010).
- Pedruzzi, E., Fay, M., Elbim, C., Gaudry, M., Gougerot-Pocidalo, M. A. Differentiation of PLB-985 myeloid cells into mature neutrophils, shown by degranulation of terminally differentiated compartments in response to N-formyl peptide and priming of superoxide anion production by granulocyte-macrophage colony-stimulating factor. British Journal of Haematology. 117 (3), 719-726 (2002).
- Tucker, K. A., Lilly, M. B., Heck, L., Rado, T. A. Characterization of a new human-diploid myeloid-leukemia cell-line (Plb-985) with granulocytic and monocytic differentiating capacity. Blood. 70 (2), 372-378 (1987).
- Hsu, A. Y., et al. Inducible overexpression of zebrafish microRNA-722 suppresses chemotaxis of human neutrophil like cells. Molecular Immunology. 112, 206-214 (2019).
- Kremserova, S., Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 2087, 33-42 (2020).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunological Research. 2017, 1254792 (2017).
- Thorson, L. M., Turkalj, A., Hung, J. C. In vitro evaluation of neutrophil viability after exposure to a hypotonic medium. Nuclear Medicine Communications. 16 (7), 615-620 (1995).
- Dhurat, R., Sukesh, M. Principles and methods of preparation of platelet-rich plasma: a review and author's perspective. Journal of Cutaneous and Aesthetetic Surgery. 7 (4), 189-197 (2014).
- Etulain, J., et al. An optimised protocol for platelet-rich plasma preparation to improve its angiogenic and regenerative properties. Scientific Reports. 8 (1), 1513 (2018).
- Hannah, S., et al. Constitutive neutrophil apoptosis in culture is modulated by cell density independently of beta2 integrin-mediated adhesion. FEBS Letters. 421 (2), 141-146 (1998).
- Hsu, A. Y., et al. Phenotypical microRNA screen reveals a noncanonical role of CDK2 in regulating neutrophil migration. Proceedings of the National Acadermy of Sciences of the United States of America. 116 (37), 18561-18570 (2019).
- Martin, S. J., Bradley, J. G., Cotter, T. G. HL-60 cells induced to differentiate towards neutrophils subsequently die via apoptosis. Clinical and Experimental Immunology. 79 (3), 448-453 (1990).
- Hauert, A. B., Martinelli, S., Marone, C., Niggli, V. Differentiated HL-60 cells are a valid model system for the analysis of human neutrophil migration and chemotaxis. International Journal of Biochemistry and Cell Biology. 34 (7), 838-854 (2002).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: Cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Kambara, H., et al. Gasdermin D exerts anti-inflammatory effects by promoting neutrophil death. Cell Reports. 22 (11), 2924-2936 (2018).
- Loison, F., et al. Proteinase 3-dependent caspase-3 cleavage modulates neutrophil death and inflammation. Journal of Clinical Investigation. 124 (10), 4445-4458 (2014).
- Siemsen, D. W., et al. Neutrophil isolation from nonhuman species. Methods in Molecular Biology. 1124, 19-37 (2014).
- Hasenberg, M., et al. Rapid immunomagnetic negative enrichment of neutrophil granulocytes from murine bone marrow for functional studies in vitro and in vivo. PLoS One. 6 (2), 17314 (2011).
- Calzetti, F., Tamassia, N., Arruda-Silva, F., Gasperini, S., Cassatella, M. A. The importance of being "pure" neutrophils. Journal of Allergy and Clinical Immunology. 139 (1), 352-355 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유