Method Article
Выделение нейтрофилов человека из цельной крови и пальто Баффи
В этой статье
Резюме
Этот протокол подробно описывает метод выделения нейтрофилов из цельной крови, пухлых шерсти или мембран лейкафереза, достигая хорошего выхода, высокой чистоты и минимальной активации клеток. Мы используем градиентную очистку, осаждение эритроцитов (RBC) и лизис RBC для получения высококачественного / чистого нейтрофильного препарата.
Аннотация
Нейтрофилы (ПМН) являются наиболее распространенными лейкоцитами в кровообращении человека, варьирующимися от 40 до 70% от общего количества лейкоцитов крови. Они являются первыми клетками, набранными в месте воспаления путем быстрой экстравазации через сосуды. Там нейтрофилы выполняют множество функций, чтобы убить вторгшиеся патогены и опосредовать иммунную сигнализацию. Свежеочищенные нейтрофилы из крови человека являются моделью выбора для изучения, поскольку ни одна клеточная линия полностью не воспроизводит функции PMN и биологию. Однако нейтрофилы являются короткоживущими, терминально дифференцированными клетками и очень восприимчивы к активации в ответ на физические (температура, скорость центрифугирования) и биологические (эндотоксин, химио- и цитокины) стимулы. Поэтому крайне важно следовать стандартизированным, надежным и быстрым методам получения чистых и неактивированных клеток. Этот протокол представляет собой обновленный протокол, сочетающий центрифугирование градиента плотности, осаждение эритроцитов (RBC) и лизис RBC для получения высокой чистоты PMN и минимизации активации клеток. Кроме того, обсуждаются методы оценки качества, жизнеспособности и чистоты выделения нейтрофилов.
Введение
Врожденная иммунная система состоит из многих типов клеток, которые поддерживают иммунный гомеостаз и клиренс патогенов наряду со многими другими физиологическими функциями. Нейтрофилы составляют самый большой пул белых кровяных телец в кровообращении человека1. Большинство зрелых нейтрофилов хранятся в костном мозге, который является местом генерации новых нейтрофилов, также называемых гранулопоэзом. В костном мозге гранулоцитарные прародители выходят из клеточного цикла и терминально дифференцируются, приобретая характерные для них сегментоядерные ядра и гранулы2. В воспалительных состояниях, в ответ на хемокины, цитокины и молекулярные паттерны, связанные с повреждением и патогенами, нейтрофилы мобилизуются из кровотока и из костного мозга для выполнения широкого спектра функций. К ним относятся секреция цитокинов, прямой фагоцитоз возбудителя, высвобождение активных форм кислорода, дегрануляция антимикробных белков, образование внеклеточных ловушек нейтрофилов.
Молекулы, используемые нейтрофилами для борьбы с инфекцией, токсичны для микробов и хозяина. Таким образом, продолжительность жизни и правильное удаление стареющих/умирающих нейтрофилов строго регулируются, и они имеют ограниченную продолжительность жизни в циркуляции (<48ч)3. Благодаря этой короткой выживаемости человеческий организм вырабатывает в среднем 100 миллиардов новых нейтрофилов каждый день для поддержания гомеостаза популяции4. Экстренное гранулопоэзоэ может еще больше увеличить высвобождение нейтрофилов, как зрелых, так и незрелых, в кровь при воспалении и инфекции5. Важность нейтрофилов в врожденном иммунном ответе подчеркивается пациентами с приобретенной или врожденной нейтропениями, которые восприимчивы к бактериальным и грибковым инфекциям6.
Многие проблемы возникают при изучении биологии нейтрофилов и их роли в иммунном ответе из-за их природы, включая их короткую выживаемость и цитотоксическое содержание. Нейтрофилоподобные клеточные линии обычно дифференцировали от клеток промиелоцитарного лейкоза человека HL-60 и клеток PLB-9857,8. Хотя они могут отображать нейтрофильно-подобную морфологию и выполнять хемотаксис, эти клеточные линии не могут полностью резюмировать биологию нейтрофилов. Анализы in vitro с использованием этих клеточных линий также не могут повторно провести эксперименты in vivo. Кроме того, дифференцировка этих клеток должна быть индуцирована и может быть неблагоприятно затронута генными манипуляциями перед дифференцировки.
Недавно были разработаны методы обхода этих проблем путем использования индуцируемых промоторов для модуляции экспрессии генов после дифференцировки в клетках HL-609. Даже с такими инструментами первичные человеческие PMN необходимы для проверки целей с использованием фармакологических подходов. Таким образом, необходимо получить чистые и инактивированные нейтрофилы, выделенные из крови, чтобы подтвердить результаты клеточной линии и животных моделей. В данной работе представлен пересмотренный протокол изоляции PMN, в котором были оценены плюсы и минусы существующих методов10. Была разработана комбинация, состоящая из градиентного центрифугирования для отделения ПМН от других иммунных клеток, короткого осаждения на основе декстрана для удаления основной массы эритроцитов, быстрого остаточного лизиса эритроцитов через осмотическое давление и низкоскоростного центрифугирования для удаления загрязнения тромбоцитами.
протокол
ПРИМЕЧАНИЕ: Человеческие нейтрофилы были выделены из венозной крови из выброшенных фильтров белых кровяных клеток, полученных из лаборатории банка крови в Бостонской детской больнице. Доноры крови не поддавались идентификации, и не было никакого взаимодействия с живыми людьми или знания идентифицируемой личной информации. Таким образом, эта работа не классифицируется как исследование на людях в соответствии с правилами HHS для людей (45 CFR Part 46). Совет по институциональному обзору Бостонской детской больницы (IRB) одобрил протокол.
1. Наслоение градиента
- После стерилизации пухлой шерсти или упаковки цельной крови и ламинарного капюшона разделите кровь на 50 мл пробирки по 10 мл крови в каждой пробирке.
- Доведите объем до 35 мл с помощью 5% фетальной бытовой сыворотки (FBS) / сбалансированного раствора соли Хэнка (HBSS), чтобы разбавить кровь для более чистого градиента.
ПРИМЕЧАНИЕ: При использовании мембраны лейкафереза клетки могут быть вымыты с помощью шприца 60 мл и 30 мл 5% FBS / HBSS на фильтр. Разведение не нужно при работе со свежеприведенной цельной кровью. - Закройте крышку трубки 50 мл, перемешайте ее несколько раз путем инверсии и держите ее вверх ногами, чтобы дно было лишено эритроцитов.
- Добавьте 10 мл среды градиента плотности (см. Таблицу материалов)непосредственно под кровь. Убедитесь, что среда и кровь не смешиваются и что интерфейс острый(рисунок 1A).
ПРИМЕЧАНИЕ: Этот шаг имеет решающее значение. Убедитесь, что раствор градиента плотности находится при комнатной температуре (RT) и хорошо перемешивается перед каждым градиентом. Первый миллилитр среды градиента плотности нужно аккуратно и устойчиво наслаивать как можно медленнее. Рекомендуется установить низкую скорость электронной пипетки. - Осторожно поместите трубку в центрифугу, не нарушая уклон, и вращайтесь при 400 × g в течение 30 минут при RT, обязательно отключите тормоз. Посмотрите, как градиент вращения разделяется на верхний слой сыворотки / плазмы, среднее белое кольцо мононуклеарных клеток периферической крови (PBMCs), слой среды градиента плотности помутнения и нижнюю гранулу, состоящую из белой тонкой нейтрофильной полосы поверх эритроцитов(рисунок 1B).
ПРИМЕЧАНИЕ: Мутная или непрозрачная сторона трубки после центрифугирования может свидетельствовать о том, что клетки (нейтрофилы) активированы и могут быть не пригодны для использования. - Сначала удалите НБК, введя всасывающую пипетку непосредственно в слой PBMC. Обязательно аспирировать его полностью, пока слой сыворотки / плазмы уменьшается по мере удаления кольца. Соскоблите сторону трубки, где ячейки гранулированы всасывающим пипеткой, чтобы максимизировать удаление ПМБК. Осторожно удалите слой мутной среды градиента плотности между кольцом PBMC и гранулой нейтрофила/эритроцита.
ПРИМЕЧАНИЕ: Соскабливание гранулированных ячеек на боковой стороне трубки значительно повышает чистоту изоляции. Будьте осторожны, чтобы не аспирировать гранулы, так как большинство нейтрофилов сидят непосредственно поверх эритроцитов.
2. Оседание эритроцитов (эритроцитов)
- Используя пипетку 10 мл, перенесите гранулу нейтрофила/эритроцита в чистую трубку. Не пипетку вверх и вниз. Добавьте 5% FBS/HBSS к конечному объему 25 мл. Аккуратно перемешать путем инверсии.
ПРИМЕЧАНИЕ: Выполнение осаждения RBC после удаления PBMC улучшает выход и уменьшает активацию10. - Непосредственно добавьте 25 мл предварительного (37 °C) 3% декстрана/0,9% NaCl/H2O в пробирку, содержащую разбавленную гранулу нейтрофила/эритрофила/эритроцита, и осторожно перемешайте путем инверсии. Поместите трубку на ровной, не вибрирующей поверхности на 15 мин(рисунок 1С).
ПРИМЕЧАНИЕ: Более длительное осаждение уменьшает загрязнение эрицитов, но также снижает выход. Кроме того, длительное воздействие декстрана может привести к активации нейтрофилов или гибели клеток11. - Осторожно поднесите трубку обратно в вытяжку (для стерильной изоляции). Лишь слегка погружая пипетку в жидкость, соберите верхний слой (~ 30 мл) после поверхности жидкости вниз.
ПРИМЕЧАНИЕ: Если осаждение создает резкую границе раздела между средой и эритроцитами, гранулы RBC меньше, или, если желательна более высокая урожайность, собирают до 35 мл. - Раскрутите трубку (400 × г,10 мин, RT, используя низкий тормоз (3)), в результате чего получается красная гранула без частиц, плавающих в среде.
3. Лизис остаточных эритроцитов
- Осторожно аспирируйте супернатант, не нарушая гранулу.
- Добавьте 25 мл стерильной сверхчистой воды непосредственно в трубку и осторожно перемешайте, инвертируя в течение 28 с, чтобы лизелить эритроциты. Не используйте пипетку для повторного суспендирования гранул.
ПРИМЕЧАНИЕ: Не превышайте 30 с, так как длительные гипотонические состояния могут активироваться и привести к гибели нейтрофилов12. - Немедленно добавьте 25 мл стерильного 1,8% NaCl/H2O в пробирку и осторожно перемешайте путем инвертирования, чтобы вернуть раствор в изотонические условия.
ПРИМЕЧАНИЕ: Раствор должен быть красного цвета, но без мутности. - Открутка вниз при 200 × г в течение 3-5 мин с низким тормозом (уровень 3) для минимизации эритроцитов и осаждения тромбоцитов вместе с нейтрофилами(Рисунок 1D и Рисунок 2)13,14.
ПРИМЕЧАНИЕ: Гранула должна быть белой с минимальным слоем RBC сверху, который можно аккуратно удалить, пока надпоставление аспирируется. - Повторное суспендирование нейтрофилов путем пипетирования питательной среды (10% FBS/RPMI1640) непосредственно на гранулу, но не пипеткой вверх и вниз. Раскачивая трубку горизонтально из стороны в сторону, чтобы свести к минимуму активацию клеток.
ПРИМЕЧАНИЕ: Клетки должны храниться в концентрации ~2 × 106 клеток/мл, так как более высокая плотность приведет к увеличению активации/гибели клеток15. По этой же причине гранулы клеток должны быть повторно суспендированы как можно скорее. - Если наблюдается агрегация или слипание клеток, фильтруйте клеточную суспензию с помощью сетки 70 мкм, чтобы отбросить слипшиеся нейтрофилы.
4. Определение качества выделения нейтрофилов
- Окрашивают клетки маркерами, специфичными для нейтрофилов (CD66b, CD11b), эозинофилов (CD193)(рисунок 3),и маркером активации, таким как CD62L(рисунок 4). Получение 20 000 клеток с помощью проточной цитометрии. Проанализируйте чистоту и активацию клеток с помощью стратегий гаширования, предложенных на рисунках 3 и 4.
ПРИМЕЧАНИЕ: Качество препарата нейтрофилов может быть оценено с использованием 3% раствора уксусной кислоты-метиленового синего для визуализации уникального лопастного ядра нейтрофилов. - Определение жизнеспособности клеток с помощью Annexin V/propidium iodide (PI)(рисунок 5).
ПРИМЕЧАНИЕ: Окрашивание трипанов в синий цвет может быть использовано для оценки жизнеспособности клеток.
Результаты
При использовании градиента плотности для очистки нейтрофилов крайне важно, чтобы интерфейс между кровью и средой градиента плотности был как можно более резким, и чтобы после центрифугирования оставалось четкое разделение слоя (этап 1.4). После лизиса RBC буфер должен быть прозрачно-красным, а не мутным (шаг 3.3). Если препарат мутный, может потребоваться второй раунд лизиса (этап 3), хотя это может повлиять на выживаемость нейтрофилов(рисунок 1). После лизиса рекомендуется низкоскоростное центрифугирование (200 × г),когда чистота является приоритетной, поскольку она значительно снижает загрязнение тромбоцитов. Однако высокоскоростное центрифугирование (400 × г)увеличивает выход за счет чистоты (этап 3.4, рис. 2). После выделения нейтрофилов флуоресцентно-активированная сортировка клеток может быть использована для оценки чистоты выделения (этап 4.1) и должна быть выбрана вместо микроскопии. Хотя распределение FSC/SSC только клеток обеспечивает оценку качества изоляции клеток(рисунок 3A),использование специфических клеточных маркеров должно быть предпочтительным. При этом наиболее распространенные загрязняющие клеточные популяции окрашиваются специфическими антителами вместе с CD66b, специфически экспрессируемыми на гранулоцитах. Окрашивание CD45 используется для различения лейкоцитов (CD45+) и эритроцитов и тромбоцитов (CD45-).
Другие загрязняющие вещества включают лимфоциты (CD3+ или CD19+, рисунок 3F),моноциты (CD14+, рисунок 3D)и эозинофилы (CD193+, рисунок 3G). CD11b представляет собой интегрин, экспрессируемый на миелоидной линии; нейтрофилы и моноциты являются CD11b+, тогда как лимфоциты являются CD11b-(рисунок 3C). Поскольку активация нейтрофилов может влиять на последующие эксперименты, следует оценить экспрессию CD62L; нейтрофилы становятся CD62L- после активации (шаг 4.1). Пептид fMLP может быть использован в качестве положительного контроля для сбрасывать CD62L(рисунок 4). Также важно оценить здоровье нейтрофилов перед выполнением анализов; нейтрофилы имеют относительно короткий период полувыпада, и активация может еще больше сократить его (шаг 4.2). Стандартное окрашивание Annexin V и PI может дать информацию о живом/мертвом состоянии культуры нейтрофилов в назначенное время(рисунок 5).

Рисунок 1:Градиент плотности на основе среднего разделения гранулоцитов. (А) до и (В) после центрифугирования. Обратите внимание на резкую границе раздела между слоями среды градиента плотности и градиента плотности. (C)Осаждение гранул в В суспендированной (1:1) в 5% FBS/HBSS и 3% Декстран-0,9% NaCl. (D)гранулы ПМН после лизиса остаточных эритроцитов в супернатанте(С)сН2О. Сокращения: ПБМК = мононуклеарная клетка периферической крови; ПМН = нейтрофил; Эритроцит = эритроциты; FBS = фетальная бытовая сыворотка; HBSS = Сбалансированный солевой раствор Хэнка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2:Вращение на более низких скоростях после лизиса эрицитов уменьшило загрязнение тромбоцитов. После лизиса эритроцитов сH2O клетки раскрутывались вниз при 200 × г (A)или 400 × г (B). Нейтрофилы окрашивали, и проводили анализ проточной цитометрии, как описано на Фиг.3,с добавлением анти-CD41 для маркировки тромбоцитов. Сокращения: эритроциты = эритроциты; CD41 = кластер дифференциации 41; SSC-A = площадь бокового рассеяния. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
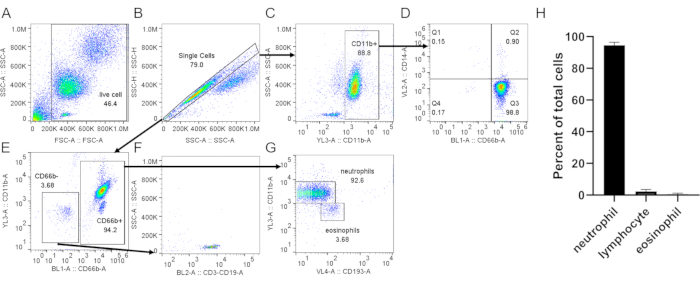
Рисунок 3:Оценка нейтрофилов, выделенных из пышной шерсти. Изолированные нейтрофилы окрашивали анти-CD66b, анти-CD11b, анти-CD14 и анти-CD193 в соответствии со стандартным протоколом. Одиночные ячейки(B)были закрыты от общих ячеек(A). (C)CD11b+ ячейки были закрыты из одиночных ячеек. (D)Точечный график, показывающий нейтрофилы (CD66b+, CD14 низкий /-) и очень низкую моноцитарную контаминации (CD66b-, CD14+, Q1). (E)CD66b- и CD66b+ ячейки были закрыты. (F)CD66b- клетки были положительными для маркеров лимфоцитов (CD3, CD19). (G) Экспрессия CD11b и CD193 в CD66b+ клетках, показывающая различные популяции нейтрофилов (CD66b+, CD11b+, CD193-) и эозинофилов (CD66b+, CD11b-, CD193+). В репрезентативном результате, показанном здесь, чистота нейтрофилов составляет ~ 93% с ~ 3,7% лимфоцитов и ~ 3,7% загрязнения эозинофилами. (H) Количественная оценка чистоты нейтрофилов после очистки. Данные собраны из 5 отдельных испытаний и представлены как средние ± SD. Сокращения: CD = кластер дифференциации; SSC-A = SSC-A = площадь бокового рассеяния; FSC-A = прямой точечный разброс. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4:Градиентная очистка не вызывала выпадения CD62L. (A-B)Контрольные(A)или fMLP-стимулированные нейтрофилы(B)(1 мМ fMLP в течение 15 мин при 37 °C) окрашивали нейтрофильными маркерами и CD62L. (C)Средняя интенсивность флуоресцентности для CD62L снижается в клетках, обработанных fMLP, что указывает на выпание CD62L и активацию нейтрофилов. Сокращения: CD26L = L-селектин; fMLP = N-формилметионил-лейцил-фенилаланин; SSC-A = SSC-A = площадь бокового рассеяния; FSC-A = прямой точечный разброс; ПЭ = фикоэритрин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5:Самопроизвольная гибель нейтрофилов, очищенных градиентом плотности или набором изоляции нейтрофилов. Нейтрофилы очищали градиентом плотности(A и B)или коммерческими микрошвухами(C и D)и культивировали в течение 0 ч(A и C)или 24 ч(B и D)в RPMI-10% FCS. Клетки окрашивали с использованием Annexin V и PI в соответствующие моменты времени в соответствии со стандартным протоколом. (E)Количественная оценка спонтанной смерти очищенных нейтрофилов. n=5, среднее ± SD. Сокращения: SSC-A = SSC-A = боковая зона рассеяния; FSC-A = прямой точечный разброс; PI = йодид пропидия; FCS = сыворотка для икр плода; FITC = флуоресцеин изотиоцианат; AV5 = Приложение V. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Из-за короткой продолжительности жизни, терминального дифференцировки и литического содержания нейтрофилов изучение этих клеток всегда было проблемой. Помимо использования мышиных моделей или клеток из когорт пациентов, клеточные линии являются полезными инструментами, помогающими изучать биологию нейтрофилов16. Тем не менее, нейтрофильные клеточные линии не могут полностью повторить все аспекты биологии нейтрофилов, добавляя дополнительный уровень сложности в изучении этих клеток. Наиболее часто используемой моделью in vitro является клеточная линия HL-60, которая может быть дифференцирована в нейтрофильные клетки путем обработки диметилсульфоксидом или ретиноевой кислотой17,18. Хотя эти клетки полезны при изучении миграции и дыхательного всплеска, они не подходят для изучения микробиоцидной активности нейтрофилов. Существуют и другие клеточные линии (PLB-98, NB4), и они также связаны с их набором ограничений19.
Крайне важно подтвердить с помощью первичных наблюдений за нейтрофилами человека, сделанных с помощью моделей заболеваний мышей и клеточных линий. Нейтрофилы не могут быть эффективно криоконсервированы и, таким образом, часто выделяются из цельной крови или пышной шерсти, полученной от доноров и немедленно обработанной. После выделения клетки начинают подвергаться сложной форме спонтанной гибели, регулируемой окислением, цитоплазмазами и протеазами, обнаруженными в гранулах нейтрофилов20,21. Неправильные методы или техники выделения могут привести к активации нейтрофилов, только ускоряя гибель клеток. Крайне важно иметь надежный и последовательный метод получения чистых и качественных нейтрофилов от доноров.
Было опубликовано много методов выделения нейтрофилов человека10,22. Они в основном делятся на две категории, с некоторыми общими стратегиями. Первая категория основана на антителах, будучи либо положительным, либо отрицательным отбором. Положительный отбор будет маркировать нейтрофилы напрямую, что обеспечивает высокочистую клеточную популяцию, хотя он также приводит к быстрой активации клеток, гибели клеток, а также к нежелательной маркировке нейтрофилов23. Отрицательный отбор, хотя и оставляющий клетки немаркированными и дающий очень чистую популяцию, ускоряет гибель нейтрофилов, хотя точный механизм неизвестен(рисунок 5). Необходимо дополнительно исследовать вопрос о том, изменяется ли экспрессия генов или белков после положительного или отрицательного отбора. Более того, из-за количества антител, необходимых для истощения других типов клеток, эти методы не могут выводить большое количество нейтрофилов. Тем не менее, анализы на основе антител все еще могут использоваться для краткосрочной культуры и экспериментов в меньших масштабах и являются методами выбора для экспериментов, требующих очень высокой чистоты клеток, таких как исследования экспрессии генов и белков.
Второй тип метода изоляции основан на градиенте и плотности. Он обычно включает в себя Перколла, Фиколла-Пака или другие компоненты полисахарида / поливинилпирролидона и использует силу центрифугирования для разделения различных типов клеток крови на основе плотности клеток. Эти методы часто дополняются осаждением эритроцитов декстраном. Эти методы могут обрабатывать большие масштабы исходного материала и могут достигать высокой чистоты. Одним из предостережений выделения на основе плотности является неэффективное отделение других гораздо менее распространенных гранулоцитов (в основном эозинофилов) от нейтрофилов, и это, следовательно, является основным ограничением представленного протокола, поскольку даже наличие загрязнения мелкими клетками может повлиять на реакцию нейтрофилов24.
Здесь представлен обобщенный метод, основанный на градиентной изоляции, уточняющий предыдущие методы10,22. Мы используем текущее занижение специфичности нейтрофилов для надежного выделения чистых нейтрофилов человека с ограниченными остаточными тромбоцитами и эритроцитами, предотвращая активацию нейтрофилов и ускоренную смерть. Наиболее важным этапом является наслоение градиента, которое гораздо эффективнее получается путем добавления среды градиента плотности под кровью для получения резкого интерфейса. Быстрое исследование кольца PBMC и градиента после центрифугирования может выявить возможное загрязнение, активацию и низкий выход. При работе с мембраной лейкафереза или пухлой оболочкой важно разжижение крови, поскольку чрезмерная плотность клеток приведет к агрегации клеток, что приведет к примесям и активации клеток.
Этот протокол должен быть завершен в течение 2 ч, чтобы обеспечить свежесть клеток, и этапы, включающие градиентную среду плотности, декстран и лизис, должны быть выполнены немедленно, так как воздействие этих растворов может изменить нейтрофилы. При этом протоколе ожидаемый выход нейтрофилов составляет не менее ~ 10 миллионов / 10 мл цельной крови и не менее ~ 60 миллионов / 10 мл пышной шерсти. Оценка качества выделения должна быть сделана следующим образом: активированные нейтрофилы должны быть менее 10%, загрязнение лимфоцитов ниже 5%, минимальный эозинофил (тот же боковой рассеяние, но меньшая популяция прямого рассеяния), а жизнеспособность клеток должна быть более 90%. Более низкая чистота может быть результатом неправильного наслоения или хранения среды градиента плотности или из-за качества и свежести исходного продукта крови.
Раскрытие информации
Авторы заявляют, что исследование проводилось при отсутствии какого-либо конфликта интересов.
Благодарности
Этот проект был поддержан P01HL095489. A.Y.H поддерживался T32HL066987.
Материалы
| Name | Company | Catalog Number | Comments |
| 3% Acetic Acid with Methylene Blue | Stemcell technologies | #07060 | |
| Attune NxT | invitrogen | A24858 | FACS analyzer |
| Cd11b-PE | biolegend | 301305 | |
| CD14-BV421 | biolegend | 367144 | |
| CD193-BV605 | biolegend | 310716 | |
| CD19-PerCP | biolegend | 302228 | |
| CD3-PerCP | biolegend | 300326 | |
| CD41-APC | biolegend | 303710 | |
| Cd45-APC | biolegend | 103111 | |
| CD62L-PE | biolegend | 304802 | |
| CD66b-FITC | biolegend | 305103 | |
| Centrifuge 5810R | Eppendorf | 22625101 | Centrifuge |
| Dextran | Fisher | BP1580 | |
| Fetal Bovine Serum (FBS) | R&D systems | S11150H | complement inactivation of FBS is recommended |
| FITC Annexin V Apoptosis Detection Kit I | BD | 556547 | |
| Hanks balanced salt solution (-CaCl2), (-MgCl2) (-MgSO4) | Gibco | 14175-095 | HBSS without Ca2+/Mg2+ is advised as they have been shown to lead to neutrohpil activation |
| Lymphoprep | Stemcell technologies | #07801 | density gradient medium |
| MACSxpress Whole Blood Neutrophil Isolation Kit, human | Miltenyi | 130-104-434 | |
| RPMI-1640 | Gibco | 11875093 | |
| Sodium chloride | sigma | 71376 | |
| Trypan Blue Solution, 0.4% | Thermofisher | 15250061 | |
| ultrapure water | KD medical | RGF-3410 |
Ссылки
- Rosales, C. Neutrophil: A cell with many roles in inflammation or several cell types. Frontiers in Physiology. 9, 113 (2018).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Stoller, J. K. Murray & Nadel's textbook of respiratory medicine, 6th edition. Annals of the American Thoracic Society. 12 (8), 1257-1258 (2015).
- Dancey, J. T., Deubelbeiss, K. A., Harker, L. A., Finch, C. A. Neutrophil kinetics in man. Journal of Clinical Investigation. 58 (3), 705-715 (1976).
- Manz, M. G., Boettcher, S. Emergency granulopoiesis. Nature Reviews. Immunology. 14 (5), 302-314 (2014).
- Summers, C., et al. Neutrophil kinetics in health and disease. Trends in Immunology. 31 (8), 318-324 (2010).
- Pedruzzi, E., Fay, M., Elbim, C., Gaudry, M., Gougerot-Pocidalo, M. A. Differentiation of PLB-985 myeloid cells into mature neutrophils, shown by degranulation of terminally differentiated compartments in response to N-formyl peptide and priming of superoxide anion production by granulocyte-macrophage colony-stimulating factor. British Journal of Haematology. 117 (3), 719-726 (2002).
- Tucker, K. A., Lilly, M. B., Heck, L., Rado, T. A. Characterization of a new human-diploid myeloid-leukemia cell-line (Plb-985) with granulocytic and monocytic differentiating capacity. Blood. 70 (2), 372-378 (1987).
- Hsu, A. Y., et al. Inducible overexpression of zebrafish microRNA-722 suppresses chemotaxis of human neutrophil like cells. Molecular Immunology. 112, 206-214 (2019).
- Kremserova, S., Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 2087, 33-42 (2020).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunological Research. 2017, 1254792 (2017).
- Thorson, L. M., Turkalj, A., Hung, J. C. In vitro evaluation of neutrophil viability after exposure to a hypotonic medium. Nuclear Medicine Communications. 16 (7), 615-620 (1995).
- Dhurat, R., Sukesh, M. Principles and methods of preparation of platelet-rich plasma: a review and author's perspective. Journal of Cutaneous and Aesthetetic Surgery. 7 (4), 189-197 (2014).
- Etulain, J., et al. An optimised protocol for platelet-rich plasma preparation to improve its angiogenic and regenerative properties. Scientific Reports. 8 (1), 1513 (2018).
- Hannah, S., et al. Constitutive neutrophil apoptosis in culture is modulated by cell density independently of beta2 integrin-mediated adhesion. FEBS Letters. 421 (2), 141-146 (1998).
- Hsu, A. Y., et al. Phenotypical microRNA screen reveals a noncanonical role of CDK2 in regulating neutrophil migration. Proceedings of the National Acadermy of Sciences of the United States of America. 116 (37), 18561-18570 (2019).
- Martin, S. J., Bradley, J. G., Cotter, T. G. HL-60 cells induced to differentiate towards neutrophils subsequently die via apoptosis. Clinical and Experimental Immunology. 79 (3), 448-453 (1990).
- Hauert, A. B., Martinelli, S., Marone, C., Niggli, V. Differentiated HL-60 cells are a valid model system for the analysis of human neutrophil migration and chemotaxis. International Journal of Biochemistry and Cell Biology. 34 (7), 838-854 (2002).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: Cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Kambara, H., et al. Gasdermin D exerts anti-inflammatory effects by promoting neutrophil death. Cell Reports. 22 (11), 2924-2936 (2018).
- Loison, F., et al. Proteinase 3-dependent caspase-3 cleavage modulates neutrophil death and inflammation. Journal of Clinical Investigation. 124 (10), 4445-4458 (2014).
- Siemsen, D. W., et al. Neutrophil isolation from nonhuman species. Methods in Molecular Biology. 1124, 19-37 (2014).
- Hasenberg, M., et al. Rapid immunomagnetic negative enrichment of neutrophil granulocytes from murine bone marrow for functional studies in vitro and in vivo. PLoS One. 6 (2), 17314 (2011).
- Calzetti, F., Tamassia, N., Arruda-Silva, F., Gasperini, S., Cassatella, M. A. The importance of being "pure" neutrophils. Journal of Allergy and Clinical Immunology. 139 (1), 352-355 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены