Method Article
פיתוח מודלים דרוזופילה מלנוגסטר להדמיה ובקרה אופטוגנטית של תפקוד הלב
In This Article
Summary
הפרוטוקול הנוכחי מתאר את הדור של Drosophila melanogaster המבטא eNpHR2.0 או ReaChR opsins בלב עבור הדמיית OCT וקצב לב אופטוגנטי. מדווחות הוראות מפורטות להדמיית Drosophila OCT ואפנון פעימות לב, כולל סימולציה של דום לב בר-שחזור, ברדיקרדיה וטכיקרדיה בבעלי חיים חיים בשלבי התפתחות שונים.
Abstract
השימוש ב-Drosophila melanogaster (זבוב הפירות) כאורגניזם מודל הבטיח התקדמות משמעותית בתחומים רבים של מדע הביולוגיה, החל מארגון תאים וחקירות גנומיות וכלה במחקרים התנהגותיים. בשל הידע המדעי המצטבר, בשנים האחרונות הובאה דרוזופילה לתחום מידול מחלות אנושיות, כולל הפרעות לב. העבודה המוצגת מתארת את המערכת הניסיונית לניטור ומניפולציה של תפקוד הלב בהקשר של אורגניזם חי שלם באמצעות אור אדום (617 ננומטר) וללא הליכים פולשניים. שליטה על הלב הושגה באמצעות כלים אופטוגנטיים. אופטוגנטיקה משלבת את הביטוי של אופסינים מהונדסים רגישים לאור ואת ההפעלה האופטית שלהם כדי לווסת את הרקמה הביולוגית המעניינת. בעבודה זו, נעשה שימוש בהדמיית טומוגרפיה אופטית משולבת מותאמת אישית (OCT) ובמערכת גירוי אופטוגנטית כדי להמחיש ולווסת את הלב המתפקד D. melanogaster בשלבי ההתפתחות של זחל הכוכב השלישי ובשלבים ההתפתחותיים המוקדמים של הפופאל. המערכת הגנטית הכפולה של UAS/GAL4 שימשה לביטוי הלורהודופסין (eNpHR2.0) ותעלה בהזזה אדומה (ReaChR), במיוחד בלב הזבוב. פרטים על הכנת D. melanogaster להדמיית OCT חיה וקצב אופטוגנטי מסופקים. תוכנת אינטגרציה שפותחה במעבדה עיבדה את נתוני ההדמיה כדי ליצור מצגות חזותיות ומאפיינים כמותיים של תפקוד הלב של דרוזופילה . התוצאות מדגימות את ההיתכנות של ייזום דום לב וברדיקרדיה הנגרמים על ידי הפעלת eNpHR2.0 וביצוע קצב לב עם הפעלת ReaChR.
Introduction
בסוף שנת 2010, כתב העת Nature Methods בחר באופטוגנטיקה כשיטת השנההראשונה. שימוש בכלים גנטיים (אופסינים מהונדסים) המווסתים על ידי אור כדי לשלוט ברקמות ביולוגיות מעניינות בדיוק ובמהירות חסרי תקדים פתח שער הצפה ליישומים חדשים. עד כה, רוב ההישגים שייכים למדעי המוח. הטכנולוגיה הוצגה כשיטה חדשה לשליטה מדויקת בנוירונים בודדים2 והתקדמה לתגליות בתחום התפקודים הקוגניטיביים של אורגניזמים חיים3. מלכתחילה, מדעני מוח הדגימו את היכולת לווסת את התנהגות האורגניזם כולו. ביטוי והפעלת אור של ChR2 opsin בעכברים נוירונים דופמינרגיים גרמו להפעלה שלהם והספיקו כדי להניע התניה התנהגותית4. עיכוב אופטוגנטי של תת-קבוצה של נוירונים המכילים הלורהודופסין NpHR2.0 שהועבר למוקד האפילפטי של מוח המכרסמים הביא להנחתה של התקפים אלקטרואנצפלוגרפיים5.
יישומים אופטוגנטיים בקרדיולוגיה מתפתחים בקצב קבוע6. ChR2 התבטא בהצלחה בתרבית תאים קרדיומיוציטים ובעכברים; קצב הלב נערך על ידי הבזקי אור כחול (שבוצעו באמצעות סיב מושתל בבעלי חיים חיים)7. בדגי זברה, ChR2 בא לידי ביטוי ושימש לזיהוי אזור הלב שעושה את הקצב; הפעלת NpHR גרמה לדום לב8. לקצב הלב האופטוגנטי יש פוטנציאל ייחודי לפיתוח טיפולי קצב וסינכרון מחדש חדשים9. לאחרונה דווח גם על ניסיונות להקים מערכת אוטוגנית להפסקת הפרעות קצב10.
מחקר מקיף ופיתוח טיפולים טיפוליים חדשים מחייבים יישום של מערכות מודל שונות, מתרבית תאים ועד יונקים. לב של בעל חוליות הוא איבר מורכב מאוד. קרדיומיוציטים (CM) מהווים שליש מכלל תאי הלב; תאים אחרים כוללים נוירונים, תאי שריר חלק וסקולריים ותאים שאינם מעוררים (כלומר, תאי אנדותל, פיברובלסטים ותאי מערכת החיסון). חקר תרבית תאי CM מגביל את תרגום התוצאות המתקבלות ליישומים רפואיים אנושיים. המניפולציות הגנטיות של אורגניזמי מודל יונקים מוגבלות וגוזלות זמן רב. למודלים קטנים יותר של חסרי חוליות יש יתרונות רבים; מערכת הלב וכלי הדם שלהם נושאת את כל האלמנטים ההיסטולוגיים החיוניים. Drosophila melanogaster (זבוב הפירות) היא מערכת מודל גנטית פשוטה ורבת עוצמה לחקור את תפקידם של גנים הקשורים למחלות אנושיות, כולל מחלות לב11,12,13. כבעלי חיים קצרי מועד, זבובי פירות מהווים הזדמנות מצוינת לדמות שינויים בתפקוד הלב התלויים בגיל או במחלות שניתן לעקוב אחריהם במהלך החיים14,15,16,17. צינור הלב של זבוב הפירות ממוקם בצד הגבי של גופו בטווח של 200 מיקרומטר מפני השטח של הקוטיקולה, מה שמאפשר לאור הנראה לעין כמעט אינפרה-אדום להגיע לצינור הלב. תכונה אנטומית זו מאפשרת קצב אופטי לא פולשני של הלב Drosophila באמצעות כלים אופטוגנטיים קיימים.
כדי לנטר את הלב Drosophila, פותחה מערכת הדמיה מותאמת אישית של טומוגרפיה קוהרנטית אופטית בתחום הספקטרלי (SD-OCT) עם מודול עירור LED משולב של אור אדום18. שינויים מורפולוגיים וקצביים בלב זבוב פירות פשוט יחסית ניתנים לניתוח בקלות באמצעות טכנולוגיית הדמיה ביו-רפואית לא פולשנית זו 12,19,20,21. עם ביצועי חתך אופטי משופרים ורזולוציה מרחבית בקנה מידה מיקרוני, OCT שימש בהצלחה כדי לחקור את המבנה ולנטר את תפקוד הלב Drosophila בשלבים התפתחותיים שונים, כולל הזחל השלישי כוכב ו pupa18 מוקדם. מערכת זו מאפשרת גם ניטור וגירוי בו זמנית של מצב הלב של הדרוזופילה בבעל החיים השלם. תצוגה סכמטית של מערכת OCT מוצגת באיור 1. מערכת SD-OCT משתמשת בדיודה סופרלומינסנטית (SLD) כמקור האור (אורך גל מרכזי: 850 ננומטר ± 10 ננומטר, FWHM: 165 ננומטר, ראו טבלת חומרים). באמצעות עדשה אובייקטיבית של 10x, מערכת ההדמיה OCT יכולה להשיג רזולוציה צירית של ~4.4 מיקרומטר באוויר ו~3.3 מיקרומטר ברקמה ורזולוציה רוחבית של ~2.8 מיקרומטר, מספיק כדי לפתור פרטים עדינים של מבני לב הזבוב18,22. אותות הפרעה של אור מוחזר מזרוע הייחוס ומזרוע הדגימה מזוהים באמצעות ספקטרומטר עם מצלמת סריקת קו של 2048 פיקסלים (קצב קו מרבי: 80 קילוהרץ, ראה טבלת חומרים). רגישות המערכת הנמדדת היא ~ 95.1 dB. כל סריקת OCT במצב B יוצרת תמונת חתך במישור התמונה xz. תמונות חוזרות במצב B נרכשות באותו מיקום כדי ליצור תמונות במצב M הלוכדות את הלב הפועם במשך יותר מ- ~30 שניות 18,22,23. קצב הפריימים להדמיה במצב M הוא ~ 125 פריימים לשנייה, מספיק כדי ללכוד את הדינמיקה הפועמת של לב זבוב הפירות.
לצורך ויסות אופטוגנטי של תפקוד הלב Drosophila , מודול תאורה עם מקור אור LED 617 ננומטר משולב עם זרוע הדגימה של מערכת SD-OCT. אור הגירוי מתמקד בנקודה בקוטר ~2.2 מ"מ על משטח הדגימה, באותו מיקום כמו נקודת המיקוד של ההדמיה. תוכנה שנכתבה בהתאמה אישית משמשת לשליטה במצב התאורה (עוצמת האור, רוחב הפולס ומחזור העבודה), התאמת תדר גירוי פולס האור וסנכרון תאורת מודול ה-LED ורכישת הדמיית OCT במצב M22.
פרסומים אחרונים תיארו את המערכת המהונדסת Drosophila המורכבת מ-ChR2, ReaChR ו-eNpHR2.0 אופסינים המווסתים באופן מרחבי-טמפורלי באמצעות המערכת הגנטית UAS/GAL4. התוצאות שהתקבלו הדגימו את היכולת ליזום דום לב וברדיקרדיה הנגרמת על ידי הפעלת אור אדום של eNpHR2.0 וקצב לב בתדר גבוה יותר הנגרם על ידי הפעלת אור כחול של ChR2. ניסויי קצב דומים בוצעו עם ערוץ אחר, ReaChR, הניתן להשראה על ידי תאורת אור אדום22,23,24. ביטוי האופסין בכל הניסויים המתוארים הונע על ידי 24B-GAL4, שבו ביטוי אופסין נצפה במגוון רחב של רקמות, כולל קרדיומיוציטים ותאי שריר מסביב. במחקר הנוכחי, 24B-GAL4 הוחלף על ידי נהג Hand-GAL4 כדי להשיג ביטוי אופסינים eNpHR2.0 ו-ReaChR ספציפיים ללב.
בסך הכל, תוצאות הניסוי שהוצגו מדגימות דום לב ברדיקרדיה וטכיקרדיה הניתנים לשחזור ומחלות לב של ברדיקרדיה וטכיקרדיה. פרוטוקול מפורט עם הוראות שלב אחר שלב ליצירת מודלים של Drosophila מהונדסים וביצוע הדמיית OCT בו זמנית וניסויי קצב אופטוגנטיים בבעלי חיים מסופק.
Protocol
עבור המחקר הנוכחי, eNpHR2.0 קו מהונדס w[*]; P{y[+t7.7] w[+mC]=UAS-eNpHR-YFP}attP2, ReaChR קו מהונדס w[*]; P{y[+t7.7] w[+mC]=UAS-ReaChR}su(Hw)attP5/CyO, ודרייבר GAL4 ספציפי ללב המכיל מקטע ויסות גן יד w[1118]; P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM3 Sb[1] (מלאי מנהלי התקנים זה יצוין כ-Hand-GAL4) שימשו. y[*] w[*]; P{w[+mC]=UAS-2xEGFP}AH3 שימש כקו הכתבים של GFP. מלאי הדרוזופילה שהוזכרו התקבלו ממרכז המניות של בלומינגטון דרוזופילה (BDSC, ראו טבלת חומרים) ונשמרו בטמפרטורת החדר או בטמפרטורה של 18 מעלות צלזיוס על מדיה סטנדרטית של קמח תירס. המודלים של דרוזופילה שפותחו במחקר זה זמינים על פי בקשה לעבודה משותפת.
1. צלבים גנטיים של דרוזופילה והכנת מדיה
- שנה את מאזן הכרומוזומים השלישי TM3 Sb[1] ל- TM6 Sb Tb, ויצר w[1118]; P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM6 Sb Tb (Hand-GAL4/TM6 Sb Tb). ראו איור משלים מס' 1 לתכנית המעברים. הניחו צלבים בבקבוקונים עם מדיה רגילה של קמח תירס.
הערה: נוכחותו של סמן שחפת מאפשרת למשתמשים להבחין בין זחלים וגלמים המכילים טרנסגן אופסין ודרייבר GAL4 לבין בעלי חיים המכילים אופסין אך ללא נהג25. - שמור את הצלבים הגנטיים באינקובטור של 25 מעלות צלזיוס, 70% לחות על מדיה המכילה רשתית טרנסית (ATR) שפותחה במיוחד (ראה טבלת חומרים) בחושך למשך 5 ימים לאיסוף זחלים ו-6 ימים לאיסוף גלמים.
- שלב חמש נקבות בתולות Hand-GAL4 /TM6 Sb Tb ושניים עד שלושה זכרים ממניות UAS-opsin (eNpHR2.0, או ReaChR) לכל בקבוקון. ראו את דיאגרמת הצלב עבור eNpHR2.0 ו-ReaChR opsin באיור 2A ובאיור 2B, בהתאמה.
- למחרת, הכינו בקבוקוני מדיה המכילים ATR.
- הכן מזון מוגדר למחצה על פי ההוראות של BDSC26. במקום סוכרוז וגלוקוז, הוסיפו רק סוכרוז (5.14 גרם/100 מ"ל). מצננים ל~60°C תוך ערבוב קבוע.
- הכינו בקבוקוני זבובים צרים, והוסיפו 50 מיקרו-ליטר של תמיסת ATR-אתנול של 100 mM לכל בקבוקון.
- באמצעות פיפטה סרולוגית, יש להשליך מזון לזבובים כדי לצמצם את בקבוקוני הזבובים, 5 מ"ל לבקבוקון. וורטקס במהירות מקסימלית במשך 10 שניות.
- חברו את הבקבוקונים, ועטפו אותם בבד הכהה כדי להגן עליהם מפני אור. תנו לבקבוקונים להתייבש למשך 12 שעות לפחות (למשך הלילה).
- למחרת, העבירו את הזבובים בהתמדה מטילים ביצים משלב 1.3. לבקבוקונים עם מזון המכיל ATR (שלב 1.4.4.). הגן על המדפים באמצעות בקבוקונים מפני אור.
- לאחר 24-48 שעות (תלוי במספר הביצים המוטלות), יש להשליך את ההורים כדי למנוע אכלוס יתר של בקבוקונים.
- לאסוף צאצאים שאינם שחפת ולהשתמש בהם להדמיית לב.
הערה: ההבדלים הפנוטיפיים בשלבי הזחל והפופל מודגמים באיור 2C. הסיכום וציר הזמן המשוער של שלבי הכנת הדגימה מוצגים באיור 3.
2. שליטה אופטוגנטית של הלב Drosophila
- בחרו זחל UAS-opsin/Hand-GAL4 /pupa מהבקבוקון (שלב 1.7.), הניחו טישו ונגבו בעדינות את המדיה ממשטח הגוף באמצעות מברשת צביעה.
- הכינו את שקופית המיקרוסקופ והניחו חתיכה קטנה של סרט דו-צדדי באמצע.
- בעזרת מברשת או פינצטה עדינה, הניחו בעדינות את הזחל/גולם על משטח הסרט כשהצד הגבי כלפי מעלה וניצב לצד הארוך של המגלשה. הפעילו לחץ עדין כדי להצמיד את הזחל/גולם למשטח הסרט.
- הניחו את המגלשה על במת ההדמיה, זחל/גולם עם הפנים כלפי מטה.
- הפעל את מקור האור OCT באמצעות תוכנת בקרת לייזר (ראה טבלת חומרים). פתח את תוכנת הבקרה SD-OCT הכתובה בהתאמה אישית ולאחר מכן לחץ על חלון התצוגה המקדימה .
- הגדר את פרמטרי הסריקה בתוכנת SD-OCT.
הערה: המטרה היא ליישר את הדגימה להדמיה אופטימלית של הלב הפועם, כך שבחירה בטווח X ובטווח Y מכסה את אזור הלב. בשלב זה, הן מספר סריקות A והן סריקות B הם 400. הטווח בכיווני x ו-y הוא ~490 μm ו-~537 μm, ומראה את שני החתכים האורתוגונליים של הלב (xz ו-yz), בהתאמה. - השתמש במיקרומניפולטורים כדי לשלוט בשלב הדגימה כדי להביא את לב הזבוב למיקוד. התאם את מיקום המוקד כדי למזער את השתקפות האור ממשטח הקוטיקולה של הזבוב. שקלו למרוח שמן מינרלי על משטח הזחל/הגלמים כדי למזער את ההשתקפות.
הערה: שמן עלול להגביר את הסיכון לתנועת בעלי חיים על ידי פגיעה בתכונות דבק הסרט. - ודא כי לב הזבוב יכול להיות מוצג במלואו בחלון התמונה ללא כל עיוותים, להיות חסום החוצה על ידי רקמות, וצללים לא זניחים והשתקפויות; אחרת, חזור לשלב 2.7.
- הגדר את פרמטרי הסריקה לרכישת תמונת OCT במצב M.
הערה: מספר סריקות A מופחת בהשוואה לשלב 2.7. עבור קצב פריימים מהיר יותר כדי ללכוד את הדינמיקה הפועמת של לב הזבוב (כמה הרץ). מספר סריקות B מציין את מספר המסגרות החוזרות עבור הדמיה במצב M, אשר ניתן להתאים על סמך זמן ההקלטה וזיכרון המערכת הזמין. בניסוי זה, 128 סריקות A יכולות לאפשר מהירות של ~ 125 פריימים לשנייה, ו -4,000 סריקות B חוזרות מוקלטות, ומספקות הקלטה רציפה של ~ 32 שניות. - קבל חמש קבוצות של נתוני בקרה ללא פולסים של גירוי אור אדום כדי לחשב את הדופק במנוחה (RHR).
- תכנן את פעימת האור עבור גירוי הקצב בתוכנת בקרת OCT המותאמת אישית. ב"הגדרות", הוסף את רצפי פולס האור המתוכננים כדי לשלוט בתדר הדופק, רוחב הדופק, משך הגירוי וזמן ההמתנה בהתאם לפרוטוקולי גירוי שונים.
הערה: ה-RHR נמדד מניסוי הבקרה ללא תאורת אור ומשמש לחישוב התדירות שבה יש לפעום את האור לניסויים טכיפאקינג ובראדיפאקינג22. - פתח את תוכנת בקר האור (ראה טבלת חומרים) כדי ליצור פולסים של אור אדום. בחרו את מצב הדופק ב"בחירת מצב". לחץ פעמיים על הדמות עבור הגדרות "פרופיל דופק" ובחר מצב עוקב. שמור על עוצמת הכיבוי כ- 0, והגדר את אחוז עוצמת ה- ON בעת חישוב צפיפות ההספק בפועל.
הערה: פולסים של נורות גירוי מופעלים על ידי אות מתוכנת הבקרה OCT בהתאם להגדרות בשלב 2.12. - רכוש קטעי וידאו במצב M של הלב Drosophila הפועם עם גירוי קל על ידי לחיצה על לרכוש בתוכנת בקרת OCT. חזור על המדידות 5x.
3. ניתוח תמונות
- פתח את תוכנת סגמנטציית לב הזבוב שפותחה בהתאמה אישית.
- לחץ על בחר קובץ ולאחר מכן בחר את הקובץ לניתוח בממשק המשתמש הגרפי שמופיע.
- הזינו את הגבולות האנכיים והאופקיים של אזור הלב בפיקסלים בתיבות המלל העליונות. לחץ על שינוי גודל. באמצעות המחוון בתחתית, ודא שכל אזור הלב גלוי ושהוא ממלא את כל הקופסה עבור האוסף כולו. אם לא, חזור על תהליך זה והתאם את הגבולות.
- לחץ על חיזוי כדי לחזות את אזור הלב. התוכנית תעבור כעת על כל פרוסה באוסף ותבחר את אזור הלב, תוך כ-3 דקות.
- לחץ על עלילת משאבי אנוש לאחר השלמת החיזוי. פעולה זו תפתח חלון חדש המציג חלקה של אזור הלב לאורך זמן. ודא שאזורי הפסגה או העמק הנכונים נבחרו. בחר דופק ולאחר מכן HR כדי ליצור דמות סופית, ואת הפרמטרים הפונקציונליים יישמרו בקבצי .csv בו זמנית.
תוצאות
ד. חיות מלנוגסטר המבטאות אופסינים רגישים לאור אדום eNpHR2.0 או ReaChR בצינור הלב נוצרו על ידי קבלת צאצאים מההצלבה בין כל קו מהונדס של UAS-opsin לבין נהג Hand-GAL4. ספציפיות הרקמה של מנהל ההתקן GAL4 אומתה על-ידי הדמיית ביטוי GFP (איור 4). זחל דרוזופילה 3 ושלבי התפתחות מוקדמים של הגלמים שימשו להדגמת ההשפעות של הפעלת eNpHR2.0 ו-ReaChR על ידי אור אדום. פולסים מתוכננים של ~ 617 ננומטר אור אדום, שהועברו על ידי LED, האירו את הזחל / הגולם והפעילו את eNpHR2.0 ו- ReaChR בלב. למרות שאורך גל התגובה המרבי המדווח של NpHR הוא ~580 ננומטר ושל ReaChR הוא ~600 ננומטר, תאורת אור של 617 ננומטר יכולה לחדור עמוק יותר עם אספקת אנרגיית אור משופרת לעבר רקמת הלב המבטאת אופסין22.
הזחל/הגולם, שהורכב על מגלשת המיקרוסקופ עם הצד הגבי כלפי מטה במערך המיקרוסקופ ההפוך, הואר על ידי קרן אור LED המופנית למקטע גוף A7. דוגמאות לתמונות חתך הגוף מוצגות באיור 5A ובאיור 6A. הלב מופיע כצורה מעגלית מתכווצת ומתרחבת בהקלטות הווידאו המורכבות מ-4,000 פריימים (סרטונים משלימים 1-6). כדי לחקות מצבי לב שונים, תוכננו ארבעה סוגים של פולסים קלים. פעימה בודדת שנמשכה 10 שניות לאחר זמן ההמתנה של 5 שניות יצרה דום לב בר-שיקום המושרה על-ידי eNpHR2.0, כפי שמוצג באיור 5B. עבור קצב הלב בתדרים איטיים יותר מקצב הלב במנוחה (RHR), בתיווך eNpHR2.0, נעשה שימוש בשני רצפי פעימות אור עם תדרי קצב השווים ל-RHR/2 ו-RHR/4 הנמשכים 8 שניות עם זמן המתנה של 6 שניות בין לבין (איור 5C). מחזור העבודה של כל רצף פולסים קלים היה 90%. משטר גירוי קל זה גרם למחלת לב המזכירה ברדיקרדיה. דפוס הגירוי להגברת קצב הלב עקב הפעלת ReaChR כלל שלושה רצפים של פעימות אור בתדרים של RHR + 0.5 הרץ, RHR + 1 הרץ ו- RHR + 1.5 הרץ, בהתאמה, עם רוחב דופק של 20 אלפיות השנייה (איור 5D). משטר דופק זה נועד לגרום למצב לב טכיקרדי. צפיפות הספק האור הייתה 7.49 mW/mm2 במהלך כל הניסויים. עבור ניסויי בקרה, לא נקבעה תאורת אור.
כל גרסה ניסיונית הוקלטה חמש פעמים. סרטונים במצב M של לב הזבוב עובדו למסכות דו-ממדיות באמצעות FlyNet 2.027. תוכנה זו מפלחת באופן אוטומטי את אזור הלב כדי לייצר את מערכי הנתונים של תפקוד הלב. התוכנית מספקת מסכה של הלב בכל פריים, אשר ניתן לתקן באופן ידני, במידת הצורך, כדי ליצור כימות מדויק של הפרמטרים הפונקציונליים של הלב הפועם, כגון קצב הלב (HR), ממד דיאסטולי סופי (EDD), וממד סיסטולי סופי (ESD), קיצור שברים (FR), אזור דיאסטולי סופי (EDA), אזור סיסטולי סופי (ESA) וכו '. הדופק נמדד על ידי ניתוח אזור הלב לאורך זמן. סרטון הבקרה ללא פולסים קלים משמש ליצירת דופק בסיסי (לדוגמה, RHR) עבור כל חיה.
איור 5B ואיור 6B מראים דום לב ארוך של 10 שניות שנגרם על-ידי הפעלת Hand>eNpHR2.0 באמצעות אור אדום (617 ננומטר) בזחלים ובגלמים, בהתאמה. כאשר האור האדום נדלק, לבה של הדרוזופילה הפסיק לפעום ונשאר במצב זה עד סוף הדלקת האור. תפקוד הלב הוחזר לאחר כיבוי האור האדום. בעלי חיים שלא ביטאו אופסין (בקרת "ללא אופסין") לא הגיבו להארת האור האדום (איור משלים 2A ואיור משלים 3A). ניסויי הבקרה עם חיות Hand>eNpHR2.0 שבהן תאורת האור האדום של 10 שניות לא הופעלה (בקרת "ללא אור") הראו שהלב פועם כרגיל (איור משלים 4A ואיור משלים 4C).
באמצעות חיות Hand>eNpHR2.0 , הוחלו פולסים של אור אדום בתדרים נמוכים יותר מה-RHR. תדירות התכווצות הלב הופחתה בעקבות אותות האור; קצב הלב האיטי הזה מחקה סוג אחד של הפרעות קצב לב, ברדיקרדיה (איור 5C ואיור 6C עבור זחל וגלמים, בהתאמה). קצב הלב האיטי יותר לא נצפה ב"ללא אופסין" (איור משלים 2B ואיור משלים 3B) ובניסויי בקרה "ללא אור" (איור משלים 4A ואיור משלים 4C).
הגברת קצב הלב יכולה להיות מושגת על ידי הפעלת אופסין Hand>ReaChR עם פעימות אור אדום בתדירות גבוהה יותר מה-RHR של החיה הנתונה. סדרה של שלוש רכבות פולסים קלות בתדרי גירוי שונים (למשל, RHR + 0.5 הרץ, RHR + 1 הרץ, RHR + 1.5 הרץ) יושמו על זחלי >ReaChR ולבבות גלמים. הנתונים שהתקבלו מראים בבירור קצב לב מוגבר בעקבות פעימות האור (איור 5D ואיור 6D עבור זחל וגלמים, בהתאמה). מצב הלב שהוכח בניסויים אלה מחקה טכיקרדיה. ניסויי בקרה שלילית מוצגים באיור משלים 2C, איור משלים 3C ואיור משלים 4B,D.
באופן כללי, התוצאות מדגימות את ההיתכנות של בקרה אופטוגנטית לא פולשנית וספציפית על קצב הלב בשלבים התפתחותיים שונים במודלים מהונדסים של בעלי חיים של D. melanogaster.
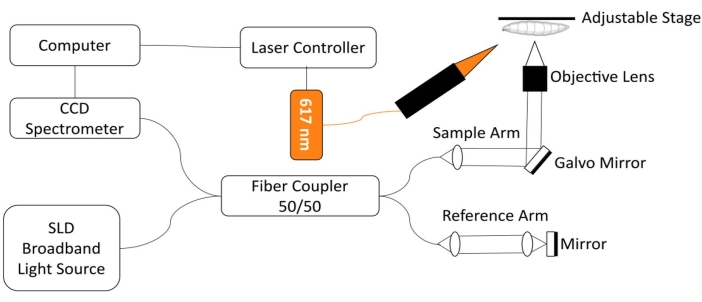
איור 1: מערכת הדמיה OCT משולבת עם מודול LED של 617 ננומטר לבקרה אופטוגנטית של תפקוד הלב של דרוזופילה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
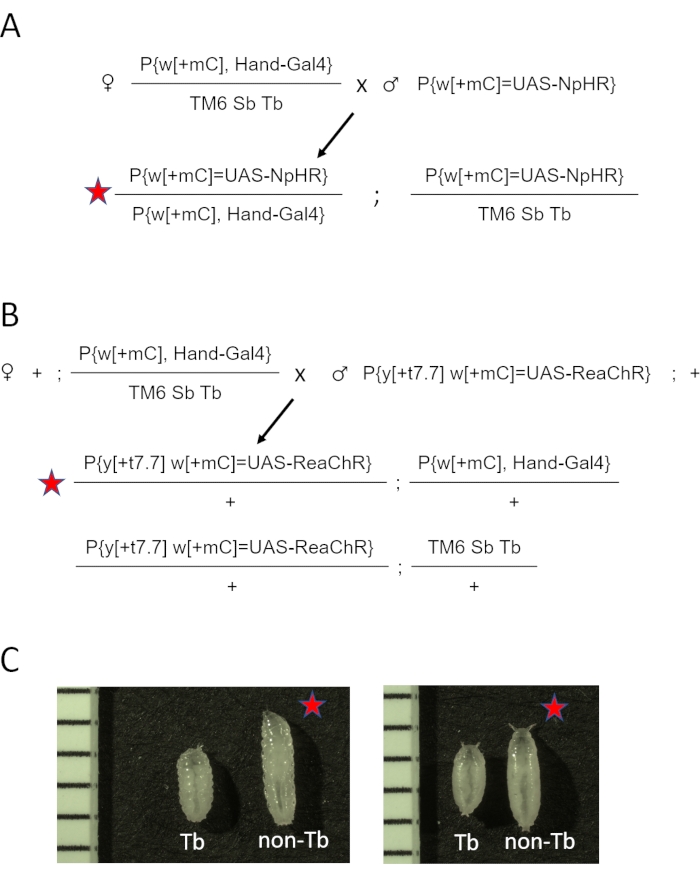
איור 2: יצירת חיות D. melanogaster המבטאות אופסין בלב. (A) דיאגרמת צלב גנטית. נקבות Hand-GAL4/TM6 SbTb הועברו לזכרים הנושאים eNpHR2.0. צאצאי Hand-GAL4/eNpHR2.0 שהתקבלו (מסומנים על ידי הכוכב האדום) נאספו להדמיית OCT, ו- Hand-GAL4/TM6 Sb Tb הושלכו על סמך המראה הפנוטיפי שלהם. (B) דיאגרמת צלב גנטית. נקבות Hand-GAL4/TM6 SbTb הועברו לזכרים הנושאים את ReaChR. צאצאי Hand-GAL4/ReaChR שהתקבלו (מסומנים על ידי הכוכב האדום) נאספו להדמיית OCT, ו- Hand-GAL4/TM6 Sb Tb הושלכו על סמך המראה הפנוטיפי שלהם. (C) הבדלים פנוטיפיים בין Hand-GAL4/opsin (כוכב אדום) לבין צאצאי Hand-GAL4/TM6 Tb. לבעלי חיים הנושאים את המוטציה בגן השחפת על כרומוזום TM6 יש צורת גוף "טובי" בהשוואה לזחל או גלמים רגילים, שאינם שחפת. הלוח השמאלי מציג זחלים; הפאנל הימני מציג גלמים מוקדמים. התמונות כוללות גם סרגל עם סימוני 1 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
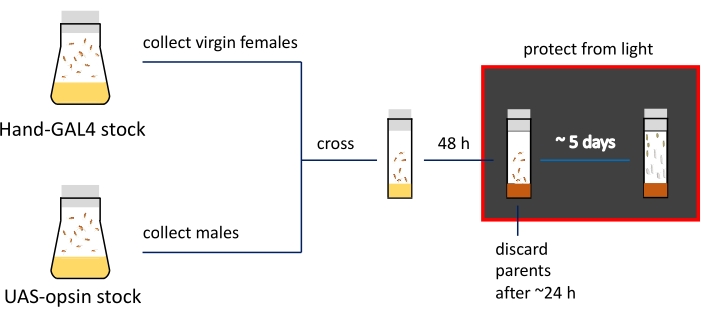
איור 3: הצגה סכמטית וציר זמן של הליכי ההכנה להדמיה. מלאי ההורים נשמר בבקבוקי זבובים; נקבות וזכרים בתולים נחצים בבקבוקונים צרים מלאים במזון רגיל (מסומנים בצבע צהוב). באופן פעיל זבובים מטילים ביצים מועברים מדיה המכילה ATR (מוצג בקבוקונים חומים). בקבוקונים עם צאצאים מתפתחים צריכים להישמר בחושך משלב זה. זחלי כוכב שלישי וגלמים מוקדמים נאספים מדפנות הבקבוקונים לצורך הדמיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
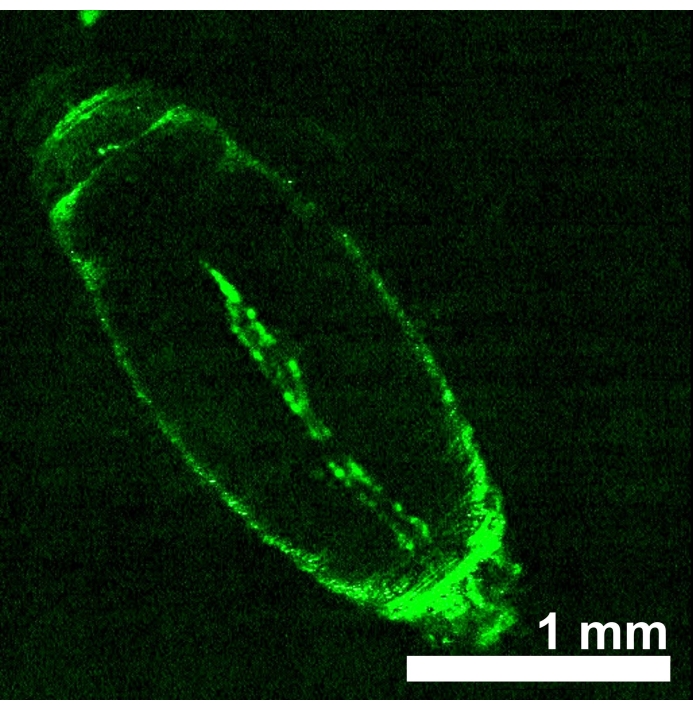
איור 4: D. melanogaster גולם מוקדם המבטא UAS-GFP (BDSC 6658) מונע על-ידי Hand-GAL4 (BDSC 48396). תבנית הפלואורסצנציה מאשרת את ספציפיות הלב של נהג Hand-GAL4 . אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
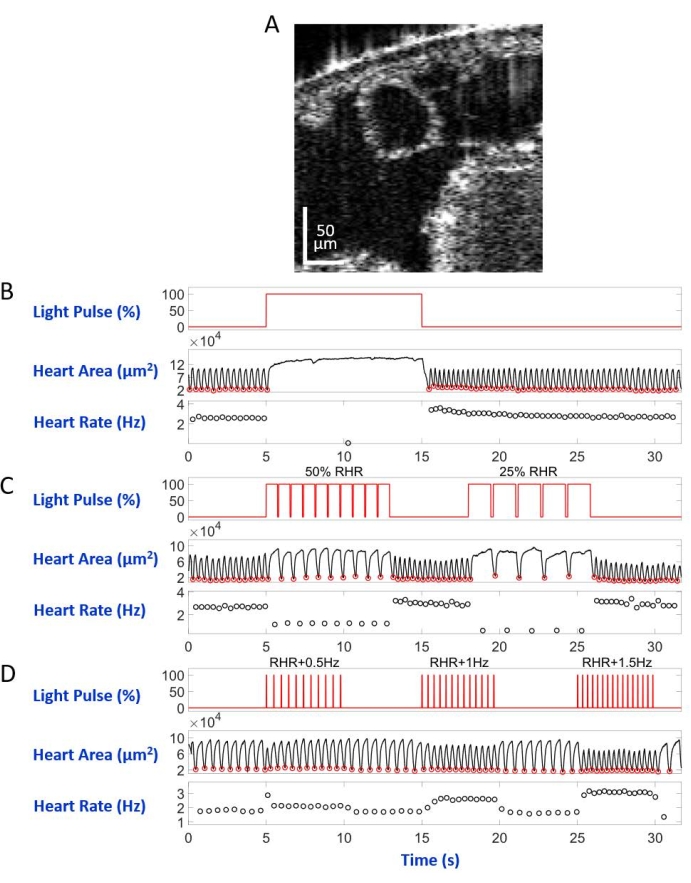
איור 5: סימולציה של דום לב, ברדיקרדיה וטכיקרדיה אצל זחלי D. melanogaster. (A) תמונת OCT של חתך גוף זחל. הלב מופיע כעיגול מתחת לפני השטח של הגוף. (ב) הצגה גרפית של דום הלב הניתן לשחזור. הלוח העליון מציג את התזמון (ציר X) של תאורת האור האדום (ציר Y, אחוז רמת ההספק של מקור האור). הלוח האמצעי מציין את השינוי באזור הלב (ציר Y, מיקרומטרים רבועים) לאורך זמן (ציר X). הפאנל התחתון מציג את השינוי בדופק (ציר Y, הרץ) לאורך זמן (ציר X). (C) הצגה גרפית של ברדיקרדיה ניתנת לשחזור בתיווך eNpHR2.0. הפאנל העליון מראה פולסים של תאורת האור האדום, הגורמים לשתי תקופות של ברדיקרדיה: 50% מה-RHR ו-25% מה-RHR. שינויים באזור הלב ובקצב הלב מוצגים בלוחות האמצעיים והתחתונים, בהתאמה. (D) הצגה גרפית של קצב הלב על ידי ReaChR מופעל. הפאנל העליון מציג סדרה של פעימות אור אדום של 20 אלפיות השנייה המתרחשות בתדרי RHR + 0.5 הרץ, RHR + 1 הרץ ו- RHR + 1.5 הרץ. התכווצויות הלב עוקבות אחר תדרי דופק האור, כפי שמוצג בלוח האמצעי והתחתון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
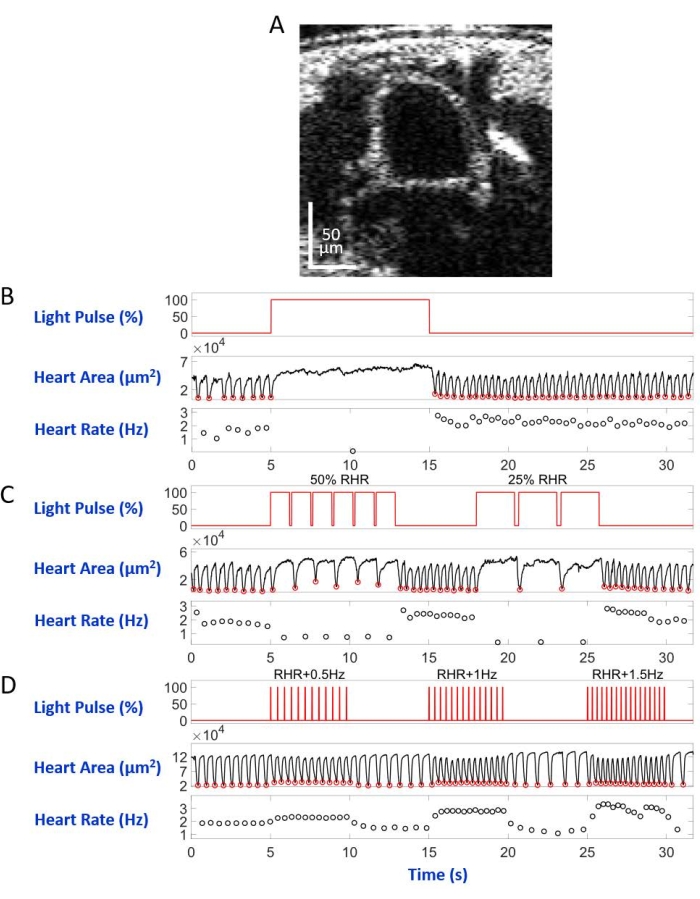
איור 6: סימולציה של דום לב, ברדיקרדיה וטכיקרדיה ב-D. melanogaster pupa . (A) תמונת OCT של חתך גוף הפופל. הלב מופיע כעיגול מתחת לפני השטח של הגוף. (ב) הצגה גרפית של דום הלב הניתן לשחזור. הלוח העליון מציג את התזמון (ציר X) של תאורת האור האדום (ציר Y, אחוז רמת ההספק של מקור האור). הלוח האמצעי מציין את השינוי באזור הלב (ציר Y, מיקרומטרים רבועים) לאורך זמן (ציר X). הפאנל התחתון מציג את השינוי בדופק (ציר Y, הרץ) לאורך זמן (ציר X). (C) הצגה גרפית של ברדיקרדיה ניתנת לשחזור בתיווך eNpHR2.0. הפאנל העליון מראה פולסים של תאורת האור האדום, הגורמים לשתי תקופות של ברדיקרדיה: 50% מה-RHR ו-25% מה-RHR. הלוחות האמצעיים והתחתונים מראים שינויים באזור הלב ובקצב הלב, בהתאמה. (D) הצגה גרפית של קצב הלב על ידי ReaChR מופעל. הפאנל העליון מציג סדרה של פעימות אור אדום של 20 אלפיות השנייה בתדרי RHR + 0.5 הרץ, RHR + 1 הרץ ו- RHR + 1.5 הרץ. התכווצויות הלב עוקבות אחר התדרים של דופק האור, כפי שמוצג בלוח האמצעי והתחתון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
איור משלים 1: צלבים גנטיים להחלפת כרומוזום מאזן TM3 Sb בכרומוזום TM6 Sb Tb. נקבות בתולות יד-GAL4 w+/ TM3 Sb נחצו עם nub-GAL4NP3537 tub-GAL80ts w+/ TM6 Sb Tb זכרים. נבחרו צאצאי כף יד-GAL4 w+/ TM6 Sb Gb, כולל נקבות בתולות וזכרים (הקרנה לעיניים פיגמנטיות בשילוב עם צורת גוף טובה). זבובים נבחרים נחצו בעצמם כדי לבסס מלאי יציב. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 2: בניסויי בקרה, קצב הלב של זחלי הבר (wt) אינו משתנה עם הדלקת האור האדום. (A) לא נצפה דום לב במהלך הדלקת האור האדום בזחל wt. הלוח העליון מציג את תמונות הלב במצב M. הקו האדום מציין את תזמון התאורה. הפאנלים האמצעיים והתחתונים מראים את אזור הלב ואת קצב הלב במהלך זמן ההדמיה של 32 שניות. (ב,ג) פעימות אור אדום אינן משנות את קצב הלב בזחל wt. הלוחות העליונים מציגים את תמונות הלב במצב M. הקו האדום מציין את תזמון התאורה. הפאנלים האמצעיים והתחתונים מראים את אזור הלב ואת קצב הלב במהלך זמן ההדמיה של 32 שניות. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 3: בניסויי בקרה, קצב הלב של הגלמים מסוג בר (wt) אינו משתנה עם הדלקת האור האדום. (A) לא נצפה דום לב במהלך הדלקת האור האדום בזחל wt. הלוח העליון מציג את תמונות הלב במצב M. הקו האדום מציין את תזמון התאורה. הפאנלים האמצעיים והתחתונים מראים את אזור הלב ואת קצב הלב במהלך זמן ההדמיה של 32 שניות. (ב,ג) פעימות אור אדום אינן משנות את קצב הלב בגולם wt. הלוחות העליונים מציגים את תמונות הלב במצב M. הקו האדום מציין את תזמון התאורה. הפאנלים האמצעיים והתחתונים מראים את אזור הלב ואת קצב הלב במהלך זמן ההדמיה של 32 שניות. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 4: זחלי D. melanogaster וגלמים המבטאים יד> eNpHR2.0 או יד>ReaChR אינם מראים שינויים משמעותיים ב-HR במהלך הדמיית OCT ללא תאורת אור אדום. (A) קצב הלב של זחל Hand>eNpHR2.0. (B) קצב הלב של זחלי יד>ReaChR . (C) קצב הלב של גלמים ידניים>eNpHR2.0. (D) קצב הלב של גולם יד>ReaChR . אנא לחץ כאן כדי להוריד קובץ זה.
סרטון משלים 1: eNpHR2.0 מופעל גורם לדום לב בזחל D. melanogaster. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו משלים 2: מופעל eNpHR2.0 גורם לדום לב ב D. melanogaster pupa. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו משלים 3: ברדיקרדיה ניתנת לשחזור בתיווך eNpHR2.0 בזחל D. melanogaster. אנא לחץ כאן כדי להוריד סרטון זה.
סרטון משלים 4: ברדיקרדיה ניתנת לשחזור בתיווך eNpHR2.0 ב- D. melanogaster pupa. אנא לחץ כאן כדי להוריד סרטון זה.
סרטון משלים 5: קצב הלב על ידי מופעל ReaChR בזחל D. melanogaster. אנא לחץ כאן כדי להוריד סרטון זה.
סרטון משלים 6: קצב לב על ידי ReaChR מופעל ב D. melanogaster pupa. אנא לחץ כאן כדי להוריד סרטון זה.
Discussion
בהשוואה לדוחות הקודמים שלנו שבהם הביטוי של אופסינים הונע לא רק בלב אלא גם ברקמות השריר שמסביב, העבודה הנוכחית מדווחת באמצעות נהג ספציפי ללב, Hand-GAL4. תצורה גנטית חדשה זו של אופסין > היד המשמשת לוויסות לב אופטוגנטי מאשרת עוד יותר את התוצאות שדווחו בעבר ומבססת מודל מחקר לב וכלי דם דרוזופילה טוב יותר.
הכנת המדיה חיונית להצלחת הניסויים. חלבוני אופסין זקוקים לליגנד, רשתית כל-טרנסית (ATR), כדי לתפקד28. זבובים אינם מייצרים מספיק ATR, ולכן יש להשלים את ATR למדיית הזבובים. במחקר זה, המזון המיידי שדווח בעבר הוחלף במדיה מוגדרת למחצה29. המתכון החדש של מדיה המכילה ATR הוצג כדי להבטיח הפצה אחידה של ATR. ATR אינו מסיס במים; כאשר מלאי ATR מבוסס אתנול של 100 mM מתווסף למדיה מבוססת מים, הוא מתפזר על ידי מערבולת הבקבוקונים המכילים מדיה חמה מוגדרת למחצה. כמו כן, ריכוז ה-ATR שדווח קודם לכן הופחת מ-10 mM עבור eNpHR2.0 ו-3 mM עבור ReaChR22 לריכוז סופי של 1 mM עבור שניהם. ריכוז זה מספיק כדי להבטיח תפקוד תקין של eNpHR2.0 ו-ReaChR.
מרכיב חיוני בהצלחת הניסוי הוא עיבוד הנתונים המשופר עם FlyNet 2.027. המעבדה המשיכה לפתח תוכנה זו כדי לשפר הן את היעילות החישובית והן את הדיוק של אלגוריתם סגמנטציה אוטומטי של לב זבוב. מסכות החתך המיוצרות על ידי תוכנה זו משמשות לגזירת נתונים פיזיולוגיים של Drosophila כגון קיצור שברים ומהירות דופן הלב. גישה זו אפשרה ניתוח נתונים יעיל עם פיקוח אנושי מינימלי, מה שהופך את זה מהיר ואמין יותר לאפיין את תפקוד הלב עבור מערכי נתונים של הדמיית לב זבוב גדול.
אוטם שריר הלב נותר הגורם המוביל למוות, ואיסכמיה שריר הלב תורמת לשני שלישים מכלל המקרים של אי ספיקת לב, אשר מתגלה במהירות בין הגורמים המובילים לתמותה ותחלואה בארצות הברית30. פיתוח טיפולים ומכשור רפואי חדשים דורש היכרות מעמיקה עם המנגנונים של הפרעות לב ברמה הפיזיולוגית והביוכימית. מטרות אלה יכולות להיות מושגות בעזרת אורגניזמים מודל. D. melanogaster ביססה את עצמה כאחד הדגמים האמינים והיעילים ביותר 31,32,33,34,35. עבודה זו יצרה את המודלים המדומים של הפרעות לב דרוזופילה המושרים על ידי גישה אופטוגנטית לא פולשנית. הפיתוח של טכנולוגיות קצב לב אופטיות לא פולשניות מספק בסיס לפיתוח חלופה למכשירי קצב לב חשמליים מסורתיים. שימוש ב-OCT כדי לבחון את תפקוד הלב בזמן אמת מאפשר למחקרים לאפיין במדויק פיזיולוגיה רלוונטית של הלב במודלים של דרוזופילה למחקרים מתקדמים, כולל סינון מועמדים לתרופות. להדמיית OCT יש עומק חדירה של ~ 1 מ"מ, מה שעובד היטב עבור מחקרי לב Drosophila אך מגביל את השימוש בו כדי לאפיין את תפקוד הלב במודלים גדולים יותר של בעלי חיים. יתר על כן, תרגום ישיר של מחקר דרוזופילה למודלים של יונקים מהווה אתגר. יש לפתח כלים אופטוגנטיים חדשים כדי לשפר את רגישות האופסינים ולתרגם אותם למערכות מודל שונות, כולל דגי זברה, עכברים, חולדות ואורגנואידים של לב האדם, לצורך מחקר קרדיווסקולרי.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מודים לאנדריי קומרוב, יוקסואן וואנג וג'ינטאו ג'ו על עזרתם בניתוח נתונים ומודים לחברי המעבדה של ג'ואו על הדיונים החשובים שלהם. העבודה במעבדתו של ד"ר ג'ואו נתמכה על ידי קרן סטארט-אפ מאוניברסיטת וושינגטון בסנט לואיס, מענקי המכונים הלאומיים לבריאות (NIH) R01-EB025209 ו-R01-HL156265, ופרס המחקר החדשני של קרן קלייקו.
Materials
| Name | Company | Catalog Number | Comments |
| All-trans retinal | Cayman Chemicals | 18449 | |
| Bacto Peptone | Gibco | 02-10-2025 | |
| BioLED Light Source Control Module, 4-channel | Migtex Systems | BLS-SA04-US | Part of the optogenetic stimulation module |
| Broadband Light Source Module | Superlum | cBLMD-T-850-HP | Part of the SD-OCT imaging system |
| Cobra-S 800 OCT Spectrometers | Wasatch Photonics | CS800-840/180-80-OC2K-U3 | Part of the SD-OCT imaging system |
| Delicate Task Wipers | Kimberly-Clark Professtional | 34155 | tissues |
| Drosophila agar | Genesee Scientific | 66-103 | |
| Drosophila culture bottles | Genesee Scientific | 32-131 | |
| FlyNet 2.0 Software | Z-Lab | Custom software for fly heart segmentation and heart function analysis developed in the Zhou lab | |
| High-Power LED Collimator Sources | Migtex Systems | BLS-LCS-0617-03-22 | Part of the optogenetic stimulation module |
| Inactive dry yeast | Genesee Scientific | 62-106 | |
| Microscope slides | AmScope | BS-72P | |
| Narrow plugs for Drosophila culture | Genesee Scientific | 59-200 | |
| Narrow vials for Drosophila culture | Genesee Scientific | 32-116SB | |
| Permanent double-sided tape | Scotch | ||
| Plugs for Drosophila bottles | Genesee Scientific | 59-194 | |
| Propionic Acid | Sigma | P1386-1L | |
| SD-OCT control software | Z-Lab | Custom software for image acquisition and pacing control developed in the Zhou lab | |
| SD-OCT imaging and optogenetic pacing system | Z-Lab | Imaging and optogenetic pacing system developed in the Zhou lab (~$50k BOM) | |
| Sucrose | Carolina | 89-2871 | |
| w[*]; P{y[+t7.7] w[+mC]=UAS-eNpHR-YFP}attP2 | Bloomington Drosophila Stock Center (BDSC) | stock # 41752 | eNpHR2.0 transgenic line |
| w[*]; P{y[+t7.7] w[+mC]=UAS-ReaChR}su(Hw)attP5/CyO | Bloomington Drosophila Stock Center (BDSC) | stock # 53748 | ReaChR transgenic line |
| w[1118]; P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM3 Sb[1] | Bloomington Drosophila Stock Center (BDSC) | stock # 48396 | Heart specific GAL4 driver containing Hand gene regulatory fragment |
| y[*] w[*]; P{w[+mC]=UAS-2xEGFP}AH3 | Bloomington Drosophila Stock Center (BDSC) | stock #6658 | GFP reporter line |
| Yeast extract | Lab Scientific bioKEMIX | 978-907-4243 |
References
- Nature Methods. Method of the Year 2010. Nature Methods. 8, 1(2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deisseroth, K. Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience. 18 (9), 1213-1225 (2015).
- Tsai, H. -C. Phasic firing in dopaminergic neurons is sufficient for behavioral conditioning. Science. 324 (5930), 1080-1084 (2009).
- Wykes, R. C., et al. Optogenetic and potassium channel gene therapy in a rodent model of focal neocortical epilepsy. Science Translational Medicine. 4 (161), (2012).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nature Reviews Cardiology. 18 (5), 349-367 (2021).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
- Arrenberg, A. B., Stainier, D. Y. R., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Nussinovitch, U., Gepstein, L. Optogenetics for in vivo cardiac pacing and resynchronization therapies. Nature Biotechnology. 33 (7), 750-754 (2015).
- Nyns, E. C. A., et al. An automated hybrid bioelectronic system for autogenous restoration of sinus rhythm in atrial fibrillation. Science Translational Medicine. 11 (481), (2019).
- Bier, E., Bodmer, R. Drosophila, an emerging model for cardiac disease. Gene. 342 (1), 1-11 (2004).
- Wolf, M. J., Amrein, H., Izatt, J. A., Choma, M. A., Reedy, M. C., Rockman, H. A. Drosophila as a model for the identification of genes causing adult human heart disease. Proceedings of the National Academy of Sciences of the United States of America. 103 (5), 1394-1399 (2006).
- Yu, L., Lee, T., Lin, N., Wolf, M. J. Affecting rhomboid-3 function causes a dilated heart in adult Drosophila. PLOS Genetics. 6 (5), 1000969(2010).
- Cooper, A. S., Rymond, K. E., Ward, M. A., Bocook, E. L., Cooper, R. L. Monitoring heart function in larval Drosophila melanogaster for physiological studies. Journal of Visualized Experiments. (33), e1596(2009).
- Zhu, Y. C., Yocom, E., Sifers, J., Uradu, H., Cooper, R. L. Modulatory effects on Drosophila larva hearts: Room temperature, acute and chronic cold stress. Journal of Comparative Physiology. B, Biochemical, Systemic, and Environmental Physiology. 186 (7), 829-841 (2016).
- Zhu, Y. C., Uradu, H., Majeed, Z. R., Cooper, R. L. Optogenetic stimulation of Drosophila heart rate at different temperatures and Ca2+ concentrations. Physiological Reports. 4 (3), 12695(2016).
- Malloy, C., et al. Using optogenetics to assess neuroendocrine modulation of heart rate in Drosophila melanogaster larvae. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural, and Behavioral Physiology. 203 (10), 791-806 (2017).
- Men, J., et al. Drosophila preparation and longitudinal imaging of heart function in vivo using optical coherence microscopy (OCM). Journal of Visualized Experiments. (118), e55002(2016).
- Choma, M. A., Izatt, S. D., Wessells, R. J., Bodmer, R., Izatt, J. A. In vivo imaging of the adult Drosophila melanogaster heart with real-time optical coherence tomography. Circulation. 114 (2), 35-36 (2006).
- Li, A., et al. Changes in the expression of the Alzheimer's disease-associated presenilin gene in drosophila heart leads to cardiac dysfunction. Current Alzheimer Research. 8 (3), 313-322 (2011).
- Li, A., et al. Silencing of the Drosophila ortholog of SOX5 in heart leads to cardiac dysfunction as detected by optical coherence tomography. Human Molecular Genetics. 22 (18), 3798-3806 (2013).
- Men, J., Li, A., Jerwick, J., Li, Z., Tanzi, R. E., Zhou, C. Non-invasive red-light optogenetic control of Drosophila cardiac function. Communications Biology. 3 (1), 1-10 (2020).
- Alex, A., Li, A., Tanzi, R. E., Zhou, C. Optogenetic pacing in Drosophila melanogaster. Science Advances. 1 (9), 1500639(2015).
- Stanley, C. E., Mauss, A. S., Borst, A., Cooper, R. L. The effects of chloride flux on Drosophila heart rate. Methods and Protocols. 2 (3), 73(2019).
- Lindsley, D. L., Zimm, G. G. The Genome of Drosophila melanogaster. , Elsevier. (1992).
- Bloomington Drosophila Stock Center. , Available from: https://bdsc.indiana.edu/information/recipes/germanfood.html (2022).
- Dong, Z., et al. FlyNet 2.0: Drosophila heart 3D (2D + time) segmentation in optical coherence microscopy images using a convolutional long short-term memory neural network. Biomedical Optics Express. 11 (3), 1568-1579 (2020).
- Deisseroth, K. Optogenetics. Nature Methods. 8 (1), 26-29 (2011).
- Backhaus, B., Sulkowski, E., Schlote, F. W. A semi-synthetic, general-purpose medium for Drosophila melanogaster. Drosophila Information Service. 60, 210-212 (1984).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139 (10), 56(2019).
- Wolf, M. J., Rockman, H. A. Drosophila, genetic screens, and cardiac function. Circulation Research. 109 (7), 794-806 (2011).
- Choma, M. A., Suter, M. J., Vakoc, B. J., Bouma, B. E., Tearney, G. J. Physiological homology between Drosophila melanogaster and vertebrate cardiovascular systems. Disease Models & Mechanisms. 4 (3), 411-420 (2011).
- Ocorr, K., Vogler, G., Bodmer, R. Methods to assess Drosophila heart development, function and aging. Methods [Supplement to Methods in Enzymology]. 68 (1), 265-272 (2014).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Disease Models & Mechanisms. 9 (3), 235-244 (2016).
- Rotstein, B., Paululat, A. On the morphology of the Drosophila heart. Journal of Cardiovascular Development and Disease. 3 (2), 15(2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved