Method Article
ショウ ジョウバエのメラノガスター モデルの開発による心機能のイメージングと光遺伝学的制御
要約
本プロトコールは、OCT画像化および光遺伝学的心臓ペーシングのために、心臓においてeNpHR2.0またはReaChRオプシンを発現するショウジョウバエメラノガスターの生成を記載する。ショウジョウバエOCTイメージングおよび心拍調節のための詳細な指示は、異なる発達段階における生きた動物における回復可能な心停止、徐脈、および頻脈のシミュレーションを含む、報告されている。
要約
ショウジョウバエの メラノガステr(ショウジョウバエ)をモデル生物として使用することで、細胞組織やゲノム調査から行動研究まで、生物科学の多くの分野で大きな進歩が見られました。蓄積された科学的知識のために、近年、 ショウジョウバエ は心臓病を含むヒトの疾患をモデル化する分野に持ち込まれました。提示された研究は、赤色光(617nm)を使用し、侵襲的な手順なしで、生きている生物全体の文脈で心機能を監視および操作するための実験システムを記述する。心臓の制御は、光遺伝学的ツールを使用して達成された。光遺伝学は、光感受性トランスジェニックオプシンの発現およびそれらの光学的活性化を組み合わせて、目的の生物学的組織を調節する。この研究では、カスタム統合光コヒーレンス断層撮影(OCT)イメージングおよび光遺伝学的刺激システムを使用して、第3齢幼虫および初期の蛹発生段階で機能している D.メラノガスター 心臓を視覚化および調節した。UAS/GAL4二重遺伝子系は、ハロロドプシン(eNpHR2.0)および赤方シフトチャネルロドプシン(ReaChR)を、特にハエ心臓において発現させるために使用された。ライブOCTイメージングおよび光遺伝学的ペーシングのための D.メラノガスター の準備に関する詳細が提供される。ラボで開発された統合ソフトウェアがイメージングデータを処理して、 ショウジョウバエ の心機能の視覚的なプレゼンテーションと定量的特性を作成しました。この結果は、eNpHR2.0活性化によって引き起こされる心停止および徐脈を開始し、ReaChR活性化時に心臓ペーシングを行うことの実現可能性を実証する。
概要
2010年末、Nature Methods誌は、オプトジェネティクスをMethod of the Year1に選出しました。光によって調節される遺伝的ツール(トランスジェニックオプシン)を使用して、前例のない精度とスピードで目的の生物学的組織を制御することは、新しいアプリケーションのための洪水の扉を開きました。今日まで、業績の大部分は神経科学に属しています。この技術は、単一ニューロン2 の精密制御の新しい方法として導入され、生体認知機能3の領域における発見に発展しました。最初から、神経科学者は生物全体の行動を調節する能力を実証しました。マウスにおけるChR2オプシンの発現および光活性化は、ドーパミン作動性ニューロンの活性化を引き起こし、行動条件付けを駆動するのに十分であった4。げっ歯類脳のてんかん焦点に送達されたハロロドプシンNpHR2.0を含むニューロンのサブセットの光遺伝学的阻害は、脳波発作の減弱をもたらした5。
心臓病学における光遺伝学的応用は、着実なペースで発展している6.ChR2は、心筋細胞培養物およびマウスにおいて首尾よく発現された。心臓のペーシングは、青色光の点滅によって実施された(生きた動物に移植された繊維を用いて実施された)7。ゼブラフィッシュでは、ChR2が発現し、ペースメイキング心臓領域を同定するために使用された。NpHR活性化は心停止を誘発した8.光遺伝学的心臓ペーシングは、新しいペーシングおよび再同期療法を開発するためのユニークな可能性を秘めています9。自家性不整脈終結系を確立する試みも最近報告されている10.
広範な研究と新しい治療法の開発には、細胞培養から哺乳類まで、さまざまなモデルシステムの適用が必要です。脊椎動物の心臓は非常に複雑な器官です。心筋細胞(CM)は、すべての心臓細胞の3分の1を構成する。他の細胞には、ニューロン、血管平滑筋細胞、および非興奮性細胞(すなわち、内皮細胞、線維芽細胞、および免疫細胞)が含まれる。CM細胞培養の研究は、得られた結果の翻訳をヒトの医療用途に限定する。哺乳類モデル生物の遺伝子操作は限られており、時間がかかる。より小さな無脊椎動物モデルには多くの利点があります。彼らの心血管系は、すべての重要な組織学的要素を運びます。ショウジョウバエメラノガスター(ショウジョウバエ)は、心疾患を含むヒト疾患に関連する遺伝子の役割を調査するための単純で強力な遺伝子モデルシステムである11、12、13。短命の動物として、ショウジョウバエは、生涯を通じて追跡できる年齢または疾患依存性の心機能変化をモデル化する絶好の機会を表しています14,15,16,17。フルーツフライの心臓管は、キューティクル表面から200μm以内の体の背側に位置し、可視光から近赤外光が心臓管に到達することを可能にする。この解剖学的特徴は、既存の光遺伝学的ツールを使用してショウジョウバエの心臓の非侵襲的な光学ペーシングを可能にする。
ショウジョウバエの心臓を監視するために、赤色光LED励起モジュールを内蔵したカスタムスペクトルドメイン光コヒーレンス断層撮影(SD-OCT)イメージングシステムが開発されました18。比較的単純なショウジョウバエ心臓の形態学的およびリズミカルな変化は、この非侵襲的な生物医学的画像化技術12、19、20、21を用いて容易に分析することができる。強化された光学的切断性能とミクロンスケールの空間分解能により、OCTは、第3齢幼虫および初期蛹18を含むさまざまな発生段階におけるショウジョウバエ心臓の構造を調査し、機能を監視するために首尾よく使用されてきた18。このシステムはまた、無傷の動物におけるショウジョウバエの心臓状態の同時モニタリングおよび刺激を可能にする。OCTシステムの概略図を図1に示す。SD-OCTシステムは、光源としてスーパールミネッセンスダイオード(SLD)を使用しています(中心波長:850nm±10nm、FWHM:165nm、材料表参照)。10倍の対物レンズを使用して、OCTイメージングシステムは、空気中で約4.4μm、組織で約3.3μmの軸方向分解能および約2.8μmの横方向分解能を達成することができ、フライハート構造の細かい詳細を解決するのに十分である18,22。リファレンスアームとサンプルアームからの反射光の干渉信号は、2048ピクセルのラインスキャンカメラを備えた分光器を使用して検出されます(最大ラインレート:80kHz、材料表を参照)。測定されたシステム感度は約95.1dBです。各BモードOCTスキャンは、xz画像平面に断面画像を生成する。繰り返しBモード画像が同じ位置で取得され、〜30秒以上にわたって鼓動する心臓をキャプチャするMモード画像18、22、23が作成されます。Mモードイメージングのフレームレートは約125フレーム/秒で、ショウジョウバエの心臓の鼓動ダイナミクスを捉えるのに十分です。
ショウジョウバエの心機能の光遺伝学的調節のために、617nmのLED光源を備えた照明モジュールがSD-OCTシステムのサンプルアームと統合されています。刺激光は、試料表面上の直径約2.2mmのスポットに、撮像フォーカススポットと同じ位置に集光される。照明モード(光強度、パルス幅、およびデューティサイクル)を制御し、光パルス刺激周波数を調整し、LEDモジュール照明とMモードOCT画像化取得22を同期させるために、カスタム記述されたソフトウェアが利用される。
最近の出版物は、UAS/GAL4遺伝子系を用いて時空間的に調節されたChR2、ReaChR、およびeNpHR2.0オプシンからなるショウジョウバエトランスジェニック系を記載した。得られた結果は、eNpHR2.0の赤色光活性化によって引き起こされる心停止および徐脈を開始する能力、およびChR2の青色光活性化によって引き起こされるより高い周波数の心臓ペーシングを実証した。 同様のペーシング実験は、赤色光照明によって誘導可能な別のチャネルロドプシンReaChRを用いて実施された22、23、24。記載されたすべての実験におけるオプシン発現は、24B-GAL4によって駆動され、そこでは、心筋細胞および周囲の筋肉細胞を含む広範囲の組織においてオプシン発現が観察された。現在の研究では、心臓特異的eNpHR2.0およびReaChRオプシン発現を達成するために、24B-GAL4をHand-GAL4ドライバに置き換えた。
全体として、提示された実験結果は、回復可能な心停止および誘導性徐脈および頻脈心臓状態を示す。トランスジェニック ショウジョウバエ モデルを作成し、生きた動物におけるOCTイメージングと光遺伝学的ペーシング実験を同時に実施するためのステップバイステップの手順を含む詳細なプロトコルが提供されています。
プロトコル
本研究では、eNpHR2.0トランスジェニック株 w[*];P{y[+t7.7] w[+mC]=UAS-eNpHR-YFP}attP2, ReaChR トランスジェニック ライン w[*];P{y[+t7.7] w[+mC]=UAS-ReaChR}su(Hw)attP5/CyO、および ハンド 遺伝子調節フラグメントw [1118]を含む心臓特異的GAL4ドライバー;P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM3 Sb[1] (このドライバ ストックは Hand-GAL4 として表示されます) が使用されました。 y[*] w[*];P{w[+mC]=UAS-2xEGFP}AH3 が GFP レポーター回線として使用されました。言及されたショウジョウバエストックは、ブルーミントン ショウジョウバエ ストックセンター(BDSC、 材料表を参照)から入手し、標準的なコーンミール培地上で室温または18°Cで維持した。本研究で開発された ショウジョウバエ モデルは、共同研究の要請に応じて入手可能である。
1 .ショウジョウバエの 遺伝的交配と培地調製
- 第3染色体バラン サーTM3 Sb[1]をTM6 Sb Tbに変更し、w[1118]を作成する。P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM6 Sb Tb (Hand-GAL4/TM6 Sb Tb). 交差方式については 、補足図 1 を参照してください。通常のコーンミール培地でバイアルにクロスを設定します。
注: Tb マーカーの存在により、ユーザーはオプシン導入遺伝子およびGAL4ドライバーを含む幼虫および蛹を、オプシンを含むがドライバー25を含まない動物と区別することができる。 - 遺伝子交配を、特別に調合された全トランス網膜I(ATR)含有培地( 材料表を参照)上の25°C、湿度70%のインキュベーターに暗所で、幼虫収集の場合は5日間、蛹収集の場合は6日間保管します。
- バイアルあたり、5人の ハンドGAL4 / TM6 Sb Tb 処女女性とUASオプシン株(eNpHR2.0、またはReaChR)の2〜3人の男性を組み合わせる。eNpHR2.0 および ReaChR オプシンのクロス図を、それぞれ 図 2A および 図 2B を参照してください。
- 翌日、ATR含有培地バイアルを準備する。
- BDSC26の指示に従って半定義食品を準備します。スクロースとグルコースの代わりに、スクロース(5.14 g / 100 mL)のみを追加します。一定の攪拌で〜60°Cに冷却する。
- ナローフライバイアルを調製し、各バイアルに50μLの100mM ATR-エタノール溶液を加える。
- 血清学的ピペットを用いて、フライフードを狭いフライバイアル、バイアルあたり5mLに処分する。10秒間の最高速度での渦。
- バイアルを差し込み、暗い布で包んで光から保護します。バイアルを少なくとも12時間(一晩)乾燥させます。
- 翌日、ステップ1.3から着実に卵を産むハエを移します。ATR含有食品を含むバイアルに(ステップ1.4.4。バイアルでラックを光から保護します。
- 24〜48時間後(産まれた卵の数によって異なります)、バイアルの過剰人口を防ぐために両親を捨てます。
- 非Tb 子孫を収集し、心臓イメージングのためにそれらを使用します。
注:幼虫期と蛹期における表現型の違いを 図2Cに示します。試料作製手順の概要とおおよそのタイムラインを 図3に示します。
2.ショウジョウバエの心臓の光遺伝学的制御
- バイアルから UAS-opsin/Hand-GAL4幼虫/ 蛹を摘み取り(ステップ1.7)、ティッシュを貼り、ペイントブラシを使用して体表面から媒体を優しく拭き取ります。
- 顕微鏡スライドを準備し、中央に小さな両面テープを置きます。
- ブラシまたは細かいピンセットを使用して、幼虫/蛹をテープ表面にそっと置き、背側を上にしてスライドの長辺に垂直にします。幼虫/蛹をテープ表面に付着させるために穏やかな圧力をかける。
- スライドをイメージングステージの上に置き、幼虫/蛹を下に向けて置きます。
- レーザー制御ソフトウェアでOCT光源をオンにします( 材料表を参照)。カスタムメイドのSD-OCTコントロールソフトウェアを開き、[ プレビュー] ウィンドウをクリックします。
- SD-OCTソフトウェアでスキャンパラメータを設定します。
注:目標は、鼓動する心臓の最適なイメージングのためにサンプルを整列させることであり、X範囲とY範囲を選択すると、心臓の領域がカバーされます。このステップでは、A スキャンと B スキャンの両方の回数は 400 です。x方向とy方向の範囲は〜490μmと〜537μmで、それぞれ心臓の2つの直交断面(xzとyz)を示しています。 - マイクロマニピュレータを使用してサンプルステージを制御し、フライハートに焦点を合わせます。焦点位置を調整して、フライキューティクル表面からの光の反射を最小限に抑えます。反射を最小限に抑えるために、幼虫/蛹の表面に鉱物油を塗布することを検討してください。
注:オイルは、テープの粘着特性を損なうことにより、動物の動きのリスクを高める可能性があります。 - フライハートが歪み、組織によって遮断されることなく、そして無視できない影や反射なしに画像ウィンドウで完全に見えるようにしてください。それ以外の場合は、ステップ 2.7 に戻ります。
- MモードOCT画像取得のスキャンパラメータを設定します。
メモ: A スキャンの数は、ステップ 2.7 と比較して減少します。より速いフレームレートは、フライハート(数Hz)の鼓動ダイナミクスをキャプチャするために。Bスキャンの数は、Mモードイメージングの繰り返しフレーム数を示し、記録時間と使用可能なシステムメモリに基づいて調整できます。この実験では、128回のAスキャンで約125フレーム/秒の速度が得られ、4,000回の繰り返しBスキャンが記録され、約32秒の連続記録が得られます。 - 赤色光刺激パルスなしで5組の制御データを取得し、安静時心拍数(RHR)を計算します。
- カスタムOCT制御ソフトウェアでペーシング刺激用の光パルスを設計します。「設定」で、異なる刺激プロトコルに従ってパルス周波数、パルス幅、刺激持続時間、および待ち時間を制御するために、設計された光パルスシーケンスを追加します。
注:RHRは、光照明なしで対照実験から測定され、タキペーシングおよびブレイディペーシング実験22のために光がパルス化されるべき周波数を計算するために使用される。 - ライトコントローラソフトウェア( 材料表を参照)を開き、赤色光パルスを生成します。「モード選択」で パルスモード を選択します。「パルスプロファイル」設定の図をダブルクリックし、 フォロワーモードを選択します。OFF強度を0のままにし、実際の電力密度を計算する際にON強度の割合を設定します。
メモ: 刺激光パルスは、ステップ 2.12 の設定に従って、OCT 制御ソフトウェアからの信号によってトリガされます。 - OCT制御ソフトウェアの[取得]をクリックして、光刺激でショウ ジョウバエ の心臓を鼓動させるMモードビデオ を取得します 。測定を5倍繰り返します。
3. 画像解析
- カスタム開発のフライハートセグメンテーションソフトウェアを開きます。
- [ファイル の選択 ]をクリックし、表示されるGUIで分析するファイルを選択します。
- 上部のテキストボックスに、心臓領域の垂直方向と水平方向の両方の境界をピクセル単位で入力します。[ サイズ変更]をクリックします。下部のスライダーを使用して、心臓領域全体が表示され、コレクション全体のボックス全体がいっぱいになっていることを確認します。そうでない場合は、このプロセスを繰り返して境界を調整します。
- [予測]をクリックして、心臓領域を予測します。プログラムはコレクション内のすべてのスライスを通過し、約3分かかる心臓領域を選択します。
- 予測が完了したら、 HRプロット をクリックします。これにより、時間の経過とともに心臓領域のプロットを表示する新しいウィンドウが開きます。正しいピークまたはバレー領域が選択されていることを確認します。 パルス を選択してから HR を選択して最終的な図を生成し、機能パラメータは.csvファイルに同時に保存されます。
結果
D.メラノガスター動物は、心臓管内で赤色光感受性オプシンeNpHR2.0またはReaChRを発現し、各UAS−オプシントランスジェニック系統とHand−GAL4ドライバーとの間の交配から子孫を得ることによって生成した。GAL4ドライバーの組織特異性は、GFP発現をイメージングすることによって検証した(図4)。ショウジョウバエの3齢幼虫および発生期初期の蛹を用いて、赤色光によるeNpHR2.0およびReaChR活性化の効果を実証した。LEDによって送達される〜617nmの赤色光パルスを設計し、幼虫/蛹を照らし、心臓のeNpHR2.0およびReaChRを活性化した。報告されたNpHRの最大応答波長は約580nmであり、ReaChRの応答波長は約600nmであるが、617nmの光照明は、オプシン発現心臓組織22への光エネルギー送達を増強してより深く浸透することができる。
倒立顕微鏡セットアップで背側を下にして顕微鏡スライドに取り付け、幼虫/蛹はA7ボディセグメントに向けられたLED光ビームによって照らされました。身体断面画像の例を図5A及び図6Aに示す。心臓は、4,000フレームからなるビデオ録画では、収縮し、拡張する円形として現れる(補足ビデオ1-6)。異なる心臓の状態を模倣するために、4種類の光パルスが設計されました。図5Bに示すように、5秒の待ち時間の後10秒持続する単一のパルスは、eNpHR2.0によって誘発される回復可能な心停止を生じた。eNpHR2.0によって媒介される安静時心拍数(RHR)よりも遅い周波数での心臓ペーシングについて、RHR/2およびRHR/4に等しいペーシング周波数が8秒間持続し、その間の待ち時間が6sの2つの光パルスシーケンスが使用された(図5C)。各光パルスシーケンスのデューティサイクルは90%であった。この光刺激レジメンは、徐脈を連想させる心臓病を引き起こした。ReaChRの活性化により心拍数を増加させる刺激パターンは、それぞれRHR + 0.5Hz、RHR + 1Hz、およびRHR + 1.5Hzの周波数で、パルス幅が20msの3つの一連の光パルスで構成されていました(図5D)。このパルスレジメンは、頻脈性心臓病を引き起こすことを目的としていた。光出力密度は、すべての実験中に7.49mW/mm2であった。対照実験では、光照明は設定しなかった。
各実験変異体を5回記録した。フライハートのMモードビデオは、FlyNet 2.027を使用して2Dマスクに処理された。このソフトウェアは、心臓領域を自動的にセグメント化して心機能データセットを生成します。プログラムは、心拍数(HR)、拡張末期次元(EDD)、および収縮終期次元(ESD)、フラクショナル短縮(FR)、拡張末期領域(EDA)、収縮終期領域(ESA)など、鼓動する心臓の機能パラメータの正確な定量化を生成するために、必要に応じて手動でさらに補正することができる各フレーム内の心臓のマスクを提供する。心拍数は、時間の経過とともに心臓領域を分析することによって測定されます。光パルスのないコントロールビデオは、各動物のベースライン心拍数(例えば、RHR)を確立するために使用される。
図5Bおよび図6Bは、幼虫および蛹において、それぞれ赤色光(617nm)を用いたHand>eNpHR2.0活性化によって引き起こされる10秒間の長い心停止を示す。赤いライトが点灯すると、ショウジョウバエの心臓は鼓動を停止し、ライト照明が終了するまでこの状態のままでした。心臓機能は、赤色のライトが消された後、回復した。オプシンを発現させなかった動物(「オプシンなし」対照)は、赤色光照明に応答しなかった(補足図2Aおよび補足図3A)。10秒の赤色光照明がオンにされなかったHand>eNpHR2.0動物を用いた対照実験(「光なし」対照)は、正常な心臓拍動を示した(補足図4Aおよび補足図4C)。
Hand>eNpHR2.0動物を用いて、RHRよりも低い周波数で赤色光パルスを印加した。心臓収縮周波数は、光信号に続いて減少した。この遅い心拍数は、心臓不整脈の1つのタイプ、徐脈を模倣する(それぞれ幼虫および蛹の図5Cおよび図6C)。遅い心臓ペーシングは、「オプシンなし」(補足図2Bおよび補足図3B)および「光なし」(補足図4Aおよび補足図4C)対照実験では観察されなかった。
心拍数の増加は、与えられた動物のRHRよりも高い周波数で赤色光パルス列で Hand>ReaChR オプシンを活性化することによって達成することができる。異なる刺激周波数(例えば、RHR + 0.5Hz、RHR + 1Hz、RHR + 1.5Hz)での一連の3つの光パルス列を、 Hand>ReaChR 幼虫および蛹の心臓に適用した。得られたデータは、光パルス後の心拍数の増加をはっきりと示している(幼虫および蛹についてそれぞれ図5D および 図6D )。これらの実験で実証された心臓の状態は、頻脈を模倣する。陰性対照実験は、補足図 2C、補足図3C、および 補足図4B、Dに示されている。
全体として、結果は、 D. melanogasterのトランスジェニック動物モデルにおける様々な発達段階における心臓リズムの非侵襲的および特異的な光遺伝学的制御の実現可能性を実証する。
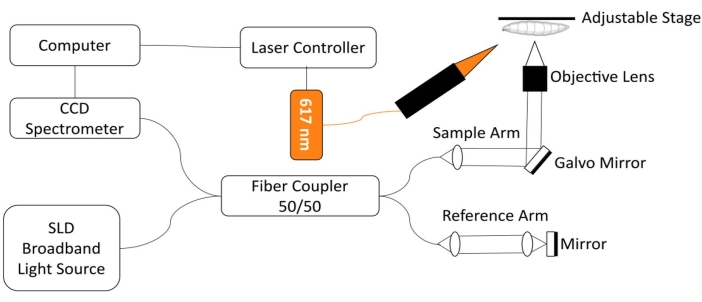
図1:ショウジョウバエの心機能の光遺伝学的制御のための617nmのLEDモジュールと統合されたOCTイメージングシステム 。この図の拡大版を見るにはここをクリックしてください。
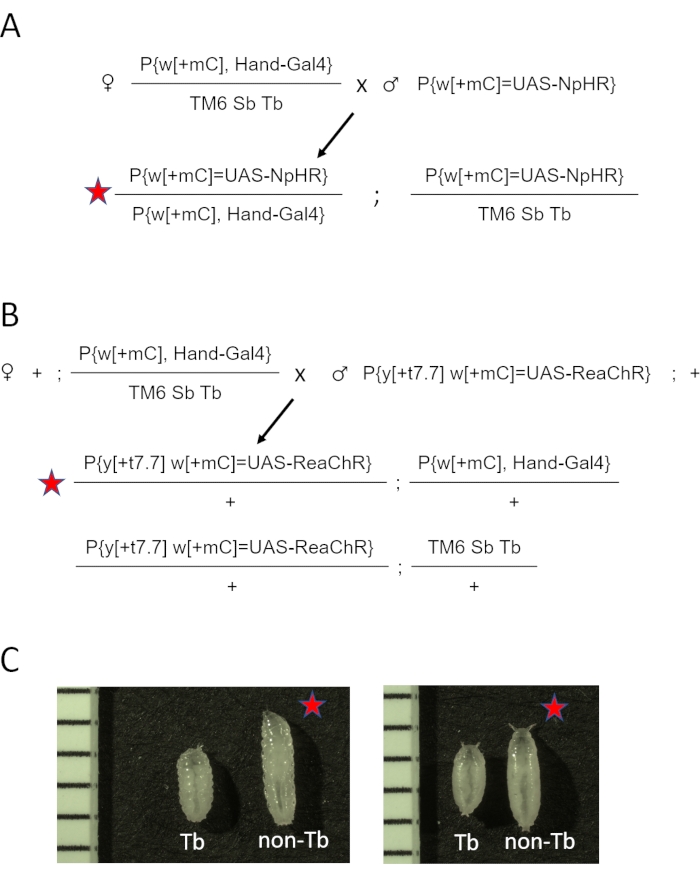
図2:心臓にオプシンを発現するD.メラノガスター動物の生成(A)遺伝子交配図。雌ハンドGAL4/TM6 SbTbは、eNpHR2.0を保有する雄に交配した。得られたHand-GAL4/eNpHR2.0子孫(赤い星印)をOCTイメージングのために収集し、Hand-GAL4/TM6 Sb Tbを表現型の外観に基づいて廃棄した。(B)遺伝子交配図。雌ハンドGAL4/TM6 SbTbは、ReaChRを保有する雄に交配された。得られたHand-GAL4/ReaChR子孫(赤い星印)をOCTイメージングのために収集し、Hand-GAL4/TM6 Sb Tbを表現型の外観に基づいて廃棄した。(C) ハンド-GAL4/オプシン(赤い星)とハンド-GAL4/TM6 Tbの子孫の表現型の違い。TM6染色体上にTb遺伝子変異を有する動物は、正常な非Tb幼虫または蛹と比較して「タビー」体型を有する。左側のパネルは幼虫を示しています。右側のパネルは初期の蛹を示しています。画像には、1mmマークの定規も含まれています。この図の拡大版を表示するには、ここをクリックしてください。
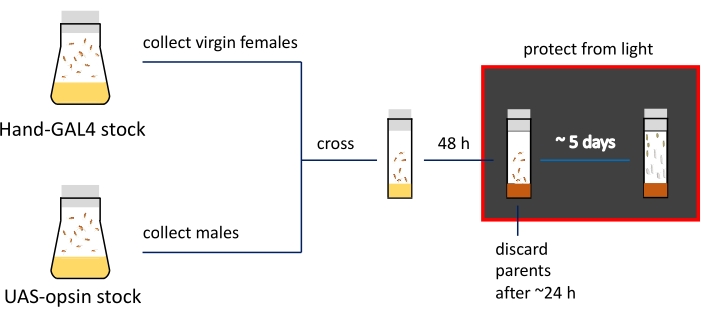
図3:イメージング準備手順の概略プレゼンテーションとタイムライン。 親の在庫はフライボトルに保管されています。処女の女性と男性は、通常の食物(黄色で示される)で満たされた狭いバイアルで交差する。積極的に産卵するハエは、ATR含有培地(茶色で示されている)バイアルに移される。発達中の子孫を持つバイアルは、このステップから暗闇の中に保管する必要があります。3齢幼虫および初期の蛹は、イメージングのためにバイアル壁から収集される。 この図の拡大版を表示するには、ここをクリックしてください。
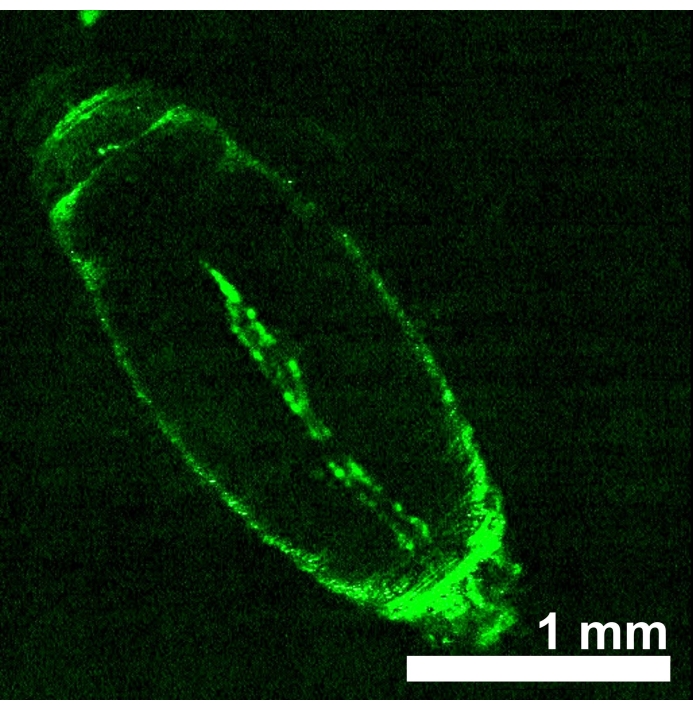
図4:ハンド-GAL4(BDSC 48396)によって駆動されるUAS-GFP(BDSC 6658)を発現するD. melanogaster初期蛹。蛍光パターンは、Hand-GAL4ドライバーの心臓特異性を確認します。この図の拡大版を表示するには、ここをクリックしてください。
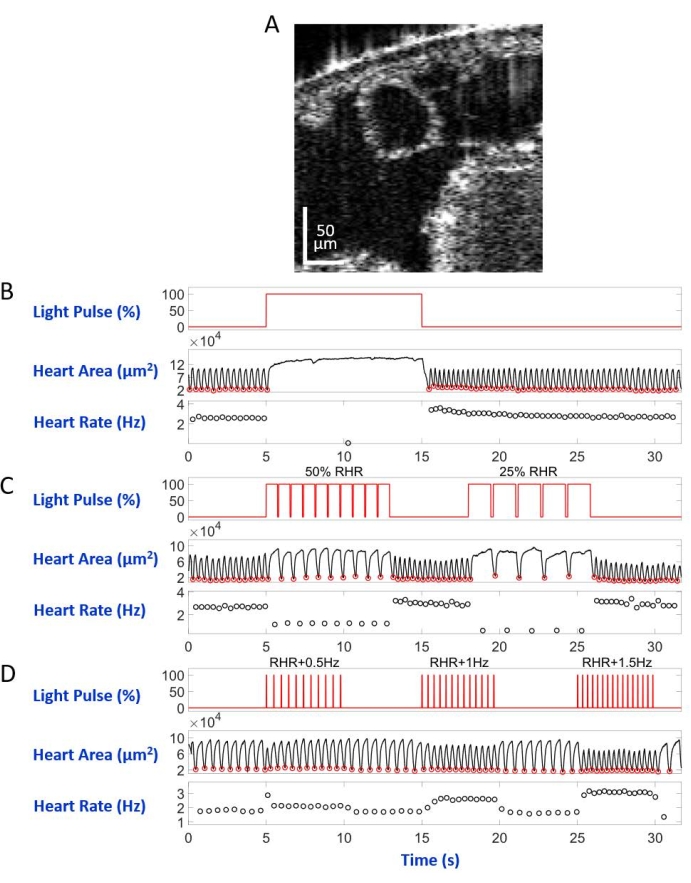
図5: D.メラノガスター 幼虫における心停止、徐脈、頻脈のシミュレーション。 (A)幼虫の体断面のOCT画像。心臓は体の表面の下に円として現れます。(B)回復可能な心停止のグラフィックプレゼンテーション。上段のパネルは、赤色光照明のタイミング(X軸)(Y軸、光源電力レベルパーセンテージ)を示しています。中央のパネルは、心臓領域(Y軸、平方マイクロメートル)の経時的な変化(X軸)を示します。下のパネルは、経時的な心拍数の変化(Y軸、ヘルツ)(X軸)を示しています。(C)eNpHR2.0媒介性回復可能な徐脈のグラフィックプレゼンテーション。上のパネルは、赤光照明のパルスを示し、RHRの50%およびRHRの25%の2つの徐脈期間を誘発する。心拍領域と心拍数の変化は、それぞれ中央パネルと下部パネルに表示されます。(D)活性化ReaChRによる心臓ペーシングのグラフィックプレゼンテーション。上のパネルは、RHR + 0.5 Hz、RHR + 1 Hz、およびRHR + 1.5 Hzの周波数で発生する一連の20 msの赤色光パルスを示しています。心臓の収縮は、中央および下部のパネルに示すように、光パルス周波数に従います。 この図の拡大版を表示するには、ここをクリックしてください。
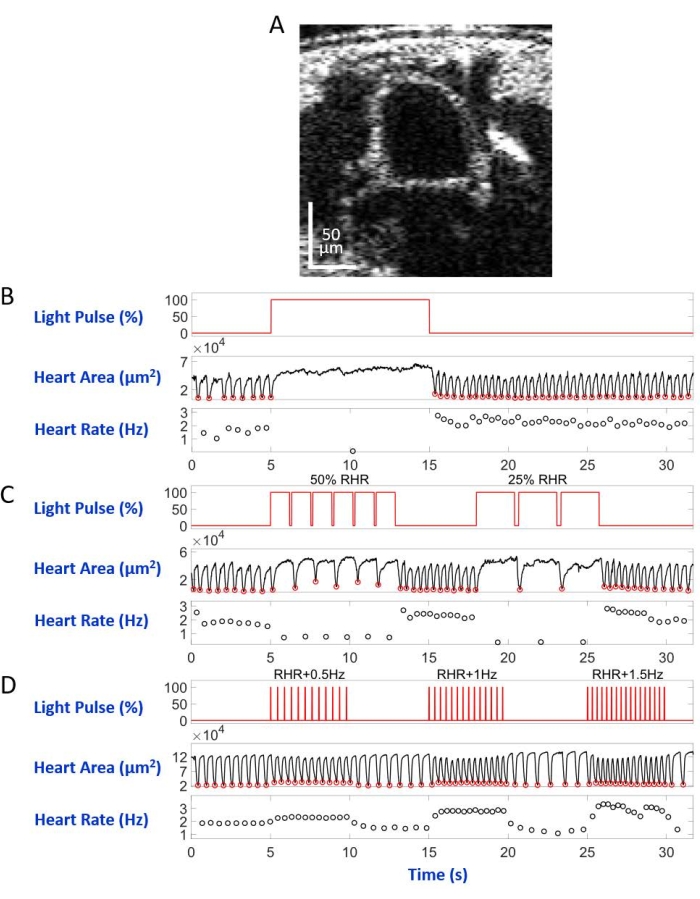
図6: D.メラノガスター 蛹における心停止、徐脈、頻脈のシミュレーション (A)蛹体断面のOCT画像。心臓は体の表面の下に円として現れます。(B)回復可能な心停止のグラフィックプレゼンテーション。上段のパネルは、赤色光照明のタイミング(X軸)(Y軸、光源電力レベルパーセンテージ)を示しています。中央のパネルは、心臓領域(Y軸、平方マイクロメートル)の経時的な変化(X軸)を示します。下のパネルは、経時的な心拍数の変化(Y軸、ヘルツ)(X軸)を示しています。(C)eNpHR2.0媒介性回復可能な徐脈のグラフィックプレゼンテーション。上のパネルは、赤光照明のパルスを示し、RHRの50%およびRHRの25%の2つの徐脈期間を誘発する。中央パネルと下部パネルには、それぞれ心面積と心拍数の変化が表示されます。(D)活性化ReaChRによる心臓ペーシングのグラフィックプレゼンテーション。上のパネルは、RHR + 0.5 Hz、RHR + 1 Hz、およびRHR + 1.5 Hzの周波数で一連の20 msの赤色光パルスを示しています。心臓の収縮は、中央および下部のパネルに示すように、光パルスの周波数に従います。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1:TM3 Sbバランサー染色体をTM6 Sb Tbで置き換えるための遺伝子交配。処女雌ハンドGAL4 w+/TM3 Sbは、nub-GAL4NP3537タブ-GAL80ts w+/TM6 Sb Tbオスと交配した。処女雌および雄を含む手-GAL4 w+/TM6 Sb Tb子孫を選択した(タビー体型と組み合わせた色素沈着した眼のスクリーニング)。選択されたハエは、安定したストックを確立するために自己交配された。このファイルをダウンロードするには、ここをクリックしてください。
補足図2:対照実験では、野生型(wt)幼虫の心臓リズムは赤色光照明時に変化しない。 (a)wt幼虫において赤色光照明中に心停止は観察されなかった。上のパネルは、Mモードの心臓画像を示しています。赤い線は照明のタイミングを示します。中央と下部のパネルは、32秒のイメージング時間中の心臓領域と心拍数を示しています。(B,C)赤色光パルスは、重量幼虫の心拍数を変化させない。上のパネルは、Mモードの心臓画像を示しています。赤い線は照明のタイミングを示します。中央と下部のパネルは、32秒のイメージング時間中の心臓領域と心拍数を示しています。 このファイルをダウンロードするには、ここをクリックしてください。
補足図3:対照実験では、野生型(wt)蛹の心臓リズムは赤色光照明時に変化しない。 (a)wt幼虫において赤色光照明中に心停止は観察されなかった。上のパネルは、Mモードの心臓画像を示しています。赤い線は照明のタイミングを示します。中央と下部のパネルは、32秒のイメージング時間中の心臓領域と心拍数を示しています。(B,C)赤色光パルスは、体重蛹の心拍数を変化させない。上のパネルは、Mモードの心臓画像を示しています。赤い線は照明のタイミングを示します。中央と下部のパネルは、32秒のイメージング時間中の心臓領域と心拍数を示しています。 このファイルをダウンロードするには、ここをクリックしてください。
補足図4:Hand>eNpHR2.0またはHand>ReaChRを発現するD.メラノガスター幼虫および蛹は、赤色光照明なしでOCTイメージング中に有意なHR変化を示さない。(A)手>eNpHR2.0幼虫の心拍数。(B)ハンド>ReaChR幼虫の心拍数。(C) 手>eNpHR2.0蛹の心拍数。(D) 手>ReaChR蛹の心拍数。このファイルをダウンロードするには、ここをクリックしてください。
補足ビデオ1:活性化されたeNpHR2.0は、D.メラノガスター幼虫に心停止を引き起こす。このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオ2:活性化されたeNpHR2.0は、D.メラノガスター蛹に心停止を引き起こす。このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオ3:D.メラノガスター幼虫におけるeNpHR2.0媒介性回復可能な徐脈。このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオ4:D.メラノガスター蛹におけるeNpHR2.0媒介性回復可能な徐脈。このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオ5:D.メラノガスター幼虫における活性化ReaChRによる心臓ペーシング。このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオ6:D.メラノガスター蛹における活性化ReaChRによる心臓ペーシング。このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
オプシンの発現が心臓だけでなく周囲の筋肉組織でも駆動された以前の報告と比較して、本研究は心臓特異的ドライバー であるHand-GAL4を用いて報告している。この新しい Hand> オプシン遺伝子構成は、光遺伝学的心臓調節に使用され、以前に報告された結果をさらに確認し、より良い ショウジョウバエ の心臓血管研究モデルを確立する。
メディアの準備は、実験の成功に不可欠です。オプシンタンパク質は、リガンドである全トランスレチナール(ATR)を機能させるために28を必要とする。ハエは十分なATRを生成しないので、ATRはフライメディアに補足されなければならない。この研究では、以前に報告されたインスタント食品を半定義培地29に置き換えた。ATR含有媒体の新しいレシピは、ATRの均一な分布を確保するために導入されました。ATRは水に溶けません。エタノールベースの100mM ATRストックを水系媒体に添加すると、温かいセミディフィニション培地を含むバイアルをボルテックス処理することによって分散させる。また、以前に報告されたATR濃度は、eNpHR2.0の10 mMおよびReaChR22 の3 mMから、両方の最終濃度の1 mMに減少した。この濃度は、適切なeNpHR2.0およびReaChR機能を保証するのに十分である。
実験の成功に不可欠な要素は、FlyNet 2.027によるデータ処理の改善です。ラボは、自動化されたフライハートセグメンテーションアルゴリズムの計算効率と精度の両方を向上させるために、このソフトウェアの開発を続けています。このソフトウェアによって生成された断面マスクは、フラクショナルショートニングや心壁速度などの ショウジョウバエ の生理学的データを導出するために使用されます。このアプローチにより、最小限の人間の監督で効率的なデータ分析が可能になり、大型のハエ心臓イメージングデータセットの心臓機能をより迅速かつ確実に特徴付けることができます。
心筋梗塞は依然として主要な死因であり、心筋虚血は心不全の全症例の3分の2に寄与しており、これは米国における死亡率および罹患率の主要な原因の中で急速に出現している30。新しい治療薬や医療機器の開発には、生理学的および生化学的レベルでの心臓疾患のメカニズムに関する深い知識が必要です。これらの目標は、モデル生物の助けを借りて達成することができます。D.メラノガスターは、最も信頼性が高く効率的なモデル31,32,33,34,35の1つとしての地位を確立しています。この研究は、非侵襲的な光遺伝学的アプローチによって誘導されたシミュレートされたショウジョウバエ心臓障害モデルを生成した。非侵襲的光学式心臓ペーシング技術の開発は、従来の電気心臓ペーシング装置に代わるものを開発するための基礎を提供する。OCTを使用して心機能をリアルタイムで観察することで、ショウジョウバエモデルにおける関連する心臓生理学を正確に特徴付け、医薬品候補スクリーニングを含む高度な調査を行うことができます。OCTイメージングは、約1mmの浸透深さを有し、ショウジョウバエの心臓研究には適しているが、より大きな動物モデルにおける心機能を特徴付けるためにその使用を制限している。さらに、ショウジョウバエの研究を哺乳類のモデルに直接翻訳することは課題です。心臓血管研究のために、オプシンの感度を向上させ、ゼブラフィッシュ、マウス、ラット、ヒト心臓オルガノイドなどのさまざまなモデルシステムに変換するための新しい光遺伝学的ツールを開発する必要があります。
開示事項
著者らには開示するものは何もありません。
謝辞
著者らは、Andrey Komarov、Yuxuan Wang、Jiantao Zhuのデータ分析への協力に感謝し、Zhou研究室のメンバーの貴重な議論に感謝している。周博士の研究室での研究は、セントルイスのワシントン大学のスタートアップ基金、国立衛生研究所(NIH)の助成金R01-EB025209とR01-HL156265、クレイコ財団の革新的研究賞によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| All-trans retinal | Cayman Chemicals | 18449 | |
| Bacto Peptone | Gibco | 02-10-2025 | |
| BioLED Light Source Control Module, 4-channel | Migtex Systems | BLS-SA04-US | Part of the optogenetic stimulation module |
| Broadband Light Source Module | Superlum | cBLMD-T-850-HP | Part of the SD-OCT imaging system |
| Cobra-S 800 OCT Spectrometers | Wasatch Photonics | CS800-840/180-80-OC2K-U3 | Part of the SD-OCT imaging system |
| Delicate Task Wipers | Kimberly-Clark Professtional | 34155 | tissues |
| Drosophila agar | Genesee Scientific | 66-103 | |
| Drosophila culture bottles | Genesee Scientific | 32-131 | |
| FlyNet 2.0 Software | Z-Lab | Custom software for fly heart segmentation and heart function analysis developed in the Zhou lab | |
| High-Power LED Collimator Sources | Migtex Systems | BLS-LCS-0617-03-22 | Part of the optogenetic stimulation module |
| Inactive dry yeast | Genesee Scientific | 62-106 | |
| Microscope slides | AmScope | BS-72P | |
| Narrow plugs for Drosophila culture | Genesee Scientific | 59-200 | |
| Narrow vials for Drosophila culture | Genesee Scientific | 32-116SB | |
| Permanent double-sided tape | Scotch | ||
| Plugs for Drosophila bottles | Genesee Scientific | 59-194 | |
| Propionic Acid | Sigma | P1386-1L | |
| SD-OCT control software | Z-Lab | Custom software for image acquisition and pacing control developed in the Zhou lab | |
| SD-OCT imaging and optogenetic pacing system | Z-Lab | Imaging and optogenetic pacing system developed in the Zhou lab (~$50k BOM) | |
| Sucrose | Carolina | 89-2871 | |
| w[*]; P{y[+t7.7] w[+mC]=UAS-eNpHR-YFP}attP2 | Bloomington Drosophila Stock Center (BDSC) | stock # 41752 | eNpHR2.0 transgenic line |
| w[*]; P{y[+t7.7] w[+mC]=UAS-ReaChR}su(Hw)attP5/CyO | Bloomington Drosophila Stock Center (BDSC) | stock # 53748 | ReaChR transgenic line |
| w[1118]; P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM3 Sb[1] | Bloomington Drosophila Stock Center (BDSC) | stock # 48396 | Heart specific GAL4 driver containing Hand gene regulatory fragment |
| y[*] w[*]; P{w[+mC]=UAS-2xEGFP}AH3 | Bloomington Drosophila Stock Center (BDSC) | stock #6658 | GFP reporter line |
| Yeast extract | Lab Scientific bioKEMIX | 978-907-4243 |
参考文献
- Nature Methods. Method of the Year 2010. Nature Methods. 8, 1 (2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deisseroth, K. Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience. 18 (9), 1213-1225 (2015).
- Tsai, H. -. C. Phasic firing in dopaminergic neurons is sufficient for behavioral conditioning. Science. 324 (5930), 1080-1084 (2009).
- Wykes, R. C., et al. Optogenetic and potassium channel gene therapy in a rodent model of focal neocortical epilepsy. Science Translational Medicine. 4 (161), (2012).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nature Reviews Cardiology. 18 (5), 349-367 (2021).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
- Arrenberg, A. B., Stainier, D. Y. R., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Nussinovitch, U., Gepstein, L. Optogenetics for in vivo cardiac pacing and resynchronization therapies. Nature Biotechnology. 33 (7), 750-754 (2015).
- Nyns, E. C. A., et al. An automated hybrid bioelectronic system for autogenous restoration of sinus rhythm in atrial fibrillation. Science Translational Medicine. 11 (481), (2019).
- Bier, E., Bodmer, R. Drosophila, an emerging model for cardiac disease. Gene. 342 (1), 1-11 (2004).
- Wolf, M. J., Amrein, H., Izatt, J. A., Choma, M. A., Reedy, M. C., Rockman, H. A. Drosophila as a model for the identification of genes causing adult human heart disease. Proceedings of the National Academy of Sciences of the United States of America. 103 (5), 1394-1399 (2006).
- Yu, L., Lee, T., Lin, N., Wolf, M. J. Affecting rhomboid-3 function causes a dilated heart in adult Drosophila. PLOS Genetics. 6 (5), 1000969 (2010).
- Cooper, A. S., Rymond, K. E., Ward, M. A., Bocook, E. L., Cooper, R. L. Monitoring heart function in larval Drosophila melanogaster for physiological studies. Journal of Visualized Experiments. (33), e1596 (2009).
- Zhu, Y. C., Yocom, E., Sifers, J., Uradu, H., Cooper, R. L. Modulatory effects on Drosophila larva hearts: Room temperature, acute and chronic cold stress. Journal of Comparative Physiology. B, Biochemical, Systemic, and Environmental Physiology. 186 (7), 829-841 (2016).
- Zhu, Y. C., Uradu, H., Majeed, Z. R., Cooper, R. L. Optogenetic stimulation of Drosophila heart rate at different temperatures and Ca2+ concentrations. Physiological Reports. 4 (3), 12695 (2016).
- Malloy, C., et al. Using optogenetics to assess neuroendocrine modulation of heart rate in Drosophila melanogaster larvae. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural, and Behavioral Physiology. 203 (10), 791-806 (2017).
- Men, J., et al. Drosophila preparation and longitudinal imaging of heart function in vivo using optical coherence microscopy (OCM). Journal of Visualized Experiments. (118), e55002 (2016).
- Choma, M. A., Izatt, S. D., Wessells, R. J., Bodmer, R., Izatt, J. A. In vivo imaging of the adult Drosophila melanogaster heart with real-time optical coherence tomography. Circulation. 114 (2), 35-36 (2006).
- Li, A., et al. Changes in the expression of the Alzheimer's disease-associated presenilin gene in drosophila heart leads to cardiac dysfunction. Current Alzheimer Research. 8 (3), 313-322 (2011).
- Li, A., et al. Silencing of the Drosophila ortholog of SOX5 in heart leads to cardiac dysfunction as detected by optical coherence tomography. Human Molecular Genetics. 22 (18), 3798-3806 (2013).
- Men, J., Li, A., Jerwick, J., Li, Z., Tanzi, R. E., Zhou, C. Non-invasive red-light optogenetic control of Drosophila cardiac function. Communications Biology. 3 (1), 1-10 (2020).
- Alex, A., Li, A., Tanzi, R. E., Zhou, C. Optogenetic pacing in Drosophila melanogaster. Science Advances. 1 (9), 1500639 (2015).
- Stanley, C. E., Mauss, A. S., Borst, A., Cooper, R. L. The effects of chloride flux on Drosophila heart rate. Methods and Protocols. 2 (3), 73 (2019).
- Lindsley, D. L., Zimm, G. G. . The Genome of Drosophila melanogaster. , (1992).
- . Bloomington Drosophila Stock Center Available from: https://bdsc.indiana.edu/information/recipes/germanfood.html (2022)
- Dong, Z., et al. FlyNet 2.0: Drosophila heart 3D (2D + time) segmentation in optical coherence microscopy images using a convolutional long short-term memory neural network. Biomedical Optics Express. 11 (3), 1568-1579 (2020).
- Deisseroth, K. Optogenetics. Nature Methods. 8 (1), 26-29 (2011).
- Backhaus, B., Sulkowski, E., Schlote, F. W. A semi-synthetic, general-purpose medium for Drosophila melanogaster. Drosophila Information Service. 60, 210-212 (1984).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139 (10), 56 (2019).
- Wolf, M. J., Rockman, H. A. Drosophila, genetic screens, and cardiac function. Circulation Research. 109 (7), 794-806 (2011).
- Choma, M. A., Suter, M. J., Vakoc, B. J., Bouma, B. E., Tearney, G. J. Physiological homology between Drosophila melanogaster and vertebrate cardiovascular systems. Disease Models & Mechanisms. 4 (3), 411-420 (2011).
- Ocorr, K., Vogler, G., Bodmer, R. Methods to assess Drosophila heart development, function and aging. Methods [Supplement to Methods in Enzymology]. 68 (1), 265-272 (2014).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Disease Models & Mechanisms. 9 (3), 235-244 (2016).
- Rotstein, B., Paululat, A. On the morphology of the Drosophila heart. Journal of Cardiovascular Development and Disease. 3 (2), 15 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved