Method Article
הדמיה סימולטנית של דינמיקה מיקרוגליאלית ופעילות עצבית בעכברים ערים
In This Article
Summary
במאמר זה אנו מתארים פרוטוקול המשלב הזרקת וירוסים הקשורים באדנו עם השתלת חלון גולגולתי לצורך הדמיה סימולטנית של דינמיקה מיקרוגליאלית ופעילות עצבית בעכברים ערים.
Abstract
מאחר שתפקודי המוח נמצאים תחת השפעה מתמשכת של אותות שמקורם ברקמות היקפיות, חיוני להבהיר כיצד תאי גלייה במוח חשים תנאים ביולוגיים שונים בפריפריה ומעבירים את האותות לנוירונים. מיקרוגליה, תאי מערכת החיסון במוח, מעורבים בהתפתחות סינפטית ובפלסטיות. לכן, תרומת תאי המיקרוגליה לבניית מעגלים עצביים בתגובה למצב הפנימי של הגוף צריכה להיבחן באופן ביקורתי על ידי הדמיה תוך-חיונית של הקשר בין דינמיקה מיקרוגליאלית לפעילות עצבית.
במאמר זה אנו מתארים שיטה לדימות סימולטני של דינמיקה מיקרוגליאלית ופעילות עצבית בעכברים ערים. וירוס הקשור באדנו המקודד R-CaMP, אינדיקטור סידן מקודד גן של חלבון פלואורסצנטי אדום, הוזרק לשכבה 2/3 של קליפת המוח הראייתית העיקרית בעכברים טרנסגניים CX3CR1-EGFP המבטאים EGFP במיקרוגליה. לאחר הזרקה ויראלית, חלון גולגולת הותקן על פני המוח של האזור המוזרק. הדמיית שני פוטונים In vivo בעכברים ערים 4 שבועות לאחר הניתוח הראתה כי פעילות עצבית ודינמיקה מיקרוגליאלית יכולות להיקלט בו זמנית ברזולוציה טמפורלית של תת-שנייה. טכניקה זו יכולה לחשוף את התיאום בין דינמיקה מיקרוגליאלית לבין פעילות עצבית, כאשר הראשון מגיב למצבים אימונולוגיים היקפיים והאחרון מקודד את מצבי המוח הפנימיים.
Introduction
ישנן עדויות הולכות וגדלות לכך שהמצב הפנימי של הגוף משפיע כל הזמן על תפקודי המוח אצל בעלי חיים 1,2,3,4,5. לפיכך, כדי להשיג הבנה עמוקה יותר של תפקודי המוח, חיוני להבהיר כיצד תאי גלייה במוח מנטרים תנאים ביולוגיים בפריפריה ומעבירים את המידע לנוירונים.
מיקרוגליה, תאי מערכת החיסון במוח, מעורבים בהתפתחות סינפטית ובפלסטיות, אשר מפסלים מאפיינים של מעגלים עצביים במוח 6,7,8,9. לדוגמה, עבודתם החלוצית של Wake et al. הראתה כי תהליכים מיקרוגליאליים יוצרים מגע עם סינפסות באופן תלוי פעילות עצבית בניאוקורטקס של עכבר וכי איסכמיה מלאכותית גורמת לאובדן סינפסות בעקבות מגע ממושך עם מיקרוגליה10. טרמבליי ועמיתיו מצאו כי שינוי החוויה החזותית משנה את אופן האינטראקציה של מיקרוגליאה עם סינפסות. במהלך התקופה הקריטית שבה תחלופת עמוד השדרה הדנדריטי בקליפת המוח הראייתית הראשונית (V1) מוגברת על ידי חסך דו-עיני, הסתגלות כהה מפחיתה את תנועתיות התהליכים המיקרוגליאליים ומגדילה הן את תדירות המגע שלהם עם שסעים סינפטיים והן את מספר התכלילים התאיים במיקרוגליה11. תוצאות אלה מצביעות על כך שתהליכים מיקרוגליאליים חשים פעילות עצבית וסביבתם כדי לעצב מחדש מעגלים עצביים. יתר על כן, מחקר שנערך לאחרונה דיווח כי מעקב מיקרוגליאה שונה בין תנאי ערות למצב של הרדמה, דבר המצביע על החשיבות של ניסויים בעכברים ערים לחקר תקשורת נוירון-מיקרוגליה בתנאים פיזיולוגיים12.
דימות סידן דו-פוטוני In vivo הוא כלי רב עוצמה לרישום דינמיקת סידן, המשקפת ירי עצבי מתמשך, במאות נוירונים בו זמנית בחיהחיה 13,14,15. דימות סידן בנוירונים דורש בדרך כלל רזולוציה טמפורלית של יותר מכמה הרץ כדי לעקוב אחר תגובות עצביות מהירות16,17. לעומת זאת, מחקרים קודמים שעקבו אחר דינמיקה של מיקרוגליה דגמו מבנים מיקרוגליאליים ברזולוציה טמפורלית נמוכה יחסית של פחות מ-0.1 הרץ18,19,20. מחקר שנערך לאחרונה יישם הדמיה סימולטנית של שני פוטונים כדי להבין תקשורת נוירון-מיקרוגליה21. עם זאת, עדיין לא ברור כיצד תהליכים מיקרוגליאליים דינמיים מגיבים לפעילות העצבית הסובבת ברזולוציה זמנית של יותר מכמה הרץ בעכברים ערים. על מנת לטפל בבעיה זו, אנו מתארים שיטת הדמיה סימולטנית in vivo של שני פוטונים של פעילות עצבית ודינמיקה מיקרוגליאלית עם רזולוציה טמפורלית גבוהה מ-1 הרץ בעכברים ערים. שיטה זו מאפשרת לנו להשיג הדמיה יציבה בעכברים ערים בקצב פריימים גבוה יותר (מקסימום, 30 הרץ עם גודל מסגרת פיקסל של 512 x 512 פיקסלים) ומספקת דרך נוחה יותר לחקור את התנהגות המעקב של מיקרוגליה או את האינטראקציה שלהם עם פעילות עצבית בעכברים ערים.
Protocol
כל הניסויים אושרו על ידי ועדת האתיקה של בעלי חיים והוועדה לבטיחות ניסויים רקומביננטיים גנטיים של בית הספר לרפואה והפקולטה לרפואה באוניברסיטת טוקיו, ובוצעו בהתאם להנחיותיהן.
1. הכנה
- לעקר את כל המכשירים והמנגנונים הדרושים לניתוח באמצעות autoclave או 70% אתנול.
- הכנת פיפטה זכוכית.
- קבע היטב נימי 75 μL מכויל למחזיק המושך micropipette. הגדר את המושך לתוכנית עם הפרמטרים המומלצים כ- P (לחץ) = 500, חום = 680, PULL = 30, VEL = 60, TIME = 180.
- לאחר סיום התוכנית (בדרך כלל 4.5 עד 5 שניות), הנימים מחולקים לשתי פיפטות זכוכית עם זנבות מתחדדים. לאחר מכן, שברו את החלק הדיסטלי של הזנבות בפינצטה כדי לשמור על קוטר הקצה בטווח של 30-50 מיקרומטר. לשם כך, לשבור את הזנבות 1 ס"מ דיסטלי עד סוף החלק המשופע.
- עבור קרניוטומיה, הכינו חלון גולגולתי על-ידי הדבקת דיסק זכוכית חיצוני גדול יותר, בקוטר 4 מ"מ, בעובי 0.15 ± 0.02 מ"מ, לדיסק זכוכית פנימי קטן יותר, בקוטר 2 מ"מ, בעובי 0.525 ± 0.075 מ"מ, באמצעות מגיב ריפוי אור UV (איור 2A).
2. הזרקת AAV
- הכנת מנגנון הזרקה
- הניחו פיפטה מזכוכית המחוברת למזרק המילטון 26G דרך צינור על מחזיק פיפטה של מכשיר סטריאוטקסי, ולאחר מכן הטו את מחזיק הפיפט 60° קדימה מהציר האנכי (איור 1A,B).
- ממלאים את פיפטת הזכוכית, המזרק וצינור החיבור בפרפין נוזלי. מניחים את המזרק על מזרק מיקרו.
- הליך כירורגי
הערה: הניתוח הבא בוצע בתא מעוקר. לצורך הניתוח נעשה שימוש בסטריאומיקרוסקופ במידת הצורך.- מרדימים עכבר CX3CR1-EGFP זכר (מידע מפורט בטבלת החומרים) בגיל 7 עד 8 שבועות (משקל גוף 22-26 גרם) עם 3% איזופלורן בתא אטום לגזים. לאחר 3 דקות, הוציאו את העכבר מהחדר כאשר הוא מאבד תנועה רצונית למעט נשימה, ולאחר מכן עברו להרדמה רציפה על ידי צינור אף עם 2% איזופלורן.
הערה: ידוע כי איזופלורן מפעיל מיקרוגליה. עם זאת, מכיוון שההדמיה מבוצעת 4 שבועות לאחר הניתוח, אין השפעה של איזופלורן על העכברים במהלך ההדמיה. למרות שהרדמה איזופלורנית משמשת למספר דקות כאשר עכברים מונחים במכשיר הסטריאוטקסי לפני הדמיה (שלב 4.2.1), מצאנו כי ההשפעה של הרדמה קצרה זו היא זניחה. - במהלך הניתוח, שמור על העכבר חם עם כרית חימום ב 37 ° C כדי למנוע היפותרמיה. יש למרוח משחת עיניים על שתי העיניים למניעת יובש בקרנית ולתת זריקת מלוקסיקם, תת עורית (5 מ"ג/ק"ג). חבר את העכבר למוט אוזניים עזר, ולאחר מכן קבע את העכבר על המכשיר הסטריאוטקסי עם הצד הגבי שלו כלפי מעלה.
- התאמת ריכוז האיזופלורן לאחוז מתאים (1%-2%) במהלך הניתוח תוך ניטור הנשימה וקצב הלב. הסירו את השיער באמצעות קרם אפילציה וחיטאו את הראש מספר פעמים בתנועה סיבובית עם פילינג על בסיס יוד או כלורהקסידין ואלכוהול. לאחר מכן, להזריק 0.1 מ"ל של 1% לידוקאין תת עורית ולהחיל וילונות סטריליים כדי לאבטח את אתר הניתוח.
- חתכו את הקרקפת לאורך קו האמצע בעזרת מספריים ובצעו את החתך באורך של כ-2 ס"מ, כדי להבטיח חשיפה טובה של הגולגולת מעל קליפת המוח הראייתית הראשונית הימנית. לאחר החתך בקרקפת, השקו את הראש במי מלח לאורך כל ההליך כדי למנוע מהגולגולת והמוח החשופים להתייבש.
- הסר את periosteum על הגולגולת החשופה באמצעות מלקחיים. קדחו את הגולגולת על הקואורדינטות הסטריאוטקסיות: 3 מ"מ לרוחב לקו האמצע, 0.5 מ"מ קדמי לקו הלמדא, ליצירת חור קטן בקוטר של כ-0.5 מ"מ. יש לשטוף דם ושאריות רקמות מהמקדח, במידת הצורך.
- מלא את פיפטת הזכוכית ב- 1 μL של rAAV2/1-hSyn-R-CaMP1.07 באמצעות ההליך הבא בטיטר של 8.3 x 1012 גנומים וקטוריים/מ"ל22.
- מקדמים את המזרק כדי להוציא 1 μL של פרפין נוזלי מפיפטת הזכוכית. מניחים פיסת סרט שקוף, בגודל של כ-2X2 ס"מ, על גולגולת העכבר החשופה ומוציאים טיפה של 1 מיקרוליטר של תמיסת AAV על הסרט באמצעות פיפטר.
- הניחו את קצה פיפטת הזכוכית לתוך טיפת תמיסת AAV על הסרט ומשכו בעדינות את המזרק כדי לשאוף את תמיסת ה- AAV. לאחר הפליטה, סובב את הסטופרקוק בצורת T כדי לשחרר את הלחץ בתוך הצינור ואת פיפטת הזכוכית.
- הכניסו את פיפטת הזכוכית לעומק של 500 מיקרומטר מפני השטח של המוח דרך החור שנוצר בשלב 2.2.5, ואז הזריקו 0.5 מיקרוליטר של תמיסת AAV באמצעות המיקרו-מזרק (איור 1C). השתמש בקצב זרימת נפח ההזרקה של 2.0 μL / h; זריקה של 0.5 μL לוקח 15 דקות, ולאחר מכן לחכות 5 דקות.
- לאחר ההזרקה, למשוך בעדינות את פיפטת הזכוכית ולשטוף את משטח המוח עם מלוחים.
- מרדימים עכבר CX3CR1-EGFP זכר (מידע מפורט בטבלת החומרים) בגיל 7 עד 8 שבועות (משקל גוף 22-26 גרם) עם 3% איזופלורן בתא אטום לגזים. לאחר 3 דקות, הוציאו את העכבר מהחדר כאשר הוא מאבד תנועה רצונית למעט נשימה, ולאחר מכן עברו להרדמה רציפה על ידי צינור אף עם 2% איזופלורן.
3. השתלת חלון גולגולת
הערה: השתלת חלון גולגולת מתבצעת לאחר הזרקת AAV באותו היום.
- סמן עיגול בקוטר 2.5 מ"מ על הגולגולת, ממורכז 3 מ"מ לרוחב מהלמדא. צור חריץ עגול לאורך הסימן על הגולגולת על ידי קידוח. נקו את הפסולת מכיוון שהיא עלולה להשפיע לרעה על נראות הגולגולת ומרחו מלח במהלך תהליך הקידוח כדי למנוע התחממות.
- כדי לבדוק אם עומק הקידוח בחריץ המעגלי מספיק כדי להסיר את שבר הגולגולת המרכזי, לחץ בעדינות על הגולגולת המרכזית עם מלקחיים. אם הוא נע אנכית עם התנגדות קטנה, עומק הקידוח מספיק.
- כאשר החריץ מגיע לעומק מספיק, הכניסו את קצה המלקחיים לתחתית שבר הגולגולת המרכזי והרימו והוציאו אותו בעדינות כדי לחשוף את פני השטח של המוח (איור 1D).
- בעזרת מחט 27 גרם, דוקרים וקורעים את הדורה בקצה משטח המוח החשוף. הכנס את קצה המלקחיים דרך החור שנוצר בקצה הדורה. החזיקו את הדורה וקילפו אותה כדי לחשוף את פני השטח של המוח.
הערה: אם מתרחש דימום, שטפו את משטח המוח במי מלח עד שהדימום ייפסק. - בעזרת מלקחיים, מפזרים סיבים המוסטטיים בזה אחר זה במי מלח בכלי של 3.5 מ"מ, ולאחר מכן מניחים את הסיבים ההמוסטטיים לאורך שולי החור שבו נמצאת הדורה הטרנסקטית.
- הניחו חלון גולגולת שהוכן בשלב 1.3 על משטח המוח החשוף, ולאחר מכן הדביקו אותו לגולגולת בדבק מיידי תוך לחיצה עדינה על החלון כך שהחלון יהיה במגע הדוק עם הגולגולת.
- לאחר מכן, מרחו דבק מיידי על כל הגולגולת החשופה, ולאחר מכן חברו בזהירות לוחית ראש לגולגולת כך שהחלון ימוקם במרכז החור המרובע של לוחית הראש (איור 2C). ודא שפני השטח של לוח הראש מקבילים לפני השטח של חלון הזכוכית.
- לאחר שהדבק התקשה מספיק, מרחו מלט דנטלי על הגולגולת החשופה כדי לחזק את החיבור בין הראש ללוחית הראש (איור 2).
הערה: אם הניסויים כוללים הצגת גירויים חזותיים לעכברים, יש להימנע מאור תועה לאזור ההדמיה. מומלץ להשחיר את המלט על ידי ערבובו עם הפחם הפעיל להפחתת השתקפות האור. - מוציאים את העכבר מההרדמה לאחר שהמלט התקשה מספיק (כ-20 דקות). לאחר מכן, הכניסו את העכבר לכלוב חדש כדי להתאושש לבד.
- לאחר שאישר את הכרתו ואת תנועתו מרצון, המעידה על התאוששות מלאה, החזיר את העכבר לכלוב הביתי. במהלך ההתאוששות, לנהל מנה שנייה, או יותר במידת הצורך, meloxicam (פעם כל 24 שעות במשך 1-3 ימים) אם התנהגויות ברורות המציין כאב להתרחש.
4. In vivo הדמיה של שני פוטונים של מיקרוגליה ודינמיקה של סידן עצבי
- התרגלות עכברים למכשיר המיקרוסקופ
- שלושה שבועות לאחר הניתוח, השר הרדמה בעכבר עם 3% איזופלורן, ומקם את העכבר מתחת לעדשת 25x אובייקטיבית של מיקרוסקופ שני פוטונים באמצעות מכשיר סטריאוטקסי מותאם אישית (איור 3C). עבור ההתקנה כאן, העכבר מוגדר על החלק העליון של הליכון מותר לרוץ בחופשיות.
- כ-10 דקות לאחר מכן, הוציאו את העכבר משלב המיקרוסקופ והחזירו אותו לכלוב הביתי. חזור על ההרגלה לפחות 3 פעמים בכל יום חלופי לפני רכישת תמונה של שני פוטונים.
- רכישת תמונה של שני פוטונים
הערה: אנו ממליצים לבצע את רכישת התמונה יותר מ -4 שבועות לאחר הניתוח, מכיוון שהפעלת מיקרוגליאה חוזרת בהדרגה לרמה הבסיסית.- כמו בשלב 4.1, יש להשרות הרדמה בעכבר עם איזופלורן 3% ולהציב את העכבר מתחת לעדשת המטרה של המיקרוסקופ הדו-פוטוני באמצעות מכשיר סטריאוטקסי בהתאמה אישית.
- התקן הצללה בהתאמה אישית וצג LCD לגירוי חזותי כמתואר להלן (איור 3D).
- מקם את העדשה כך שתתמקד על פני השטח של המוח, ולאחר מכן הגדר מיקום עדשה זה כמיקום Z המקורי. שמור על קואורדינטות x-y קבועות והרם את העדשה האובייקטיבית; הסר את העכבר ואת המכשיר הסטריאוטקסי מהעדשה האובייקטיבית ומההליכון.
- חברו מכשיר הצללה לחלק העליון של פלטת הראש באמצעות סיליקון, אשר מושחר על ידי ערבוב עם אבקת פחם, וודאו שהרווח בין פלטת הראש למכשיר ההצללה אטום היטב.
- מלאו את מכשיר ההצללה במים מזוקקים, ולאחר מכן תקנו שוב את העכבר ואת המסגרת הסטריאוטקסית מתחת למטרה ועל ההליכון. אפסו בזהירות את מישור המוקד על פני המוח, בדקו את עומק עדשת המטרה.
הערה: כדי למנוע את הסיכון של פגיעה בעדשת המטרה, הגדר תחילה את קואורדינטות xyz ולאחר מכן החל את התקן ההצללה של עדשת האובייקט. זה גם סביר להתקין את הכיסוי הראשון, ולאחר מכן להתאים את הקואורדינטות, אבל טיפול זהיר הכרחי עבור אפשרות זו. - כסו את עדשת האובייקט ברדיד אלומיניום שחור כדי למנוע זיהום אור מצג ה-LCD המשמש לגירוי חזותי דרך עדשת האובייקט (איור 3D). הגדר צג LCD בגודל 10 אינץ' בגודל 12.5 ס"מ מול עיני העכבר כדי להציג גירויים חזותיים (איור 3D).
- הגדר את מסנני איסוף הפליטה הפלואורסצנטית לפלואורסצנטיות EGFP (מסנן פליטה של 525/50 ננומטר) ולפלואורסצנטיות R-CaMP (מסנן פליטה של 593/46 ננומטר) ואת אורך גל העירור ל- 1,000 ננומטר. קבל תמונות ברזולוציה מרחבית של 0.25 מיקרומטר/פיקסל באמצעות יעד NA של 25x 1.1 ו-GaAsP PMTs.
- מצאו את אזור ההדמיה שבו ניתן לצלם בו-זמנית תאי עצב R-CaMP(+) ותאי מיקרוגליה מסוג EGFP(+) בשכבה 2/3. עבור מערך זה, הנתונים שהתקבלו באיור 4 ובווידאו 1 היו בעומק של 100 מיקרומטר מפני השטח של הפיאל, באמצעות תצוגה מקדימה של תמונה חיה. שמור על עוצמת לייזר עירור נמוכה ככל האפשר כדי למנוע הלבנת אור ונזק הנגרם על ידי טמפרטורה מקומית מוגברת באזור ההדמיה.
- קבל תמונות בקצב פריימים של 30 הרץ. במקביל לרכישת התמונה, הצג גירויים חזותיים נסחפים ב-100% ניגודיות, 1.5 הרץ, 0.04 מחזורים למעלה ב-12 כיוונים ב-6 כיוונים מ-0° עד 150° בצעדים של 30° לעכבר17.
- לאחר רכישת התמונה, הוציאו את העכבר משלב המיקרוסקופ, נתקו את מכשיר ההצללה ואת המכשיר הסטריאוטקסי מהעכבר והחזירו את העכבר לכלוב הביתי שלו.
- רישום נתונים
- המר ושמור את נתוני התמונה שנרכשו (תבנית nd2 במקרה זה) כסדרה של קובצי תמונה tiff לכל ערוץ צבע, באמצעות פיג'י או התוכנה שסופקה עם המיקרוסקופ.
- החל Turboreg, תוסף של פיג'י, כדי לבצע רישום עם מצב = תרגום. השתמשו בתמונה ממוצעת כתמונת הייחוס עם קובצי התמונה tiff של ערוץ EGFP.
- בצעו את העיבוד הבא עבור כל מסגרת באמצעות MATLAB.
הערה: למרות ש- MATLAB משמש בעיבוד הבא, התיאור מתמקד בעיקר בכוונה של כל שלב, כך שניתן יהיה לנתח נתונים על ידי תוכנות תכנות אחרות כגון Python.- השתמש בפונקציה imread כדי לקרוא שתי תמונות EGFP tiff לפני ואחרי רישום של אותה מסגרת, בהתאמה. השתמש בפונקציה imread כדי לקרוא את תמונת R-CaMP tiff של אותה מסגרת.
- השתמש בפונקציה normcorr2 כדי לחשב את פונקציית המתאם בין המשתנים הווקטוריים של שתי תמונות GFP שנקראו בשלב 4.3.3.1.
- השתמש בפונקציה max כדי לזהות את האינדקס הליניארי עם המתאם הצולב הגבוה ביותר של פונקציית המתאם, ולאחר מכן השתמש בפונקציה ind2sub כדי לחשב את מיקום התנועה של התמונה הרשומה מהתמונה המקורית שלה.
- השתמש בפונקציה imwarp כדי לתרגם את תמונת R-CaMP למיקום המחושב בשלב 4.3.3.3 ולאחר מכן השתמש בפונקציית הכתיבה כדי לשמור את התמונה הרשומה של R-CaMP.
- יצירת עקבות סידן
- בצעו את העיבוד הבא באמצעות MATLAB. השתמש בפונקציה imread כדי לקרוא את כל התמונות הרשומות של R-CaMP tiff שנוצרו בשלב 4.3.3.4. אם התמונות הרשומות כבר נטענו כמשתנה בסביבת העבודה, השמט שלב זה.
- השתמש בפונקציה mean כדי ליצור תמונת הקרנת זמן. השתמש בפונקציה imshow כדי להציג את התמונה הממוצעת כאיור; השתמש בפונקציה roipoly כדי ליצור מסיכת ROI בינארית של מבנה המטרה (עמוד השדרה הדנדריטי בנתונים אלה).
- באמצעות פונקציית הממוצע עם התמונות המתקבלות על ידי הכפלת המסיכה הבינארית בתמונות של כל מסגרת כמשתני קלט, חשב את עוצמת הפלואורסצנטיות הממוצעת בתוך החזר ההשקעה עבור כל מסגרת.
- כפי שתואר קודם לכן17, למשתנה המתקבל בשלב 4.4.3, יש להחיל את מסנן התדרים Butter worth בחיתוך = 1.6 שניות, לחיתוך רעש בתדר גבוה, ולאחר מכן להחיל את מסנן חציון הזזה בחלון הזמן = 200 שניות, לחיתוך רעש בתדר נמוך.
תוצאות
ביצענו הזרקת AAV והשתלת חלון גולגולת ב-V1 של עכבר מהונדס CX3XR1-EGFP בן 8 שבועות כמתואר בפרוטוקול זה. ארבעה שבועות לאחר הניתוח ביצענו סימולטני in vivo הדמיה של שני פוטונים של פעילות עצבית מבוססת R-CaMP ודינמיקה מיקרוגליאלית בשכבה 2/3 של V1 (איור 4 ווידאו 1). במהלך ההדמיה, העכבר הונח על הליכון והורשה לרוץ בחופשיות. התמונות נרכשו בקצב פריימים של 30 הרץ עם רזולוציה מרחבית של 0.25 מיקרומטר לפיקסל באמצעות מטרות 25x, 1.1 NA ו- GaAsP PMTs. הן EGFP והן R-CaMP היו מעוררים באורך גל של 1,000 ננומטר, ופלואורסצנטיות EGFP (מסנן פליטה של 525/50 ננומטר) ופלואורסצנטיות R-CaMP (מסנן פליטה של 593/46 ננומטר) נאספו בו זמנית. לאחר רישום הנתונים שנרכשו כדי למזער את תוצרי התנועה, כל ארבע פריימים הוערכו בממוצע למסגרת אחת כדי להפחית את רעשי הרקע. גירויים חזותיים מגרגרים הוצגו לעכבר, והתגובות החזותיות של תאי עצב ועמוד שדרה דנדריטי בודד נותחו (איור 4D). תהליכי מיקרוגליאה הראו דינמיקה מהירה ושינו את המורפולוגיה שלהם תוך 10 שניות (איור 4E ווידאו 1). כפי שמפורט בסעיף הדיון, כאשר הזרקת AAV נכשלה, לא ניתן היה לזהות את הביטוי של R-CaMP. אם הניתוח לא הצליח, לא ניתן היה להבחין באותות של EGFP ו- R-CaMP.
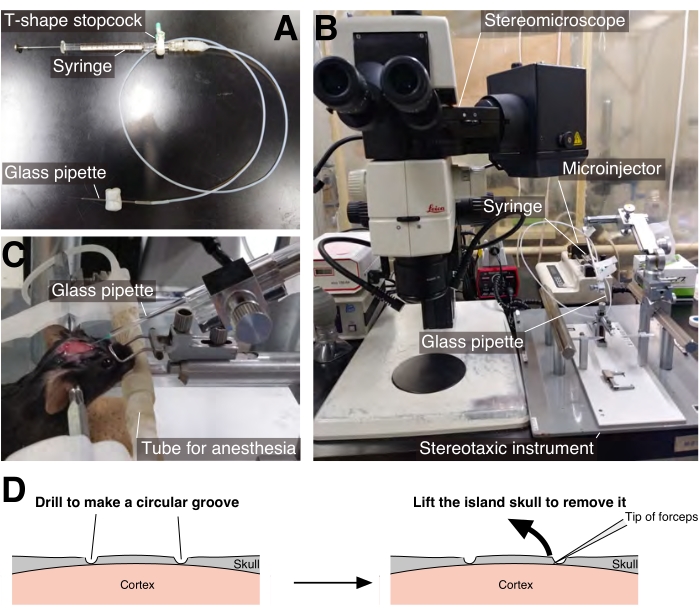
איור 1: הזרקת AAV . (A) פיפטת זכוכית חוברה למזרק המילטון 26 גרם באמצעות צינור סיליקון. (B) ההגדרה להזרקת AAV. (C) תמיסת AAV הוזרק דרך פיפטת זכוכית המוטה 60° קדימה מהציר האנכי. (D) תרשים סכמטי של הליך הגולגולת הפתוחה (המתואר בשלב 3.3). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
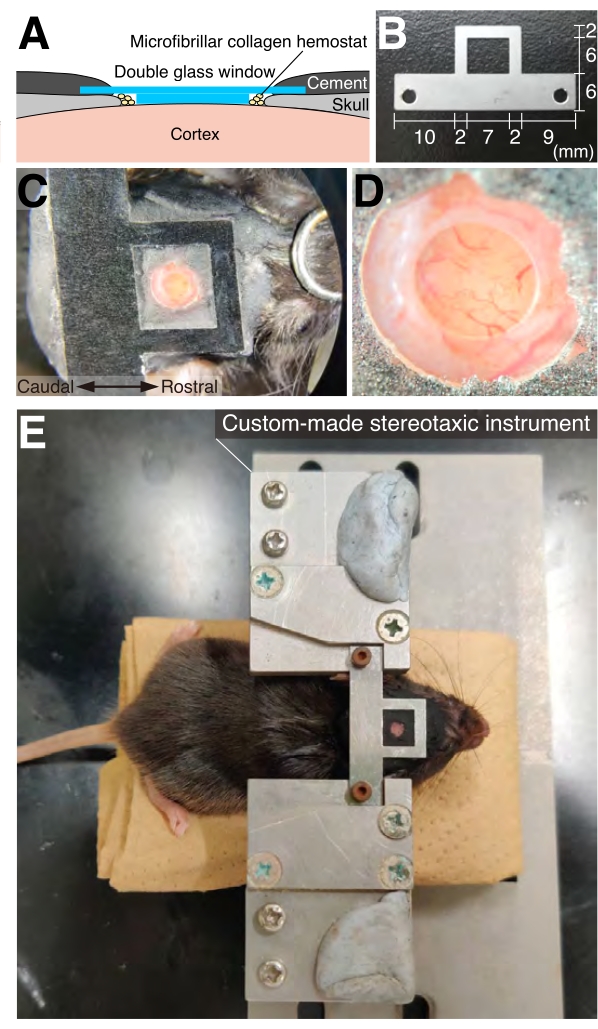
איור 2: חלון גולגולת ולוחית ראש . (A) תרשים סכמטי של השתלת חלון גולגולתי. (ב) נעשה שימוש בלוחיות ראש בהתאמה אישית. עבור הדמיה בהמיספרה הימנית, יש להשתמש בזרוע הקצרה יותר בצד ימין. (C) מבט גבי של עכבר עם חלון גולגולת ולוחית ראש מושתלת. (D) מבט בהגדלה גבוהה של חלון הגולגולת המוצג באיור 2C. (E) מבט גבי של עכבר הקבוע במכשיר סטריאוטקסי בהתאמה אישית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: ההכנה לדימות in vivo של שני פוטונים. (A) מבט גבי על התקן הצללה. (B) מבט מהצד על התקן הצללה. (C) מבט על עכבר עם התקן ההצללה על לוחית הראש מתחת לעדשת המטרה. העכבר מונח על ההליכון. (D) מבט תחת מיקרוסקופ עירור שני פוטונים. צג המציג גירויים חזותיים ממוקם בצד ימין של הדמות. עדשת האובייקט מכוסה במכשיר ההצללה ובנייר אלומיניום שחור כדי למנוע אור מהצג לעדשת האובייקט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
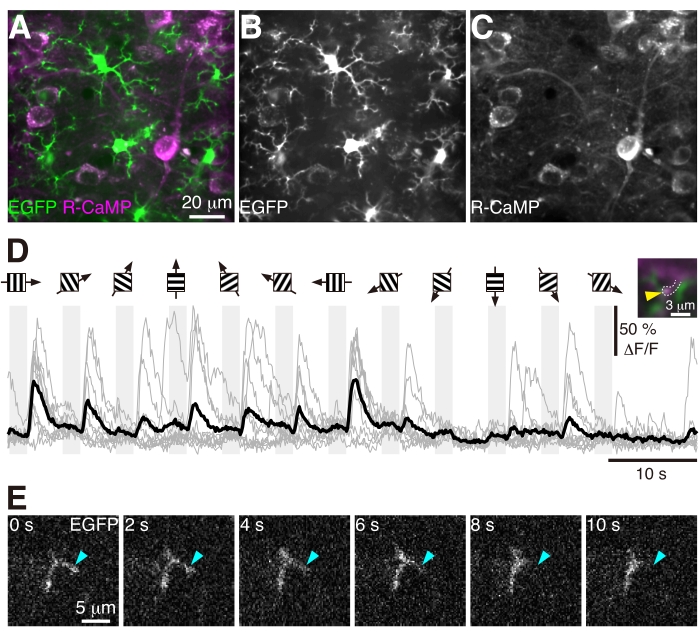
איור 4: דינמיקה של מיקרוגליה ותגובות חזותיות בעמוד שדרה דנדריטי. (A-C) תמונות ממוצעות בזמן של תאי מיקרוגליה מסוג EGFP (+) ותאי עצב מסוג R-CaMP(+) בשכבה 2/3 של V1 בעכבר מהונדס CX3XR1-EGFP בן 12 שבועות. עוצמת האות בכל ערוץ נורמלה באופן עצמאי. (D) תגובות חזותיות בעמוד השדרה הדנדריטי. דיאגרמות פסים עם חצים שחורים מציינות את כיוון הגירויים הסורגים המוצגים בתזמון המצוין על ידי עמודות אפורות. אצל עקבות סידן, קווים אפורים מציינים תגובות אינדיבידואליות, וקו שחור מציין את הממוצע שלהן. בכניסה הימנית, ראש חץ צהוב מציין את עמוד השדרה הדנדריטי שבו נוצר אזור העניין (ROI) כדי לרכוש את עקבות הסידן. (E) תהליך מיקרוגליה (ראש חץ ציאן) הראה נסיגה מהירה תוך 10 שניות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
וידאו 1: הדמיה של שני פוטונים של פעילות עצבית ודינמיקה מיקרוגליאלית. נתוני הדמיה של תאי עצב מסוג EGFP(+) ותאי עצב מסוג R-CaMP(+) בשכבה 2/3 של V1 בעכבר מהונדס CX3XR1-EGFP בן 12 שבועות. בצד שמאל של הסרט, מגנטה מציינת R-CaMP בתאי עצב, וירוק מציין EGFP במיקרוגליה. מרכז הסרט מתאים לאות EGFP, והצד הימני מתאים לאות R-CaMP. עוצמת האות בכל ערוץ נורמלה באופן עצמאי. קצב הפריימים של הסרט מהיר פי 40 מהקצב בפועל. סרגל קנה מידה = 10 מיקרומטר אנא לחץ כאן להורדת סרטון זה.
Discussion
אנו מתארים את הפרוטוקול של הזרקת AAV וקרניוטומיה להדמיה סימולטנית של דינמיקה מיקרוגליאלית ופעילות עצבית בעכברים ערים, כמו גם עיבוד נתונים. טכניקה זו יכולה לחשוף את התיאום בין דינמיקה מיקרוגליאלית ופעילות עצבית בסקאלות זמן הנעות בין תת-שנייה לעשרות שניות.
פרוטוקול הניתוח כולל מספר שלבים תובעניים מבחינה טכנית. הזרקת AAV היא אחד השלבים הקריטיים. הזרקת AAV לא מוצלחת עלולה לגרום לירידה משמעותית בביטוי של R-CaMP. ישנן שתי סיבות עיקריות: פיפטות זכוכית סתומות ונזק לרקמות. סתימת פיפטות זכוכית מפחיתה או חוסמת לחלוטין את פליטת תמיסת AAV. ניתן להימנע ממצב זה על ידי צביעת תמיסת AAV בצבע כגון ירוק מהיר ומאשר ויזואלית את הצלחת ההזרקה. נזק לרקמות הנגרם על ידי הזרקת AAV מונע ביטוי גנים אקסוגניים בסמוך למרכז אתר ההזרקה. הנזק שנגרם על ידי הזרקת AAV עשוי להיגרם על ידי עלייה פתאומית בשטף מקצה פיפטת הזכוכית לאחר הצטברות הלחץ בתוך הפיפטה. לכן, היציאה של תמיסת AAV מפיפטת הזכוכית צריכה להיות קבועה במהלך ההזרקה. בחירת פיפטות זכוכית בקוטר מעט רחב יותר בקצותיהן תפתור בעיה זו. בהשתלת חלון גולגולתי, מהירות הניתוח היא קריטית. אם הניתוח אורך זמן רב מדי, רקמת המוח עלולה להיפגע קשות. לפיכך, תרגול חוזר הוא הכרחי כדי להבטיח את המהירות ואת החלקות של הניתוח. בנוסף, במהלך 4 השבועות שבין הניתוח להדמיה, איכות ההדמיה עשויה להיפגע על ידי התחדשות רקמות בין חלון הגולגולת לרקמת המוח בשיטה הקונבנציונלית17. השיטה כאן מתגברת על בעיה זו על ידי יישום משקפיים עבים עבור דיסק הזכוכית הפנימי של חלונות הגולגולת כדי לעכב התחדשות רקמות ולשמור על החלון נקי. במערכת המתוארת כאן, השפעה זו ניכרה באמצעות דיסק זכוכית פנימי בעובי של 0.525 ± 0.075 מיקרומטר.
השיטה יכולה להיות מיושמת בהצלחה על עכברים מעל גיל 4 שבועות, אך היישום על עכברים צעירים עלול להיות בעייתי. בעכברים צעירים, הגולגולת מראה צמיחה מהירה ובולטת, מה שגורם לחוסר התאמה בין עצם הגולגולת לחלון הזכוכית.
בכמה מחקרים חדשניים, נעשה שימוש בדימות in vivo של שני פוטונים כדי לחקור אינטראקציות מיקרוגליה-נוירון 12,21,23. במיוחד בעבודה החלוצית של מרליני ואחרים, הם ביצעו סימולטני in vivo הדמיה של דינמיקה מיקרוגליאלית ופעילות עצבית בתוך גופי התא21. בשיטה זו, על ידי שימוש במשקפיים פנימיים עבים יותר עבור חלונות גולגולת, אנו יכולים לדכא ארטיפקטים תנועתיים בכיוון העומק ולהשיג מדידה יציבה של פעילות עצבית במיקרו-מבנים, כגון עמוד שדרה דנדריטי. שיטה זו תסייע לחקור אינטראקציות של תהליך סינפסה-מיקרוגליאה בעכברים ערים.
לאחרונה, מחקר במבחנה הראה כי לתהליכים מיקרוגליאליים דקים דמויי פילופודיה יש תנועתיות מהירה יותר מאשר תהליכים עבים, דבר המצביע על חשיבות תנועתיותם המהירה יותר במעקב19. המערכת כאן יכולה לעקוב אחר תנועתיות של תהליכים מיקרוגליאליים דקים ברזולוציה זמנית בין תת-שנייה לכמה עשרות שניות. מאפיין זה מסייע להבהיר את המשמעות הפונקציונלית של תנועתיותם למעקב in vivo.
בעתיד, השילוב של טכניקת הדמיה זו עם התערבויות, כגון אופטוגנטיקה24 או כימוגנטיקה25, המיושמות על מעגלים עצביים מקומיים או קשרים עצביים בין-אזוריים ישפוך אור על תפקודים מיקרוגליאליים חדשים בהתפתחות סינפטית ופלסטיות אשר מפסלים מאפיינים של מעגלים עצביים. כמו כן, שילוב נוסף של הדמיה, התערבות ומשימות התנהגותיות יתרום לחשיפת התיאום בין תאי מיקרוגליה ונוירונים העומדים בבסיס התנהגויות ספציפיות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לד"ר מסאשי קונדו ולד"ר מסאנורי מצוזאקי על אספקת וקטורי הנגיף. עבודה זו נתמכה על ידי Grants-in-Aid for Scientific Research (20H00481, 20A301, 20H05894, 20H05895 to S.O.), הסוכנות היפנית למחקר ופיתוח רפואי (JP19gm1310003 ו- JP17gm5010003 ל- S.O. ו- JP19dm0207082 ל- H.M.), מרכז UTokyo למדע אינטגרטיבי של התנהגות אנושית (CiSHuB), סוכנות המדע והטכנולוגיה היפנית Moonshot R&D (JPMJMS2024 עד H.M.), הקרן למדעי המוח (ל H. M).
Materials
| Name | Company | Catalog Number | Comments |
| 10-inch LCD monitor | EIZO | DuraVision FDX1003 | For presenting grating visual stimuli |
| 26G Hamilton syringe | Hamilton | 701N | |
| 27G needle | Terumo | NN-2719S | |
| AAV-hSyn-R-CAMP1.07 | N/A | N/A | Kindly gifted from Prof. Matsuzaki's laboratory |
| Activated charcoal powder | Nacalai tesque | 07909-65 | |
| Black aluminum foil | THORLABS | BKF12 | |
| CX3CR1-EGFP mouse | Jackson laboratory | IMSR_JAX: 005582 | CX3CR-1EGFP/+ knock-in/knock-out mice expressing EGFP in microglia in the brain under the control of the endogenous Cx3cr1 locus. |
| DENT SILICONE-V | Shofu Inc | N/A | For the attachment of a shading device to a head-plate |
| Dental cement (quick resin, liquid) | Shofu Inc | N/A | AB |
| Dental cement(quick resin, powder) | Shofu Inc | N/A | B Color 3 |
| Drill | Toyo Associates | HP-200 | |
| Glass capillary pipette | Drummond Scientific Company | 2-000-075 | |
| Glass disc (large) | Matsunami | N/A | 4mm in diameter, 0.15±0.02mm in thickness |
| Glass disc (small) | Matsunami | N/A | 2mm in diameter, 0.525±0.075mm in thickness |
| Head-plate | Customized | N/A | Material: SUS304, thickness: 0.5mm, see Figure2B for the shape |
| Hemostatic fiber | Davol Inc | 1010090 | |
| ImageJ Fiji software | Free software | For data registration | |
| Instant glue (Aron alpha) | Daiichi Sankyo | N/A | |
| Isoflurane | Pfizer | N/A | |
| Lidocaine | Astrazeneca | N/A | |
| MATLAB 2017b | MathWorks | N/A | For data registration and processing |
| Meloxicam | Tokyo Chemical Industry | M1959 | |
| Microinjector | KD Scientific | KDS-100 | |
| Micropipette puller | Sutter Instrument Company | P-97 | |
| Multi-photon excitation microscope | NIKON | N/A | The commercial name is "A1MP+". |
| Objective lens | NIKON | N/A | The commercial name is "CFI75 apochromat 25xC W". |
| Paraffin Liquid | Nacalai tesque | 26132-35 | |
| Psychtoolbox | Free software | For presenting grating visual stimuli | |
| Shading device | Customized | N/A | |
| Stereomicroscope | Leica | M165 FC | |
| Stereotaxic instrument | Narishige Scientific Instrument | SR-611 | For the surgery |
| Stereotaxic instrument | Customized | N/A | For fixing mice under the two-photon microscope |
| Stopcock | ISIS | VXB1079 | |
| Surgical silk | Ethicon | K881H | |
| Treadmill | Customized | N/A | |
| UV light curing agent | Norland Products Inc | NOA 65 | |
| Vaporizer | Penlon | Sigma Delta | Anesthetic machine |
References
- Andoh, M., et al. Exercise reverses behavioral and synaptic abnormalities after maternal inflammation. Cell Reports. 27 (10), 2817-2825 (2019).
- Inoue, K., Tsuda, M. Microglia in neuropathic pain: cellular and molecular mechanisms and therapeutic potential. Nature Reviews. Neuroscience. 19 (3), 138-152 (2018).
- Clasadonte, J., Scemes, E., Wang, Z., Boison, D., Haydon, P. G. Connexin 43-mediates astroglial metabolic networks contribute to the regulation of the sleep-wake cycle. Neuron. 95 (6), 1365-1380 (2017).
- Taylor, A. M. W., et al. Microglia disrupt mesolimbic reward circuitry in chronic pain. Journal of Neuroscience. 35 (22), 8442-8450 (2015).
- Kondo, S., Kohsaka, S., Okabe, S. Long-term changes of spine dynamics and microglia after transient peripheral immune response triggered by LPS in vivo. Molecular Brain. 4, 27 (2011).
- Wu, Y., Dissing-Olsen, L., MacVicar, B. A., Stevens, B. Microglia: Dynamic mediators of synapse development and plasticity. Trends in Immunology. 36 (10), 605-613 (2015).
- Andoh, M., Koyama, R. Microglia regulate synaptic development and plasticity. Developmental Neurobiology. 81 (5), 568-590 (2020).
- Iida, T., Tanaka, S., Okabe, S. Spatial impact of microglial distribution on dynamics of dendritic spines. European Journal of Neuroscience. 49 (11), 1400-1417 (2019).
- Nakayama, H., et al. Microglia permit climbing fiber elimination by promoting GABAergic inhibition in the developing cerebellum. Nature Communications. 9 (1), 2830 (2018).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Tremblay, M. E., Lowery, R. L., Majewska, A. K. Microglial interactions with synapses are modulated by visual experience. PLoS Biology. 8 (11), 10000527 (2010).
- Liu, Y. U., et al. Neuronal network activity controls microglial process surveillance in awake mice via norepinephrine signaling. Nature Neuroscience. 22 (11), 1771-1781 (2019).
- Kim, T. H., Schnitzer, M. J. Fluorescence imaging of large-scale neural ensemble dynamics. Cell. 185 (1), 9-41 (2022).
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
- Isshiki, M., Okabe, S. Evaluation of cranial window types for in vivo two-photon imaging of brain microstructures. Microscopy (Oxf). 63 (1), 53-63 (2014).
- Ohtsuki, G., et al. Similarity of visual selectivity among clonally related neurons in visual cortex. Neuron. 75 (1), 65-72 (2012).
- Maruoka, H., et al. Lattice system of functionally distinct cell types in the neocortex. Science. 358 (6363), 610-615 (2017).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Bernier, L. P., et al. Nanoscale surveillance of the brain by microglia via cAMP-regulated filopodia. Cell Reports. 27 (10), 2895 (2019).
- Sun, W., et al. In vivo two-photon imaging of anesthesia-specific alterations in microglial surveillance and photodamage-directed motility in mouse cortex. Frontiers in Neuroscience. 13, 421 (2019).
- Merlini, M., et al. Microglial Gi-dependent dynamics regulate brain network hyperexcitability. Nature Neuroscience. 24 (1), 19-23 (2021).
- Kondo, M., Kobayashi, K., Ohkura, M., Nakai, J., Matsuzaki, M. Two-photon calcium imaging of the medial prefrontal cortex and hippocampus without cortical invasion. eLife. 6, 26839 (2017).
- Badimon, A., et al. Negative feedback control of neuronal activity by microglia. Nature. 586 (7829), 417-423 (2020).
- Rajasethupathy, P., Ferenczi, E., Deisseroth, K. Targeting neural circuits. Cell. 165 (3), 524-534 (2016).
- Roth, B. L. DREADDs for Neuroscientists. Neuron. 89 (4), 683-694 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved