Method Article
Одновременная визуализация динамики микроглии и активности нейронов у бодрствующих мышей
В этой статье
Резюме
Здесь мы описываем протокол, сочетающий инъекцию аденоассоциированного вируса с имплантацией черепного окна для одновременной визуализации динамики микроглии и активности нейронов у бодрствующих мышей.
Аннотация
Поскольку функции мозга находятся под постоянным влиянием сигналов, поступающих из периферических тканей, очень важно выяснить, как глиальные клетки мозга воспринимают различные биологические условия на периферии и передают сигналы нейронам. Микроглия, иммунные клетки в головном мозге, участвуют в синаптическом развитии и пластичности. Таким образом, вклад микроглии в построение нейронных цепей в ответ на внутреннее состояние организма должен быть критически проверен с помощью прижизненной визуализации взаимосвязи между динамикой микроглии и активностью нейронов.
Здесь мы описываем технику одновременной визуализации динамики микроглии и активности нейронов у бодрствующих мышей. Аденоассоциированный вирус, кодирующий R-CaMP, генно-кодируемый кальцием индикатор красного флуоресцентного белка, вводили в слой 2/3 первичной зрительной коры у трансгенных мышей CX3CR1-EGFP, экспрессирующих EGFP в микроглии. После вирусной инъекции на поверхность мозга инъецируемой области устанавливалось черепное окно. Двухфотонная визуализация in vivo у бодрствующих мышей через 4 недели после операции показала, что нейронная активность и динамика микроглии могут быть зарегистрированы одновременно с временным разрешением менее секунды. Этот метод может выявить координацию между динамикой микроглии и активностью нейронов, причем первые реагируют на периферические иммунологические состояния, а вторые кодируют внутренние состояния мозга.
Введение
Появляется все больше доказательств того, что внутреннее состояние организма постоянно влияет на функции мозга у животных 1,2,3,4,5. Соответственно, чтобы получить более глубокое понимание функций мозга, крайне важно выяснить, как глиальные клетки в мозге контролируют биологические условия на периферии и передают информацию нейронам.
Микроглия, иммунные клетки в головном мозге, участвуют в синапсовом развитии и пластичности, которые формируют характеристики нейронных цепей в мозге 6,7,8,9. Например, новаторская работа Wake et al. продемонстрировала, что микроглиальные процессы вступают в контакт с синапсами в зависимости от активности нейронов в неокортексе мыши и что искусственная ишемия вызывает потерю синапсов после длительного контакта с микроглией10. Тремблей и др. обнаружили, что изменение зрительного опыта изменяет модальность взаимодействия микроглии с синапсами. В критический период, когда дендритный оборот позвоночника в первичной зрительной коре (V1) увеличивается за счет бинокулярной депривации, темновая адаптация снижает подвижность микроглиальных процессов и увеличивает как частоту их контакта с синаптическими щелями, так и количество клеточных включений в микроглии11. Эти результаты свидетельствуют о том, что микроглиальные процессы ощущают нейронную активность и окружающую их среду для ремоделирования нейронных цепей. Кроме того, недавнее исследование показало, что наблюдение за микроглией различается между бодрствующими и анестезированными состояниями, что свидетельствует о важности экспериментов с использованием бодрствующих мышей для изучения связи нейрон-микроглия в физиологических условиях12.
Двухфотонная кальциевая визуализация in vivo является мощным инструментом для регистрации динамики кальция, отражающей продолжающееся возбуждение нейронов, в сотнях нейронов одновременно у живого животного13,14,15. Визуализация кальция в нейронах обычно требует временного разрешения более нескольких Гц для отслеживания быстрых нейронных реакций16,17. Напротив, в предыдущих исследованиях, отслеживающих динамику микроглии, были отобраны структуры микроглии с относительно низким временным разрешением менее 0,1 Гц18,19,20. В одном недавнем исследовании была применена одновременная двухфотонная визуализация для понимания связи между нейронами и микроглией21. Тем не менее, до сих пор неясно, как динамические микроглиальные процессы реагируют на окружающую нейронную активность с временным разрешением более нескольких Гц у бодрствующих мышей. Чтобы решить эту проблему, мы описываем одновременный метод двухфотонной визуализации in vivo нейронной активности и динамики микроглии с временным разрешением выше 1 Гц у бодрствующих мышей. Этот метод позволяет нам добиться стабильной визуализации у бодрствующих мышей с более высокой частотой кадров (максимум, 30 Гц с размером пиксельного кадра 512 x 512 пикселей) и обеспечивает более благоприятный способ исследования наблюдательного поведения микроглии или их взаимодействия с нейронной активностью у бодрствующих мышей.
протокол
Все эксперименты были одобрены Комитетом по этике животных и Комитетом по безопасности генетических рекомбинантных экспериментов Высшей школы медицины и медицинского факультета Токийского университета и выполнены в соответствии с их рекомендациями.
1. Подготовка
- Стерилизуйте все инструменты и аппараты, необходимые для операции, с помощью автоклава или 70% этанола.
- Приготовление стеклянной пипетки.
- Надежно закрепите калиброванный капилляр объемом 75 мкл на держателе съемника микропипетки. Установите съемник в программу с рекомендуемыми параметрами P (давление) = 500, HEAT = 680, PULL = 30, VEL = 60, TIME = 180.
- После окончания программы (обычно от 4,5 до 5 с) капилляр разделяют на две стеклянные пипетки с сужающимися хвостиками. Затем разбейте пинцетом дистальную часть хвостов, чтобы диаметр кончика не превышал 30-50 мкм. Для этого разломайте хвостики на 1 см дистальнее конца скошенной части.
- Для трепанации черепа подготовьте черепное окно, приклеив больший внешний стеклянный диск диаметром 4 мм, толщиной 0,15 ± 0,02 мм к меньшему внутреннему стеклянному диску диаметром 2 мм, толщиной 0,525 ± 0,075 мм с использованием реагента для отверждения ультрафиолетовым светом (рис. 2A).
2. Впрыск AAV
- Подготовка инъекционного аппарата
- Поместите стеклянную пипетку, соединенную со шприцем Гамильтона 26 г через трубку, на держатель пипетки стереотаксического инструмента, а затем наклоните держатель пипетки на 60° вперед от вертикальной оси (рис. 1A, B).
- Наполните стеклянную пипетку, шприц и соединительную трубку жидким парафином. Поместите шприц на микроинжектор.
- Хирургическое вмешательство
ПРИМЕЧАНИЕ: Следующая операция была выполнена в стерилизованной кабине. При необходимости для операции использовался стереомикроскоп.- Анестезировать самца мыши CX3CR1-EGFP (подробная информация в таблице материалов) в возрасте от 7 до 8 недель (масса тела 22-26 г) 3% изофлураном в газонепроницаемой камере. Через 3 мин выньте мышь из камеры, когда она потеряет произвольное движение, кроме дыхания, а затем переключитесь на непрерывную анестезию назальной трубкой с 2% изофлураном.
ПРИМЕЧАНИЕ: Известно, что изофлуран активирует микроглию. Однако, поскольку визуализация проводится через 4 недели после операции, изофлуран не оказывает влияния на мышей во время визуализации. Хотя изофлурановая анестезия используется в течение нескольких минут, когда мышей помещают в стереотаксический инструмент перед визуализацией (этап 4.2.1), мы обнаружили, что эффект этой короткой анестезии незначителен. - Во время операции держите мышь в тепле с помощью грелки при температуре 37 °C, чтобы предотвратить переохлаждение. Нанесите глазную мазь на оба глаза, чтобы предотвратить сухость роговицы, и введите инъекцию мелоксикама подкожно (5 мг / кг). Прикрепите мышь к вспомогательной ушной планке, а затем закрепите мышь на стереотаксическом инструменте тыльной стороной вверх.
- Отрегулируйте концентрацию изофлурана до соответствующего процента (1-2%) во время операции, контролируя дыхание и частоту сердечных сокращений. Удалите волосы с помощью крема для депиляции и продезинфицируйте голову несколько раз круговыми движениями скрабом на основе йода или хлоргексидина и спиртом. Затем введите 0,1 мл 1% лидокаина подкожно и наложите стерильные простыни, чтобы закрепить место операции.
- Надрежьте кожу головы ножницами по средней линии и сделайте разрез длиной около 2 см, чтобы обеспечить хорошее обнажение черепа над правой первичной зрительной корой. После разреза кожи головы орошите голову физиологическим раствором на протяжении всей процедуры, чтобы предотвратить высыхание обнаженного черепа и мозга.
- Удалите надкостницу на обнаженном черепе с помощью щипцов. Просверлите череп по стереотаксическим координатам: 3 мм сбоку от средней линии, 0,5 мм спереди лямбда-линии, чтобы создать небольшое отверстие диаметром примерно 0,5 мм. При необходимости смойте кровь и остатки тканей со сверла.
- Заполните стеклянную пипетку 1 мкл rAAV2/1-hSyn-R-CaMP1.07, используя следующую процедуру при титре 8,3 x 1012 векторных геномов/мл22.
- Продвиньте шприц, чтобы вытолкнуть 1 мкл жидкого парафина из стеклянной пипетки. Поместите кусок прозрачной пленки размером примерно 2 см х 2 см на открытый череп мыши и вытесните каплю 1 мкл раствора AAV на пленку с помощью пипетки.
- Поместите стеклянный наконечник пипетки в каплю раствора AAV на пленке и осторожно потяните шприц, чтобы аспирировать раствор AAV. После выброса поверните Т-образный запорный кран, чтобы сбросить давление внутри трубки и стеклянной пипетки.
- Вставьте стеклянную пипетку на глубину 500 мкм от поверхности мозга через отверстие, созданное на шаге 2.2.5, а затем введите 0,5 мкл раствора AAV с помощью микроинжектора (рис. 1C). Используйте объемный расход впрыска 2,0 мкл / ч; инъекция 0,5 мкл занимает 15 мин, а затем ждать 5 мин.
- После инъекции аккуратно извлеките стеклянную пипетку и промойте поверхность мозга физиологическим раствором.
- Анестезировать самца мыши CX3CR1-EGFP (подробная информация в таблице материалов) в возрасте от 7 до 8 недель (масса тела 22-26 г) 3% изофлураном в газонепроницаемой камере. Через 3 мин выньте мышь из камеры, когда она потеряет произвольное движение, кроме дыхания, а затем переключитесь на непрерывную анестезию назальной трубкой с 2% изофлураном.
3. Имплантация черепного окна
ПРИМЕЧАНИЕ: Имплантация черепного окна следует за инъекцией AAV в тот же день.
- Отметьте на черепе круг диаметром 2,5 мм, расположенный по центру на расстоянии 3 мм сбоку от лямбды. Создайте круглую канавку вдоль отметины на черепе с помощью сверления. Очистите мусор, так как это может отрицательно повлиять на видимость черепа, и нанесите физиологический раствор во время процесса сверления, чтобы предотвратить нагрев.
- Чтобы проверить, достаточна ли глубина сверления в круглой канавке для удаления центрального фрагмента черепа, аккуратно прижмите центральный череп щипцами. Если он движется вертикально с небольшим сопротивлением, глубина бурения достаточна.
- Когда бороздка достигнет достаточной глубины, вставьте кончик щипцов в нижнюю часть центрального фрагмента черепа, осторожно поднимите и извлеките его, чтобы обнажить поверхность мозга (рис. 1D).
- Используя иглу 27 G, уколите и разорвите твердую мозговую оболочку на краю открытой поверхности мозга. Вставьте кончик щипцов через отверстие, сделанное на краю твердой мозговой оболочки. Возьмитесь за твердую мозговую оболочку и снимите ее, чтобы обнажить поверхность мозга.
ПРИМЕЧАНИЕ: Если происходит кровотечение, промойте поверхность мозга физиологическим раствором до тех пор, пока кровотечение не остановится. - С помощью щипцов рассредоточите гемостатических волокон одно за другим в физиологическом растворе в чашке диаметром 3,5 мм, а затем поместите гемостатических волокон по краям отверстия, в котором присутствует пересеченная твердая мозговая оболочка.
- Поместите черепное окно, подготовленное на шаге 1.3, на открытую поверхность мозга, а затем приклейте его к черепу с помощью мгновенного клея, осторожно нажимая на окно, чтобы окно находилось в тесном контакте с черепом.
- После этого нанесите мгновенный клей на весь открытый череп, а затем осторожно прикрепите головную пластину к черепу так, чтобы окно находилось в центре квадратного отверстия головной пластины (рис. 2C). Убедитесь, что поверхность головной пластины параллельна поверхности стеклянного окна.
- После того, как клей достаточно затвердеет, нанесите стоматологический цемент на обнаженный череп, чтобы укрепить крепление между головой и головной пластиной (рис. 2).
ПРИМЕЧАНИЕ: Если эксперименты включают представление визуальных стимулов мышам, следует избегать рассеянного света в область визуализации. Желательно почернить цемент, смешав его с активированным углем для уменьшения отражения света. - Извлеките мышь из анестезии после того, как цемент достаточно затвердеет (около 20 мин). Затем поместите мышь в новую клетку, чтобы она восстановилась в одиночестве.
- После подтверждения ее сознания и произвольного движения, свидетельствующего о полном выздоровлении, поместите мышь обратно в домашнюю клетку. Во время выздоровления вводите вторую или, при необходимости, более дозу мелоксикама (один раз каждые 24 часа в течение 1-3 дней), если возникают очевидные симптомы, указывающие на боль.
4. Двухфотонная визуализация микроглии и динамики кальция в нейронах in vivo
- Привыкание мышей к аппарату микроскопа
- Через три недели после операции наведите на мышь анестезию 3% изофлураном и поместите мышь под 25-кратный объектив двухфотонного микроскопа с помощью специально изготовленного стереотаксического прибора (рис. 3C). Для настройки здесь мышь устанавливается на верхнюю часть беговой дорожки и может свободно бегать.
- Примерно через 10 минут извлеките мышь из предметного столика микроскопа и верните ее в домашнюю клетку. Повторяйте привыкание не менее 3 раз через день перед получением двухфотонного изображения.
- Получение двухфотонных изображений
ПРИМЕЧАНИЕ: Мы рекомендуем проводить получение изображения более чем через 4 недели после операции, так как активация микроглии постепенно возвращается к базальному уровню.- Как и на шаге 4.1, индуцируют анестезию у мыши 3% изофлураном и устанавливают мышь под линзу объектива двухфотонного микроскопа с помощью изготовленного на заказ стереотаксического прибора.
- Установите изготовленное на заказ затеняющее устройство и ЖК-монитор для визуальной стимуляции, как описано ниже (рис. 3D).
- Расположите линзу так, чтобы она сфокусировалась на поверхности мозга, а затем установите это положение объектива в исходное положение Z. Сохраняйте координаты x-y постоянными и поднимите линзу объектива; Извлеките мышь и стереотаксический прибор из линзы объектива и беговой дорожки.
- Прикрепите затеняющее устройство к верхней части головной пластины с помощью силикона, который чернеет путем смешивания с порошком древесного угля, и убедитесь, что пространство между головной пластиной и затеняющим устройством хорошо закрыто.
- Наполните затеняющее устройство дистиллированной водой, а затем снова закрепите мышь и стереотаксическую рамку под объективом и на беговой дорожке. Аккуратно сбросьте фокальную плоскость на поверхности мозга, проверив глубину линзы объектива.
ПРИМЕЧАНИЕ: Чтобы избежать риска повреждения объектива, сначала установите координаты xyz, а затем примените затеняющее устройство объектива. Также разумно сначала установить крышку, а потом корректировать координаты, но для этого варианта необходимо осторожное обращение. - Накройте линзу объектива черной алюминиевой фольгой, чтобы избежать загрязнения света от ЖК-монитора, используемого для визуальной стимуляции через линзу объектива (рис. 3D). Установите 10-дюймовый ЖК-монитор на расстоянии 12,5 см перед глазами мыши для отображения визуальных стимулов (рис. 3D).
- Настройте фильтры сбора флуоресцентного излучения на флуоресценцию EGFP (эмиссионный фильтр 525/50 нм) и флуоресценцию R-CaMP (эмиссионный фильтр 593/46 нм) и длину волны возбуждения до 1,000 нм. Получение изображений с пространственным разрешением 0,25 мкм/пиксель с помощью объектива 25x 1,1 NA и ФЭУ GaAsP.
- Найдите область визуализации, в которой нейроны R-CaMP (+) и микроглия EGFP (+) могут быть одновременно визуализированы в слое 2/3. Для этой установки данные, полученные на рисунке 4 и видео 1 , находились на глубине 100 мкм от поверхности пиала с использованием предварительного просмотра изображения в реальном времени. Держите мощность возбуждающего лазера как можно ниже, чтобы избежать фотообесцвечивания и повреждений, вызванных повышенной локальной температурой в области изображения.
- Получайте изображения с частотой кадров 30 Гц. Одновременно с получением изображения представьте дрейфующие визуальные стимулы с 100% контрастностью, 1,5 Гц, 0,04 цикла на градус в 12 направлениях при 6 ориентациях от 0° до 150° с шагом 30° к мыши17.
- После получения изображения извлеките мышь из предметного столика микроскопа, отсоедините затеняющее устройство и стереотаксический инструмент от мыши и верните мышь в домашнюю клетку.
- Регистрация данных
- Преобразуйте и сохраните полученные данные изображения (в данном случае формат nd2) в виде серии файлов изображений tiff для каждого цветового канала, используя Fiji или программное обеспечение, поставляемое с микроскопом.
- Примените Turboreg, плагин Фиджи, для выполнения регистрации с mode = translation. Используйте усредненное изображение в качестве эталонного изображения с файлами изображений tiff канала EGFP.
- Выполните следующую обработку для каждого кадра с помощью MATLAB.
ПРИМЕЧАНИЕ: Хотя MATLAB используется в следующей обработке, описание в основном фокусируется на намерении каждого шага, чтобы данные могли быть проанализированы другим программным обеспечением, таким как Python.- Используйте функцию imread для чтения двух изображений EGFP tiff до и после регистрации одного и того же кадра соответственно. Используйте функцию imread для чтения изображения R-CaMP tiff того же кадра.
- Используйте функцию normcorr2 для вычисления функции корреляции между векторизованными переменными двух изображений GFP, прочитанных на шаге 4.3.3.1.
- Используйте функцию max для определения линейного индекса с наибольшей перекрестной корреляцией корреляционной функции, а затем используйте функцию ind2sub для вычисления положения движения зарегистрированного изображения по исходному изображению.
- Используйте функцию imwarp для преобразования изображения R-CaMP в положение, рассчитанное на шаге 4.3.3.3, а затем используйте функцию imwrite для сохранения зарегистрированного изображения R-CaMP.
- Образование следов кальция
- Выполните следующую обработку с помощью MATLAB. Используйте функцию imread для чтения всех зарегистрированных изображений R-CaMP tiff, сгенерированных на шаге 4.3.3.4. Если зарегистрированные изображения уже загружены в качестве переменной в рабочую область, пропустите этот шаг.
- Используйте функцию среднего значения для создания изображения временной проекции. Используйте функцию imshow, чтобы отобразить усредненное изображение в виде рисунка; используйте функцию roipoly для создания двоичной маски ROI целевой структуры (дендритный позвоночник в этих данных).
- Используя функцию среднего с изображениями, полученными путем умножения двоичной маски на изображения каждого кадра в качестве входных переменных, вычислите усредненную интенсивность флуоресценции в пределах ROI для каждого кадра.
- Как описано ранее17, к переменной, полученной на шаге 4.4.3, примените частотный фильтр стоимости сливочного масла при отсечке = 1,6 с, для резки высокочастотного шума, а затем примените скользящий медианный фильтр на временном окне = 200 с, для сокращения низкочастотного шума.
Результаты
Мы выполнили инъекцию AAV и имплантацию черепного окна в V1 8-недельной трансгенной мыши CX3XR1-EGFP, как описано в этом протоколе. Через четыре недели после операции мы выполнили одновременную двухфотонную визуализацию in vivo нейронной активности и динамики микроглии на основе R-CaMP в слое 2/3 V1 (рис. 4 и видео 1). Во время визуализации мышь помещали на беговую дорожку и позволяли свободно бегать. Изображения были получены с частотой кадров 30 Гц с пространственным разрешением 0,25 мкм/пиксель с использованием объектива 25x, 1,1 NA и GaAsP PMT. Как EGFP, так и R-CaMP возбуждались на длине волны 1,000 нм, и флуоресценция EGFP (эмиссионный фильтр 525/50 нм) и флуоресценция R-CaMP (эмиссионный фильтр 593/46 нм) собирались одновременно. После регистрации полученных данных для минимизации артефактов движения каждые четыре кадра были усреднены в один кадр для уменьшения фонового шума. Мышам были представлены решетчатые визуальные стимулы, а также проанализированы визуальные реакции нейронов и отдельных дендритных шипов (рис. 4D). Микроглиальные процессы показали быструю динамику и изменили свою морфологию в течение 10 с (рис. 4E и видео 1). Как подробно описано в разделе «Обсуждение», когда инъекция AAV не удалась, экспрессия R-CaMP не могла быть обнаружена. Если операция не была успешной, сигналы EGFP и R-CaMP не могли наблюдаться.
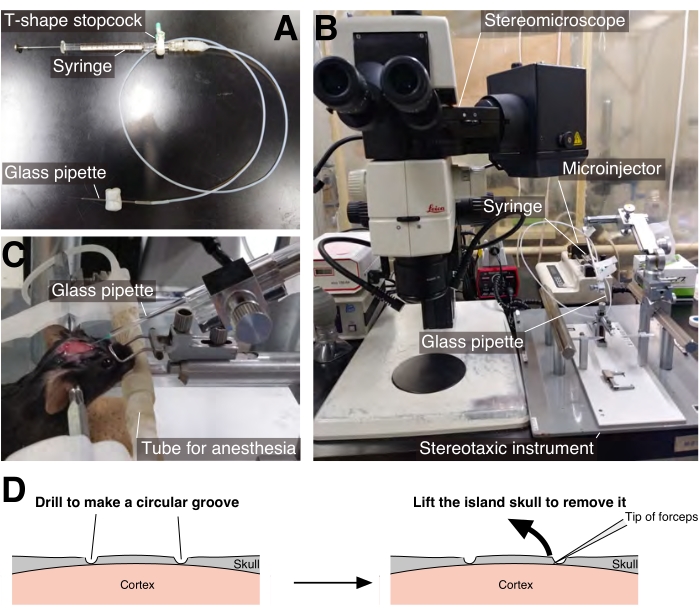
Рисунок 1: Инъекция AAV . (A) Стеклянная пипетка была соединена со шприцем Гамильтона 26 г с помощью силиконовой трубки. (B) Установка для впрыска AAV. (C) Раствор AAV вводили через стеклянную пипетку, наклоненную на 60° кпереди от вертикальной оси. (D) Принципиальная схема процедуры вскрытия черепа (описана на шаге 3.3). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
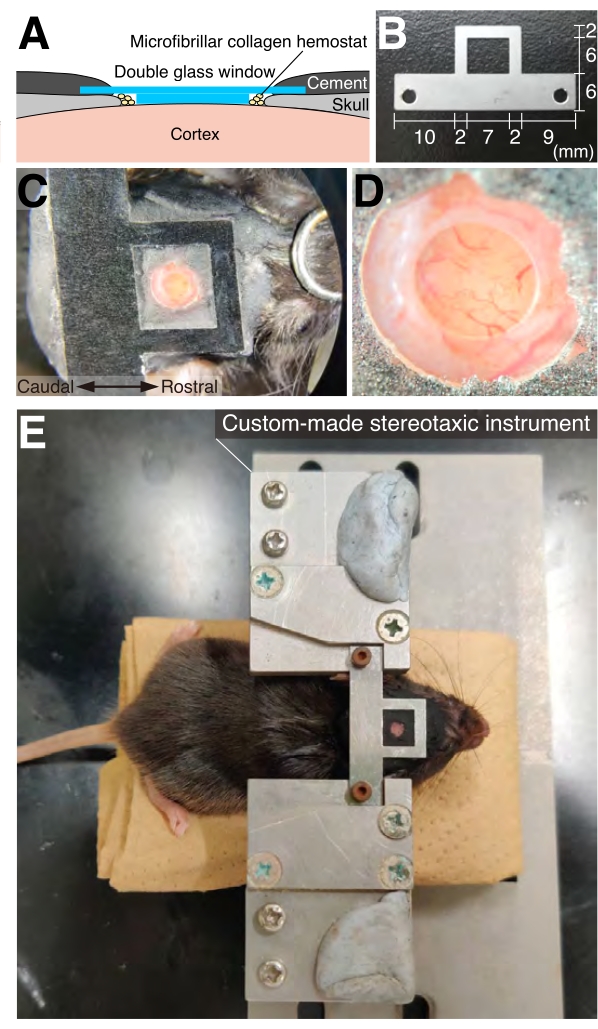
Рисунок 2: Черепное окно и головная пластина . (А) Принципиальная схема имплантации черепного окна. b) использовались изготовленные по индивидуальному заказу головные пластины. Для визуализации в правом полушарии следует использовать более короткую руку с правой стороны. (C) Дорсальный вид мыши с черепным окном и имплантированной пластиной головы. (D) Вид черепного окна с большим увеличением, показанный на рисунке 2C. (E) Вид на спине мыши, зафиксированный с помощью изготовленного на заказ стереотаксического прибора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Установка для двухфотонной визуализации in vivo. (А) Вид со спины затеняющего устройства. (B) Вид сбоку затеняющего устройства. (C) Вид мыши с затеняющим устройством на голове под объективом. Мышь помещается на беговую дорожку. (D) Вид под двухфотонным возбуждающим микроскопом. Монитор, представляющий визуальные стимулы, размещается в правой части фигуры. Линза объектива покрыта затеняющим устройством и черной алюминиевой фольгой, чтобы избежать попадания света от монитора к линзе объектива. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
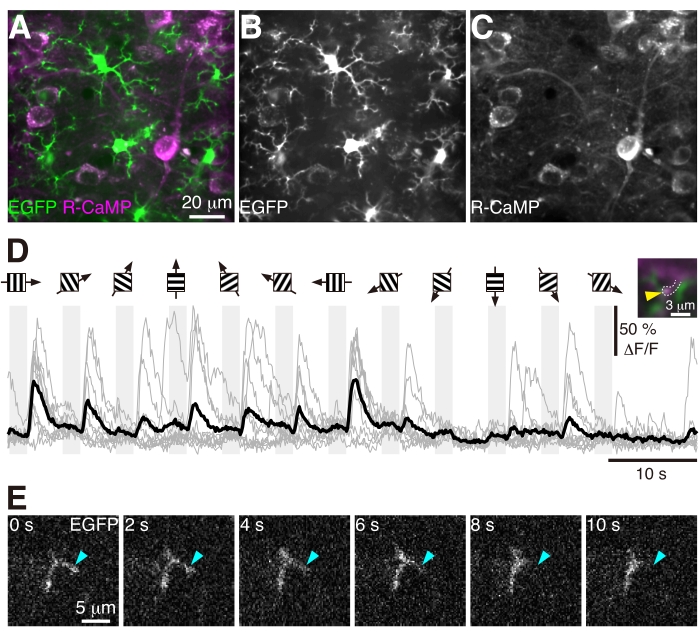
Рисунок 4: Динамика микроглии и зрительные реакции в дендритном позвоночнике. (А-С) Усредненные по времени изображения микроглии EGFP (+) и нейронов R-CaMP (+) в слое 2/3 V1 у 12-недельной трансгенной мыши CX3XR1-EGFP. Интенсивность сигнала в каждом канале нормировалась независимо. (D) Зрительные реакции в дендритном отделе позвоночника. Полосатые диаграммы с черными стрелками указывают направление стимулов решетки, представленных во времени, обозначенном серыми столбцами. В кальциевых следах серые линии указывают на индивидуальные реакции, а черная линия указывает на их среднее значение. На правой вставке желтая стрелка указывает на дендритный позвоночник, в котором была сформирована интересующая область (ROI) для получения следов кальция. (E) Микроглиальный отросток (голубой наконечник стрелы) показал быстрое втягивание через 10 с. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Видео 1: Двухфотонная визуализация активности нейронов и динамики микроглии. Данные визуализации микроглии EGFP (+) и нейронов R-CaMP (+) в слое 2/3 V1 у 12-недельной трансгенной мыши CX3XR1-EGFP. В левой части фильма пурпурный цвет указывает на R-CaMP в нейронах, а зеленый — на EGFP в микроглии. Центр ролика соответствует сигналу EGFP, а правая часть — сигналу R-CaMP. Интенсивность сигнала в каждом канале нормировалась независимо. Частота кадров фильма в 40 раз выше, чем фактическая. Масштабная линейка = 10 мкм Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Обсуждение
Мы описываем протокол инъекции AAV и трепанации черепа для одновременной визуализации динамики микроглии и активности нейронов у бодрствующих мышей, а также обработки данных. Этот метод может выявить координацию между динамикой микроглии и активностью нейронов в масштабах времени от менее секунды до десятков секунд.
Протокол операции включает в себя несколько технически сложных этапов. Инъекция AAV является одним из важнейших шагов. Неудачная инъекция AAV может вызвать значительное снижение экспрессии R-CaMP. Основных причин две: засорение стеклянных пипеток и повреждение тканей. Засорение стеклянных пипеток уменьшает или полностью блокирует выброс раствора AAV. Этой ситуации можно избежать, покрасив раствор AAV красителем типа быстрого зеленого и визуально подтвердив успешность инъекции. Повреждение тканей, вызванное инъекцией AAV, предотвращает экспрессию экзогенных генов вблизи центра места инъекции. Повреждение, вызванное инъекцией AAV, вероятно, вызвано внезапным увеличением оттока от наконечника стеклянной пипетки после накопления давления внутри пипетки. Поэтому отток раствора AAV из стеклянной пипетки должен быть постоянным во время инъекции. Выбор стеклянных пипеток с немного большим диаметром на концах решил бы эту проблему. При имплантации черепного окна скорость операции имеет решающее значение. Если операция занимает слишком много времени, мозговая ткань может быть серьезно повреждена. Соответственно, повторная практика необходима для обеспечения скорости и гладкости операции. Кроме того, в течение 4 недель от операции до визуализации качество визуализации может быть снижено за счет регенерации ткани между черепным окном и тканью головного мозга обычным методом17. Этот метод решает эту проблему, применяя толстые стекла к внутреннему стеклянному диску черепных окон, чтобы ингибировать регенерацию тканей и сохранять окно чистым. В системе, описанной здесь, этот эффект был очевиден при использовании внутреннего стеклянного диска толщиной 0,525 ± 0,075 мкм.
Метод может быть успешно применен к мышам старше 4 недель, но применение к более молодым мышам может быть проблематичным. У молодых мышей череп демонстрирует быстрый и заметный рост, что вызывает несоответствие между черепной костью и стеклянным окном.
В некоторых передовых исследованиях двухфотонная визуализация in vivo использовалась для изучения взаимодействий микроглии и нейронов 12,21,23. В частности, в новаторской работе Merlini et al. они выполнили одновременную визуализацию in vivo динамики микроглии и нейронной активности в клеточных телах21. В этом методе, используя более толстые внутренние очки для черепных окон, мы могли бы подавить артефакты движения в ориентации глубины и добиться стабильного измерения активности нейронов в микроструктурах, таких как дендритные шипы. Этот метод поможет исследовать взаимодействие синапсов и микроглиальных процессов у бодрствующих мышей.
Недавнее исследование in vitro показало, что тонкие филоподиеподобные микроглиальные отростки имеют более быструю подвижность, чем толстые отростки, что свидетельствует о важности их более быстрой подвижности при эпиднадзоре19. Система здесь может отслеживать подвижность тонких микроглиальных процессов с временным разрешением от субсекунды до нескольких десятков секунд. Это свойство помогает выяснить функциональное значение их подвижности для наблюдения in vivo.
В будущем сочетание этого метода визуализации с вмешательствами, такими как оптогенетика24 или хемогенетика25, применяемые к локальным нейронным цепям или межрегиональным нейронным связям, прольет свет на новые функции микроглии в синаптическом развитии и пластичности, которые формируют характеристики нейронных цепей. Кроме того, дальнейшая интеграция визуализации, вмешательства и поведенческих задач будет способствовать выявлению координации микроглии и нейронов, лежащих в основе специфического поведения.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Мы благодарим д-ра Масаси Кондо и д-ра Масанори Мацудзаки за предоставление вирусных векторов. Эта работа была поддержана грантами на научные исследования (20H00481, 20A301, 20H05894, 20H05895 для S.O.), Японским агентством медицинских исследований и разработок (JP19gm1310003 и JP17gm5010003 для S.O. и JP19dm0207082 для HM), Центром интегративной науки о поведении человека UTokyo (CiSHuB), Японским агентством по науке и технологиям Moonshot R&D (JPMJMS2024 для H.M.), Фонд науки о мозге (Х. М.).
Материалы
| Name | Company | Catalog Number | Comments |
| 10-inch LCD monitor | EIZO | DuraVision FDX1003 | For presenting grating visual stimuli |
| 26G Hamilton syringe | Hamilton | 701N | |
| 27G needle | Terumo | NN-2719S | |
| AAV-hSyn-R-CAMP1.07 | N/A | N/A | Kindly gifted from Prof. Matsuzaki's laboratory |
| Activated charcoal powder | Nacalai tesque | 07909-65 | |
| Black aluminum foil | THORLABS | BKF12 | |
| CX3CR1-EGFP mouse | Jackson laboratory | IMSR_JAX: 005582 | CX3CR-1EGFP/+ knock-in/knock-out mice expressing EGFP in microglia in the brain under the control of the endogenous Cx3cr1 locus. |
| DENT SILICONE-V | Shofu Inc | N/A | For the attachment of a shading device to a head-plate |
| Dental cement (quick resin, liquid) | Shofu Inc | N/A | AB |
| Dental cement(quick resin, powder) | Shofu Inc | N/A | B Color 3 |
| Drill | Toyo Associates | HP-200 | |
| Glass capillary pipette | Drummond Scientific Company | 2-000-075 | |
| Glass disc (large) | Matsunami | N/A | 4mm in diameter, 0.15±0.02mm in thickness |
| Glass disc (small) | Matsunami | N/A | 2mm in diameter, 0.525±0.075mm in thickness |
| Head-plate | Customized | N/A | Material: SUS304, thickness: 0.5mm, see Figure2B for the shape |
| Hemostatic fiber | Davol Inc | 1010090 | |
| ImageJ Fiji software | Free software | For data registration | |
| Instant glue (Aron alpha) | Daiichi Sankyo | N/A | |
| Isoflurane | Pfizer | N/A | |
| Lidocaine | Astrazeneca | N/A | |
| MATLAB 2017b | MathWorks | N/A | For data registration and processing |
| Meloxicam | Tokyo Chemical Industry | M1959 | |
| Microinjector | KD Scientific | KDS-100 | |
| Micropipette puller | Sutter Instrument Company | P-97 | |
| Multi-photon excitation microscope | NIKON | N/A | The commercial name is "A1MP+". |
| Objective lens | NIKON | N/A | The commercial name is "CFI75 apochromat 25xC W". |
| Paraffin Liquid | Nacalai tesque | 26132-35 | |
| Psychtoolbox | Free software | For presenting grating visual stimuli | |
| Shading device | Customized | N/A | |
| Stereomicroscope | Leica | M165 FC | |
| Stereotaxic instrument | Narishige Scientific Instrument | SR-611 | For the surgery |
| Stereotaxic instrument | Customized | N/A | For fixing mice under the two-photon microscope |
| Stopcock | ISIS | VXB1079 | |
| Surgical silk | Ethicon | K881H | |
| Treadmill | Customized | N/A | |
| UV light curing agent | Norland Products Inc | NOA 65 | |
| Vaporizer | Penlon | Sigma Delta | Anesthetic machine |
Ссылки
- Andoh, M., et al. Exercise reverses behavioral and synaptic abnormalities after maternal inflammation. Cell Reports. 27 (10), 2817-2825 (2019).
- Inoue, K., Tsuda, M. Microglia in neuropathic pain: cellular and molecular mechanisms and therapeutic potential. Nature Reviews. Neuroscience. 19 (3), 138-152 (2018).
- Clasadonte, J., Scemes, E., Wang, Z., Boison, D., Haydon, P. G. Connexin 43-mediates astroglial metabolic networks contribute to the regulation of the sleep-wake cycle. Neuron. 95 (6), 1365-1380 (2017).
- Taylor, A. M. W., et al. Microglia disrupt mesolimbic reward circuitry in chronic pain. Journal of Neuroscience. 35 (22), 8442-8450 (2015).
- Kondo, S., Kohsaka, S., Okabe, S. Long-term changes of spine dynamics and microglia after transient peripheral immune response triggered by LPS in vivo. Molecular Brain. 4, 27 (2011).
- Wu, Y., Dissing-Olsen, L., MacVicar, B. A., Stevens, B. Microglia: Dynamic mediators of synapse development and plasticity. Trends in Immunology. 36 (10), 605-613 (2015).
- Andoh, M., Koyama, R. Microglia regulate synaptic development and plasticity. Developmental Neurobiology. 81 (5), 568-590 (2020).
- Iida, T., Tanaka, S., Okabe, S. Spatial impact of microglial distribution on dynamics of dendritic spines. European Journal of Neuroscience. 49 (11), 1400-1417 (2019).
- Nakayama, H., et al. Microglia permit climbing fiber elimination by promoting GABAergic inhibition in the developing cerebellum. Nature Communications. 9 (1), 2830 (2018).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Tremblay, M. E., Lowery, R. L., Majewska, A. K. Microglial interactions with synapses are modulated by visual experience. PLoS Biology. 8 (11), 10000527 (2010).
- Liu, Y. U., et al. Neuronal network activity controls microglial process surveillance in awake mice via norepinephrine signaling. Nature Neuroscience. 22 (11), 1771-1781 (2019).
- Kim, T. H., Schnitzer, M. J. Fluorescence imaging of large-scale neural ensemble dynamics. Cell. 185 (1), 9-41 (2022).
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
- Isshiki, M., Okabe, S. Evaluation of cranial window types for in vivo two-photon imaging of brain microstructures. Microscopy (Oxf). 63 (1), 53-63 (2014).
- Ohtsuki, G., et al. Similarity of visual selectivity among clonally related neurons in visual cortex. Neuron. 75 (1), 65-72 (2012).
- Maruoka, H., et al. Lattice system of functionally distinct cell types in the neocortex. Science. 358 (6363), 610-615 (2017).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Bernier, L. P., et al. Nanoscale surveillance of the brain by microglia via cAMP-regulated filopodia. Cell Reports. 27 (10), 2895 (2019).
- Sun, W., et al. In vivo two-photon imaging of anesthesia-specific alterations in microglial surveillance and photodamage-directed motility in mouse cortex. Frontiers in Neuroscience. 13, 421 (2019).
- Merlini, M., et al. Microglial Gi-dependent dynamics regulate brain network hyperexcitability. Nature Neuroscience. 24 (1), 19-23 (2021).
- Kondo, M., Kobayashi, K., Ohkura, M., Nakai, J., Matsuzaki, M. Two-photon calcium imaging of the medial prefrontal cortex and hippocampus without cortical invasion. eLife. 6, 26839 (2017).
- Badimon, A., et al. Negative feedback control of neuronal activity by microglia. Nature. 586 (7829), 417-423 (2020).
- Rajasethupathy, P., Ferenczi, E., Deisseroth, K. Targeting neural circuits. Cell. 165 (3), 524-534 (2016).
- Roth, B. L. DREADDs for Neuroscientists. Neuron. 89 (4), 683-694 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены