Method Article
הדמיה אורכית תוך-חיונית של דינמיקת כלי הדם במח העצם הגולגולתי
In This Article
Summary
מיקרוסקופיה תוך-ויטלית מאפשרת לחקור תהליכים ביולוגיים דינמיים כגון התחדשות רקמות והתפתחות גידולים. מח העצם הגולריאלי, רקמה דינמית ביותר, מציע תובנות לגבי המטופואיזיס ותפקוד כלי הדם. שימוש בשתל קיבוע ראש מודפס בתלת מימד תואם ביולוגית מאפשר הדמיה אורכית חוזרת, ומשפר את ההבנה שלנו לגבי דינמיקת הרקמות ומיקרו-סביבת הגידול.
Abstract
הדמיית מיקרוסקופיה פלואורסצנטית אורכית תוך-חיונית התגלתה כטכניקה חיונית לחקר תהליכים ביולוגיים דינמיים, במיוחד בהקשר של התחדשות רקמות, התפתחות גידול ותגובות טיפוליות. בפרט, מח העצם הגולגולתי הוא רקמה דינמית ביותר, שבה הגורל ההמטופויאטי קשור זה בזה עם המיקרו-סביבה שמסביב, עם כלי דם מיוחדים המגיבים להמטופואיזיס נורמלי ופתולוגי. הדמיה מסורתית של רקמות קבועות מציעה מידע סטטי, ולעתים קרובות מגבילה הבנה מקיפה של תהליכים אלה.
השילוב של בעלי חיים טרנסגניים המבטאים סמנים ספציפיים לתאים, עוקבי תאים חיים, התקדמות בציוד הדמיה ושימוש בתאים מיוחדים העלה את המיקרוסקופיה התוך-חיונית לכלי מרכזי להשגת תובנות לגבי תופעות ביולוגיות דינמיות. יישום אחד של הדמיה תוך-חיונית הוא חקירת התנהגות כלי הגידול וההשפעות הטיפוליות. שתל קיבוע ראש טיטניום בהדפסת תלת מימד חדש יכול להיות מחובר ביציבות לגולגולת העכבר ומתאים להדמיה אורכית במהלך מספר מפגשים.
הפרוטוקול המוצע מאפשר בחינה מרחבית וזמנית של דינמיקת כלי הדם במח העצם הגולריאלי, כולל הדמיה וכימות של הטרוגניות כלי הדם, אינטראקציה עם תאים סטרומליים והמטופויאטיים ומדידת פרמטרים תפקודיים של כלי הדם. בנוסף, הטכניקה מאפשרת הדמיה של מיטות כלי דם מבוססות וניטור השפעות טיפוליות, ניוד תאי גזע ולוקליזציה של תרכובות כימותרפיות לאורך זמן באמצעות מיקרוסקופיה דו-פוטונית. בסך הכל, פרוטוקול הדמיה אורכי תוך-חיוני זה מספק פלטפורמה מקיפה לחקירת התנהגות כלי הגידול ודינמיקה של תאים המטופויאטיים, ומציע תובנות חשובות לגבי התהליכים המורכבים השולטים בתופעות ביולוגיות אלה.
Introduction
הדמיית מיקרוסקופיה תוך-חיונית של מח העצם הגולגולתי (BM) משמשת כטכניקה רבת עוצמה והכרחית לחקירת התהליכים הדינמיים של המטופואיזה, ויסות מיקרו-סביבה של רקמות ודינמיקה של כלי הדם בתוך נישת ה-BM. המטרה העיקרית של גישה מתודולוגית זו היא לאפשר הדמיה וניתוח בזמן אמת של התנהגויות תאיות, אינטראקציות וארגון מרחבי בתוך מיקרו-סביבת BM in vivo. על ידי התבוננות ישירה ב-BM calvaria באמצעות טכניקות הדמיה מתקדמות בשילוב עם תיוג פלואורסצנטי, החוקרים יכולים להבהיר את יחסי הגומלין המורכבים בין תאי גזע המטופויאטיים (HSCs), תאי סטרומה וכלי הדם שמסביב, ובכך לספק תובנות חיוניות לגבי ויסות ההמטופואיזיס ותגובות חיסוניות.
פיתוח וניצול של תאי גזע הדמיית מיקרוסקופיה תוך-חיונית מתוך המגבלות של שיטות הדמיה היסטולוגיות והדמיה ex vivo מסורתיות, שלעתים קרובות אינן מצליחות ללכוד את האופי הדינמי של התנהגויות ואינטראקציות תאיות עם רקמה. בניגוד לטכניקות הדמיה סטטיות, מיקרוסקופיה תוך-חיונית מאפשרת לחוקרים לצפות בדינמיקה התאית בזמן אמת, ומאפשרת לחקור תהליכים אורכיים כגון נדידת תאים, התפשטות והתמיינות בתוך הנישה הטבעית שלהם, מבלי להקריב חיות ניסוי. יתר על כן, מיקרוסקופיה תוך-חיונית מספקת את היתרון הייחודי של חקר התנהגויות תפקודיות in vivo, כגון פונקציונליות כלי דם (למשל, זלוף, חדירות, היפוקסיה), ובכך שומרת על הרלוונטיות הפיזיולוגית והימנעות מחפצים הקשורים לקיבוע ועיבוד רקמות. מחקרים חלוציים בתחום הוכיחו את היתרונות העצומים של גישה זו 1,2, וממצאיהם אומתו והורחבו על ידי גישות מעודנות יותר 3,4,5 שהשתמשו במיקרוסקופיה תוך-חיונית כדי לעקוב אחר לוקליזציה אנדוגנית של HSC, נדידה ואינטראקציות עם כלי הדם בתוך נישת BM. יתר על כן, מיקרוסקופיה תוך-חיונית הייתה חיונית בהבהרת המנגנונים העומדים בבסיס הפרעות המטופויאטיות, כגון לוקמיה ותסמונות כשל BM, והציעה תובנות חדשות לגבי תנועתיות תאים לוקמיים 6,7, השלכות כלי דם הקשורות למחלה8 ותגובה לתרופות9.
ישנם מספר יתרונות של הדמיית מיקרוסקופיה תוך-חיונית של אתרי העצם החלופיים לכסות BM קלוריאלי. ראשית, ה-BM הכלול בעצם הגולגולת מספק נגישות קלה להדמיה תוך-חיונית בהשוואה לעצמות עמוקות יותר כמו עצם הירך או השוקה. נגישות זו מאפשרת התבוננות ישירה במיקרו-סביבת הרקמה, כולל העצם עצמה, באמצעות הדמיה של דור הרמוני שני (SHG)10, ללא צורך בפרוצדורות כירורגיות פולשניות. שנית, הגולגולת דקה ושקופה יחסית, מה שמאפשר הדמיה טובה יותר של הדינמיקה התאית בתוך נישת ה-BM. שקיפות זו מאפשרת הדמיה ברזולוציה גבוהה עם מיקרוסקופיה דו-פוטונית, מיקרוסקופיה קונפוקלית ומיקרוסקופיה של גיליון אור, ללא צורך בטכניקות דילול או ניקוי עצם. העצם הגולגולתית מציעה פלטפורמה יציבה, שטוחה וקשיחה לניסויי הדמיה תוך-חיוניים, ממזערת חפצי תנועת רקמות ומבטיחה תנאי הדמיה עקביים לאורך תקופות תצפית ממושכות. יציבות זו מועילה במיוחד למחקרי אורך העוקבים אחר התנהגויות ותגובות תאיות לאורך זמן. יכולת שחזור היא יתרון גדול נוסף, בהתחשב במבנה הקטן יחסית והמוגדר מרחבית של עצם הגולגולת על פני חיות ניסוי. אחידות זו מאפשרת השוואה בין קבוצות ניסוי שונות ומאפשרת ניתוח סטטיסטי חזק של נתוני ההדמיה.
כאן אנו מתארים שיטה להדמיית ה-BM הגולגולתי של העכבר באמצעות מיקרוסקופיה דו-פוטונית תוך-חיונית על ידי הצגת שתל קיבוע ראש11 שפותח לאחרונה, מודפס בתלת מימד באמצעות סגסוגת טיטניום דרגה 23 תואמת ביולוגית (Ti6Al4V), הכוללת כיסוי קשיח ייעודי וממוקם בקלות העשוי מאותה סגסוגת טיטניום, המאפשר סגירה בטוחה של הפצע כדי למנוע זיהומים או נזק לאתר הניתוח. השתל מקבע את ראש העכבר בחוזקה וביציבות לשלב המיקרוסקופ באמצעות מחזיק שתל, ממזער את חפצי הנשימה ומאפשר הדמיה אורכית של אותם אזורים לאורך זמן. מובאות כמה דוגמאות לתמונות מרובות צבעים המתארות תאים ומבנים ממיקרו-סביבת BM (משטח עצם SHG+; תאים מזנכימליים של nestin-GFP+; תאי אנדותל cdh5-DSRED+, cdh5-GFP+ או pdgfb-GFP+) והתא ההמטופויאטי הממאיר (תאי tdTOMATO+ AML), כמו גם חומרי ניגוד פלואורסצנטיים המתארים את לומן כלי הדם (dextran-TRITC). פרמטרים וסקולריים הנמדדים לאורך שעות או ימים, כולל אורך כלי הדם, ישר וקוטר, כמו גם חדירות באזורי כלי דם שונים, יכולים לספק מידע חשוב על התנהגות ובריאות הרקמות.
Protocol
כל הניסויים בבעלי חיים בוצעו תחת ההסכם האתי APAFIS#27215-2020041513522374 v6, שאושר על ידי "Ministère de l'enseignement supérieur, de la recherche et de l'innovation".
1. תכנון שתל קיבוע ראש טיטניום תואם ביולוגית להדפסת תלת מימד
הערה: עיצבנו שתל קיבוע ראש תואם ביולוגית באמצעות תוכנת עיצוב בעזרת מחשב (CAD) למידול פרמטרי עם יכולות מובנות של ניתוח אלמנטים סופיים (FEA) (ראה טבלת החומרים). התשומות העיקריות לתהליך התכנון כוללות מודל אנטומי ברזולוציה גבוהה של גולגולת העכבר, מודל של מטרת המיקרוסקופ ומודל של מערכת הקיבוע, אשר יחד מודיעים על מידות השתל ותצורתו. הפלט הסופי הוא קובץ רשת שאינו תלוי בפלטפורמה, בדרך כלל בפורמט STL או STEP, התואם לרוב תוכנות ההדפסה בתלת-ממד. פורמט קובץ זה מבטיח העברה חלקה למדפסת התלת מימד לייצור שתלים מדויק.
- הכנת מודל התלת מימד של העכבר
- מקם את גולגולת העכבר, מוכנה או in vivo, בסורק המיקרו-CT.
- הגדר את פרמטרי הסריקה לרזולוציה אופטימלית של פרטים אנטומיים עדינים: פתח את לוח הבקרה ובמקטע תנאי סריקה , בחר שדה ראייה (FOV). השתמש ב-LiveView כדי להגדיר את נפח הסריקה.
הערה: באמצעות רזולוציית הגלאי ה-FOV יקבע את גודל הווקסל על סמך רזולוציית הגלאי. במכונות מיקרו-CT חדשות יותר, FOV של 5 מ"מ מתאים בדרך כלל לגודל ווקסל של 5 מיקרומטר, גודל ווקסל של 10 מ"מ עד 10 מיקרומטר, גודל ווקסל של 25 מ"מ עד 21 מיקרומטר. ה-FOV המוגבל ברזולוציה זו עשוי לדרוש סריקות מרובות כדי לכסות את כל הגולגולת. סריקות מרובות דורשות חפיפה בין סריקות. - חבר מספר סריקות ברזולוציה גבוהה יחד בתוכנת הדמיה כדי ליצור מודל יחיד ומקיף של הגולגולת.
- ייבא קובצי micro-CT DICOM לתוכנת פילוח (למשל, 3D Slicer, Amira, Avizo או Mimics) כדי לבודד את הגולגולת.
- בצע פילוח מבוסס סף כדי להפריד רקמת עצם מהמבנים הסובבים ולבצע התאמות ידניות כדי לחדד אזורים מורכבים או רועשים.
- בכלי פריסה תלת-ממדיים, ייבאו תחילה קובצי DICOM וטענו את ערכת הנתונים והתבוננו בפרוסות ה-CT בתצוגות הציריות, הסגיטליות והקורונליות .
- פתח את הקטע Editor, לחץ על הוסף כדי ליצור פילוח חדש | הוסף כדי ליצור פלח שוק חדש, שאמור להיות סף.
- בחלונית Segment Editor , לחץ על אפקט הסף . התאימו את המחוונים 'סף תחתון ' ו'עליון ' (או הקלידו ערכים מספריים) כך שהאזור שיש לפלח יודגש באדום בתצוגות הפרוסה. מקטע תלת מימד עם סף מוכן.
- כדי לייצא את הגולגולת המפולחת כקובץ STL, שנה למודול סגמנטציה. ודא שהמקטע הסף נבחר. במקטע ייצוא/ייבוא מודלים ומפות תוויות, הגדר את סוג הייצוא למודלים. ופורמט קובץ: STL. לחץ על הלחצן Export.
הערה: קובצי STL משתמשים בתבנית רשת משולשת, המייצגת את פני הגולגולת באלפי משולשים, ולוכדת את הצורה האנטומית בפירוט עדין.- במידת הצורך, בצע תפירה ב- MeshLab באופן הבא:
- ייבוא רשתות שינוי על ידי לחיצה על קובץ | ייבא רשת ובחר אחת כסריקת הפניה.
- יישור סריקות אחרות באמצעות הכלי Align (מסננים | הרשמה | Align) על ידי סימון נקודות מתאימות ושימוש בתהליך.
- מיזוג הסריקות המיושרות על ידי לחיצה על מסננים | שכבת רשת | שיטוח שכבות גלויות בעזרת האפשרות Merge Only Visible Layers .
- במידת הצורך, בצע תפירה ב- MeshLab באופן הבא:
- נקה ותקן את הרשת, תוך ביטול קודקודים ומשולשים משוכפלים כדלקמן, כדי להבטיח הסרת משולשים הנגרמים מרעש ומילוי חורים לא מכוונים, לקבלת משטח חלק ורציף:
- לחץ על מסננים | ניקוי ותיקון | הסר קודקודים משוכפלים.
- לחץ על מסננים | ניקוי ותיקון | הסר פרצופים משוכפלים.
- לחץ על מסננים | ניקוי ותיקון | הסר חלקים מבודדים (לפי מספר פנים). ציין סף למספר המינימלי של פרצופים לשמירה (לדוגמה, הגדר סף נמוך כדי להסיר אשכולות קטנים או רעש).
- לחץ על מסננים | רימוינג, פישוט ובנייה מחדש | סגור חורים.
- בצע פישוט רשת ל~10,000-30,000 משולשים מכיוון שקבצי STL ראשוניים ממיקרו-CT מכילים ספירות משולשים גבוהות מאוד שאינן תואמות לתוכנת ה-CAD. באזורים עם פירוט גבוה, שמרו על משולשים קטנים יותר בחלק העליון של הגולגולת כדי להבטיח התאמה מדויקת של השתל. באזורים גסים יותר, פשטו אזורים פחות קריטיים בעזרת משולשים גדולים יותר כדי להקטין את גודל הקובץ ולמטב את יעילות העיבוד.
הערה: פישוט הרשת נעשה לפי אזורים ומפורט ב-1.1.8.1-1.1.8.3.- השתמש באפשרות Select Connected Components בכלי בחירת אזור כדי לבחור אזורים לפישוט.
- השתמש ב-Quadratic Edge Collapse Decimation באזורים שנבחרו עם פרמטרים. לחץ על מסננים | רישום, פישוט ובנייה מחדש | פישוט: השמדת קריסת הקצה המרובע. הגדר את סף האיכות ל-0.8, שמור על גבול הרשת ל-YES, שמור על טופולוגיה ל-YES, יעד מספר פנים: הגדר מספר יעד המתאים לרזולוציה הדרושה.
- חזור על הפעולה לפי הצורך עד שהמספר הכולל של המשולשים יצטמצם לרמה הרצויה. לאחר מכן, שמור את המודל הפשוט בקובץ STL.
- הכנת מודל הגולגולת במודל CAD
- ייבא את דגם הגולגולת הפשוט בפורמט STL לתוכנת ה-CAD כחלק או דגם חדש. ודא שהקובץ המיובא מומר כראוי לגוף מוצק או משטח במידת הצורך, בהתאם ליכולות התוכנה. שמור את המודל בפורמט קובץ ה-CAD המקורי כדי לאפשר שינויים נוספים ולהבטיח תאימות לשלבי העיצוב הבאים.
- מקם נקודות ייחוס על ברגמה ולמבדה וצור את ציר ברגמה-למבדה בדגם זה.
- צור את המישור החציוני כולל ציר ברגמה-למבדה.
- במישור החציוני, צרו ציר משיק לקלבריה, ואז שמרו את הגולגולת המוכנה (איור משלים S1).
- צור מכלול חדש והכנס את הגולגולת המוכנה באופן שברגמה עולה בקנה אחד עם המקור, המישור החציוני עם המישור הימני, וציר הגולגולת אופקי.
- שתל קיבוע הראש יתוכנן ישירות בתוך המכלול כדי להבטיח התאמה מושלמת לדגם הגולגולת המוכן. כדי להשיג זאת, צור את השתל כחלק חדש בתוך המכלול. התחל בניווט אל הוספה | רכיב | חלק חדש בתוכנת ה-CAD. כאשר תתבקש, בחר את משטח הקלווריה או את המישור העליון של המכלול כהפניה למיקום ועיגון החלק החדש.
- צרו קבוצה של מישורים במרווחים שווים (מרווח של 2 מ"מ) על פני הגולגולת. בכל מישור, צור סקיצה, ובכל סקיצה, צייר עקומה מוקרנת אופסט של 0.2 מ"מ בצורת קו סימטרי עם תשע נקודות, העוקב אחר החלק של המשטח העליון של הגולגולת 0.2 מ"מ מעל הגולגולת (איור משלים S2).
- צור משטח נסחף באמצעות קווים אלה - משטח גבול הגולגולת - הבטחת משטח זה חלק ללא כל פגם, שישמש לבניית תכונות השתל.
- הגדרת המשטח הנצפה על הגולגולת
הערה: בהתבסס על המודל התלת מימדי, מזוהה האזור השטוח ביותר של עצם הקלווריה האידיאלי לתצפית תלת מימדית. אזור זה נבחר בקפידה כדי להבטיח גישה אופטימלית למטרת המיקרוסקופ הדו-פוטוני תוך התחשבות בשלמות הביולוגית והמבנית של הגולגולת. ההגדרה עשויה להשתמש בקואורדינטות סטריאוטקסיות כאשר נקודת ברגמה משמשת כמקור של מערכת הקואורדינטות.- צור סקיצה במישור הגולגולת וצור קו בצורת אגס מ-AP +6.5 עד -2, רוחב 6 מ"מ ב-AP 0.0. זה יהיה קווי המתאר של פני השטח הניתנים לצפייה (איור משלים S3).
הערה: מטרת המיקרוסקופ ממוקמת למעשה ביחס למשטח הנצפה שהוגדר קודם לכן על הגולגולת. שלב זה כולל קביעת האילוצים המרחביים המוטלים על ידי גודל וצורת המטרה, תוך הבטחה שעיצוב השתל מתאים לדרישות המיקרוסקופ. - הכנס את מודל האובייקטיביות של המיקרוסקופ למכלול בצורה אנכית. הגבל את נקודת המיקוד שלו במישור המקביל למישור הגולגולתי יון עצם הגולגולת והגדר את הנפח התוחם של מטרת המיקרוסקופ.
- צור נפח על ידי טאטוא המטרה בעקבות קווי המתאר של פני השטח הניתנים לצפייה.
- צור חלון תצפית סביב המשטח הנצפה המוגדר, המבטיח גישה ללא הפרעה למטרת המיקרוסקופ.
הערה: חלון התצפית הוא מבנה דמוי טבעת בעל פונקציות משניות כגון אגירת נוזלים טבילה ומבנה מוצק לסגירה נכונה של כיסוי המגן. - צור סקיצה במישור הגולגולתי והעתק את קווי המתאר של פני השטח הנצפים.
- צור קו מתאר מקביל בעובי 0.5 מ"מ. הוצא את קווי המתאר הכפולים כלפי מעלה 0.9 מ"מ וכלפי מטה אל פני השטח משטח גבול הגולגולת עם זווית טיוטה של 4°.
- צור סקיצה במישור הגולגולת וצור קו בצורת אגס מ-AP +6.5 עד -2, רוחב 6 מ"מ ב-AP 0.0. זה יהיה קווי המתאר של פני השטח הניתנים לצפייה (איור משלים S3).
- הגדרת מבני המלט, הזנב וזנב היונים.
- צור סקיצה במישור הגולגולתי וצייר צורת C בעובי 0.5 מ"מ המתחברת לחלון התצפית והוצא בגובה 2 מ"מ וכלפי מטה אל פני השטח של משטח גבול הגולגולת עם זווית טיוטה של 4° (איור משלים S4).
- צור סקיצה במישור הגולגולתי ומלא את החלל הזה במלבנים בעובי 0.4 מ"מ הממוקמים באופן רדיאלי עם רווח של 1 מ"מ ביניהם.
- הוצאה בדומה לחלון התצפית.
- צור את זנב השתל בהסתמך על הגולגולת עד לקיבוע על ידי כיבוד הנפח הזמין.
- צור מישור רוחבי משיק למבנה המלט ועוד 12.5 מ"מ אחורה.
- שרטט מלבנים במישורים אלה. סובב גוף פירמידלי ביניהם, תוך הגדרת הזוויות כ-20° ו-37° מהאופק.
- הוסף חור M1.6 מושחל לזנב ליד מבנה המלט.
- צור סקיצה בקצה הזנב וצייר את פרופיל זנב היונה.
- הוצא פרופיל זה ב -8 מ"מ.
- אימות אי הפרעה למטרה.
- בחן את כל עיצוב השתל, כולל חלון התצפית וזנב היונה, כדי לוודא שאין הפרעה מכנית למטרת המיקרוסקופ. בדוק אם יש הפרעות לאמצעי האחסון שנוצר בשלב 1.3.3.
הערה: שלב אימות זה הוא קריטי כדי להבטיח שניתן יהיה למקם ולהזיז את המטרה כנדרש ללא הפרעה.
- בחן את כל עיצוב השתל, כולל חלון התצפית וזנב היונה, כדי לוודא שאין הפרעה מכנית למטרת המיקרוסקופ. בדוק אם יש הפרעות לאמצעי האחסון שנוצר בשלב 1.3.3.
- הסר חומר מיותר מזנב השתל כדי למזער משקל ולהפחית אי נוחות פוטנציאלית לבעל החיים.
- צרו שרטוט במישור החציוני וציירו עליו חיתוכים משולשים ליצירת מבנה מסבך בעת חילוץ באמצעות שחול מגוף הזנב.
- חזור על הפעולה במישור הניצב.
- אמת תזוזה מקסימלית על ידי סימולציה של שיטת האלמנטים הסופיים (FEM) כדי לנתח את התכונות המכניות של השתל בתנאים שונים.
הערה: סימולציה זו מסייעת בחיזוי התזוזה והלחצים המקסימליים בתוך השתל במהלך השימוש, ומבטיחה את אמינותו.- הפוך את התוספת הדמיית תוכנת CAD לזמינה.
- בסרגל הכלים סימולציה, צור מחקר סטטי חדש. נווט אל הכרטיסייה הדמיה (אם גלויה) או עבור אל הדמיה | ללמוד. בתיבת הדו-שיח לימוד, בחר סטטי כסוג המחקר. לחץ על אישור כדי ליצור את המחקר החדש (איור משלים S5).
הערה: סוג מחקר זה מתאים לניתוח דפורמציה ומתח תחת עומסים סטטיים, כצפוי בשימוש בשתל. - בחר חומר לשתל התואם את הרכב השתל בפועל (Ti6Al4V).
- הגדר אילוצים קבועים כדי לדמות את נקודות החיבור של השתל שבהן הוא ייגע בקיבוע זנב היונה. הגדר את המשטח העליון של זנב היונה כקבוע.
- הגדר את העומס האנכי על המשטח התחתון של השתל. הגדר כוח אנכי של 1 N.
- צור רשת. צמצם את הרשת באזורים שבהם צפוי מתח גבוה או עיוות (איור משלים S6). לשם כך, לחץ לחיצה ימנית על אלמנט הרשת של עץ הלימוד ובחר צור רשת... בתיבת הדו-שיח 'רשת שינוי ', התאימו את 'צפיפות רשת שינוי ' בעזרת המחוון או באמצעות הפעלת התיבה 'בקרת רשת שינוי ' לקביעת גודל הרכיבים המרבי והמינימלי בנפרד. לחץ על OK כדי ליצור את רשת השינוי.
הערה: התוכנה יוצרת באופן אוטומטי רשת ראשונית למחקר, אך לקבלת תוצאות מדויקות יותר, ניתן לחדד את הרשת כדי לבחור רשת עדינה יותר, במיוחד באזורים קריטיים ליציבות השתל (כגון חלון התצפית). רשת עדינה יותר באזורים אלה משפרת את דיוק הסימולציה על ידי לכידת ריכוזי מתח מקומיים. - התחל את הניתוח הסטטי כדי לחשב את התפלגות התזוזה, המתח והמתח על פני השתל.
- נתח את התוצאות. בחן את חלקת התזוזה כדי לזהות אזורים של עיוות מקסימלי. תרשים זה מראה עד כמה השתל יתעוות תחת העומסים המופעלים, ומדגיש את כל האזורים הנמצאים בסיכון לתנועה מוגזמת. ודא שהעיוות בתוך חלון התצפית אינו עולה על 3 מיקרון.
- לבסוף, תכנן כיסוי מגן להגנה על חלון התצפית, כאשר אינו בשימוש. מכסה זה מגן על העצם החשופה מפני מזהמים סביבתיים ונזקים פיזיים.
2. טיפולי עכבר, הרדמה והשתלה כירורגית של שתל הראש
הערה: כאן, ניתן להשתמש בעכברים זכרים או נקבות, C57BL/6 בני 7 עד 12 שבועות או עכברים מהונדסים, כפי שמתואר. כדי לגרום להתיישבות לוקמיה של ה-BM, תאים לוקמיים שנוצרו, כפי שתוארו על ידי הורטון ואחרים.12, ניתנים תוך ורידי 2-3 שבועות לפני ההדמיה. כדי להבטיח את בריאות הפצע, יש להשתמש בטכניקות סטריליות.
- מתחת למכסה המנוע, הרכיבו כלי ניתוח סטריליים (מספריים ופינצטה קהים), גוזם והחומרים המתכלים, כולל ג'ל עיניים, מי מלח, חומר חיטוי, מלט דנטלי, ספוגיות סופגות ורקמות ניקוי. הפעל את מעקר החרוזים.
- מלאו את תא האינדוקציה של ההרדמה ב-4% איזופלורן וחמצן אטמוספרי והניחו את העכבר בתא. כאשר בעל החיים מורדם לחלוטין (בדוק אם יש אובדן רפלקס יישור ודפוס נשימה עמוק ואיטי יותר), העבר את זרימת האיזופלורן לחרוט האף של מסכת ההרדמה והורד את ריכוז האיזופלורן ל-2%.
- הנח את העכבר על כרית חימום של 37 מעלות צלזיוס ונטר חזותית את קצב הנשימה. אופציונלי: לעכברים עם פנוטיפ פתולוגי, הוסף שמיכת הישרדות כדי לשמור על הטמפרטורה הנכונה לאורך כל ההרדמה.
- מתן תרופות נגד כאבים תת עורית (Buprecare, 0.01 מ"ג/ק"ג) 30 דקות לפני הניתוח.
- לגלח את ראש העכבר בעזרת סכין גילוח חשמלי.
- הוסיפו טיפה של ג'ל עיניים על עיני העכבר כדי למנוע יובש בזמן ההרדמה, וודאו שהג'ל לא יטפטף על הקרקפת.
- נקה את העכבר כדי להסיר שאריות שערות מאזור הניתוח. ספוג את החלק העליון של הקרקפת עם חומר חיטוי על רקמת כותנה. הקפד להסיר את כל השיער כדי למנוע חפצי הדמיה כמו גם סיכון לזיהום בפצע.
- בעזרת מלקחיים ומספריים סטריליים (לאחר 30 שניות בסטריליזטור), בצע חתך קטן בחלק המרכזי של הקרקפת כדי לחשוף את צלקת העצם המרכזית. עקוב אחריו כדי להגדיר את אזור ההדמיה הנכון באורך וברוחב. הסר בזהירות את חתיכת הקרקפת, הרם את העור בין האוזניים בעזרת מלקחיים ובצע חתך קטן בחלק האחורי של הראש. החזיקו את העור למעלה, העבירו את המספריים מתחת לעור וחתכו בזהירות מחוץ לאזור ההדמיה.
- הסר את רקמת החיבור בין הגולגולת לקרקפת. נגב את העצם החשופה עם PBS סטרילי על צמר גפן. המשך במהירות לחיבור שתל הראש לגולגולת העכבר כדי למנוע חשיפה ממושכת של עצם הגולגולת (<10 דקות).
- הכינו משחה עם מספיק מלט דנטלי בצלחת פטרי בהתאם להוראות היצרן ומרחו אותה במהירות על החלק התחתון של שתל קיבוע הראש.
- מבלי להכניס מלט דנטלי לאזור ההדמיה, הנח את מחזיק הראש על הגולגולת החשופה של העכבר, ולאחר מכן המתן להתייצבות.
- לאחר ההגדרה (בדרך כלל תוך 3-5 דקות), הוסף כמה טיפות של 37 מעלות צלזיוס PBS בתא ההדמיה כדי לשמור על לחות הגולגולת.
3. הדמיה באמצעות מיקרוסקופ דו-פוטוני
- לפני תחילת הניתוח, הפעל את הלייזר ואפשר לו להתחמם כדי להתייצב. הפעל את המיקרוסקופ והפעל את תוכנת הרכישה. בחר את המטרה המתאימה (טבילה של 25x/0.95 WATER לניסוי זה).
- השתמש במעמד מיקרוסקופ זקוף בשלב קבוע שיש לו מספיק מקום למקם לוח אב-טיפוס וטרינרי עם כרית חום, הכל כדי להזיז באופן אינטגרלי עם שלב ה-xy. השתמש בלוח לחם אופטי מאלומיניום מוצק כפלטפורמה להידוק שתל הראש והמסכה הסטריאוטקסית. קשר צינורות גמישים והמחברים שלהם הקשורים להזרקה ומיצוי איזופלורן למסכה בכלוב המיקרוסקופ.
- הגדר את הגדרות הרכישה לסריקה מהירה: פורמט 512 x 512 פיקסלים; מהירות 600 הרץ; וגורם זום 1.
- כוונן את קו הלייזר ב-880 ננומטר כדי להיות מסוגל לזהות את ה-SHG, GFP ו-tdTOMATO עם אותו אורך גל עירור.
- כבה את האור בחדר וסגור את הקופסה סביב מעמד המיקרוסקופ כראוי לפני הפעלת גלאי ה-NDD והגדר את שערי הזיהוי הספקטרליים: PMT1, לזיהוי SHG [388 - 431 ננומטר]; HyD2, עבור GFP [485 - 548 ננומטר] ו - HyD3 עבור tdTOMATO [551 - 645 ננומטר]. השאר את ההיסט על 0.
- צור מערך נתונים חדש של פרויקט ושנה את שמו בהתאם לניסוי הספציפי.
- לאחר ששתל קיבוע הראש מחובר לגולגולת העכבר (אושר באמצעות התקשות המלט), הפעל את האיזופלורן לכיוון המסכה הסטריאוטקסית של המיקרוסקופ.
- הביאו את העכבר במהירות למיקרוסקופ. הכנס בזהירות את שיני העכבר למסכה כדי לאפשר חדירת איזופלורן דרך אף העכבר על ידי הרמת אפו ביד אחת.
- תוך כדי החזקת העכבר ביד אחת, החלק בעדינות את זנב היונה של שתל קיבוע הראש לתוך מחזיק הקיבוע ביד השנייה ואבטח אותו בחצי סיבוב של כפתור הבורג.
- הכניסו בדיקה רקטלית משובצת מראש בג'ל על בסיס מים לניטור טמפרטורה והוסיפו טיפות עיניים לעיני העכבר.
- מלאו את תא ההדמיה הראשי בכמות גדולה של ג'ל על בסיס מים או PBS והנמיכו את מטרת הטבילה במים כדי לטבול אותו לחלוטין כדי להשיג עירור וזיהוי אופטימליים של האותות הנוצרים על ידי עירור דו-פוטוני.
- הזז את שלב ה-x-y ואת כונן ה-z כדי להתמקד בעצם המרכזית לתוך צלקת הפיגום.
הערה: נוח להשתמש בעיניות המיקרוסקופ ובמנורה מסוג מתכת הליד כמקור אור, המסוננת על ידי מסנן פליטת עירור תלת-פס. היעדר חתך אופטי אינו מאפשר להשיג תמונה ברורה; אבל עם תרגול, ניתן לזהות בקלות את האזור המרכזי של הגולגולת. - לאחר זיהוי הרקמה, המסומנת על ידי משטח עצם ווריד מרכזי, כבה את מנורת הליד המתכת וסגור את חלונות כלוב המיקרוסקופ כדי להגן על גלאי ה-HyD ולאפשר ללייזר האינפרא אדום (IR) לעבור.
- הגדר את רווח ה-PMT/SHG ל-850 וולט (טווח הפעולה הליניארי שלו) והגדר את רווחי ה-HyD ב-100%. הגדל את עוצמת לייזר ה-IR עד לקבלת תמונה עם טווח דינמי של 200 רמות אפור (עם גלאי 8 סיביות דינמיים) בנמוך מבין שלושת הערוצים. צמצם את הרווחים של הגלאים האחרים אם הבדלי הפליטה חשובים מדי או אם יש רוויה על ידי שימוש במצב טבלת חיפוש "מתחת לתחתית (LUT).
הערה: במקרה שלנו, עוצמת לייזר של 30% הספיקה כדי להשיג ניגודיות בכל הערוצים. - בתוכנת הרכישה, חפש אזור העשוי מכיסי BM (GFP+, tdTOMATO+) עטופים בתוך משטחי העצם (SHG).
- כדי למצוא החזר השקעה שונה, הפעל את LAS NAVIGATOR וצור סקירה כללית של האזור כולו באמצעות מצב ספירלה. עצור את הרכישה כאשר המשטח הנרכש גדול מספיק. שמור את הסקירה הכללית, מזג אותה ושנה את שמה: זו תהיה תמונת ההתייחסות במקרה של הדמיה אורכית.
הערה: היזהר לא ליצור ספירלה גדולה מדי מכיוון שהדבר עלול לגרום למחזיק המכשיר לבוא במגע עם המטרה. - רשום כמה מיקומי החזר ROI על ידי לחיצה על סמל התמונה הבודדת ושנה את שם כל מיקום ברשימת המשימות. צלם לכידת מסך כדי להציג את המיקום היחסי של החזר ההשקעה השונים על גבי הסקירה הכללית שנשמרה קודם לכן.
הערה: לכידת מסך זו תהיה חיונית להחלפת החזר ה-ROI בהדמיה אורכית, מכיוון שתוכנת הרכישה אינה מאפשרת לזכור קבוצת מיקומים זו בגרסה המשמשת לניסוי זה. - לרכישת נפח z-stack, בחרו במצב z-stack, הגדירו את גודל הצעד ב- 3 מיקרומטר ובטלו את הבחירה באפשרות 'אותו גודל מחסנית לכל האזורים '. בחרו את המיקום הראשון, הגדירו את המיקום העליון והתחתון , בדקו את גודל צעד ה-z, ולחצו על הגדרת מחסנית מחדש. סמל קוביה מופיע ליד שם המיקום ברשימת המיקומים. חזור על שלב זה עבור כל המיקומים של החזר ההשקעה השונים.
- לחץ על רכוש ושמור את התמונות (ערימות z של שלושה ערוצים עם תוכניות ~50) בתיקייה המתאימה. שלב זה מסמן את ה-Tctrl של הניסוי; בדוק שפרמטרי הרכישה נכונים (השג טווח דינמי נכון בשלושת הערוצים, הימנע ככל האפשר מרוויית האות ובדוק את זמן הרכישה למחזור שלם).
- כדי למדוד תכונה דינמית (חדירות כלי דם במקרה זה), רכוש זמן-lapse.
- במערך זה, שלושת הגלאים מאפשרים הדמיה בו זמנית של שלושה ערוצים; אם נדרש ערוץ רביעי לניסוי (ניטור Dextran במקרה זה), הפעל מצב רציף והוסף רצף רכישה שני. כוונן את קו הלייזר IR ב-820 ננומטר כדי להיות מסוגל לרגש את הפלואורופור Dextran Cy5. שנה את טווח הזיהוי של Hyd2 ל-[650 - 744 ננומטר] והשבת את הגלאים האחרים. בחירה בין מצב רכישת ערימות .
הערה: כברירת מחדל, לרצף הרכישה השני יש את אותם פרמטרים כמו ברצף 1. - לפני שתתחיל את ה-Timelapse, הפעל את רכישת כל העמדות כדי להבטיח שזמן ההקלטה לא יעלה על 3 דקות (תוך התחשבות בתוספת המצב הרציף), הזמן המינימלי הנדרש לאיתור דליפת הדקסטרן.
- לפני הזרקת הדקסטרן, שנה את מצב הרכישה ל-xyzt. במודול t, התאם את מרווח הזמן ל-3 דקות ואת משך הזמן לשעה.
- במערך זה, שלושת הגלאים מאפשרים הדמיה בו זמנית של שלושה ערוצים; אם נדרש ערוץ רביעי לניסוי (ניטור Dextran במקרה זה), הפעל מצב רציף והוסף רצף רכישה שני. כוונן את קו הלייזר IR ב-820 ננומטר כדי להיות מסוגל לרגש את הפלואורופור Dextran Cy5. שנה את טווח הזיהוי של Hyd2 ל-[650 - 744 ננומטר] והשבת את הגלאים האחרים. בחירה בין מצב רכישת ערימות .
- יש להזריק 100 מיקרוליטר של Dextran 70 KDa-TRITC (או 500 KDa-Cy5) ב-3 מ"ג/עכבר תוך ורידי ולהתחיל ברכישה.
- לאחר הרכישה, שמור את מערך הנתונים בתיקייה המתאימה.
הערה: במהלך השלבים הרבים הללו, עקוב אחר תדירות הנשימה והטמפרטורה של העכבר לעתים קרובות והתאם את זרימת האיזופלורן במידת הצורך. באופן אידיאלי, ניתן לרשום טמפרטורה, א.ק.ג וקצב נשימה ולכלול אותם כמטא-נתונים של הניסוי.
4. שחזור עכבר
- לאחר השלמת הפעלת ההדמיה, השבת את גלאי HyDs בתוכנת הרכישה והפעל את תיבת חימום העכבר (37 מעלות צלזיוס). פתח את כלוב המיקרוסקופ, הרם את המטרה והסר את הגשושית הרקטלית מהעכבר. לאחר מכן, החלק בעדינות את זנב היונה של שתל קיבוע הראש ממחזיק הקיבוע והעביר את העכבר מהמסכה הסטריאוטקסית של המיקרוסקופ למסכת הניתוח על כרית החום.
- כבה את הזרקת האיזופלורן מתחת למיקרוסקופ וכבה את כרית החום.
- הסר בעדינות את הג'ל על בסיס מים או PBS מגולגולת העכבר בעזרת ספוגית סטרילית.
- הוסף ג'ל תוך-אתר כדי לשמור על לחות הגולגולת בין מפגשי הדמיה, כפי שתואר קודםלכן 13.
- סגור את אזור ההדמיה של שתל הראש עם המכסה הספציפי ואבטח אותו בזהירות עם הבורג.
- הכניסו את העכבר לקופסת החימום בטמפרטורה של 37 מעלות צלזיוס והמתינו עד שיתעורר. הביאו את העכבר למתקן בעלי החיים ואכלסו אותו בכלוב נקי עם הידרוג'ל והעשרה. עקוב אחר בעלי החיים מדי יום כדי לזהות סימני כאב או זיהום, ובמקרה זה נהל את Buprecare מדי יום. כדי לשמור על לחות הקלורית, החלף את הג'ל התוך-אתר פעמיים בשבוע.
הערה: בחר כלוב גבוה עם מקלטי קרטון וחומר קינון והקפד להכניס עכברים לכלובים בודדים.
5. רכישות אורכיות
הערה: ניתן לצלם את העכבר שוב במהלך הימים הבאים. עם זאת, הקפד לא לחזור על יותר משלושה מפגשי הדמיה בשבוע כדי למנוע תופעות לא רצויות של הרדמה חוזרת, כגון יובש בעיניים או עייפות יתר, כמו גם מצוקה נשימתית והיפותרמיה.
- כדי לצלם מחדש עכבר עם מחזיק ראש שכבר מותקן, בצע את שלב 2.2 והניח טיפה קטנה של ג'ל עיניים על עיני העכבר כדי למנוע יובש במהלך ההליך.
- עקוב אחר סעיף 3 עד שלב 3.16 כדי לקבל את תמונת הסקירה הכללית.
הערה: שימוש בשתל טיטניום ראש ללא צורך לשנות את הגובה או הזווית של מיקום המחזיק מקל מאוד על מציאת אזור העניין הכללי. - במידת הצורך, יישר מחדש את התמונות הקודמות והחדשות באמצעות מודול התמונה הפתוחה והיישור.
- פתח את תמונת לכידת המסך משלב 3.17 כדי לסמן מיקומים במקומם המקורי.
הערה: שימוש בניגודיות SHG שימושי מאוד במיוחד כאשר מצפים לעיצוב מחדש של כלי הדם והתאים הקשורים המבטאים GFP. - רכוש ערימות z ו-Timelapses באותו אופן המתואר בשלבים 3.18-3.22.
6. כימות פרמטרים וסקולריים
- פרמטרים וסקולריים
- כדי לפתוח את התמונות שנוצרו באמצעות התוכנה (קבצי .lif) ב-IMARIS, תחילה המר אותן לפורמט ".ims" באמצעות ממיר הקבצים. פתח את קובץ ".ims" עם IMARIS, בדוק את המטא נתונים (סולמות X, Y, Z) ובחר את מודול הנימה . בחר דלג על יצירה אוטומטית, ערוך ידנית.
- לקבלת תצוגה חזותית טובה יותר במהלך יצירת חוטים, נווט אל הגדרות (סמל עלה), בחר קו בסגנון, והשאר את מספר הפיקסלים בערך ברירת המחדל (1). סמן את התיבות הצג דנדריטים, כולל נקודת התחלה, נקודות הסתעפות ונקודות מסוף. בטל סימון הצג עמוד שדרה.
- תחת 'ציור' (סמל מברשת), בחרו 'שיטה נתיב אוטומטי'; קוטר של 5 מיקרומטר, ומקור הערוץ המשויך לכלי השיט (TRITC-Dextran במקרה זה). לבסוף, סמן מרכז אוטומטי וקוטר אוטומטיr.
- התחל לצייר את החוטים באמצעות Shift + לחיצה ימנית על העכבר כדי לבחור נקודת התחלה של ענף ו-shift + לחיצה שמאלית כדי לבחור נקודת סיום של ענף.
הערה: נקודת ההתחלה היא בכחול בהיר, נקודות הסתעפות באדום או כחול כהה, ונקודות המסוף בירוק. - כדי להגדיר את הקוטר הנכון של החוט בזמן הציור, השתמש בלחצן הגלילה של העכבר.
- כדי לחבר שני חוטים עם נקודות קצה נפרדות, צור נקודת התחלה חדשה ביניהם וחבר אותה בכל נקודת קצה.
הערה: לפיכך, נקודות קצה ירוקות מופיעות בנקודות הסתעפות. - לאחר יצירת עץ כלי הדם, חזור להגדרות וודא שמספרי נקודות ההתחלה, ההסתעפות והקצה נכונים. בחרו חרוט כדי להמחיש את הקטרים ולאמת את המראה שלהם.
- אם קוטר נימה (או חיבור) נראה שגוי, נווט אל עריכה (סמל עיפרון), בחר את החוט להסרה בלחיצה ימנית ולחץ על מחק. צייר מחדש את החוט על ידי התאמת הקוטר על החוט באמצעות לחצן הגלילה של העכבר.
- כדי לחלץ את כל הנתונים הסטטיסטיים שנוצרו ולשמור אותם, לחץ על סמל הסטטיסטיקה | ייצוא כל הנתונים הסטטיסטיים לקובץ-(סמל תקליטונים מרובים בתחתית המסך).
הערה: כדי למנוע חוטים חריגים שעלולים להיות חריגים שאינם תואמים לכלי שיט, נכללו בניתוח הסטטיסטי רק חוטים ארוכים מ-20 מיקרומטר.
- כימות כיפות
הערה: כדי לפתוח את התמונות שנוצרו באמצעות התוכנה (קובץ .lif) ב-IMARIS, המר אותן תחילה לתבנית ".ims" באמצעות ממיר הקבצים.- כדי למזג תמונות שצולמו לפני ואחרי הזרקת דקסטרן באותה סדרת זמן, עבור למצב עודף, לחץ גם על התמונה הראשונה (Tctrl , לפני הזרקת דקסטרן) וגם על תמונת ה-Timelapse (זמן 1, 60 דקות) כדי לפתוח אותן, ושלב אותן על ידי לחיצה על ערוך והוסף נקודות זמן.
הערה: כדי לתקן סחיפה תלת-ממדית בסופו של דבר, בצע את שלבים 6.2.2-6.2.7 באמצעות פונקציית הגשר בין פיג'י ל-IMARIS. התקן את התוספים הבאים בפיג'י: "IMARIS_Bridge96.jar" ו- "IMARISBridgeUtils.jar". רישום הסחיפה התלת-ממדית מתבצע באמצעות "StackReg Pluging" (כבר זמין בפיג'י). אם אין צורך בכך, עבור לשלב 6.2.8 - כדי לבצע תיקון סחיפה תלת מימדית, פתח את פיג'י כדי לגשר על תמונות מ-IMARIS על ידי לחיצה על תוספים | מניית אימאריס | תמונה מתוך IMARIS.
- בפיג'י, בחר Plugins | הרשמה | סחיפה תלת מימדית נכונה.
- בחלונות החדשים שמופיעים, בחר את הערוץ המתאים לרישום.
הערה: זה היה Nestin-GFP במקרה זה, אבל זה יכול להיות כל ערוץ המדגיש אובייקטים נייחים ויחס אות לרקע גבוה. - כדי לשפר את הזיהוי של סחיפות קטנות, בחר Multi Time Scale Computation, Sub pixel drift correction ו-Edge enhance images, והשאר את ההגדרות האחרות כברירת מחדל.
- כדי לגשר בין התמונה המתוקנת ל-IMARIS, בחר אותה ולחץ על תוספים | מניית אימאריס | תמונה ל-IMARIS.
- שמור אותו בתיקיה המתאימה על-ידי לחיצה על קובץ | שמירה בשם.
- כדי להמחיש את כל הערוצים שנרכשו, לחץ על ערוך | הצג התאמת תצוגה. בחר את ערוץ הדקסטרן וזמן 1 (מסגרת 2 בתחתית המסך).
- צור משטח חדש המגדיר את לומן כלי הדם בנקודת זמן 1 על-ידי סימון תיבת הסימון הוסף משטח חדש (אובייקט כחול)
- ב-Surface 1, עבור אל מאפיינים ובטל את הסימון של כל הפרמטרים בהגדרות אלגוריתם. לחץ על השלב הבא (חץ כחול)
- בחר את ערוץ כלי הדם (dextn במקרה זה) תחת ערוץ המקור וסמן את Smooth and background subtraction. השאר את כל הפרמטרים האחרים בערכי ברירת מחדל. לחץ על השלב הבא (חץ כחול).
- התאימו את ערך הסף בהתאם למראה פני השטח מבחינת העובי והכיסוי של כל האזורים החיוביים. לחץ על השלב הבא (חץ כחול).
- אל תכלול משטחים לא ספציפיים (בעיקר נקודות קטנות) באמצעות המסנן כברירת מחדל מספר Voxels. לחץ על השלב האחרון (חץ ירוק).
- במידת הצורך, המשך לכוונן את המשטח באופן ידני על ידי לחיצה על עריכה (סמל עיפרון) בהגדרת פרמטרים. כדי לבחור אובייקט להסרה, לחץ עליו לחיצה ימנית ומחק על ידי בחירה באפשרות מחק. אם האובייקט למחיקה נאסף לאובייקט אחר, נתק את שני החלקים המופרדים של המשטח על-ידי לחיצה על shift + לחיצה שמאלה בין השניים ובחירה באפשרות גזור משטח. חזור על שלב זה כמה פעמים שצריך.
- לבסוף, שלב את כל הקטעים באמצעות מצב בחירה (סמל יעד מימין) ולחץ על control + גלילה כדי לשחזר את כל האובייקטים. כאשר כולם נבחרים, לחץ לחיצה ימנית ולחץ על אחד.
- כדי ליצור את משטח הייחוס, העתק משטח זה לנקודות הזמן האחרות. בחר את המשטח הגלובלי ושכפל אותו על-ידי לחיצה על שכפל ושנה את שמו ל-Intravascular.
- בחר את המשטח תוך-וסקולרי ולחץ על שכפל לכל נקודות הזמן.
- פצל את אות הדקסטרן כדי להבחין בין אזורים תוך-וסקולריים (IN) וחוץ-וסקולריים (OUT). כדי ליצור IN channeI לכל נקודות הזמן, לחץ על המשטח Intravascular | עריכה (לחצן עיפרון) | מסכה הכל.
- ב'בחירת ערוץ', בחרו בערוץ המתאים וסמנו ערוץ כפול לפני החלת המסיכה. ב-Mask Settings, סמן רק את Constant Inside/Outdoor עם הגדרת ווקסלים מחוץ למשטח ל-0. לבסוף, סמן גם החל על כל נקודות הזמן.
- ב'התאמת תצוגה', ערוץ חדש נוצר כברירת מחדל עם שם מוסתר. שנה את שמו IN.
- כדי ליצור ערוץ OUT עבור כל נקודות הזמן, חזור על שלבים 6.2.18-6.2.20, אך בחר הגדר ווקסלים בתוך המשטח ל- 0. שנה את שם הערוץ החדש הזה OUT.
- כדי לחלץ נתונים סטטיסטיים, לחץ על סמל הסטטיסטיקה | ייצוא כל הנתונים הסטטיסטיים לקובץ (סמל תקליטונים מרובים בתחתית המסך)
- כדי לנתח דליפות, חלקו את ערוץ סכום העוצמה בחוץ בערוץ סכום העוצמה בפנים עבור כל נקודת זמן.
- כדי למזג תמונות שצולמו לפני ואחרי הזרקת דקסטרן באותה סדרת זמן, עבור למצב עודף, לחץ גם על התמונה הראשונה (Tctrl , לפני הזרקת דקסטרן) וגם על תמונת ה-Timelapse (זמן 1, 60 דקות) כדי לפתוח אותן, ושלב אותן על ידי לחיצה על ערוך והוסף נקודות זמן.
תוצאות
באיור 1 ובאיור 2, מודל ה-CAD מוצג של שתל קיבוע ראש טיטניום הממוקם על גולגולת עכבר סרוקה, אשר נועד לעקוב אחר המבנה האנטומי של הגולגולת ולספק מכשיר קל משקל ותואם ביולוגית המסוגל להחזיק בחוזקה את שלב המיקרוסקופ ולהבטיח יציבות ברמת התא. על ידי ביצוע פרוטוקול שלב אחר שלב זה, השתל מחובר ביציבות לגולגולת העכבר וניתן לאבטח אותו היטב למחזיק המיקרוסקופ על ידי זנב היונה שלו, מה שמאפשר אזור הדמיה שטוח לאגירת נוזלים ותצפית תוך-חיונית לאורך זמן. ניתן לסגור אותו עם כיסוי כדי למזער כל נזק או זיהום של הפצע, מה שמאפשר הדמיה חוזרת של אותו אזור רקמה במשך שבועות. ברגע שהוא ער, העכבר החובש שתל ראש יכול להסתובב בחופשיות, להאכיל ולקיים שגרה קבועה.
איור 3 מציג תצוגת סריקת אריחים של כלי הדם הגולאריים BM העשויים מנימים הטרוגניים, כולל עורקים, נימי מעבר וסינוסואידים. כלי הדם משובצים במיקרו-סביבת רקמה מורכבת במגע הדוק עם פני העצם ותאים מזנכימליים פרי-וסקולריים. במהלך התפתחות לוקמיה, ניתן לזהות תאים לוקמיים בודדים מבודדים בתוך המיקרו-סביבה של BM בסמיכות לכלי הדם, והחריטה שלהם גדלה עם הזמן, וממלאת את הקלווריה בשלבים מאוחרים של המחלה.
איור 4 מראה כיצד תמונות המתקבלות באמצעות פרוטוקול זה יכולות לספק נתונים כמותיים, אותם ניתן לנתח בשיטות סטטיסטיות. אנו מראים כיצד לפלח כלים עם כלי הנימה IMARIS ולמדוד את האורך והקוטר של שברי כלי הדם, כמו גם את ישרותם. ניתן גם להעריך את המתאם בין פרמטרים אלה.
איור 5 מציג רכישת הדמיה אורכית של שני מיקומים שונים של ה-BM הגולגולתי במהלך התקדמות AML בימים 4, 7 ו-10, כאשר יום 10 קשור לחריטה של ~50% של ה-BM עם תאים לוקמיים, כפי שנמדד באמצעות זרימה ציטומטרית (לא מוצג). אנו יכולים לראות שיפוץ חשוב של גודל כלי הדם הקיימים, כמו גם היווצרות כלי דם חדשים באזורים ספציפיים הקשורים לאובדן עצם מקומי.
לבסוף, באיור 6, אנו מראים כיצד ניתן למדוד חדירות כלי דם כפרמטר דינמי עם הדמיית זמן-lapse המראה את היכולת של מחסומי כלי דם שונים לשמור על צבע פלואורסצנטי לאורך זמן.
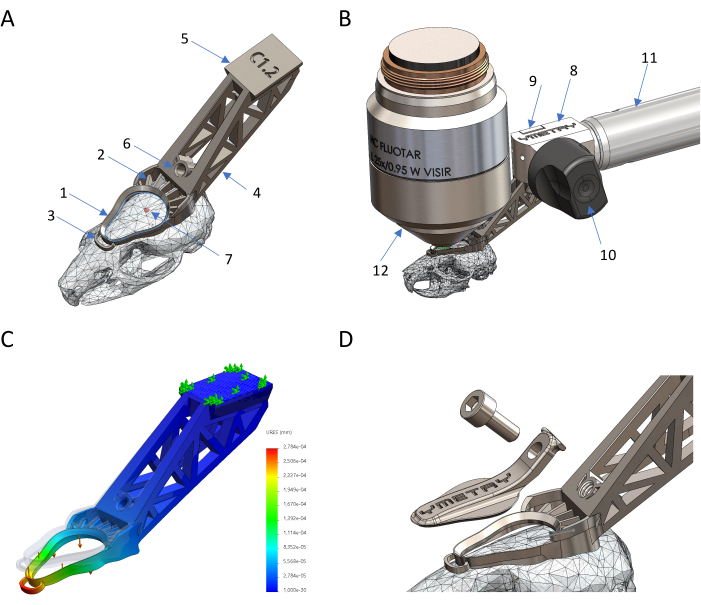
איור 1: תכנון וייצור של מחזיק ראש ביו-תואם מבוסס טיטניום. (A) חלקי השתל באתרם: טבעת תצפית אחת, 2 תכונת מלט, 3 עוגן מייצב, 4 זנב, 5 זנב יונה, 6 חור הברגה, 7 ברגמה. (ב) חיבור שתל הראש למחזיק: 8 גוף קיבוע, 9 מהדק, 10 מנוף אקסצנטרי, 11 מבנה, 12 מיקרוסקופ מטרה. (C) עיוות של השתל כנגד עומס על ידי סימולציית FEM כאשר התזוזה המקסימלית היא 0.23 מיקרומטר כנגד כוח של 0.04 N. (ד) כיסוי מגן והבורג שלו. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: הכנת העכבר להדמיה תוך חיונית. (A) מבט על שתל הראש ואזור ההדמיה שנחשף בניתוח לפני ההדמיה. (B) שתל ראש שמחובר היטב לגולגולת העכבר. (C) עכבר ער בכלוב ההתאוששות עם הכיסוי הסגור על שתל הראש. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
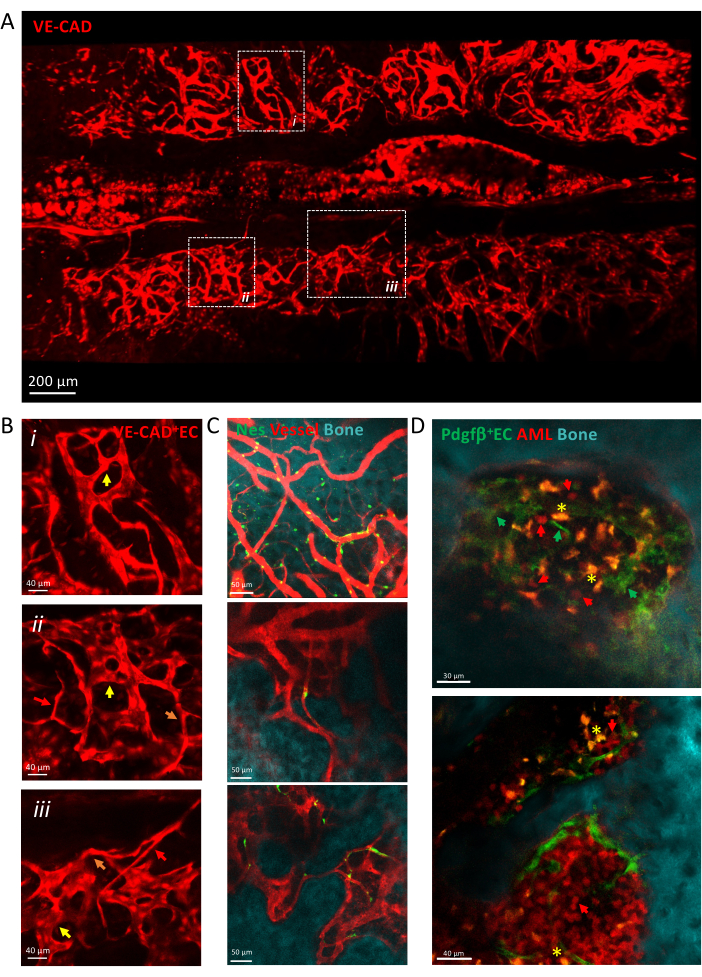
איור 3: הדמיה תוך-חיונית של כלי הדם של הקלבריה. (A) הקרנת z של תצוגת סריקת אריחים של כלי הדם של הקלווריה המסומנת על ידי cdh5-DSRED. (B) התקרב לאזורים מתוארים כדי לתאר סוגים שונים של כלי דם המתוארים על ידי חיצים, עורקים על ידי חיצים אדומים, נימי מעבר על ידי חיצים כתומים, סינוסואידים על ידי חיצים צהובים. (i) ו-(ii) הקרנות z של רקמת X מיקרומטר; (iii) פרוסה בודדת. (C) פרוסות בודדות של כמה שדות ראייה של כלי BM, שמציגות את פני השטח של העצם (SHG), את התאים הפרי-וסקולריים (nes-GFP+) ואת לומן כלי הדם (dextran-TRITC). (D) נישה וסקולרית הקשורה להתקדמות AML. פרוסות מייצגות של נקודות זמן מוקדמות (למעלה) ומאוחרות (למטה) של התפתחות AML. לוקמיה MLL-AF9 מסומנת ב-tdTOMATO (חיצים אדומים), בעוד שכלי דם מסומנים ב-pdgfb-GFP (חיצים ירוקים), משטח העצם ב-SHG ומקרופאגים בצהוב (אוטופלואורסצנטי, כוכבית צהובה). פסי קנה מידה = 200 מיקרומטר (A), 40 מיקרומטר (B,D-פאנל תחתון), 50 מיקרומטר (C). קיצורים: BM = מח עצם; GFP = חלבון פלואורסצנטי ירוק; AML = לוקמיה מיאלואידית חריפה; EC = תאי אנדותל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
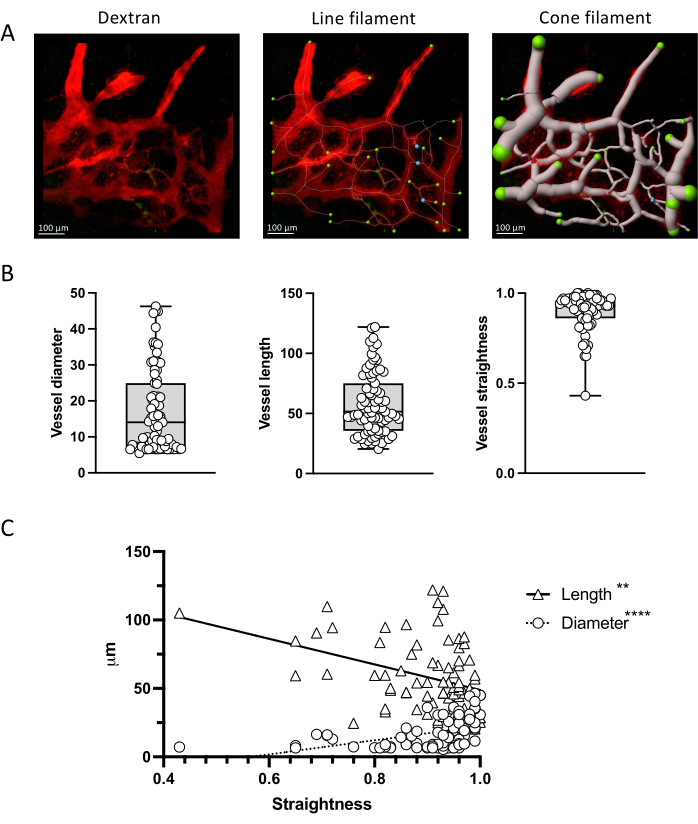
איור 4: כימות פרמטרים של כלי דם. (A) מדידת פרמטרים וסקולריים באמצעות כלי נימה IMARIS בהקרנת z מייצגת של כלי מח עצם המסומנים ב-TRITC-dextn. ייצוגי קו וחרוט מוצגים. (B) כימות של פרמטרים של כלי דם בתמונה שמוצגת ב-A. (C) מתאם בין פרמטרים וסקולריים המראים מתאם הפוך בין ישרות כלי הדם ואורכו (שלילי, Spearman r = -3523; עמ' < 0.0001; R2 = 0.2102) לעומת קוטר (חיובי; ספירמן r = 0.4110; עמ' < 0.0001; R2 = 0.1299). פסי קנה מידה = 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
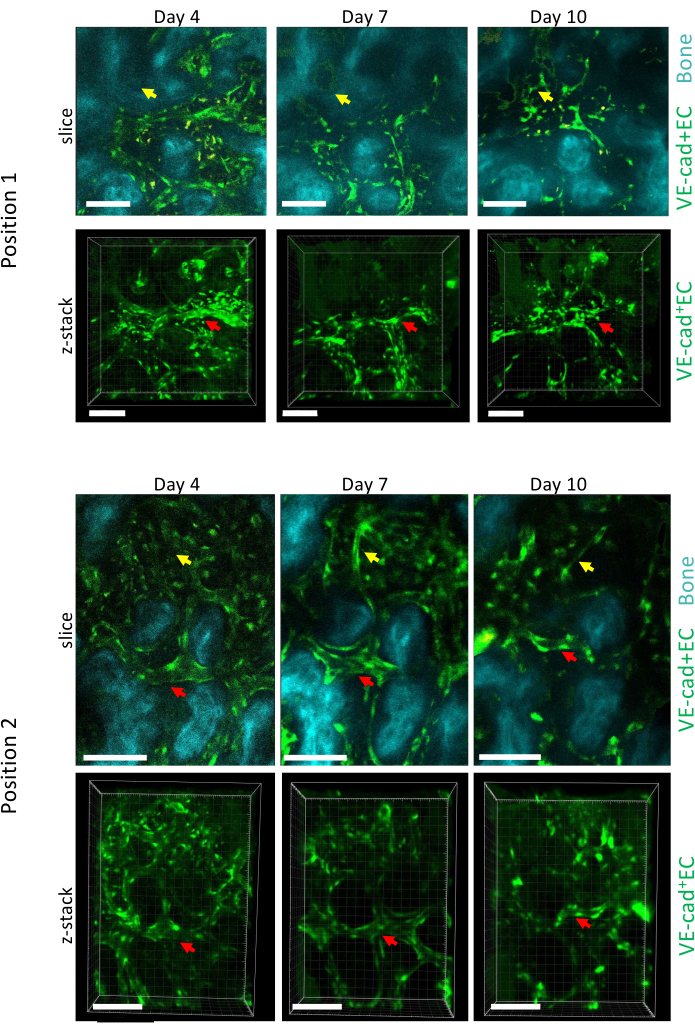
איור 5: הדמיה אורכית של שני מיקומים שונים של ה-BM של הקלווריה על פני התפתחות AML. תאי אנדותל המצפים כלי דם מסומנים ב-cdh5-GFP, משטח עצם עם SHG ומקרופאגים בצהוב (אוטופלואורסצנטי). מוצגים שיפוץ של כלים קיימים (חיצים אדומים) והיווצרות כלים חדשים (חיצים צהובים). פסי קנה מידה = 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
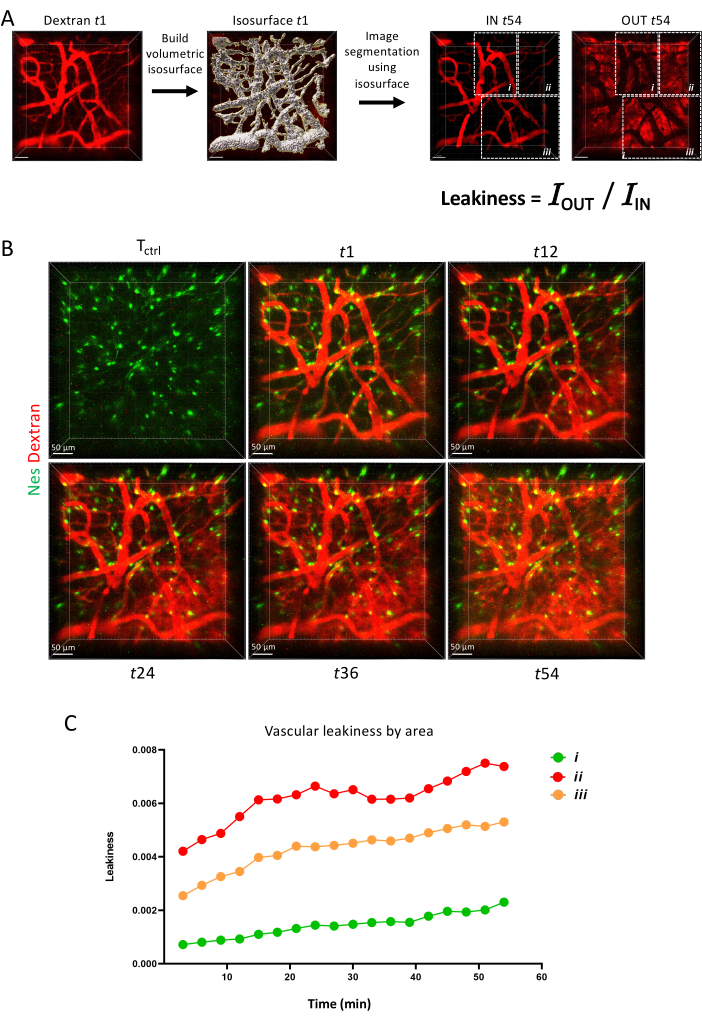
איור 6: חדירות כלי דם. (A) סכמות של מדידת חדירות כלי דם באמצעות כלי פני השטח IMARIS. (B) הקרנת Z של אותו אזור שצולמה לאורך במשך שעה אחת. (C) כימות חדירות כלי הדם בתוך אזורים כפי שמתואר ב-A. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים S1: גולגולת מוכנה. במישור החציוני, צור ציר משיק לקלבריה, ולאחר מכן שמור את הגולגולת המוכנה. אנא לחץ כאן להורדת קובץ זה.
איור משלים S2: תוכניות מרווחות של 2 מ"מ. כיצד ליצור קבוצה של מישורים במרווחים שווים (מרווח של 2 מ"מ) על פני הגולגולת. אנא לחץ כאן להורדת קובץ זה.
איור משלים S3: מתאר פני השטח הניתן לצפייה. צור סקיצה במישור הגולגולת וצור קו בצורת אגס מ-AP +6.5 עד -2, רוחב 6 מ"מ ב-AP 0.0. אנא לחץ כאן להורדת קובץ זה.
איור משלים S4: תצפית vindow. צור סקיצה במישור הגולגולתי וצייר צורת C בעובי 0.5 מ"מ המתחברת לחלון התצפית . אנא לחץ כאן להורדת קובץ זה.
איור משלים S5: לחץ על מחקר חדש. נווט אל הכרטיסייה הדמיה (אם גלויה) או עבור אל הדמיה | ללמוד. בתיבת הדו-שיח לימוד , בחר סטטי כסוג המחקר. לחץ על אישור כדי ליצור את המחקר החדש. אנא לחץ כאן להורדת קובץ זה.
איור משלים S6: לחץ לחיצה ימנית כדי ליצור רשת. צמצם את הרשת באזורים בהם צפוי מתח גבוה או עיוות. אנא לחץ כאן להורדת קובץ זה.
Discussion
החוזק העיקרי של מיקרוסקופיה תוך-חיונית הוא היכולת שלה ללכוד תהליכים תאיים דינמיים בזמן אמת בסביבתם המקורית, תוך התגברות על המגבלות של שיטות הדמיה היסטולוגיות מסורתיות והדמיה ex vivo. על ידי התבוננות ישירה ב-BM הקלוריאלי תוך שימוש בטכניקות הדמיה מתקדמות בשילוב עם תיוג פלואורסצנטי כמתואר בפרוטוקול זה, חוקרים יכולים לחקור לא רק פרמטרים תפקודיים של כלי הדם 8,14, אלא גם תהליכים אורכיים כגון השתלת תאים לוקמיים ונדידה 6,15, התפשטות ופעילות מטבולית16,17 שמירה על רלוונטיות פיזיולוגית והימנעות מממצאים הקשורים לקיבוע ועיבוד רקמות.
היתרונות של הדמיה תוך-חיונית של BM calvaria על פני אתרי עצם חלופיים כוללים נגישות קלה, שקיפות של עצם הגולגולת המאפשרת הדמיה טובה יותר ללא נזק לעצם, יציבות עצם הקלווריום ממזערת את תנועת הרקמות ויכולת שחזור על פני חיות ניסוי המאפשרת השוואה בין קבוצות ניסוי שונות. האפשרות לשחזר את בעלי החיים ולבצע הדמיה אורכית מאפשרת גם להפחית את מספר בעלי החיים המשמשים במחקר. ראוי להזכיר כי מכיוון שנצפו הבדלים ספציפיים לזן בדפוסי צמיחת כלי הגולגולת וכתוצאה מכך אוסטאוגנזה18, חשוב לקחת זאת בחשבון בעת תכנון שתל ההדמיה הספציפי לזן העכבר הרצוי כדי לאפשר תאימות אנטומית מושלמת וגישה לאתר ההדמיה הרצוי.
נקודה חשובה נוספת שיש להזכיר היא ההבדלים הפוטנציאליים בתכונות כלי הדם וההמטופויאטיות בתוך ה-BM הקלוריאלי בהשוואה לעצמות אחרות, שאלה שנחקרה בצורה גרועה עד השנים האחרונות. מחקרים חדשים מצביעים על תפקודים מקומיים לעצמות שונות, כאשר ה-BM הגולגולתי שונה מעצמות אחרות מבחינת המטופואיזה, מבנה ותפקוד העצם וכלי הדם 19,20,21,22,23, כמו גם תגובה לפתולוגיות נוירולוגיות24. יש לחקור את ההבדלים הללו ולקחת אותם בחשבון לפני הכללת ממצאים ספציפיים של קלווריה.
התכנון והבנייה של שתל הדמיה הוא צעד מפתח במערך ניסיוני זה, החל מבחירת החומר. שתלים ביו-תואמים ממלאים תפקיד מרכזי במחקר ביו-רפואי, ומאפשרים מגוון רחב של יישומים, החל מהנדסת רקמות ורפואה רגנרטיבית ועד למערכות אספקת תרופות ומכשירי ניטור in vivo . בחירת החומר לשתל ראש המותאם להדמיה תוך חיונית היא קריטית. באופן אידיאלי, החומר צריך להפגין תאימות ביולוגית מצוינת, תכונות מכניות המתאימות להבטחת גמישות מינימלית ויציבות כללית, ולבסוף, יכולת להשתלב בתוך הגולגולת מבלי לגרום לדלקת. טיטניום אידיאלי לסבילות הטובה שלו בגוף החיה, ללא אינדוקציה של תגובות שליליות במגע עם רקמות ביולוגיות, כמו גם לעמידותו בפני קורוזיה, מה שמבטיח יציבות לטווח ארוך גם אם הוא נחשף לנוזלי גוף או לתמיסות ניסיוניות. יתר על כן, החוזק המכני שלו הופך אותו לעמיד בפני עיוות ושבר. למרות חוזקו, לטיטניום יש צפיפות נמוכה יחסית, וכתוצאה מכך מכשירי הדמיה תוך-חיוניים קלים הממזערים את העומס על חיות ניסוי וחוקרים. לבסוף, הרבגוניות שלו בייצור מאפשרת התאמה אישית של התקני הדמיה תוך-חיוניים כך שיתאימו לדרישות ניסיוניות ספציפיות, כגון גודל, צורה ופונקציונליות.
כאן, עיצבנו שתל קיבוע ראש תואם ביולוגית באמצעות תוכנת CAD למידול פרמטרי עם יכולות מובנות של ניתוח אלמנטים סופיים (FEA), במיוחד SolidWorks. גישה זו מאפשרת התאמות מדויקות ואיטרטיביות לדרישות המבניות והמרחביות של השתל, ומבטיחה הן תאימות אנטומית והן עמידות מכנית. חלופות חינמיות, כגון FreeCAD, מציעות פונקציות מידול וסימולציה דומות. התשומות העיקריות לתהליך התכנון כוללות מודל אנטומי ברזולוציה גבוהה של גולגולת העכבר, מודל של מטרת המיקרוסקופ ומודל של מערכת הקיבוע, אשר יחד מודיעים על מידות השתל ותצורתו. הפלט הסופי הוא קובץ רשת שאינו תלוי בפלטפורמה, בדרך כלל בפורמט STL או STEP, התואם לרוב תוכנות ההדפסה בתלת-ממד.
השלב הראשוני כולל לכידת מאפיינים אנטומיים מפורטים של ראש העכבר באמצעות טכניקות הדמיה ברזולוציה גבוהה, כגון סריקת מיקרו-CT in vivo . גישה זו מספקת את הפירוט והדיוק האנטומיים הגבוהים ביותר, ולוכדת את המיקרו-מבנים של הגולגולת. סריקה תלת מימדית של גולגולת מוכנה ועירומה יכולה להיות גם אופציה. שיטה זו, המשתמשת בסורקי לייזר או אור מובנים, מיושמת בדרך כלל על גולגולת מוכנה ומספקת קווי מתאר מדויקים של פני השטח, אם כי עם פחות פרטים פנימיים בהשוואה למיקרו-CT. אחרת, ניתן להוריד מודלים של אנטומיה מפרסומי קוד פתוח וממסדי נתונים25 או DigiMorph {https://www.digimorph.org/specimens/Mus_musculus/}. למרות הנוחות, מודלים אלה עשויים להיות חסרים פרטים ספציפיים לדגימה, ולכן לעתים קרובות יש צורך בהתאמות עבור החיה הספציפית במחקר כגון קנה מידה למרחק ברגמה-למבדה בפועל. הנתונים הנרכשים משמשים לאחר מכן ליצירת מודל תלת מימדי מדויק של גולגולת העכבר, המשמש כתבנית הבסיס לעיצוב השתל.
כדי לאבטח את השתל על הגולגולת, מבנה מלט מתוכנן לכסות את משטח הגולגולת שנותר שאינו תפוס על ידי חלון התצפית. מבנה זה חייב לספק נקודות חיבור חזקות תוך הימנעות מתכונות אנטומיות קריטיות. למבנה המלט יש פתחים מרובים כדי להבטיח פילמור אופטימלי של המלט מתחת לשתל באמצעות דיפוזיה. בנוסף, לקירות מבנה המלט יש זווית טיוטה קטנה, המאפשרת למלט לעגן היטב כנגד קירות זוויתיים אלה. זנב השתל, המשתרע מהגוף הראשי למערכת הקיבוע, מתוכנן. רכיב זה חיוני ליישור וייצוב השתל במהלך התצפית, ותכנונו חייב לקחת בחשבון את המקום הפנוי ואת האילוצים האנטומיים של ראש העכבר. לבסוף, מנגנון זנב יונה משולב בעיצוב השתל לחיבור וניתוק קל של השתל ממערכת הקיבוע. תכונה זו משפרת את המעשיות והשימושיות של השתל במהלך תצפיות חוזרות ונשנות. מנגנון זנב היונה מספק קיבוע חוזר לשליפה קלה של רקמות שנצפו למפגשי הדמיה חוזרים ונשנים.
קוראים השוקלים אימוץ הדמיית מיקרוסקופיה תוך-חיונית של ה-BM הגולגולתי צריכים להעריך בקפידה את מטרות המחקר שלהם ואת דרישות הניסוי שלהם כדי לקבוע אם שיטה זו מתאימה למחקריהם. בעוד שמיקרוסקופיה תוך-חיונית מציעה תובנות שאין שני להן לגבי המטופואיזיס, ויסות מיקרו-סביבה של רקמות ודינמיקה של כלי דם in vivo, היא גם מציגה אתגרים ומגבלות טכניות מסוימות. החוקרים צריכים להיות מוכנים להתמודד עם אתגרים אלה באמצעות תכנון ניסיוני זהיר, אופטימיזציה של פרמטרי הדמיה ושימוש בבקרות מתאימות. בנוסף, על החוקרים לשקול את הזמינות של ציוד הדמיה מיוחד, מומחיות בטכניקות תיוג פלואורסצנטיות ומשאבים חישוביים לניתוח תמונה. בסך הכל, הדמיית מיקרוסקופיה תוך-חיונית של ה-BM הגולגולתי טומנת בחובה פוטנציאל אדיר לקדם את ההבנה שלנו לגבי המטופואיזיס וביולוגיה של כלי הדם, ומציעה חלון ייחודי לתהליכים הדינמיים המתרחשים במיקרו-סביבת BM.
Disclosures
ג'וז'ואה פודור הוא המייסד של חברת YMETRY (רישום מס' 888312352). לכותבים האחרים אין ניגודי אינטרסים.
Acknowledgements
המחברים רוצים להודות לכל הצוות של IMAG'IC ומתקני בעלי חיים במכון קוצ'ין על תמיכתם בניסויי מיקרוסקופיה ובשיכון עכברים. עכברי Tg(Nes-EGFP)33Enik ו-Tg(Pdgfb-icre/ERT2)1עכברי פרוט היו מתנה נדיבה של ד"ר בונה (מכון פרנסיס קריק, לונדון). Tg(Cdh5-cre/ERT2)1Rha ו-B6. עכברי Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J היו מתנה נדיבה של ד"ר רפי (Weill Cornell Medicine, ניו יורק). העבודה המתוארת נתמכה על ידי CNRS, INSERM ואוניברסיטת פריז סיטה, ומענקים מ-ATIP-AVENIR, Fondation ARC pour la recherche sur le cancer (R19084KS - RSE20008KSA), Ville de Paris "Emergence" (R20192KK - RPH20192KKA), Laurette Fugain (R23197KK), Cancéropôle IDF (RPH23177KKA), INCA PLBIO (RPH21162KKA), Fondation de France (RAF23152KKA), Ligue contre le cancer (282273/807251), Institut du cancer Paris Carpem, האיגוד האירופי להמטולוגיה (RAK23130KKA) ומועצת המחקר האירופית ERC-STG (EEA24092KKA). מתקן הליבה של IMAG'IC נתמך על ידי התשתית הלאומית של צרפת ביו-הדמיה (מענק ANR-10-INBS-04). מעבדת Passaro מסונפת ל-"Institut Hors Murs des Sciences Cardiovasculaires" ול-"Leukemia Institute Paris Saint-Louis.
Materials
| Name | Company | Catalog Number | Comments |
| Amira | Thermo ScientificTM | ||
| Anesthesia | Isoflurane 2% to 3% | ||
| Anesthesic mask (animal detection) | Minerve | ||
| Anesthesic unit | Minerve | ||
| B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze | Jackson laboratories | MGI:3809523 | |
| CalvariaVue | Ymetry | https://ymetry.com/site/head-fixation-implants/44-mouse-head-fixation-implant-for-calvaria.html | |
| Dental cement | Kemdent | SUN527 | |
| Dextran 500 kDa-Cy5 | Tebu-bio | DX500-S5-1 | 3 mg/mouse |
| Dextran 70 kDa-TRITC | Sigma | T1162 | 3 mg/mouse |
| Disinfectant | MP-Labo | Dermidine-60ml | |
| Electric razor | Aescular | Isis | |
| Eye gel | Ocry-gel | 10g | |
| Fiji | https://imagej.net/software/fiji/downloads | v 17 May 30 | |
| Fiji plugings to bridge with Imaris | https://imagej.net/software/fiji/downloads | Imaris_Bridge96.jar ; ImarisBridgeUtils.jar | |
| Heating box | Datesand | Thermacage | |
| Heating pad for surgery | Minerve | ||
| Imaging heating pad & rectal probe | F. Haer | ||
| Imaris v9.6.0 | Oxford instruments | ||
| Intrasite gel | Chinoxia | 2390766 | |
| LAS AF Software | Leica | LAS X 3.5.7.23225 | |
| Medication | Buprecare, 0.01 mg/kg | ||
| Objective HCX IRAPO L 25x/0.95 WATER | Leica | 506374 | |
| Saline buffer (PBS 1x) | Sigma | P4417 | Sterilize by autoclave |
| SP8 DIVE FALCON Multiphoton Microscope | Leica | ||
| Stereotoxic mask | Minerve | 1201261 | |
| Sterilizator beads | Sigma | Z742555 | |
| Surgery tools | Moria | 4877A; 2183 | |
| Survival blanket | SECURIMED | 11006 | |
| Swabs / Tissues | Sterilize by autoclave | ||
| Syringe 1 mL 26 G | BD Plastipak | 305501 | |
| Temperature controller | F. Haer | 40-90-5D-02 | |
| Tg(Nes-EGFP)33Enik mice | Jackson laboratories | MGI:5523870 | |
| Tg(Pdgfb-icre/ERT2)1Frut mice | Jackson laboratories | MGI:3793852 | |
| Tg(Cdh5-cre/ERT2)1Rha mice | Jackson laboratories | MGI:3848982 | |
| Ultrasound gel | Parker laboratories | Aquasonic 100 |
References
- Lo Celso, C., et al. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457 (7225), 92-96 (2009).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Christodoulou, C., et al. Live-animal imaging of native haematopoietic stem and progenitor cells. Nature. 578 (7794), 278-283 (2020).
- Upadhaya, S., et al. Intravital imaging reveals motility of adult hematopoietic stem cells in the bone marrow niche. Cell Stem Cell. 27 (2), 336-345.e4 (2020).
- Hawkins, E. D., et al. T-cell acute leukaemia exhibits dynamic interactions with bone marrow microenvironments. Nature. 538 (7626), 518-522 (2016).
- Duarte, D., et al. Defining the in vivo characteristics of acute myeloid leukemia cells behavior by intravital imaging. Immunol Cell Biol. 97 (2), 229-235 (2019).
- Passaro, D., et al. Increased vascular permeability in the bone marrow microenvironment contributes to disease progression and drug response in acute myeloid leukemia. Cancer Cell. 32 (3), 324-341.e6 (2017).
- Jia, Y., et al. FLT3 inhibitors upregulate CXCR4 and E-selectin ligands via ERK suppression in AML cells and CXCR4/E-selectin inhibition enhances anti-leukemia efficacy of FLT3-targeted therapy in AML. Leukemia. 37 (6), 1379-1383 (2023).
- Pendleton, E. G., Tehrani, K. F., Barrow, R. P., Mortensen, L. J. Second harmonic generation characterization of collagen in whole bone. Biomed Opt Express. 11 (8), 4379-4396 (2020).
- Dispositif de liaison d'un animal de laboratoire à au moins un système d'expérimentation, et procédé de fixation d'un tel dispositif. France patent. , WO/2021/123449 (2021).
- Horton, S. J., et al. Acute myeloid leukemia induced by MLL-ENL is cured by oncogene ablation despite acquisition of complex genetic abnormalities. Blood. 113 (20), 4922-4929 (2009).
- Scott, M. K., Akinduro, O., Lo Celso, C. In vivo 4-dimensional tracking of hematopoietic stem and progenitor cells in adult mouse calvarial bone marrow. J Vis Exp. (91), e51683(2014).
- Jung, Y., et al. Intravital imaging of mouse bone marrow: Hemodynamics and vascular permeability. Methods Mol Biol. 1763, 11-22 (2018).
- Le, V. H., et al. In vivo longitudinal visualization of bone marrow engraftment process in mouse calvaria using two-photon microscopy. Sci Rep. 7, 44097(2017).
- Spencer, J. A., et al. Direct measurement of local oxygen concentration in the bone marrow of live animals. Nature. 508 (7495), 269-273 (2014).
- Yang, M., Mahanty, A., Jin, C., Wong, A. N. N., Yoo, J. S. Label-free metabolic imaging for sensitive and robust monitoring of anti-CD47 immunotherapy response in triple-negative breast cancer. J Immunother Cancer. 10 (9), e005199(2022).
- Li, W., et al. Tracking strain-specific morphogenesis and angiogenesis of murine calvaria with large-scale optoacoustic and Ultrasound Microscopy. J Bone Miner Res. 37 (5), 1032-1043 (2022).
- Lassailly, F., Foster, K., Lopez-Onieva, L., Currie, E., Bonnet, D. Multimodal imaging reveals structural and functional heterogeneity in different bone marrow compartments: functional implications on hematopoietic stem cells. Blood. 122 (10), 1730-1740 (2013).
- Rindone, A. N., et al. Quantitative 3D imaging of the cranial microvascular environment at single-cell resolution. Nat Commun. 12 (1), 6219(2021).
- Mills, W. A. 3rd, Coburn, M. A., Eyo, U. B. The emergence of the calvarial hematopoietic niche in health and disease. Immunol Rev. 311 (1), 26-38 (2022).
- Bixel, M. G., et al. Angiogenesis is uncoupled from osteogenesis during calvarial bone regeneration. Nat Commun. 15 (1), 4575(2024).
- Koh, B. I., et al. Adult skull bone marrow is an expanding and resilient haematopoietic reservoir. Nature. 636 (8041), 172-181 (2024).
- Kolabas, Z. I., et al. Distinct molecular profiles of skull bone marrow in health and neurological disorders. Cell. 186 (17), 3706-3725.e9 (2023).
- Rosenhain, S., et al. A preclinical micro-computed tomography database including 3D whole body organ segmentations. Sci Data. 5, 180294(2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved