Method Article
Kalvarial Kemik İliğinde Vasküler Dinamiklerin İntravital Longitudinal Görüntülenmesi
Bu Makalede
Özet
İntravital mikroskopi, doku rejenerasyonu ve tümör gelişimi gibi dinamik biyolojik süreçlerin incelenmesine izin verir. Oldukça dinamik bir doku olan kalvarial kemik iliği, hematopoez ve vasküler fonksiyon hakkında bilgi verir. Biyouyumlu bir 3D baskılı kafa sabitleme implantı kullanmak, tekrarlayan uzunlamasına görüntülemeye olanak tanıyarak doku dinamikleri ve tümör mikro çevresi hakkındaki anlayışımızı geliştirir.
Özet
İntravital longitudinal floresan mikroskopi görüntüleme, özellikle doku rejenerasyonu, tümör gelişimi ve terapötik yanıtlar bağlamında dinamik biyolojik süreçleri incelemek için çok önemli bir teknik olarak ortaya çıkmıştır. Özellikle, kalvarial kemik iliği, hematopoietik kaderin çevredeki mikroçevre ile bağlantılı olduğu, normal ve patolojik hematopoezise yanıt veren özel damarlarla oldukça dinamik bir dokudur. Sabit dokuların geleneksel görüntülemesi, genellikle bu süreçlerin kapsamlı bir şekilde anlaşılmasını sınırlayan statik bilgi sunar.
Hücreye özgü belirteçleri ifade eden transgenik hayvanların, canlı hücre izleyicilerinin, görüntüleme ekipmanındaki gelişmelerin ve özel odaların kullanımının entegrasyonu, intravital mikroskopiyi dinamik biyolojik olaylara ilişkin içgörüler elde etmek için çok önemli bir araç haline getirmiştir. İntravital görüntülemenin bir uygulaması, tümör damarı davranışının ve terapötik etkilerinin araştırılmasıdır. Yeni tasarlanmış bir 3D baskılı titanyum kafa sabitleme implantı, fare kafatasına stabil bir şekilde bağlanabilir ve birden fazla seans sırasında uzunlamasına görüntüleme için uygundur.
Önerilen protokol, vasküler heterojenliğin görselleştirilmesi ve ölçülmesi, stromal ve hematopoietik hücrelerle etkileşim ve vasküler fonksiyonel parametrelerin ölçümü dahil olmak üzere kalvarial kemik iliğindeki vasküler dinamiklerin mekansal ve zamansal incelemesine izin verir. Ek olarak, teknik, yerleşik vasküler yatakların görselleştirilmesini ve terapötik etkilerin izlenmesini, kök hücre mobilizasyonunu ve iki foton mikroskobu kullanılarak kemoterapötik bileşiklerin zaman içinde lokalizasyonunu sağlar. Genel olarak, bu intravital uzunlamasına görüntüleme protokolü, hem tümör damarı davranışını hem de hematopoietik hücre dinamiklerini araştırmak için kapsamlı bir platform sağlar ve bu biyolojik olayları yöneten karmaşık süreçler hakkında değerli bilgiler sunar.
Giriş
Kalvarial kemik iliğinin (BM) intravital mikroskopi görüntülemesi, BM nişi içindeki hematopoez, doku mikroçevre düzenlemesi ve vasküler dinamiklerin dinamik süreçlerini araştırmak için güçlü ve vazgeçilmez bir teknik olarak hizmet eder. Bu metodolojik yaklaşımın birincil amacı, BM mikro ortamı içindeki hücresel davranışların, etkileşimlerin ve mekansal organizasyonun in vivo olarak gerçek zamanlı görselleştirilmesini ve analizini sağlamaktır. Araştırmacılar, floresan etiketleme ile birlikte gelişmiş görüntüleme tekniklerini kullanarak BM kalvaryasını doğrudan gözlemleyerek, hematopoietik kök hücreler (HSC'ler), stromal hücreler ve çevredeki vaskülatür arasındaki karmaşık etkileşimi aydınlatabilir ve böylece hematopoez ve bağışıklık tepkilerinin düzenlenmesi hakkında önemli bilgiler sağlayabilir.
İntravital mikroskopi görüntüleme kök hücrelerinin geliştirilmesi ve kullanılması, genellikle bir dokunun hücresel davranışlarının ve etkileşimlerinin dinamik doğasını yakalayamayan geleneksel histolojik ve ex vivo görüntüleme yöntemlerinin sınırlamalarından kaynaklanmaktadır. Statik görüntüleme tekniklerinden farklı olarak, intravital mikroskopi, araştırmacıların hücresel dinamikleri gerçek zamanlı olarak gözlemlemelerini sağlayarak, deney hayvanlarından ödün vermeden hücre göçü, çoğalma ve doğal nişleri içinde farklılaşma gibi uzunlamasına süreçlerin incelenmesine olanak tanır. Ayrıca, intravital mikroskopi, vasküler işlevsellik (örn., perfüzyon, geçirgenlik, hipoksi) gibi in vivo fonksiyonel davranışları incelemenin benzersiz avantajını sağlar, böylece fizyolojik alaka düzeyini korur ve doku fiksasyonu ve işleme ile ilişkili artefaktlardan kaçınır. Alandaki öncü çalışmalar, bu yaklaşımın 1,2 muazzam avantajlarını göstermiştir ve bulguları, endojen HSC lokalizasyonunu, göçünü ve BM nişi içindeki vaskülatür ile etkileşimleri izlemek için intravital mikroskopi kullanan daha yakın zamanda rafine edilmiş yaklaşımlar 3,4,5 ile desteklenmiş ve genişletilmiştir. Ayrıca, intravital mikroskopi, lösemi ve BM yetmezlik sendromları gibi hematopoietik bozuklukların altında yatan mekanizmaların aydınlatılmasında etkili olmuş ve lösemik hücre motilitesi 6,7, hastalıkla ilişkili vasküler çıkarımlar8 ve ilaç yanıtı9 hakkında yeni bilgiler sunmuştur.
Kalvarial BM'nin intravital mikroskopi görüntülemesinin alternatif kemik bölgelerini kaplamasının çeşitli avantajları vardır. İlk olarak, kafatası kemiği içinde bulunan BM, femur veya tibia gibi daha derin kemiklere kıyasla intravital görüntüleme için kolay erişilebilirlik sağlar. Bu erişilebilirlik, invaziv cerrahi prosedürlere gerek kalmadan ikinci harmonik oluşturma (SHG) görselleştirme10 aracılığıyla kemiğin kendisi de dahil olmak üzere doku mikro çevresinin doğrudan gözlemlenmesini kolaylaştırır. İkincisi, kafatası nispeten ince ve yarı saydamdır, bu da BM nişi içindeki hücresel dinamiklerin daha iyi görselleştirilmesine izin verir. Bu şeffaflık, kemik inceltme veya temizleme tekniklerine ihtiyaç duymadan iki foton mikroskobu, konfokal mikroskopi ve ışık tabakası mikroskobu ile yüksek çözünürlüklü görüntülemeyi kolaylaştırır. Kalvarial kemik, intravital görüntüleme deneyleri için stabil, düz ve sert bir platform sunar, doku hareket artefaktlarını en aza indirir ve uzun gözlem süreleri boyunca tutarlı görüntüleme koşulları sağlar. Bu stabilite, zaman içindeki hücresel davranışları ve tepkileri izleyen uzunlamasına çalışmalar için özellikle avantajlıdır. Tekrarlanabilirlik, deney hayvanları arasında kalvarial kemiğin nispeten küçük ve mekansal olarak tanımlanmış yapısı göz önüne alındığında bir başka büyük avantajdır. Bu tekdüzelik, farklı deney grupları arasında karşılaştırmayı kolaylaştırır ve görüntüleme verilerinin sağlam istatistiksel analizini sağlar.
Burada, enfeksiyonları veya ameliyat bölgesinin hasar görmesini önlemek için yaranın güvenli bir şekilde kapanmasına olanak tanıyan, aynı titanyum alaşımından yapılmış özel ve kolayca konumlandırılabilen bir sert kapağa sahip, biyouyumlu Grade 23 titanyum alaşımı (Ti6Al4V) kullanılarak 3D olarak basılmış, yeni geliştirilen bir kafa sabitleme implantı11'i tanıtarak, intravital iki foton mikroskobu yoluyla fare kalvarial BM'sini görüntülemek için bir yöntemi açıklıyoruz. İmplant, fare kafasını bir implant tutucu aracılığıyla mikroskop aşamasına sıkıca ve stabil bir şekilde sabitleyerek solunum artefaktlarını en aza indirir ve zaman içinde aynı alanların uzunlamasına görüntülenmesine izin verir. BM mikro ortamından (SHG + kemik yüzeyi; nestin-GFP + mezenkimal hücreler; cdh5-DSRED +, cdh5-GFP + veya pdgfb-GFP + endotel hücreleri) ve malign hematopoietik bölme (tdTOMATO + AML hücreleri) ve ayrıca damarların lümenini gösteren floresan kontrast maddeler (dekstran-TRITC). Damar uzunluğu, düzlüğü ve çapının yanı sıra farklı vasküler bölgelerdeki geçirgenlik de dahil olmak üzere saatler veya günler boyunca ölçülen vasküler parametreler, doku davranışı ve sağlığı hakkında önemli bilgiler sağlayabilir.
Protokol
Tüm hayvan deneyleri, Fransız "Ministère de l'enseignement supérieur, de la recherche et de l'innovation" tarafından onaylanan APAFIS#27215-2020041513522374 v6 etik anlaşması kapsamında gerçekleştirildi.
1. 3D baskı için biyouyumlu bir titanyum kafa sabitleme implantının tasarımı
NOT: Yerleşik Sonlu Elemanlar Analizi (FEA) özelliklerine sahip bir parametrik modelleme bilgisayar destekli tasarım (CAD) yazılımı kullanarak biyouyumlu bir kafa sabitleme implantı tasarladık (bkz. Malzeme Tablosu). Tasarım süreci için birincil girdiler, fare kafatasının yüksek çözünürlüklü bir anatomik modelini, mikroskop objektifinin bir modelini ve birlikte implantın boyutlarını ve konfigürasyonunu bilgilendiren bir fiksasyon sistemi modelini içerir. Nihai çıktı, çoğu 3D baskı yazılımıyla uyumlu, tipik olarak STL veya STEP biçiminde, platformdan bağımsız bir ağ dosyasıdır. Bu dosya formatı, doğru implant üretimi için 3D yazıcıya sorunsuz aktarım sağlar.
- Farenin 3D modelinin hazırlanması
- Hazırlanmış veya in vivo olarak fare kafatasını mikro-CT tarayıcıya yerleştirin.
- İnce anatomik ayrıntıların en iyi şekilde çözülmesi için tarama parametrelerini ayarlayın: Kontrol Panelini açın ve Tarama Koşulları bölümünde bir Görüş Alanı (FOV) seçin. Tarama ses düzeyini tanımlamak için LiveView'ı kullanın.
NOT: Dedektör çözünürlüğü aracılığıyla FOV, dedektör çözünürlüğüne göre voksel boyutunu belirleyecektir. Daha yeni mikro-CT makinelerinde, 5 mm'lik bir FOV tipik olarak 5 μm voksel boyutuna, 10 mm FOV ila 10 μm voksel boyutuna, 25 mm FOV ila 21 μm voksel boyutuna karşılık gelir. Bu çözünürlükteki sınırlı FOV, tüm kafatasını kaplamak için birden fazla tarama gerektirebilir. Birden çok tarama, taramalar arasında çakışma gerektirir. - Kafatasının tek ve kapsamlı bir modelini oluşturmak için birden fazla yüksek çözünürlüklü taramayı görüntüleme yazılımında birleştirin.
- Kafatasını izole etmek için mikro-CT DICOM dosyalarını segmentasyon yazılımına (ör. 3D Slicer, Amira, Avizo veya Mimics) aktarın.
- Kemik dokusunu çevredeki yapılardan ayırmak için eşik tabanlı segmentasyon gerçekleştirin ve karmaşık veya gürültülü bölgeleri iyileştirmek için manuel ayarlamalar yapın.
- 3D Slicer'da, önce DICOM dosyalarını içe aktarın ve veri kümesini yükleyin ve eksenel, sagital ve koronal dilim görünümlerinde CT dilimlerini gözlemleyin.
- Segment Düzenleme'yiaçın, yeni bir segmentasyon oluşturmak için Ekle'ye tıklayın | Eşiklenecek yeni bir segment oluşturmak için Ekle'yi tıklayın.
- Segment Düzenleyici panelinde, Eşik efektini tıklayın. Alt ve Üst eşik kaydırıcılarını ayarlayın (veya sayısal değerler yazın), böylece segmentlere ayrılacak bölge dilim görünümlerinde kırmızı renkle vurgulanır. Eşikli bir 3D segment hazır.
- Segmentli kafatasını bir STL dosyası olarak dışa aktarmak için Segmentasyon Modülüne geçin. Eşikli segmentin seçili olduğundan emin olun. Modelleri ve Etiket Haritalarını Dışa/İçe Aktar bölümünde, Dışa Aktarma türünü Modeller olarak ayarlayın. ve Dosya Formatı: STL. Dışa Aktar düğmesini tıklayın.
NOT: STL dosyaları, kafatasının yüzeyini binlerce üçgenle temsil eden ve anatomik şekli ince ayrıntılarla yakalayan üçgen bir ağ formatı kullanır.- Gerekirse, MeshLab'da aşağıdaki gibi dikiş yapın:
- Dosya | Mesh'i içe aktarın ve referans taraması olarak birini seçin.
- Hizalama aracını kullanarak diğer taramaları hizalayın (Filtreler | Kayıt | Hizala) karşılık gelen noktaları işaretleyerek ve İşlem'i kullanarak.
- Filtreler | Kafes Katmanı | Yalnızca Görünür Katmanları Birleştir seçeneğiyle Görünür Katmanları Düzleştirin.
- Gerekirse, MeshLab'da aşağıdaki gibi dikiş yapın:
- Pürüzsüz ve sürekli bir yüzey elde etmek için gürültünün neden olduğu üçgenlerin çıkarılmasını ve istenmeyen deliklerin doldurulmasını sağlamak için aşağıdaki gibi yinelenen köşeleri ve üçgenleri ortadan kaldırarak ağı temizleyin ve onarın:
- Filtreler | Temizlik ve Onarım | Yinelenen köşeleri kaldırın.
- Filtreler | Temizlik ve Onarım | Yinelenen yüzleri kaldırın.
- Filtreler | Temizlik ve Onarım | İzole edilmiş parçaları çıkarın (yüz numarasına göre). Korunacak minimum yüz sayısı için bir eşik belirtin (örneğin, küçük kümeleri veya gürültüyü kaldırmak için bu eşiği düşük ayarlayın).
- Filtreler | Yeniden Meshleme, Basitleştirme ve Yeniden Yapılandırma | Delikleri kapatın.
- Mikro-CT'den gelen ilk STL dosyaları CAD yazılımıyla uyumlu olmayan çok yüksek üçgen sayıları içerdiğinden, ~ 10.000-30.000 üçgene kadar ağ basitleştirmesi gerçekleştirin. Yüksek detaylı alanlarda, implantın doğru şekilde oturmasını sağlamak için kafatasının üst kısmında daha küçük üçgenler tutun. Daha kaba bölgelerde, dosya boyutunu küçültmek ve işleme verimliliğini optimize etmek için daha az kritik bölgeleri daha büyük üçgenlerle basitleştirin.
NOT: Ağ basitleştirmesi alanlara göre yapılır ve 1.1.8.1-1.1.8.3'te detaylandırılır.- Basitleştirilecek alanları seçmek için Bölge seçim aracında Bağlı Bileşenleri Seç'i kullanın.
- Parametrelerle seçilen alanlarda Kuadratik Kenar Daraltma Kararını kullanın. Filtreler | Yeniden Örgü, Basitleştirme ve Yeniden Yapılandırma | Basitleştirme: Kuadrik kenar çökme desiyonu. Kalite Eşiğini 0,8 olarak ayarlayın, Ağın Sınırını Koru'yu EVET olarak ayarlayın, Topolojiyi Koru'yu EVET olarak Koru, Hedef Yüz Sayısı: gereken çözünürlüğe karşılık gelen bir hedef sayı ayarlayın.
- Toplam üçgen sayısı istenen seviyeye düşene kadar gerektiği kadar yineleyin. Ardından, basitleştirilmiş modeli bir STL dosyasına kaydedin.
- Kafatası modelinin CAD modelinde hazırlanması
- Basitleştirilmiş kafatası modelini STL formatında CAD yazılımına yeni bir parça veya model olarak aktarın. Yazılımın özelliklerine bağlı olarak, içe aktarılan dosyanın gerekirse katı veya yüzey gövdesine düzgün bir şekilde dönüştürüldüğünden emin olun. Daha fazla değişiklik yapmak ve sonraki tasarım adımlarıyla uyumluluğu sağlamak için modeli yerel CAD dosya formatında kaydedin.
- Bregma ve Lambda üzerine referans noktaları yerleştirin ve bu modelde Bregma-Lambda eksenini oluşturun.
- Bregma-Lambda ekseni dahil olmak üzere Medyan düzlemini oluşturun.
- Medyan düzlemde, kalvariaya teğet bir eksen oluşturun, ardından hazırlanan kafatasını kaydedin (Ek Şekil S1).
- Yeni bir montaj oluşturun ve hazırlanan kafatasını Bregma'nın orijin ile çakışacağı, Medyan düzlemi sağ düzlemle çakışacak ve kalvarial eksen yatay olacak şekilde yerleştirin.
- Kafa sabitleme implantı, hazırlanan kafatası modeline mükemmel bir uyum sağlamak için doğrudan montaj içinde tasarlanacaktır. Bunu başarmak için, implantı montaj içinde yeni bir parça olarak oluşturun. Ekle | Bileşen | CAD yazılımında Yeni Bölüm. İstendiğinde, yeni parçayı konumlandırmak ve sabitlemek için referans olarak kalvaria yüzeyini veya montajın üst düzlemini seçin.
- Kafatası boyunca eşit aralıklı düzlemlerden (2 mm aralıklı) oluşan bir set oluşturun. Her düzlemde bir eskiz oluşturun ve her eskizde, kafatasının üst yüzeyinin kafatasının 0,2 mm üzerindeki bölümünü takip ederek, dokuz noktalı simetrik bir eğri şeklinde 0,2 mm ofset projeksiyonlu bir eğri çizin (Ek Şekil S2).
- İmplant özelliklerinin yapımında kullanılmak üzere bu spline'ları ( Kafatası Sınır Yüzeyi) kullanarak süpürülmüş bir yüzey oluşturun, bu yüzeyin herhangi bir kusur olmadan pürüzsüz olmasını sağlayın.
- Kafatasındaki gözlemlenebilir yüzeyin tanımı
NOT: 3D modele dayanarak, 3D gözlem için ideal olan kalvaria kemiğinin en düz bölgesi tanımlanmıştır. Bu bölge, kafatasının biyolojik ve yapısal bütünlüğü göz önünde bulundurularak iki fotonlu mikroskobun hedefine en uygun erişimi sağlamak için özenle seçilmiştir. Tanım, Bregma noktasının koordinat sisteminin kökeni olarak hizmet ettiği stereotaksik koordinatları kullanabilir.- Kalvarial düzlemde bir çizim oluşturun ve AP 0.0'da AP +6.5 ila -2, 6 mm genişliğinde armut şeklinde bir eğri oluşturun. Bu, Gözlemlenebilir Yüzey Konturu olacaktır (Ek Şekil S3).
NOT: Mikroskop objektifi, kafatası üzerinde önceden tanımlanmış gözlemlenebilir yüzeye göre sanal olarak konumlandırılmıştır. Bu adım, objektifin boyutu ve şekli tarafından uygulanan uzamsal kısıtlamaların belirlenmesini ve implant tasarımının mikroskobun gereksinimlerini karşılamasını sağlamayı içerir. - Mikroskop objektif modelini düzeneğe dikey olarak yerleştirin. Odak noktasını, kalvarial kemik iyonu olan kalvarial düzleme paralel bir düzlem üzerinde sınırlayın ve Mikroskop Objektifinin Sınırlayıcı Hacmini tanımlayın.
- Gözlemlenebilir Yüzey Konturu'nu takip ederek hedefi süpürerek bir hacim oluşturun.
- Tanımlanan gözlemlenebilir yüzeyin etrafında bir gözlem penceresi oluşturun ve mikroskop objektifi için engelsiz erişim sağlayın.
NOT: Gözlem penceresi, koruyucu kapağın doğru şekilde kapatılması için daldırma sıvısı tutma ve katı yapı gibi ikincil işlevlere sahip halka benzeri bir yapıdır. - Kalvarial düzlemde bir çizim oluşturun ve gözlemlenebilir yüzey konturunu kopyalayın.
- 0,5 mm kalınlığında paralel bir kontur oluşturun. Bu çift konturu 0,9 mm yukarı ve aşağı doğru 4 ° 'lik bir taslak açısı ile yüzey Kafatası Sınır Yüzeyine sıkın.
- Kalvarial düzlemde bir çizim oluşturun ve AP 0.0'da AP +6.5 ila -2, 6 mm genişliğinde armut şeklinde bir eğri oluşturun. Bu, Gözlemlenebilir Yüzey Konturu olacaktır (Ek Şekil S3).
- Çimentolama, kuyruk ve kırlangıç kuyruğu yapılarının tanımlanması.
- Kalvarial düzlemde bir eskiz oluşturun ve Gözlem Penceresine bağlanan 0,5 mm kalınlığında bir C şekli çizin ve 2° draft açısıyla yüzey Kafatası Sınır Yüzeyine 4 mm yüksekliğe ve aşağıya doğru ekstrüzyon yapın (Ek Şekil S4).
- Kalvarial düzlemde bir çizim oluşturun ve bu alanı, aralarında 1 mm boşluk olacak şekilde radyal olarak yerleştirilmiş 0,4 mm kalınlığında dikdörtgenlerle doldurun.
- Gözlem Penceresine benzer şekilde ekstrüzyon yapın.
- Mevcut hacme saygı duyarak kafatasına fiksasyona güvenerek implantın kuyruğunu oluşturun.
- Çimentolama yapısına teğet olarak enine bir düzlem ve geriye doğru 12,5 mm daha oluşturun.
- Bu düzlemler üzerine dikdörtgenler çizin. Açıları yataydan yaklaşık 20° ve 37° ayarlayarak piramidal bir cismi arasında süpürün.
- Çimentolama yapısının yanındaki kuyruğa dişli bir M1.6 deliği ekleyin.
- Kuyruğun ucunda bir eskiz oluşturun ve kırlangıç kuyruğu profilini çizin.
- Bu profili 8 mm sıkın.
- Hedefe müdahale edilmediğinin doğrulanması.
- Mikroskop objektifine mekanik bir müdahale olmadığından emin olmak için gözlem penceresi ve kırlangıç kuyruğu da dahil olmak üzere tüm implant tasarımını inceleyin. Adım 1.3.3'te oluşturulan ses seviyesiyle ilgili parazit olup olmadığını kontrol edin.
NOT: Bu doğrulama adımı, hedefin herhangi bir engel olmaksızın gerektiği gibi konumlandırılabilmesini ve hareket ettirilebilmesini sağlamak için kritik öneme sahiptir.
- Mikroskop objektifine mekanik bir müdahale olmadığından emin olmak için gözlem penceresi ve kırlangıç kuyruğu da dahil olmak üzere tüm implant tasarımını inceleyin. Adım 1.3.3'te oluşturulan ses seviyesiyle ilgili parazit olup olmadığını kontrol edin.
- Ağırlığı en aza indirmek ve hayvan için olası rahatsızlığı azaltmak için implantın kuyruğundan gereksiz materyali çıkarın.
- Medyan düzlemde bir eskiz oluşturun ve Kuyruk gövdesinden ekstrüzyon ile çıkarıldığında bir kafes yapı oluşturmak için üzerine üçgen kesikler çizin.
- Dik düzlemde tekrarlayın.
- Çeşitli koşullar altında implantın mekanik özelliklerini analiz etmek için Sonlu Elemanlar Yöntemi (FEM) simülasyonu ile maksimum yer değiştirmeyi doğrulayın.
NOT: Bu simülasyon, kullanım sırasında implant içindeki maksimum yer değiştirmeyi ve gerilmeleri tahmin etmeye yardımcı olarak güvenilirliğini sağlar.- CAD yazılımı simülasyonu eklentisini etkinleştirin.
- Simülasyon araç çubuğunda yeni bir statik etüt oluşturun. Simülasyon sekmesine gidin (görünüyorsa) veya Simülasyon | Ders çalışma. Etüt iletişim kutusunda, etüt türü olarak Statik'i seçin. Yeni etüdü oluşturmak için Tamam'a tıklayın (Ek Şekil S5).
NOT: Bu çalışma türü, implant kullanımında beklendiği gibi statik yükler altında deformasyon ve stresi analiz etmek için uygundur. - İmplant için gerçek implant bileşimine (Ti6Al4V) uygun bir malzeme seçin.
- İmplantın kırlangıç kuyruğu fiksasyonuna temas edeceği bağlantı noktalarını simüle etmek için sabit kısıtlamalar tanımlayın. Kırlangıç kuyruğunun üst yüzeyini sabit olarak tanımlayın.
- İmplantın alt yüzeyindeki dikey yükü tanımlayın. 1 N dikey kuvvet ayarlayın.
- Bir ağ oluşturun. Yüksek gerilme veya deformasyonun beklendiği alanlarda ağı rafine edin (Ek Şekil S6). Bunu yapmak için, çalışma ağacının mesh öğesine sağ tıklayın ve Mesh Oluştur'u seçin. Kafes iletişim kutusunda, maksimum ve minimum öğe boyutlarını bağımsız olarak ayarlamak için kaydırıcıyla veya Kafes Kontrolü kutusunu etkinleştirerek Kafes Yoğunluğu'nu ayarlayın. Ağı oluşturmak için Tamam'a tıklayın.
NOT: Yazılım, çalışma için otomatik olarak bir başlangıç ağı oluşturur, ancak daha doğru sonuçlar için, ağ, özellikle implant stabilitesi için kritik olan bölgelerde (gözlem penceresi gibi) daha ince bir ağ seçmek üzere iyileştirilebilir. Bu bölgelerdeki daha ince örgü, yerel stres konsantrasyonlarını yakalayarak simülasyonun doğruluğunu artırır. - İmplant boyunca yer değiştirme, gerilme ve gerinim dağılımlarını hesaplamak için statik analizi başlatın.
- Sonuçları analiz edin. Maksimum deformasyon alanlarını belirlemek için yer değiştirme grafiğini inceleyin. Bu grafik, implantın uygulanan yükler altında ne kadar deforme olacağını gösterir ve aşırı hareket riski olan herhangi bir alanı vurgular. Gözlem Penceresi içindeki deformasyonun 3 mikronu geçmemesine dikkat edin.
- Son olarak, kullanılmadığı zaman gözlem penceresini korumak için koruyucu bir kapak tasarlayın. Bu kapak, açıkta kalan kemiği çevresel kirleticilerden ve fiziksel hasarlardan korur.
2. Fare tedavileri, anestezi ve kafa implantının cerrahi implantasyonu
NOT: Burada, gösterildiği gibi erkek veya dişi, 7 ila 12 haftalık C57BL / 6 veya transgenik fareler kullanılabilir. BM'nin lösemi kolonizasyonunu indüklemek için, Horton ve ark.12 tarafından tarif edildiği gibi üretilen lösemik hücreler, görüntülemeden 2-3 hafta önce intravenöz olarak uygulanır. Yaranın sağlığını garanti altına almak için steril teknikler kullanılmalıdır.
- Kaputun altına steril cerrahi aletleri (künt makas ve cımbız), düzelticiyi ve göz jeli, salin, dezenfektan, diş çimentosu, emici çubuklar ve temizleme dokusu dahil olmak üzere sarf malzemelerini monte edin. Boncuk sterilizatörünü açın.
- Anestezik indüksiyon odasını %4 izofluran ve atmosferik oksijen ile doldurun ve fareyi odaya yerleştirin. Hayvan tamamen uyuşturulduğunda (doğru refleks kaybı ve daha derin ve daha yavaş solunum paterni olup olmadığını kontrol edin), izofluran akışını anestezik maskenin burun konisine getirin ve izofluran konsantrasyonunu% 2'ye düşürün.
- Fareyi 37 °C'lik bir ısıtma yastığının üzerine yerleştirin ve solunum hızını görsel olarak izleyin. İsteğe bağlı: Patolojik fenotipli fareler için, anestezi boyunca doğru sıcaklığı korumak için bir hayatta kalma battaniyesi ekleyin.
- Ameliyattan 30 dakika önce ağrı kesici ilaçları deri altına (Buprecare, 0.01 mg/kg) uygulayın.
- Fare kafasını elektrikli tıraş makinesiyle tıraş edin.
- Anestezi altındayken kuruluğu önlemek için farenin gözlerine bir damla oftalmik jel ekleyin ve jelin kafa derisine damlamadığından emin olun.
- Cerrahi alanda kalan tüyleri temizlemek için fareyi temizleyin. Kafa derisinin üst kısmını pamuklu bir mendil üzerinde dezenfektan ile temizleyin. Görüntüleme artefaktlarının yanı sıra yara enfeksiyonu riskini önlemek için tüm tüyleri aldığınızdan emin olun.
- Steril forseps ve makas kullanarak (sterilizatörde 30 saniye sonra), merkezi kemik izini ortaya çıkarmak için kafa derisinin orta kısmında küçük bir kesi yapın. Doğru uzunluk ve genişlik görüntüleme alanını tanımlamak için takip edin. Kafa derisinin bir parçasını dikkatlice çıkarın, forseps kullanarak kulaklar arasındaki cildi kaldırın ve başın arkasında küçük bir kesi yapın. Cildi yukarıda tutarak, makası cildin altından geçirin ve görüntüleme alanının dışında dikkatlice kesin.
- Kafatası ve kafa derisi arasındaki bağ dokusunu çıkarın. Açıkta kalan kemiği pamuklu bir bezle steril PBS ile silin. Kafatası kemiğinin uzun süre maruz kalmasını önlemek için kafa implantının farenin kafatasına takılmasına hızla ilerleyin (<10 dk).
- Üreticinin talimatlarını izleyerek bir Petri kabında yeterli diş çimentosu içeren bir macun yapın ve hızlı bir şekilde kafa sabitleme implantının altına uygulayın.
- Görüntüleme alanının içine herhangi bir diş çimentosu girmeden, baş tutucuyu farenin açıkta kalan kafatasına yerleştirin ve ardından oturmasını bekleyin.
- Ayarlandıktan sonra (normalde 3-5 dakika içinde), kafatasını nemli tutmak için görüntüleme odasına birkaç damla 37 °C PBS ekleyin.
3. İki fotonlu mikroskop kullanarak görüntüleme
- Ameliyata başlamadan önce lazeri açın ve stabilize olması için ısınmasına izin verin. Mikroskobu açın ve edinme yazılımını başlatın. Uygun hedefi seçin (bu deney için 25x/0,95 SUYA daldırma).
- Tümü xy aşaması ile bütünleşik olarak hareket ettirilecek olan, ısı yastıklı bir veteriner breadboard'u yerleştirmek için yeterli alana sahip, sabit aşamalı bir dik mikroskop standı kullanın. Kafa implantını ve stereotaksik maskeyi sabitlemek için platform olarak sağlam bir alüminyum optik devre tahtası kullanın. İzofluran enjeksiyonu ve ekstraksiyonu ile ilişkili esnek hortumları ve konektörlerini mikroskop kafesindeki maskeye bağlayın.
- Edinme ayarlarını hızlı taramak için yapılandırın: 512 x 512 piksel format; hız 600 Hz; ve yakınlaştırma faktörü 1.
- Aynı uyarma dalga boyuna sahip SHG, GFP ve tdTOMON'u algılayabilmek için lazer çizgisini 880 nm'de ayarlayın.
- NDD dedektörlerini etkinleştirmeden önce odadaki ışığı kapatın ve mikroskop standının etrafındaki kutuyu düzgün bir şekilde kapatın ve spektral algılama kapılarını tanımlayın: PMT1, SHG'yi [388 - 431 nm] algılamak için; GFP [485 - 548 nm] için HyD2 ve tdTOMATO [551 - 645 nm] için HyD3. Uzaklığı 0'da bırakın.
- Yeni bir proje veri kümesi oluşturun ve belirli bir denemeye göre yeniden adlandırın.
- Kafa sabitleme implantı fare kafatasına takıldıktan sonra (çimento sertleşmesi ile onaylanır), izofluranı mikroskobun stereotaksik maskesine doğru açın.
- Fareyi hızlı bir şekilde mikroskoba getirin. Bir elinizle burnunu kaldırarak izofluranın fare burnundan geçmesine izin vermek için fare dişlerini dikkatlice maskeye yerleştirin.
- Fareyi bir elinizle tutarken, diğer elinizle kafa sabitleme implantının kırlangıç kuyruğunu yavaşça sabitleme tutucusuna kaydırın ve vida topuzunu yarım çevirerek sabitleyin.
- Sıcaklık izleme için su bazlı bir jel ile önceden gömülü bir rektal prob yerleştirin ve fare gözlerine oftalmik damlalar ekleyin.
- Kafa görüntüleme haznesini büyük miktarda su bazlı jel veya PBS ile doldurun ve iki foton uyarımı tarafından üretilen sinyallerin optimum uyarılmasını ve algılanmasını sağlamak için suya daldırma hedefini tamamen daldırmak için indirin.
- Merkezi kemiğe iskele izine odaklanmak için xy aşamasını ve z sürücüsünü hareket ettirin.
NOT: Mikroskobun göz merceklerinin ve üç bantlı bir uyarma emisyon filtresi ile filtrelenmiş bir ışık kaynağı olarak metal halojenür tipi bir lambanın kullanılması uygundur. Optik kesit eksikliği, net bir görüntü elde etmeyi imkansız hale getirir; Ancak pratikle, kafatasının merkezi alanı kolayca tanınabilir. - Bir kemik yüzeyi ve merkezi damar ile işaretlenmiş dokuyu tanımladıktan sonra, HyD dedektörlerini korumak ve Kızılötesi (IR) lazerin geçmesine izin vermek için metal halojenür lambasını kapatın ve mikroskop kafesi pencerelerini kapatın.
- PMT/SHG kazancını 850 V'a (doğrusal çalışma aralığı) ayarlayın ve HyD kazancını %100'e ayarlayın. Üç kanalın en küçüğünde 200 gri seviyeli (8 bit dedektör dinamik ile) dinamik aralığa sahip bir görüntü elde edilene kadar IR lazer gücünü artırın. Emisyon farkları çok önemliyse veya doygunluk varsa, "daha düşük" arama tablosu (LUT) modunu kullanarak diğer dedektörlerin kazançlarını azaltın.
NOT: Bizim durumumuzda, tüm kanallarda kontrast elde etmek için% 30'luk bir lazer gücü yeterliydi. - Edinme yazılımında, kemik yüzeyleri (SHG) içinde yer alan BM ceplerinden (GFP+, tdTOMATO+) yapılmış bir bölge arayın.
- Farklı yatırım getirileri bulmak için LAS NAVIGATOR'ı etkinleştirin ve spiral modu kullanarak tüm bölgeye genel bir bakış oluşturun. Elde edilen yüzey yeterince büyük olduğunda edinmeyi durdurun. Genel bakışı kaydedin, birleştirin ve yeniden adlandırın: bu, uzunlamasına görüntüleme durumunda referans görüntü olacaktır.
NOT: Cihaz tutucunun objektifle temas etmesine neden olabileceğinden çok büyük bir spiral oluşturmamaya dikkat edin. - Tek görüntü simgesine tıklayarak bazı ROI pozisyonlarını kaydedin ve görev listesindeki her pozisyonu yeniden adlandırın. Çeşitli ROI'lerin göreceli konumunun önceden kaydedilmiş genel bakışın üzerine bindirilmesi için bir ekran görüntüsü alın.
NOT: Bu ekran yakalama, edinim yazılımı bu deney için kullanılan sürümde bu pozisyon grubunun geri çağrılmasına izin vermediğinden, boylamsal görüntülemede ROI'lerin değiştirilmesi için gerekli olacaktır. - Bir z yığını birimi elde etmek için z yığını modunu seçin, adım boyutunu 3 μm olarak tanımlayın ve tüm bölgeler için aynı yığın boyutu seçeneğinin seçimini kaldırın. İlk konumu seçin, üst ve alt konumları tanımlayın, z adım boyutunu kontrol edin ve yığını yeniden tanımla'ya tıklayın. Konum listesindeki konumun adının yanında bir küp simgesi görünür. Farklı ROI'lerin tüm pozisyonları için bu adımı tekrarlayın.
- Görüntüleri (~50 planlı üç kanallı z-yığınları) al'a basın ve uygun klasöre kaydedin. Bu adım, deneyin Tctrl'sini işaretler; Alım parametrelerinin doğru olup olmadığını kontrol edin (üç kanalda doğru dinamik aralık elde edin, sinyal doygunluğundan mümkün olduğunca kaçının ve tam bir döngü için alım süresini kontrol edin).
- Dinamik bir özelliği ölçmek için (bu durumda vasküler geçirgenlik), bir timelapse elde edin.
- Bu kurulumda, üç dedektör üç kanalın aynı anda görüntülenmesine izin verir; deney için dördüncü bir kanal gerekiyorsa (bu durumda Dekstran izleme), sıralı modu etkinleştirin ve ikinci bir alım dizisi ekleyin. Dextran Cy5 floroforu uyarabilmek için IR lazer çizgisini 820 nm'de ayarlayın. Hyd2 algılama aralığını [650 - 744 nm] olarak değiştirin ve diğer dedektörleri devre dışı bırakın. Yığın alma modu arasında seçim yapın.
NOT: Varsayılan olarak, ikinci alım dizisi dizi 1 ile aynı parametrelere sahiptir. - Timelapse'a başlamadan önce, kayıt süresinin dekstran sızıntısını tespit etmek için gereken minimum süre olan 3 dakikayı (sıralı modun eklenmesini dikkate alarak) aşmamasını sağlamak için tüm konumların alımını başlatın.
- Dekstran enjeksiyonundan önce, alım modunu xyzt olarak değiştirin. T modülünde zaman aralığını 3 dk ve süreyi 1 saat olarak ayarlayın.
- Bu kurulumda, üç dedektör üç kanalın aynı anda görüntülenmesine izin verir; deney için dördüncü bir kanal gerekiyorsa (bu durumda Dekstran izleme), sıralı modu etkinleştirin ve ikinci bir alım dizisi ekleyin. Dextran Cy5 floroforu uyarabilmek için IR lazer çizgisini 820 nm'de ayarlayın. Hyd2 algılama aralığını [650 - 744 nm] olarak değiştirin ve diğer dedektörleri devre dışı bırakın. Yığın alma modu arasında seçim yapın.
- İntravenöz olarak 3 mg / farede 100 μL Dekstran 70 KDa-TRITC (veya 500 KDa-Cy5) enjekte edin ve edinime başlayın.
- Alma işleminden sonra, veri kümesini uygun klasöre kaydedin.
NOT: Bu sayısız adım sırasında, farenin solunum frekansını ve sıcaklığını sık sık izleyin ve gerekirse izofluran akışını ayarlayın. İdeal olarak, sıcaklık, EKG ve solunum hızı kaydedilebilir ve deneyin meta verileri olarak dahil edilebilir.
4. Fare kurtarma
- Görüntüleme oturumu tamamlandıktan sonra, kayıt yazılımı içindeki HyDs dedektörünü devre dışı bırakın ve fare ısıtma kutusunu (37 °C) açın. Mikroskop kafesini açın, objektifi kaldırın ve rektal probu fareden çıkarın. Ardından, kafa sabitleme implantının kırlangıç kuyruğunu sabitleme tutucusundan yavaşça kaydırın ve fareyi mikroskobun stereotaksik maskesinden ısı yastığı üzerindeki ameliyat maskesine hareket ettirin.
- Mikroskop altında izofluran enjeksiyonunu kapatın ve ısı yastığını kapatın.
- Su bazlı jeli veya PBS'yi steril bir çubukla farenin kafatasından nazikçe çıkarın.
- Daha önce tarif edildiği gibi, görüntüleme seansları arasında kafatası nemini korumak için intrasite jeli ekleyin13.
- Kafa implantının görüntüleme alanını özel kapakla kapatın ve vida ile dikkatlice sabitleyin.
- Fareyi 37 °C'deki ısıtma kutusuna koyun ve uyanana kadar bekleyin. Fareyi hayvan tesisine getirin ve hidrojel ve zenginleştirme içeren temiz bir kafese koyun. Herhangi bir ağrı veya enfeksiyon belirtisini tespit etmek için hayvanları her gün izleyin, bu durumda Buprecare'i günlük olarak uygulayın. Kalvarial nemi korumak için, intrasite jeli haftada 2 kez değiştirin.
NOT: Karton barınakları ve yuvalama malzemeleri olan yüksek bir kafes seçin ve fareleri ayrı kafeslere koyduğunuzdan emin olun.
5. Boyuna satın almalar
NOT: Farenin görüntüsü sonraki günlerde tekrar görüntülenebilir. Bununla birlikte, tekrarlanan anestezinin göz kuruluğu veya aşırı yorgunluk gibi istenmeyen etkilerinin yanı sıra solunum sıkıntısı ve hipotermi gibi istenmeyen etkilerinden kaçınmak için haftada üçten fazla görüntüleme seansını tekrarlamadığınızdan emin olun.
- Kafa tutucusu takılı bir fareyi yeniden görüntülemek için adım 2.2'yi izleyin ve işlem sırasında kuruluğu önlemek için farenin gözlerine küçük bir damla oftalmik jel damlatın.
- Genel bakış görüntüsünü elde etmek için bölüm 3'ü adım 3.16'ya kadar izleyin.
NOT: Tutucu pozisyonunun yüksekliğini veya açısını değiştirmek zorunda kalmadan baş titanyum implantı kullanmak, genel ilgi alanını bulmayı çok kolaylaştırır. - Gerekirse, açık görüntü ve hizalama modülünü kullanarak önceki ve yeni görüntüleri yeniden hizalayın.
- Konumları orijinal yerlerinde işaretlemek için adım 3.17'deki ekran yakalama görüntüsünü açın.
NOT: SHG kontrastının kullanılması, özellikle kan damarlarının ve GFP'yi ifade eden ilişkili hücrelerin yeniden şekillenmesini beklerken çok yararlıdır. - Z-yığınlarını ve zaman aralıklarını 3.18-3.22 adımlarında açıklanan şekilde elde edin.
6. Vasküler parametre ölçümü
- Vasküler parametreler
- Yazılım ile oluşturulan görüntüleri (.lif dosyaları) IMARIS'te açmak için önce Dosya Dönüştürücü ile ".ims" formatına dönüştürün. IMARIS ile ".ims" dosyasını açın, meta verileri (X, Y, Z ölçekleri) kontrol edin ve Filament modülünü seçin. Otomatik oluşturmayı atla'yı seçin, manuel olarak düzenleyin.
- Filament oluşturma sırasında daha iyi bir görselleştirme için Ayarlar'a (yaprak sembolü) gidin, Stilde Çizgi'yi seçin ve piksel sayısını varsayılan değerde (1) bırakın. Başlangıç Noktası, Dal noktaları ve Terminal noktaları dahil olmak üzere dendritleri göster kutularını işaretleyin. Sırtı Göster'in işaretini kaldırın.
- Çizim (fırça sembolü) altında, Otomatik Yol Yöntemi'ni; çap olarak 5 μm'yi ve kap ile ilişkili kanal kaynağını (bu durumda TRITC-Dextran) seçin. Son olarak, otomatik merkez ve otomatik çapr'yi işaretleyin.
- Dalın başlangıç noktasını seçmek için shift + sağ fare tıklamasını ve bir dalın bitiş noktasını seçmek için shift + sol tıklamayı kullanarak filamentleri çizmeye başlayın.
NOT: Başlangıç noktası açık mavi, dallanma noktaları kırmızı veya koyu mavi ve bitiş noktaları yeşil renktedir. - Çizim sırasında filamentin doğru çapını ayarlamak için farenin kaydırma düğmesini kullanın.
- Farklı bağlantı noktalarına sahip iki filamenti birleştirmek için, aralarında yeni bir başlangıç noktası oluşturun ve her bir uç noktada bağlayın.
NOT: Böylece, dallanma noktalarında yeşil terminal noktaları görünür. - Vasküler ağaç oluşturulduktan sonra ayarlara geri dönün ve başlangıç, dallanma ve bitiş noktalarının sayılarının doğru olduğundan emin olun. Çapları görselleştirmek ve görünümlerini doğrulamak için koniyi seçin.
- Bir filament çapı (veya bağlantısı) yanlış görünüyorsa, Düzenle'ye (kalem sembolü) gidin, sağ tıklama ile çıkarılacak filamenti seçin ve Sil'e tıklayın. Fare kaydırma düğmesi ile filament üzerindeki çapı ayarlayarak filamenti yeniden çizin.
- Oluşturulan tüm istatistik verilerini çıkarmak ve kaydetmek için, İstatistik simgesine tıklayın | tüm istatistikleri dosyaya aktar- (ekranın altındaki birden çok disket simgesi).
NOT: Damarlara karşılık gelmeyen potansiyel olarak anormal filamentleri önlemek için, istatistiksel analize yalnızca 20 μm'den daha uzun filamentler dahil edildi.
- Sızıntı miktarı ölçümü
NOT: Yazılım (.lif dosyası) ile oluşturulan görüntüleri IMARIS'te açmak için öncelikle Dosya Dönüştürücü ile ".ims" formatına dönüştürün.- Aynı zaman serisinde dekstran enjeksiyonundan önce ve sonra çekilen görüntüleri birleştirmek için Aşma moduna gidin, hem ilk görüntüye tıklayın (Tctrl , dekstran enjeksiyonundan önce) hem de timelapse görüntüye (zaman 1, 60 dakika) tıklayarak açın ve Düzenle'ye tıklayarak birleştirin ve Zaman Noktaları ekleyin.
NOT: Nihai 3D sapmayı düzeltmek için, Fiji ve IMARIS arasındaki köprü işlevini kullanarak 6.2.2-6.2.7 adımlarını izleyin. Fiji'ye aşağıdaki eklentileri yükleyin: "IMARIS_Bridge96.jar" ve "IMARISBridgeUtils.jar". 3D drift Kaydı, "StackReg Pluging" (Fiji'de zaten mevcut) kullanılarak gerçekleştirilir. Gerekli değilse, adım 6.2.8'e gidin - 3D sapma düzeltmesi yapmak için, Eklentiler | İMARIS | IMARIS'ten görüntü.
- Fiji'de Eklentiler | Kayıt | Doğru 3D kayma.
- Görünen yeni pencerelerde, kayıt için uygun kanalı seçin.
NOT: Bu durumda Nestin-GFP idi, ancak hareketsiz nesneleri ve yüksek sinyal-arka plan oranını vurgulayan herhangi bir kanal olabilir. - Küçük sapmaların algılanmasını geliştirmek için Çok zamanlı ölçek hesaplaması, Alt piksel kayması düzeltmesi ve Kenar görüntüleri geliştir'i seçin ve diğer ayarları varsayılan olarak bırakın.
- Düzeltilen görüntüyü IMARIS ile köprülemek için onu seçin ve Eklentiler | İMARIS | IMARIS'e görüntü.
- Dosya | Farklı kaydet'i tıklayın.
- Alınan tüm kanalları görselleştirmek için Düzenle | Ekran ayarını göster. Dekstran kanalını ve zaman 1'i seçin (ekranın altındaki kare 2 ).
- Yeni yüzey ekle onay kutusunu (mavi nesne) işaretleyerek 1. zaman noktasında vasküler lümeni tanımlayan yeni bir yüzey oluşturun
- Yüzey 1'de Özellikler'e gidin ve Algoritma Ayarları'ndaki tüm parametrelerin işaretini kaldırın. Sonraki adıma tıklayın (mavi ok)
- Kaynak kanal altında vasküler kanalı (bu durumda dekstran) seçin ve Düzgün ve arka plan çıkarma'yı işaretleyin. Diğer tüm parametreleri varsayılan değerlerde bırakın. Sonraki adıma tıklayın (mavi ok).
- Eşik değerini, tüm pozitif alanların kalınlığı ve kapsama alanı açısından yüzey görünümüne göre ayarlayın. Sonraki adıma tıklayın (mavi ok).
- Varsayılan olarak filtreyi kullanarak spesifik olmayan yüzeyleri (çoğunlukla küçük noktalar) hariç tutun Voksel Sayısı. Son adıma tıklayın (yeşil ok).
- Gerekirse, Parametreleri ayarlama bölümündeki düzenle'ye (kalem simgesi) tıklayarak yüzeyi manuel olarak ayarlamaya devam edin. Kaldırılacak bir nesneyi seçmek için üzerine sol tıklayın ve sil'i seçerek silin. Silinecek nesne başka bir nesneyle harmanlanmışsa, ikisi arasında shift + sola tıklayarak ve Yüzeyi Kes'i seçerek yüzeyin iki ayrı bölümünün bağlantısını kesin. Bu adımı gerektiği kadar tekrarlayın.
- Son olarak, seçim modunu (sağdaki hedef simgesi) kullanarak tüm segmentleri birleştirin ve tüm nesneleri kurtarmak için control + scroll tuşlarına basın. Tümü seçildiğinde, sol tıklayın ve birleştir'i tıklayın.
- Referans yüzeyini oluşturmak için, bu yüzeyi diğer zaman noktalarına kopyalayın. Genel yüzeyi seçin ve Çoğalt'a tıklayarak çoğaltın ve İntravasküler olarak yeniden adlandırın.
- Yüzeyi seçin İntravasküler ve tıklayın Tüm Zaman Noktalarına Çoğalt.
- İç (IN) ve ekstravasküler (OUT) alanları ayırt etmek için dekstran sinyalini bölün. Tüm zaman noktaları için bir IN channeI oluşturmak için, yüzeye tıklayın İntravasküler | Düzenle (kalem düğmesi) | Tümünü Maskele.
- Kanal Seçimi'nde uygun kanalı seçin ve maskeyi uygulamadan önce kanalı çoğalt'ı işaretleyin. Maske Ayarları'nda, vokseller dış yüzeyi 0 olarak ayarlayarak yalnızca Sabit iç/dış seçeneğini işaretleyin. Son olarak, işaretleyin Ayrıca Tüm zaman noktalarına uygula.
- Görüntü Ayarı'nda, varsayılan olarak adı maskelenmiş olarak yeni bir kanal oluşturulur. olarak yeniden adlandırın.
- Tüm zaman noktaları için kanal ÇIKIŞI oluşturmak için 6.2.18-6.2.20 adımlarını tekrarlayın, ancak Yüzey içindeki vokselleri 0 olarak ayarla'yı seçin. Bu yeni kanalı OUT olarak yeniden adlandırın.
- İstatistiksel verileri çıkarmak için İstatistik simgesine tıklayın | Tüm İstatistikleri Dosyaya Aktar (ekranın altındaki birden fazla Disket simgesi)
- Sızıntıyı analiz etmek için, her zaman noktası için dış yoğunluk toplamı kanalını içerideki yoğunluk toplamı kanalına bölün.
- Aynı zaman serisinde dekstran enjeksiyonundan önce ve sonra çekilen görüntüleri birleştirmek için Aşma moduna gidin, hem ilk görüntüye tıklayın (Tctrl , dekstran enjeksiyonundan önce) hem de timelapse görüntüye (zaman 1, 60 dakika) tıklayarak açın ve Düzenle'ye tıklayarak birleştirin ve Zaman Noktaları ekleyin.
Sonuçlar
Şekil 1 ve Şekil 2'de, CAD modeli, kafatasının anatomik yapısını takip etmek ve mikroskop aşamasına sıkıca tutunabilen hafif ve biyouyumlu bir cihaz sağlamak için tasarlanmış, taranmış bir fare kafatası üzerine yerleştirilmiş bir titanyum kafa sabitleme implantının gösterilmiştir. Bu adım adım protokolü izleyerek, implant fare kafatasına stabil bir şekilde tutturulur ve kırlangıç kuyruğu ile mikroskop tutucusuna sıkıca sabitlenebilir, bu da zaman içinde sıvı tutma ve intravital gözlem için düz bir görüntüleme alanı sağlar. Yaranın herhangi bir hasarını veya enfeksiyonunu en aza indirmek için bir kapakla kapatılabilir ve aynı doku alanının haftalarca tekrar tekrar görüntülenmesine izin verir. Uyandıktan sonra, kafa implantı takan fare serbestçe dolaşabilir, beslenebilir ve düzenli bir rutine sahip olabilir.
Şekil 3, arterioller, geçiş kılcal damarları ve sinüzoidler dahil olmak üzere heterojen kılcal damarlardan oluşan kalvarial BM damar sisteminin bir döşeme taraması görünümünü göstermektedir. Damarlar, kemik yüzeyi ve perivasküler mezenkimal hücrelerle yakın temas halinde olan karmaşık bir doku mikro ortamına gömülür. Lösemi gelişimi sırasında, tek izole lösemik hücreler, BM mikroçevresi içinde damarların yakınında tespit edilebilir ve aşılanmaları zamanla artar ve hastalığın geç evrelerinde kalvariyi doldurur.
Şekil 4, bu protokol ile elde edilen görüntülerin istatistiksel yöntemlerle analiz edilebilen nicel verileri nasıl sağlayabileceğini göstermektedir. IMARIS filament aracı ile damarların nasıl segmentlere ayrılacağını ve vasküler fragmanların uzunluğunun ve çapının yanı sıra düzlüklerinin nasıl ölçüleceğini gösteriyoruz. Bu parametrelerin korelasyonu da değerlendirilebilir.
Şekil 5, 4, 7 ve 10. günlerde AML ilerlemesi sırasında kalvarial BM'nin iki farklı pozisyonunun uzunlamasına görüntüleme edinimini göstermektedir ve 10. gün, akış sitometrisi ile ölçüldüğü gibi, BM'nin lösemik hücrelerle ~% 50 aşılanması ile ilişkilidir (gösterilmemiştir). Önceden var olan damarların boyutunun önemli bir şekilde yeniden şekillenmesinin yanı sıra, yerel kemik kaybı ile ilişkili belirli alanlarda yeni damarların oluşumunu gözlemleyebiliriz.
Son olarak, Şekil 6'da, farklı vasküler bariyerlerin zaman içinde bir floresan boyayı tutma yeteneğini gösteren hızlandırılmış görüntüleme ile vasküler geçirgenliğin dinamik bir parametre olarak nasıl ölçülebileceğini gösteriyoruz.
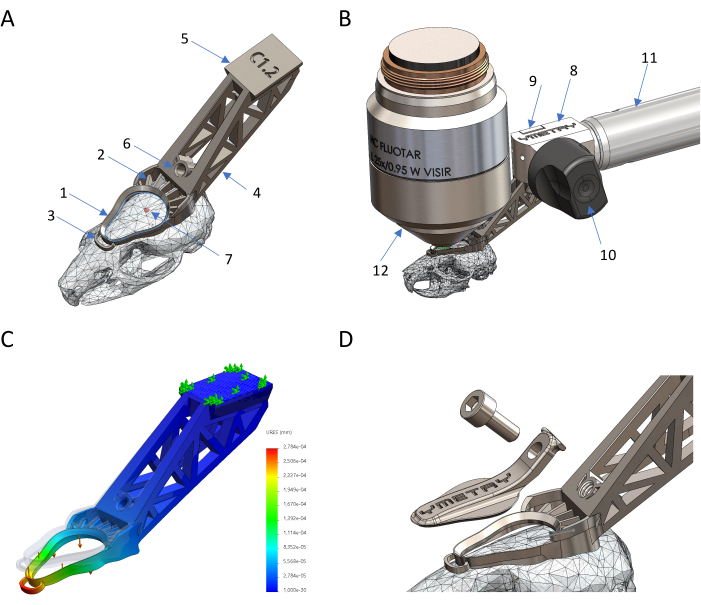
Şekil 1: Titanyum bazlı biyouyumlu kafa tutucunun tasarımı ve üretimi. (A) İmplantın yerinde parçaları: 1 gözlem halkası, 2 çimentolama özelliği, 3 stabilize ankraj, 4 kuyruk, 5 kırlangıç kuyruğu, 6 dişli delik, 7 Bregma. (B) Kafa implantının tutucuya bağlantısı: 8 sabitleme gövdesi, 9 kelepçe, 10 eksantrik kol, 11 yapı, 12 mikroskop objektifi. (C) Maksimum yer değiştirmenin 0,04 N kuvvete karşı 0,23 μm olduğu FEM simülasyonu ile implantın yüke karşı deformasyonu. (D) Kapağın ve vidasının korunması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: İntravital görüntüleme için farenin hazırlanması. (A) Görüntülemeden önce cerrahi olarak maruz kalan baş implantının ve görüntüleme alanının görünümü. (B) Fare kafatasına sıkıca tutturulmuş kafa implantı. (C) Fare, kafa implantı üzerindeki kapalı kapak ile kurtarma kafesinde uyanık. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
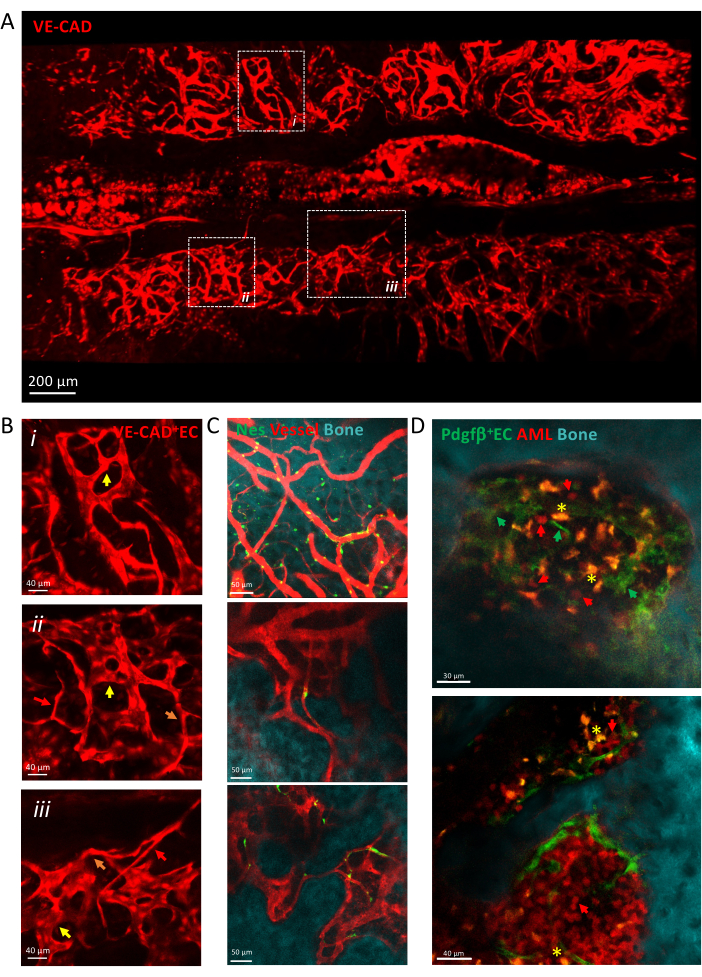
Şekil 3: Calvaria vaskülatürünün intravital görüntülemesi. (A) cdh5-DSRED ile etiketlenmiş calvaria vaskülatürünün karo tarama görünümünün z-projeksiyonu. (B) Oklarla, arteriollerle kırmızı oklarla, geçiş kılcal damarları turuncu oklarla, sinüzoidler sarı oklarla gösterilen farklı damar türlerini tanımlamak için tasvir edilen alanları yakınlaştırın. (i) ve (ii) X μm dokusunun z-projeksiyonları; (iii) tek dilim. (C) Kemik yüzeyini (SHG), perivasküler hücreleri (nes-GFP +) ve vasküler lümeni (dekstran-TRITC) gösteren, BM damarlarının çeşitli görüş alanlarının tek dilimleri. (D) AML ilerlemesi ile ilişkili vasküler niş. AML gelişiminin erken (üst) ve geç (alt) zaman noktalarının temsili dilimleri. MLL-AF9 lösemi tdTOMATO (kırmızı oklar) ile etiketlenirken, damarlar pdgfb-GFP (yeşil oklar), kemik yüzeyi SHG ile ve makrofajlar sarı (otofloresan, sarı yıldız) ile etiketlenir. Ölçek çubukları = 200 μm (A), 40 μm (B,D-alt panel), 50 μm (C). Kısaltmalar: BM = kemik iliği; GFP = yeşil floresan proteini; AML = akut miyeloid lösemi; EC= Endotel hücreleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
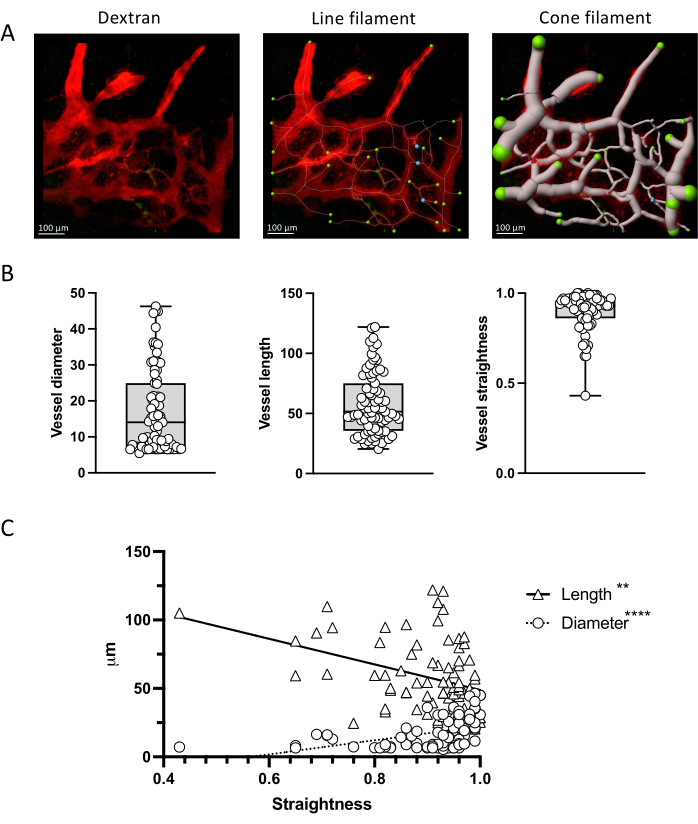
Şekil 4: Vasküler parametre ölçümü. (A) TRITC-dekstran ile işaretlenmiş kemik iliği damarlarının temsili bir z-projeksiyonunda IMARIS filament aracı ile vasküler parametrelerin ölçümü. Çizgi ve koni gösterimleri gösterilir. (B) A'da gösterilen resimdeki kap parametrelerinin miktarının belirlenmesi. (C) Damar düzlüğü ve uzunluğu arasında zıt bir korelasyon gösteren vasküler parametreler arasındaki korelasyon (negatif, Spearman r = -3523; p < 0.0001; R2 = 0.2102) vs çap (pozitif; Mızrakçı r = 0.4110; p < 0.0001; R2 = 0.1299). Ölçek çubukları = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
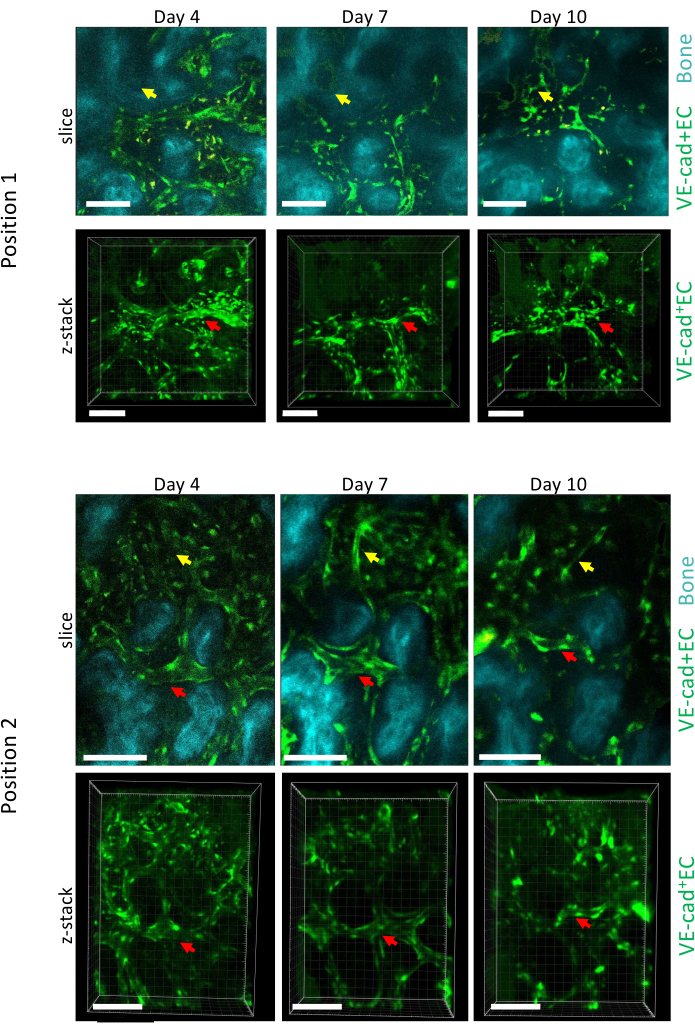
Şekil 5: AML gelişimi boyunca kalvaria BM'nin iki farklı pozisyonunun boylamsal görüntülemesi. Damarları döşeyen endotel hücreleri cdh5-GFP, kemik yüzeyi SHG ve makrofajlar sarı (otofloresan) ile işaretlenir. Önceden var olan gemilerin yeniden modellenmesi (kırmızı oklar) ve yeni damarların oluşumu (sarı oklar) gösterilmiştir. Ölçek çubukları = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
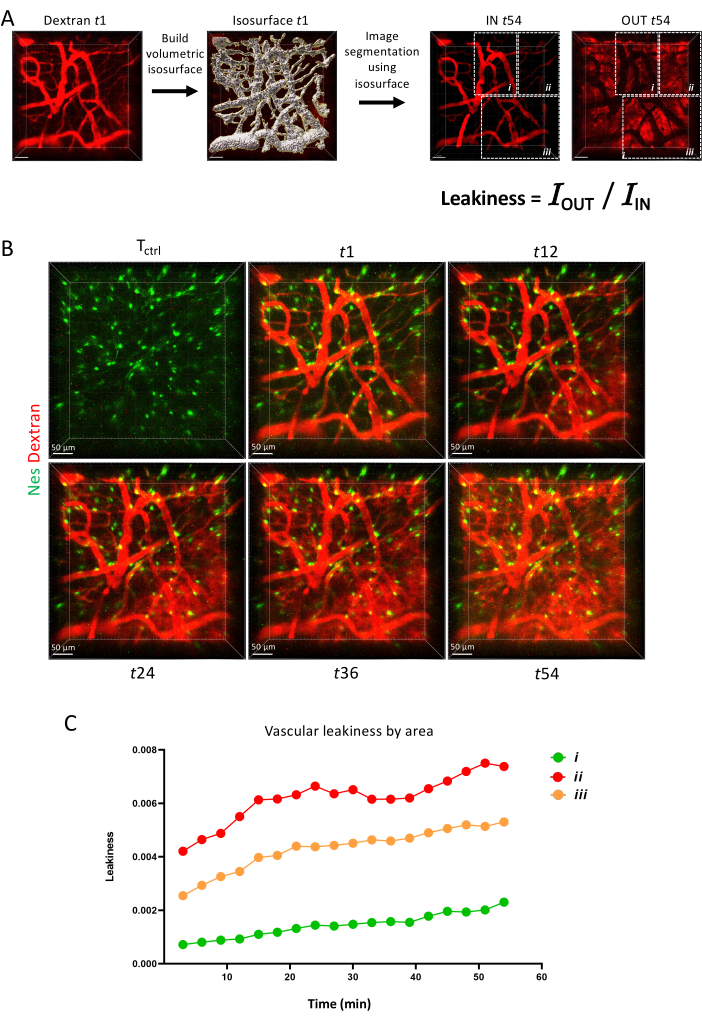
Şekil 6: Vasküler geçirgenlik. (A) IMARIS yüzey aracı ile vasküler geçirgenlik ölçümünün şemaları. (B) 1 saat boyunca uzunlamasına görüntülenen aynı alanın Z-projeksiyonu. (C) A'da gösterildiği gibi alanlar içindeki vasküler geçirgenliğin ölçülmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil S1: Hazırlanmış kafatası. Medyan düzlemde, kalvariaya teğet bir eksen oluşturun, ardından hazırlanan kafatasını kaydedin. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S2: 2 mm aralıklı planlar. Kafatası boyunca eşit aralıklı düzlemlerden (2 mm aralıklı) oluşan bir set nasıl oluşturulur. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S3: Gözlemlenebilir yüzey konturu. Kalvarial düzlemde bir çizim oluşturun ve AP 0.0'da AP +6.5 ila -2, 6 mm genişliğinde armut şeklinde bir eğri oluşturun. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S4: Gözlem vindow. Kalvarial düzlemde bir çizim oluşturun ve Gözlem penceresine bağlanarak 0,5 mm kalınlığında bir C şekli çizin. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S5: Yeni etüde tıklayın. Simülasyon sekmesine gidin (görünüyorsa) veya Simülasyon | Ders çalışma. Etüt iletişim kutusunda, etüt türü olarak Statik'i seçin. Yeni etüdü oluşturmak için Tamam'ı tıklatın. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S6: Ağ oluşturmak için sağ tıklayın. Yüksek gerilme veya deformasyonun beklendiği alanlarda ağı rafine edin. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
İntravital mikroskopinin birincil gücü, geleneksel histolojik ve ex vivo görüntüleme yöntemlerinin sınırlamalarının üstesinden gelerek, dinamik hücresel süreçleri kendi doğal ortamlarında gerçek zamanlı olarak yakalama yeteneğidir. Araştırmacılar, bu protokolde tarif edildiği gibi floresan etiketleme ile birleştirilmiş gelişmiş görüntüleme tekniklerini kullanarak kalvarial BM'yi doğrudan gözlemleyerek, sadece vasküler fonksiyonel parametreleri 8,14 değil, aynı zamanda lösemik hücre aşılaması ve göçü 6,15, proliferasyon ve metabolik aktivite16,17 gibi uzunlamasına süreçleri de inceleyebilirler fizyolojik alaka düzeyini korumak ve doku fiksasyonu ve işleme ile ilişkili artefaktlardan kaçınmak.
BM kalvaria intravital görüntülemenin alternatif kemik bölgelerine göre avantajları arasında kolay erişilebilirlik, kemik hasarı olmadan daha iyi görselleştirmeye izin veren kafatası kemiğinin şeffaflığı, doku hareket artefaktlarını en aza indiren kalvaryum kemiğinin stabilitesi ve farklı deney grupları arasında karşılaştırmayı kolaylaştıran deney hayvanları arasında tekrarlanabilirlik yer alır. Hayvanları kurtarma ve uzunlamasına görüntüleme yapma imkanı, bir çalışmada kullanılan hayvan sayısını azaltmaya da olanak tanır. Kafatası damarı büyüme modellerinde ve bunun sonucunda osteogenezdesuşa özgü farklılıklar gözlendiğinden18, mükemmel anatomik uyumluluk ve istenen görüntüleme bölgesine erişim sağlamak için istenen fare türü için spesifik görüntüleme implantını tasarlarken bunu dikkate almanın önemli olduğunu belirtmekte fayda var.
Bahsedilmesi gereken bir diğer önemli nokta, son yıllara kadar yeterince araştırılmamış bir soru olan diğer kemiklere kıyasla kalvarial BM içindeki vasküler ve hematopoietik özelliklerdeki potansiyel farklılıklardır. Yeni çalışmalar, hematopoez, kemik ve vasküler yapı ve fonksiyon 19,20,21,22,23 ve nörolojik patolojilere yanıt açısından diğer kemiklerden farklı olan kalvarial BM ile farklı kemikler için lokalize fonksiyonlar önermektedir24. Spesifik kalvaria bulgularını genelleştirmeden önce bu farklılıkların daha fazla araştırılması ve dikkate alınması gerekir.
Bir görüntüleme implantının tasarımı ve yapımı, malzeme seçiminden başlayarak bu deney düzeneği için önemli bir adımdır. Biyouyumlu implantlar, doku mühendisliği ve rejeneratif tıptan ilaç dağıtım sistemlerine ve in vivo izleme cihazlarına kadar çok çeşitli uygulamaları kolaylaştırarak biyomedikal araştırmalarda çok önemli bir rol oynamaktadır. İntravital görüntüleme için uyarlanmış bir kafa implantı için malzeme seçimi çok önemlidir. İdeal olarak, malzeme mükemmel biyouyumluluk, minimum esneklik ve genel stabilite sağlamak için uygun mekanik özellikler ve son olarak, iltihaplanmaya neden olmadan kafatasına entegre olma yeteneği sergilemelidir. Titanyum, biyolojik dokularla temas halinde advers reaksiyonların indüklenmesi olmaksızın hayvan vücudu içinde iyi tolere edilebilirliği ve ayrıca korozyona karşı direnci için idealdir ve vücut sıvılarına veya deneysel çözeltilere maruz kalsa bile uzun vadeli stabilite sağlar. Ayrıca mekanik mukavemeti onu deformasyona ve kırılmaya karşı dirençli kılar. Gücüne rağmen, titanyum nispeten düşük bir yoğunluğa sahiptir, bu da deney hayvanları ve araştırmacılar üzerindeki yükü en aza indiren hafif intravital görüntüleme cihazları ile sonuçlanır. Son olarak, üretimdeki çok yönlülüğü, intravital görüntüleme cihazlarının boyut, şekil ve işlevsellik gibi belirli deneysel gereksinimlere uyacak şekilde özelleştirilmesine olanak tanır.
Burada, özellikle SolidWorks olmak üzere yerleşik Sonlu Elemanlar Analizi (FEA) özelliklerine sahip parametrik modelleme CAD yazılımını kullanarak biyouyumlu bir kafa sabitleme implantı tasarladık. Bu yaklaşım, implantın yapısal ve mekansal gereksinimlerine yönelik hassas, yinelemeli ayarlamalar sağlayarak hem anatomik uyumluluk hem de mekanik esneklik sağlar. FreeCAD gibi ücretsiz alternatifler, benzer modelleme ve simülasyon işlevleri sunar. Tasarım süreci için birincil girdiler, fare kafatasının yüksek çözünürlüklü bir anatomik modelini, mikroskop objektifinin bir modelini ve birlikte implantın boyutlarını ve konfigürasyonunu bilgilendiren bir fiksasyon sistemi modelini içerir. Nihai çıktı, çoğu 3D baskı yazılımıyla uyumlu, tipik olarak STL veya STEP biçiminde, platformdan bağımsız bir ağ dosyasıdır.
İlk adım, in vivo mikro-CT taraması gibi yüksek çözünürlüklü görüntüleme teknikleri kullanılarak fare kafasının ayrıntılı anatomik özelliklerinin yakalanmasını içerir. Bu yaklaşım, kafatasının mikro yapılarını yakalayarak en yüksek anatomik ayrıntıyı ve doğruluğu sağlar. Hazırlanmış, Çıplak Bir Kafatasının 3D Taraması da bir seçenek olabilir. Lazer veya yapılandırılmış ışık tarayıcıları kullanan bu yöntem, hazırlanmış bir kafatası üzerinde yaygın olarak kullanılır ve mikro-BT'ye kıyasla daha az iç ayrıntıya sahip olsa da, doğru yüzey konturları sağlar. Aksi takdirde, anatomi modelleri açık kaynaklı yayınlardan ve veritabanlarından25 veya DigiMorph {https://www.digimorph.org/specimens/Mus_musculus/} indirilebilir. Uygun olsa da, bu modeller numuneye özgü ayrıntılardan yoksun olabilir, bu nedenle çalışmadaki belirli hayvan için gerçek Bregma-Lambda mesafesine ölçeklendirme gibi ayarlamalar sıklıkla gereklidir. Elde edilen veriler daha sonra farenin kafatasının hassas bir 3D modelini oluşturmak için kullanılır ve implant tasarımı için temel şablon olarak hizmet eder.
İmplantı kafatasına sabitlemek için, gözlem penceresi tarafından işgal edilmeyen kalan kafatası yüzeyini kaplayacak şekilde bir çimentolama yapısı tasarlanmıştır. Bu yapı, kritik anatomik özelliklerden kaçınırken sağlam bağlantı noktaları sağlamalıdır. Çimentolama yapısı, implantın altındaki çimentonun difüzyon yoluyla optimum polimerizasyonunu sağlamak için birden fazla açıklığa sahiptir. Ek olarak, çimentolama yapısının duvarları, çimentonun bu açılı duvarlara güvenli bir şekilde sabitlenmesini sağlayan küçük bir çekme açısına sahiptir. İmplantın ana gövdeden fiksasyon sistemine kadar uzanan kuyruğu tasarlanır. Bu bileşen, gözlem sırasında implantı hizalamak ve stabilize etmek için çok önemlidir ve tasarımı, mevcut alanı ve fare kafasının anatomik kısıtlamalarını dikkate almalıdır. Son olarak, implantın sabitleme sisteminden kolayca takılması ve çıkarılması için implant tasarımına bir kırlangıç kuyruğu mekanizması entegre edilmiştir. Bu özellik, tekrarlanan gözlemler sırasında implantın pratikliğini ve kullanılabilirliğini artırır. Kırlangıç kuyruğu mekanizması, tekrarlanan görüntüleme seansları için gözlemlenen dokuların kolay alınması için tekrarlanabilir fiksasyon sağlar.
Kalvarial BM'nin intravital mikroskopi görüntülemesini benimsemeyi düşünen okuyucular, bu yöntemin çalışmaları için uygun olup olmadığını belirlemek için araştırma hedeflerini ve deneysel gereksinimlerini dikkatlice değerlendirmelidir. İntravital mikroskopi, in vivo hematopoez, doku mikroçevresi regülasyonu ve vasküler dinamikler hakkında benzersiz bilgiler sunarken, aynı zamanda bazı teknik zorluklar ve sınırlamalar da sunar. Araştırmacılar, dikkatli deneysel tasarım, görüntüleme parametrelerinin optimizasyonu ve uygun kontrollerin kullanılması yoluyla bu zorlukları ele almaya hazır olmalıdır. Ek olarak, araştırmacılar özel görüntüleme ekipmanının mevcudiyetini, floresan etiketleme tekniklerinde uzmanlığı ve görüntü analizi için hesaplama kaynaklarını göz önünde bulundurmalıdır. Genel olarak, kalvarial BM'nin intravital mikroskopi görüntülemesi, hematopoez ve vasküler biyoloji anlayışımızı ilerletmek için muazzam bir potansiyele sahiptir ve BM mikro çevresinde meydana gelen dinamik süreçlere benzersiz bir pencere sunar.
Açıklamalar
Jozsua Fodor, YMETRY şirketinin kurucusudur (kayıt No 888312352). Diğer yazarların herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, IMAG'IC'nin tüm personeline ve Institut Cochin'deki Hayvan tesislerine mikroskopi deneyleri ve fare barınağı konusundaki destekleri için teşekkür eder. Tg(Nes-EGFP)33Enik ve Tg(Pdgfb-icre/ERT2)1Frut fareleri, Dr Bonnet'in (The Francis Crick Institute, Londra) nazik bir hediyesiydi. Tg(Cdh5-cre/ERT2)1Rha ve B6. Cg-Gt (ROSA) 26Sortm9 (CAG-tdTomato) Hze / J fareleri, Dr Rafii'nin (Weill Cornell Medicine, New York) nazik bir hediyesiydi. Açıklanan çalışma CNRS, INSERM ve Université de Paris Cite tarafından desteklenmiş ve ATIP-AVENIR, Fondation ARC pour la recherche sur le cancer (R19084KS - RSE20008KSA), Ville de Paris "Emergence" (R20192KK - RPH20192KKA), Laurette Fugain (R23197KK), Cancéropôle IDF (RPH23177KKA), INCA PLBIO (RPH21162KKA), Fondation de France (RAF23152KKA), Ligue contre le cancer (282273/807251), Institut du cancer Paris Carpem, Avrupa Hematoloji Derneği (RAK23130KKA) ve Avrupa Araştırma Konseyi ERC-STG (EEA24092KKA). IMAG'IC çekirdek tesisi, Ulusal Altyapı Fransa Biyogörüntüleme (hibe ANR-10-INBS-04) tarafından desteklenmektedir. Passaro laboratuvarı "Institut Hors Murs des Sciences Cardiovasculaires" ve "Paris Saint-Louis Lösemi Enstitüsü"ne bağlıdır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amira | Thermo ScientificTM | ||
| Anesthesia | Isoflurane 2% to 3% | ||
| Anesthesic mask (animal detection) | Minerve | ||
| Anesthesic unit | Minerve | ||
| B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze | Jackson laboratories | MGI:3809523 | |
| CalvariaVue | Ymetry | https://ymetry.com/site/head-fixation-implants/44-mouse-head-fixation-implant-for-calvaria.html | |
| Dental cement | Kemdent | SUN527 | |
| Dextran 500 kDa-Cy5 | Tebu-bio | DX500-S5-1 | 3 mg/mouse |
| Dextran 70 kDa-TRITC | Sigma | T1162 | 3 mg/mouse |
| Disinfectant | MP-Labo | Dermidine-60ml | |
| Electric razor | Aescular | Isis | |
| Eye gel | Ocry-gel | 10g | |
| Fiji | https://imagej.net/software/fiji/downloads | v 17 May 30 | |
| Fiji plugings to bridge with Imaris | https://imagej.net/software/fiji/downloads | Imaris_Bridge96.jar ; ImarisBridgeUtils.jar | |
| Heating box | Datesand | Thermacage | |
| Heating pad for surgery | Minerve | ||
| Imaging heating pad & rectal probe | F. Haer | ||
| Imaris v9.6.0 | Oxford instruments | ||
| Intrasite gel | Chinoxia | 2390766 | |
| LAS AF Software | Leica | LAS X 3.5.7.23225 | |
| Medication | Buprecare, 0.01 mg/kg | ||
| Objective HCX IRAPO L 25x/0.95 WATER | Leica | 506374 | |
| Saline buffer (PBS 1x) | Sigma | P4417 | Sterilize by autoclave |
| SP8 DIVE FALCON Multiphoton Microscope | Leica | ||
| Stereotoxic mask | Minerve | 1201261 | |
| Sterilizator beads | Sigma | Z742555 | |
| Surgery tools | Moria | 4877A; 2183 | |
| Survival blanket | SECURIMED | 11006 | |
| Swabs / Tissues | Sterilize by autoclave | ||
| Syringe 1 mL 26 G | BD Plastipak | 305501 | |
| Temperature controller | F. Haer | 40-90-5D-02 | |
| Tg(Nes-EGFP)33Enik mice | Jackson laboratories | MGI:5523870 | |
| Tg(Pdgfb-icre/ERT2)1Frut mice | Jackson laboratories | MGI:3793852 | |
| Tg(Cdh5-cre/ERT2)1Rha mice | Jackson laboratories | MGI:3848982 | |
| Ultrasound gel | Parker laboratories | Aquasonic 100 |
Referanslar
- Lo Celso, C., et al. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457 (7225), 92-96 (2009).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Christodoulou, C., et al. Live-animal imaging of native haematopoietic stem and progenitor cells. Nature. 578 (7794), 278-283 (2020).
- Upadhaya, S., et al. Intravital imaging reveals motility of adult hematopoietic stem cells in the bone marrow niche. Cell Stem Cell. 27 (2), 336-345.e4 (2020).
- Hawkins, E. D., et al. T-cell acute leukaemia exhibits dynamic interactions with bone marrow microenvironments. Nature. 538 (7626), 518-522 (2016).
- Duarte, D., et al. Defining the in vivo characteristics of acute myeloid leukemia cells behavior by intravital imaging. Immunol Cell Biol. 97 (2), 229-235 (2019).
- Passaro, D., et al. Increased vascular permeability in the bone marrow microenvironment contributes to disease progression and drug response in acute myeloid leukemia. Cancer Cell. 32 (3), 324-341.e6 (2017).
- Jia, Y., et al. FLT3 inhibitors upregulate CXCR4 and E-selectin ligands via ERK suppression in AML cells and CXCR4/E-selectin inhibition enhances anti-leukemia efficacy of FLT3-targeted therapy in AML. Leukemia. 37 (6), 1379-1383 (2023).
- Pendleton, E. G., Tehrani, K. F., Barrow, R. P., Mortensen, L. J. Second harmonic generation characterization of collagen in whole bone. Biomed Opt Express. 11 (8), 4379-4396 (2020).
- Dispositif de liaison d'un animal de laboratoire à au moins un système d'expérimentation, et procédé de fixation d'un tel dispositif. France patent. , WO/2021/123449 (2021).
- Horton, S. J., et al. Acute myeloid leukemia induced by MLL-ENL is cured by oncogene ablation despite acquisition of complex genetic abnormalities. Blood. 113 (20), 4922-4929 (2009).
- Scott, M. K., Akinduro, O., Lo Celso, C. In vivo 4-dimensional tracking of hematopoietic stem and progenitor cells in adult mouse calvarial bone marrow. J Vis Exp. (91), e51683(2014).
- Jung, Y., et al. Intravital imaging of mouse bone marrow: Hemodynamics and vascular permeability. Methods Mol Biol. 1763, 11-22 (2018).
- Le, V. H., et al. In vivo longitudinal visualization of bone marrow engraftment process in mouse calvaria using two-photon microscopy. Sci Rep. 7, 44097(2017).
- Spencer, J. A., et al. Direct measurement of local oxygen concentration in the bone marrow of live animals. Nature. 508 (7495), 269-273 (2014).
- Yang, M., Mahanty, A., Jin, C., Wong, A. N. N., Yoo, J. S. Label-free metabolic imaging for sensitive and robust monitoring of anti-CD47 immunotherapy response in triple-negative breast cancer. J Immunother Cancer. 10 (9), e005199(2022).
- Li, W., et al. Tracking strain-specific morphogenesis and angiogenesis of murine calvaria with large-scale optoacoustic and Ultrasound Microscopy. J Bone Miner Res. 37 (5), 1032-1043 (2022).
- Lassailly, F., Foster, K., Lopez-Onieva, L., Currie, E., Bonnet, D. Multimodal imaging reveals structural and functional heterogeneity in different bone marrow compartments: functional implications on hematopoietic stem cells. Blood. 122 (10), 1730-1740 (2013).
- Rindone, A. N., et al. Quantitative 3D imaging of the cranial microvascular environment at single-cell resolution. Nat Commun. 12 (1), 6219(2021).
- Mills, W. A. 3rd, Coburn, M. A., Eyo, U. B. The emergence of the calvarial hematopoietic niche in health and disease. Immunol Rev. 311 (1), 26-38 (2022).
- Bixel, M. G., et al. Angiogenesis is uncoupled from osteogenesis during calvarial bone regeneration. Nat Commun. 15 (1), 4575(2024).
- Koh, B. I., et al. Adult skull bone marrow is an expanding and resilient haematopoietic reservoir. Nature. 636 (8041), 172-181 (2024).
- Kolabas, Z. I., et al. Distinct molecular profiles of skull bone marrow in health and neurological disorders. Cell. 186 (17), 3706-3725.e9 (2023).
- Rosenhain, S., et al. A preclinical micro-computed tomography database including 3D whole body organ segmentations. Sci Data. 5, 180294(2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır