A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Assay ההתנהגות כדי למדוד את התגובה של דג הזברה לשינויים לעוצמות אור
In This Article
Summary
פיתחנו את תגובת חזותית-Motor כדי לכמת את הפלט המוטורי של דג הזברה הזחל בתגובה במרווחים ו decrements אור. בחנו גם מוטנטים דג הזברה חזון, כולל לא optokinetic (NRC) מוטנטים בתגובה, אשר נחשבו עיוור לחלוטין, כאשר נבדק על ידי assay אחר חזון, רפלקס optokinetic.
Abstract
רפלקס optokinetic (OKR) היא של Visual Basic רפלקס הוצגו על ידי רוב בעלי החוליות ואת ממלא תפקיד חשוב בייצוב עין יחסית למקום חזותית. עם זאת, OKR מחייב חיה לזהות פסים נעים יתכן כי דגים אינם תערוכה OKR לא יכול להיות עיוור לחלוטין. דג הזברה מוטציה אחת, תשובה ג optokinetic (NRC) אין OKR בכל תנאי אור נבדק נמסר להיות עיוור לחלוטין. בעבר הראינו כי OFF-הגנגליון פעילות התא יכול להיות מוקלט מוטנטים אלו. כדי לקבוע אם דגים מוטנטים עם OKR אין כמו מוטציה NRC יכול לזהות במרווחים של אור פשוט decrements פיתחנו את assay חזותי מנוע התנהגותיות (VMR). ב assay זה, זחלים דג הזברה יחיד ממוקמים היטב בכל צלחת 96-היטב המאפשר ניטור סימולטני של הזחלים באמצעות מערכת אוטומטית, מעקב וידאו. התגובות של תנועה של כל זחל עד 30 דקות אור ו -30 דקות את האור הוקלטו לכימות. דגים WT יש עלייה קצרה של פעילות מוטורית על האורות דולקים, המכונה תגובת בהלה, ואחריו לחזור נמוכה מאשר פעילות המחקר, שנקרא להקפיא. דגים WT גם להגביר את הפעילות של תנועה חדה שלהם מיד לאחר כיבוי האורות, ורק בהדרגה (מעל מספר דקות) לחזור לפעילות בסיסית של תנועה. מוטנטים NRC להגיב באופן דומה אור OFF כמו דג WT, אבל התערוכה ירידה קלה בפעילות הממוצעת שלהם לעומת דגים WT. פעילות מוטורית בתגובה אור ב NRC מוטנטים מתעכב ועכור. יש זמן עלייה איטית של התגובה NRC מוטציה לאור ON לעומת אור WT על התגובה. תוצאות המחקר מראות כי דגים NRC אינם עיוורים לגמרי. מכיוון teleosts יכול לזהות אור דרך אי - רשתית רקמות, אנו אישר כי תגובות התנהגותיות מיידית אור עוצמת השינויים דורשים עיניים שלם באמצעות (chk) מוטנטים chokh, אשר לחלוטין חוסר העיניים החל מהשלבים המוקדמים של הפיתוח. ב assay VMR שלנו, מוטנטים chk התערוכה אין תגובת בהלה לאור או כבוי, מראה כי בעיני לרוחב לפשר התנהגות זו. Assay VMR המתואר כאן משלים את assay ומבוססת OKR, אשר אינו לבחון את היכולת של הזחלים דג הזברה להגיב לשינויים בעוצמות אור. בנוסף, אוטומציה של assay VMR ניתנת ההקרנה תפוקה גבוהה עבור פגמים עוצמת אור מונע תגובות חזותית.
Protocol
פרוטוקול זה מתאר את הצעדים כדי לבצע את תגובת חזותי מוטורי זחלים של דג הזברה כדי במרווחים ו decrements אור במעבדה שלך. דג הזברה הם מערכת מודל נהדר עבור מחקרים התנהגותיים. הם קל לשמור, הם גדלים המצמד גדולים, הם מתפתחים מהר. לדוגמה, עיניו של דג הזברה הזחלים מגיבים לאור יום 3 הפיתוח בו בזמן הם מפגינים תגובת בהלה.
חלק 1: ציפוי דגים בודדים לתוך צלחת 96 היטב
- לגדל זחלים WT תחת מחזור אפל / אור 28 ° C עד הפריה ימים לפחות 4 פוסט (DPF). אור אופייני שלנו: כהה מחזור הוא 14 שעות של האורות החל מהשעה 09:00, ו - 10 שעות של האורות, החל בשעה 11:00. לקבלת התוצאות הטובות ביותר התנהגותיים, למנוע צפיפות, אנחנו בדרך כלל לשמור על לא יותר מ 50 זחלים בצלחת פטרי אחת.
- לאחר DPF 4, דג הזברה מוכנים יועברו לתוך צלחת 96-היטב. כדי לתת יותר מקום הזחלים שחייה, אנו משתמשים בדרך כלל צלחת 96-היטב עם גודל היטב גדול של 650 μl, עם זאת, תקן 96, גם צלחות עובד בסדר גמור. שימוש pipet העברת פלסטיק, בעדינות העברה חד הזחל לכל טוב.
- לאחר העברת דגים לתוך בארות, למלא בכל טוב עם דגי מים מספיק כך את פני השטח מים לשטוף כמעט לחלק העליון של בארות. או שגדשו או underfilling היטב יכול לגרום לבעיות אופטי למצלמה ההקלטה. כמו כן, לדאוג לא להכניס בועות לתוך בארות.
חלק 2: סקר של מנגנון הקלטה
עבור חלק זה של הפרוטוקול, עיין הסרט כדי לזהות רכיבים היכרות עם סט שלנו את מנגנון ההקלטה.
- בתוך חדר הקלטה הוא מקום מוגדר היטב למצב צלחת 96-היטב.
- המצלמה ממוקמת בגב מתמקדת הצלחת באמצעות מראות את הקופסה. הזווית של מראות אלה יכול להיות מותאם על ידי סיבוב הברגים שמחזיקים את המראות במקום.
- החדר הקלטה מואר מלמטה על ידי נוריות אינפרא אדום. זה מאפשר את המצלמה כדי לראות את הדגים אפילו בחושך. הזחלים אינם יכולים לגלות אור אינפרא אדום, אז זה תאורה קבועה IR אינו משפיע על הניסוי. לבן נוריות גם להאיר את תא הקלטת מלמטה. הם נשלטים בנפרד את האורות IR. מאירים את החדר באור לבן מלמעלה או מן הצדדים בהחלט אפשרי, אולם במקרים אלה, יש להקפיד להימנע חזק נועץ את פני המים שעשויים להפריע המצלמה.
- עבור ניסויים לאחרונה יותר כמה שעות, למלא את התא בעדינות עם מים זורמים כדי לעזור לשמור על טמפרטורה קבועה למשך תקופת הניסוי. אחת הדרכים להשיג זרם קבוע של מים כדי לשאוב מים ממאגר ידי משאבה באקווריום קטן מחוממת ° 28 עם חימום באקווריום טיפוסי מתחת למים.
- כדי למזער רטט תועה מחדר, יחידת הקלטה כולו צריך לשבת על גבי שולחן איזון כבד.
חלק 3: יישור הצלחת 96-היטב עם רשת המחשבים של מעקב וידאו
תוכנה
- מניחים את צלחת 96-היטב המכיל את הדגים לתוך תא ההקלטה.
- בעת השימוש באמבט מים, לאט לאט המקום הצלחת במים, נותן את מפלס המים הזדמנות להתאים מבלי לשפוך לצלחת. לחילופין, לכבות את זרימת המים, להוסיף את הצלחת, ולאחר מכן לחדש את הזרימה. כמו כן, הקפד להשתמש קפיץ או גומייה כדי להחזיק את הצלחת 96-היטב במקום.
- בתוכנה Videotrack Viewpoint, לבדוק כי כל הזחלים של הניסוי שלך נראים על מסך המחשב. שימוש בפקדים של התוכנה, ליישר את הרשת של תוכנות מעקב וידאו עם בארות של צלחת כזו דגים בתוך כל ריבוע של הרשת שלך. מחשב מעקב יהיה חישוב תנועה בנפרד לכל אחת הקופסאות האלה, אז אם אתם misalign רשת מחשב כמה תנועות דגים עלולים ללכת לאיבוד. או אפילו יותר גרוע: שני דגים סמוך יתפוס את השטח אותו להיות נחשב דג אחד. שלב זה חשוב מאוד עבור כל הקלטות שלך.
- לאחר היישור, התוכנית עיתוי כאשר האורות צריך ללכת לסירוגין. אנחנו בדרך כלל מאפשרים 3 שעות של הסתגלות אור או חושך בתיבת הן להשיג רמת הפעילות הבסיסית, אלא גם לתת את הזחלים הזדמנות להירגע בעקבות pipetting והטיפול. אחרי ההתחלה, אנחנו חלופי אז עם 30 דקות של אורות ואחריו 30 דקות של האורות, וחזור מספר פעמים.
- לאחר מכן, לסגור את הדלת של החדר הקלטה להתחיל בהקלטה.
- בפועל, אנחנו מתעדים את הפעילות של כל דג לשנייה, אבל את התוכנה Viewpoint למעשה מתעדת את מסגרת מסגרת על ידי נתונים (עיין הסרטלהפגנה של איסוף הנתונים). קביעת ערך סף של שינוי פיקסל מינימום לכל מסגרת יהיה תלוי במידה מסוימת על המצלמה הספציפית שלך ואת ההתקנה קלה. עבור ההתקנה, אנו משתמשים בדרך כלל סף של 4 פיקסלים, כלומר, אם פחות מ 4 פיקסלים משתנים, זה נחשב רקע. אם יותר מ 4 פיקסלים זזים, זה מצביע על דג נע. אנחנו נקבע באופן אמפירי, כי הפסקת זה מזהה כמעט את כל הזחל לשחות ותנועות לפנות.
- למרות תיבות הקלטה לבודד את הזחלים די טוב, לכבות את האור בחדר ולטפל כדי למזער הפרעות עם רעש מכני כגון סגירת ופתיחת דלתות בחדר, לאחר מסיבת ריקודים, או עושה לממש שגרות שלך.
חלק 4: ניתוח נתונים
- לאחר הניסוי הושלם, להעביר את הנתונים שנאספו לתוך גיליון Excel או לתוך הסוויטה ניתוח האהוב עליך.
- גיליון Excel המצורף הוא דוגמא למה הנתונים עשוי להיראות כך: הוא מכיל את הזמן בשניות מתחילת הניסוי את הפעילות של כל זחל בכל שניות לכל הדגים לאורך הניסוי כולו (ראו קובץ משלים נתונים דוגמה ב קבצים בסעיף של דף זה).
- איור 1 מציג דוגמה לפעילות של זחל אחד. איור 2 הוא זכר נציג הממוצע של הזחלים WT 40 דג הזברה. בממוצע ON ותגובות OFF בולטים ועקבית.
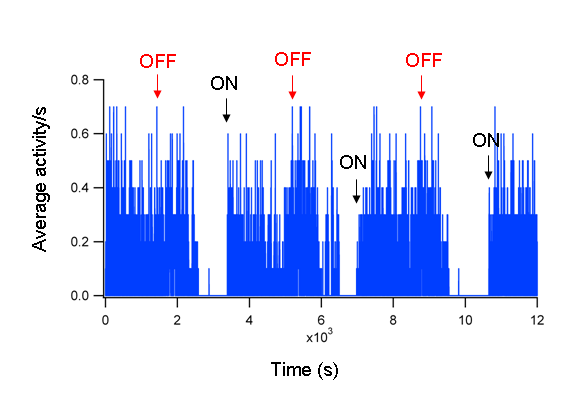
איור 1: פעילות של דג בודד הפעילות של דג WT יחיד DPF 5 בתגובה לסירוגין תקופות של 30 דקות קל לסירוגין.. התגובות ON מסומנים על ידי חצים שחורים התגובות OFF עם החצים האדומים.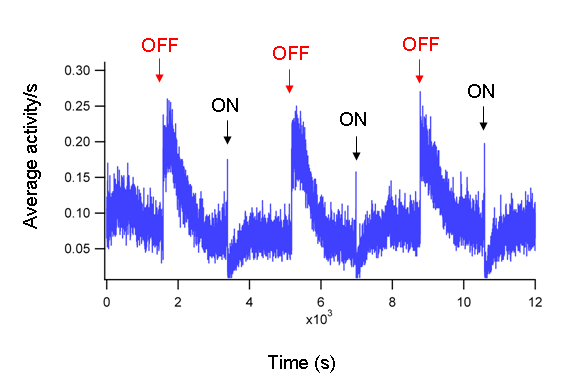
איור 2: פעילות ממוצע של דגים 40 הפעילות הממוצעת של דג 40 WT ב DPF 5 בתגובה לסירוגין תקופות של 30 דקות קל לסירוגין.. בממוצע ON (חיצים שחורים) ו OFF (חצים אדומים) תגובות בולטים ועקבית.
5. נציג תוצאות
איור 3 הוא מתאר סכימטי של המתאר את הניסוי השתמשו בכל הניסויים שלנו. 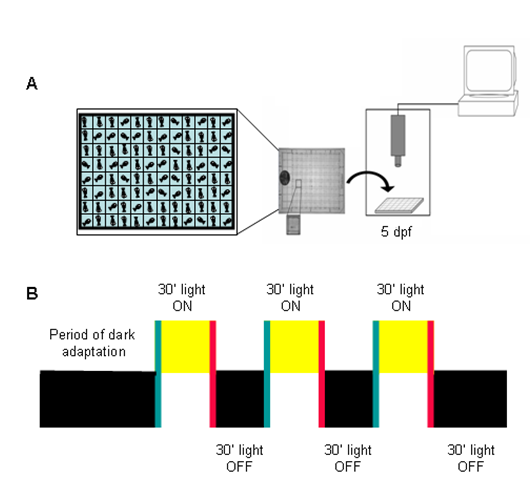
איור 3. עיצוב ניסיוני של בדיקה חזותית תגובה (VMR) מוטור. דג) הפרט ממוקמים צלחת 96-היטב בתא ההקלטה. הפעילות של דגים כל נמדד בשנייה. ב) דגים מקבלים תקופה של הסתגלות כהה או בהיר כדי ליישב אותם כדי להשיג רמת הפעילות הבסיסית. תקופות של 30 דקות על אורות ואורות OFF מוצגים ברצף עבור סכום כולל של 3 שעות. תרשים זה הותאם מ Prober et al. 2006.
מה לעשות של Visual-Motor גרפים תגובת נראה?
מדדנו את התגובות לסירוגין של דגים WT כדי במרווחים ו decrements אור. כדי לאשר תגובות אלה היו תלויים לפעולת העין, מדדנו את הפעילות של מוטנטים chk, אשר אינם מפתחים כל העיניים. איור 4 מראה את הפעילות הממוצע המתקבל חיות WT כמו גם מוטנטים chk. 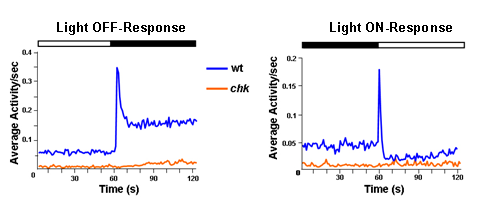
איור 4: דגים WT יש לנקות ולכבות התגובות הן בתיווך העיניים לרוחב ההתנהגות של תנועה של זחלים דג הזברה ב DPF 5 בתגובה 30 דקות של אור ו 30 דקות של OFF אור נרשם לשנייה.. עקבות מייצגת ממוצע של 480 תגובות מתוך 120 WT הפרט (כחול זכר) או זחלים chk מוטציה (כתום זכר) נרשם על 3 ניסויים. מוטנטים chk לא להגדיל באופן משמעותי את פעילותם או במרווחים או decrements אור יש רמה בסיסית נמוכה של פעילות. נתון זה הותאם מ Emran et al. 2007.
חזותית, מנוע התגובות מהדג NRC מוטציה.
מוטציה בקמ"ג נחשב עיוור לחלוטין על פי מבחן OKR. ב מוטנטים NRC, מסופי photoreceptor לא יוצרים כראוי על מסלול הראייה נפגעת קשות 1. רשתית תא גנגליון הקלטות דגים מוטנטים אלה עולה כי הם מפגינים בעיקר off-סוג תא גנגליון התגובות, כמה חריגות ב-off, אבל לא טהור ב-type 2 תגובות.
באמצעות מבחן VMR הראינו כי מוטציה NRC יש נורמלי OFF-התגובה עיכוב איטית על התגובה (seדואר איור 5). לפיכך, מוטציה NRC אינה עיוורת לחלוטין כפי שסברו קודם לכן 2. 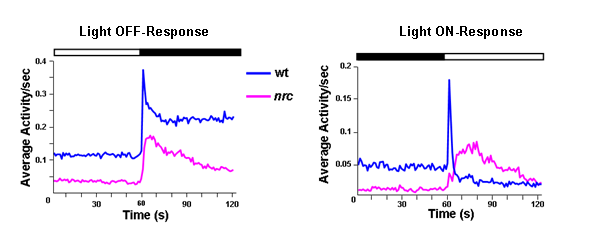
איור 5: mutats NRC להגדיל את הפעילות שלהם בתגובה לשינויים בעוצמות אור תגובות התנהגותיות להדליק ולכבות מ WT וזחלים NRC מוטציה ב DPF 5.. עקבות מייצגת ממוצע של 480 תגובות מתוך 120 דגים בודדים גנוטיפ אחד. ההתנהגות של תנועה ממוצעת של מוטנטים NRC (עקבות ורוד) מצטמצם מעט לעומת דגים WT (עקבות כחול) אבל עדיין נמרץ בעקבות האור OFF גירוי. הערה הזמן עלייה איטית בתגובה NRC מוטציה לאור ON לעומת אור על התגובה של הדג WT.
Discussion
הפרוצדורות אנחנו מראים בסרט הם כל נציג של דגים WT. עם זאת, הניסויים הללו ניתן לעשות זאת באנלוגיה על דגים מוטנטים, כמו גם (ראה סעיף נציג תוצאה). אנו ממליצים על צלחת דגים WT דגים מוטנטים על הצלחת באותו מתווה לוח דמקה למטרות שליטה אופטימלית.
בעת שימוש דגים מוטנ...
Acknowledgements
עבודה זו נתמכה על ידי המכון הלאומי לבריאות מענקים EY0081 ו 5T32UY07145 ועל ידי קרן האבירים הטמפלרים העין. ג'ייסון Rihel הוא עמית Bristol-Squibb של מדעי החיים Research Foundation.
Materials
| Name | Company | Catalog Number | Comments | |
| Microplate devices | Tool | Whatman, GE Healthcare | 7701-1651 | |
| Transfer pipetes | Tool | VWR international | 202205 | |
| Fish water | Reagent | refer to reference #4 | ||
| Recording chambers (Zebrabox) | Tool | Viewpoint Lifesciences | ||
| Videotrack Software | Tool | Viewpoint Lifesciences |
References
- Allwardt, A. B., Lall, B. A., Brockerhoff, S. E. Synapse formation is arrested in retinal photoreceptors of the zebrafish nrc mutant. J Neurosci. 21, 2330-2330 (2001).
- Emran, F., Rihel, J., Adolph, A. R. OFF ganglion cells cannot drive the optokinetic reflex in zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 104, 19126-19126 (2007).
- Prober, D. A., Rihel, J., Onah, A. A. Hypocretin/orexin overexpression induces an insomnia-like phenotype in zebrafish. J Neurosci. 26, 13400-13400 (2006).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish. , (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved