6.9 : Calorimetria a volume costante
I calorimetri sono utili per determinare il calore rilasciato o assorbito da una reazione chimica. I calorimetri a tazza di caffè sono progettati per funzionare a pressione costante (atmosferica) e sono convenienti per misurare il flusso di calore (o il cambiamento di entalpia) che accompagnano i processi che si verificano in soluzione a pressione costante. Un diverso tipo di calorimetro che opera a volume costante, colloquialmente noto come calorimetro a bomba, viene utilizzato per misurare l'energia prodotta dalle reazioni che producono grandi quantità di calore e prodotti gassosi, come le reazioni di combustione. (Il termine "bomba" deriva dall'osservazione che queste reazioni possono essere abbastanza vigorose da assomigliare a esplosioni che danneggerebbe altri calorimetri.)
La prima legge della termodinamica suggerisce che il cambiamento nell'energia interna (ΔE) di una reazione è la somma del calore (q) e del lavoro (w).
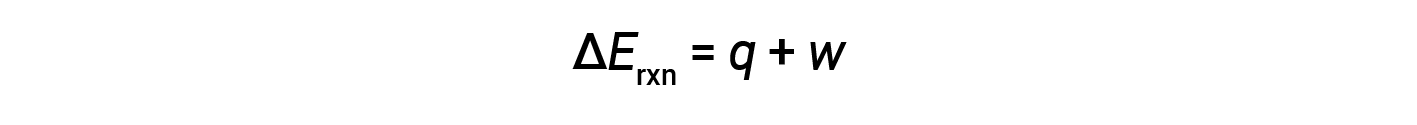
Nelle reazioni gassose, il lavoro svolto è di tipo pressione-volume, con conseguente cambiamento nel volume della reazione.
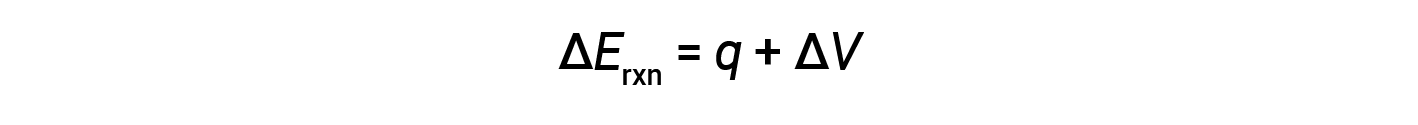
I calorimetri bomba sono progettati per funzionare a volume costante, in modo che il volume della reazione non possa cambiare (ΔV = 0).
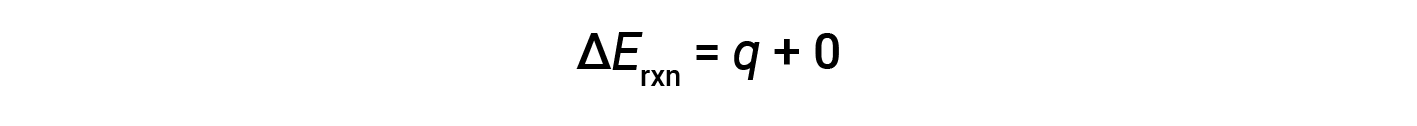
Pertanto, il lavoro svolto è zero, e il calore (qv) misurato usando un calorimetro bomba è equivalente al cambiamento nell'energia interna della reazione.
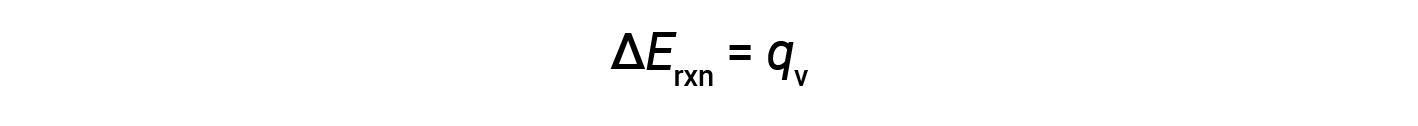
Un calorimetro bomba è costituito da un robusto contenitore di acciaio che contiene i reagenti ed è esso stesso immerso nell'acqua. Il campione viene posto nella bomba, che viene poi riempita di ossigeno ad alta pressione. Una piccola scintilla elettrica viene utilizzata per accendere il campione. L'energia prodotta dalla reazione viene assorbita dalla bomba d'acciaio e dall'acqua circostante. L'aumento di temperatura (ΔT) viene misurato e, insieme alla capacità termica nota del calorimetro (Ccal), viene utilizzato per calcolare il calore assorbito dall'intero gruppo calorimetrico (qcal).
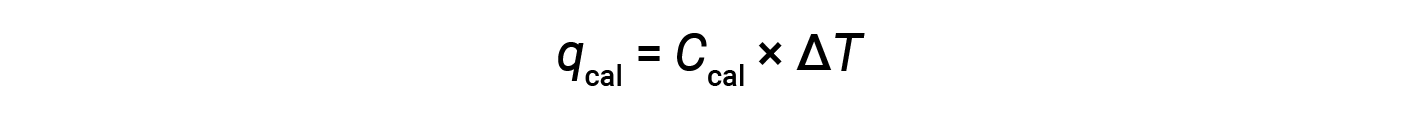
Poiché il calorimetro è isolato e non si perde calore nell'ambiente, il calore guadagnato dal calorimetro equivale al calore rilasciato dalla reazione.
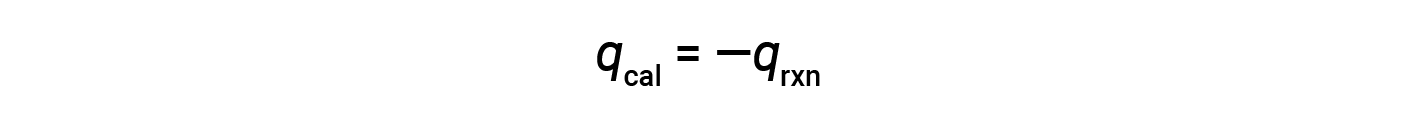
A causa delle condizioni di volume costante, il calore evoluto nella reazione corrisponde al cambiamento di energia interno.
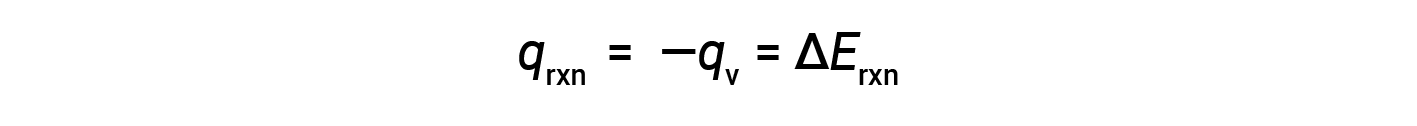
Questo è il cambiamento energetico interno per la quantità specifica di reagente in fase di combustione. ΔErxn per mole di un particolare reagente si ottiene dividendo il valore per il numero di talpe che hanno effettivamente reagito.
I calorimetri a bomba richiedono la calibrazione per determinare la capacità termica del calorimetro e garantire risultati accurati. La calibrazione viene eseguita utilizzando una reazione con una q nota, come una quantità misurata di acido benzoico accesa da una scintilla da un filo di fusibile di nichel che viene pesato prima e dopo la reazione. Il cambiamento di temperatura prodotto dalla reazione nota viene utilizzato per determinare la capacità termica del calorimetro. La calibrazione viene generalmente eseguita ogni volta prima che il calorimetro sia utilizzato per raccogliere dati di ricerca.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 5.2: Calorimetria.
Dal capitolo 6:

Now Playing
6.9 : Calorimetria a volume costante
Termochimica
26.8K Visualizzazioni

6.1 : Nozioni di base sull'energia
Termochimica
36.8K Visualizzazioni

6.2 : Prima legge della termodinamica
Termochimica
31.4K Visualizzazioni

6.3 : Energia interna
Termochimica
28.7K Visualizzazioni

6.4 : Quantificazione del calore
Termochimica
53.7K Visualizzazioni

6.5 : Quantificazione del lavoro
Termochimica
19.0K Visualizzazioni

6.6 : Entalpia
Termochimica
34.7K Visualizzazioni

6.7 : Equazioni termochimiche
Termochimica
28.1K Visualizzazioni

6.8 : Calorimetria a pressione costante
Termochimica
84.5K Visualizzazioni

6.10 : Legge di Hess
Termochimica
44.3K Visualizzazioni

6.11 : Entalpia standard di formazione
Termochimica
40.9K Visualizzazioni

6.12 : Entalpie di reazione
Termochimica
31.4K Visualizzazioni