6.12 : Entalpie di reazione
La legge di Hess può essere usata per determinare il cambiamento di entalpia di qualsiasi reazione se sono disponibili le corrispondenti entalpie di formazione dei reagenti e dei prodotti. La reazione principale può essere suddivisa in reazioni stepwise: (i) decomposizioni dei reagenti nei loro elementi componenti, per i quali i cambiamenti di entalpia sono proporzionali al negativo degli entalpie di formazione dei reagenti, −ΔHf°(reagenti), seguito da (ii) ri-combinazioni degli elementi (ottenuti nel passaggio 1) per dare i prodotti, con le variazioni di entalpia proporzionali agli entalpies di formazione dei prodotti, ΔHf° (prodotti). Il cambiamento standard dell'entalpia della reazione globale è quindi uguale a: (ii) la somma degli entalpie standard di formazione di tutti i prodotti più (i) la somma degli aspetti negativi degli entalpie standard di formazione dei reagenti, come dato dalla seguente equazione, dove ∑ rappresenta "la somma di" e n sta per i coefficienti stechiometrici.
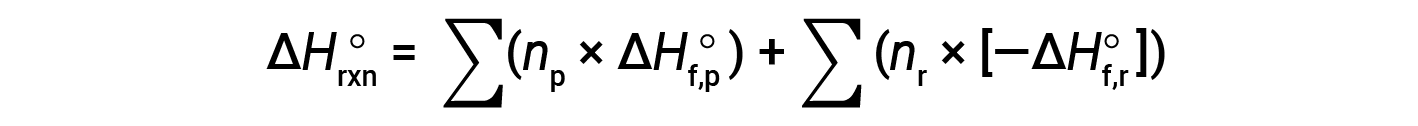
L'equazione è solitamente riarrangiata leggermente per essere scritta come segue:
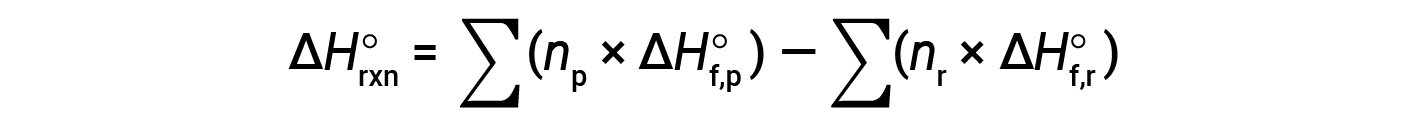
L'esempio seguente mostra in dettaglio perché questa equazione è valida e come usarla per calcolare la variazione di entalpia standard per una reazione:

Qui, viene utilizzata la forma speciale della legge di Hess e il calore dei valori di formazione per i reagenti e i prodotti: ΔHf° (HNO3) = −206,64 kJ/mol; ΔHf° (NO) = +90,2 kJ/mol; ΔHf° (NO2) = +33 kJ/mol; ΔHf° (H2O) = −285,8 kJ/mol.


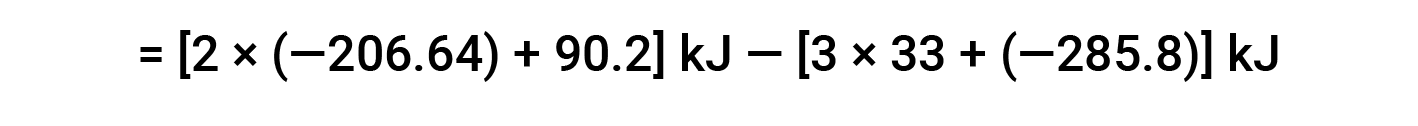
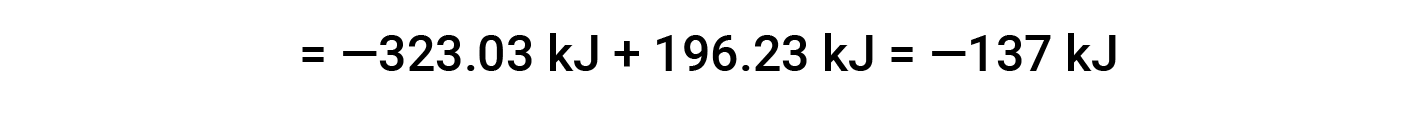
Questo testo è adattato da Openstax, Chimica 2e, Sezione 5.3: Entalpia.
Dal capitolo 6:

Now Playing
6.12 : Entalpie di reazione
Termochimica
31.5K Visualizzazioni

6.1 : Nozioni di base sull'energia
Termochimica
37.2K Visualizzazioni

6.2 : Prima legge della termodinamica
Termochimica
31.6K Visualizzazioni

6.3 : Energia interna
Termochimica
28.8K Visualizzazioni

6.4 : Quantificazione del calore
Termochimica
54.0K Visualizzazioni

6.5 : Quantificazione del lavoro
Termochimica
19.1K Visualizzazioni

6.6 : Entalpia
Termochimica
34.9K Visualizzazioni

6.7 : Equazioni termochimiche
Termochimica
28.3K Visualizzazioni

6.8 : Calorimetria a pressione costante
Termochimica
84.7K Visualizzazioni

6.9 : Calorimetria a volume costante
Termochimica
26.9K Visualizzazioni

6.10 : Legge di Hess
Termochimica
44.6K Visualizzazioni

6.11 : Entalpia standard di formazione
Termochimica
41.1K Visualizzazioni