7.2 : Lo spettro elettromagnetico
Lo spettro elettromagnetico è costituito da tutti i tipi di radiazione elettromagnetica disposti in base alla loro frequenza e lunghezza d'onda. Ognuno dei vari colori della luce visibile ha frequenze e lunghezze d'onda specifiche ad esse associate, e potete vedere che la luce visibile costituisce solo una piccola porzione dello spettro elettromagnetico. Poiché le tecnologie sviluppate per funzionare in varie parti dello spettro elettromagnetico sono diverse, per ragioni di convenienza e eredità storiche, diverse unità sono tipicamente utilizzate per diverse parti dello spettro. Ad esempio, le onde radio sono solitamente specificate come frequenze (tipicamente in unità di MHz), mentre la regione visibile è solitamente specificata nelle lunghezze d'onda (tipicamente in unità di nm o angstrom).
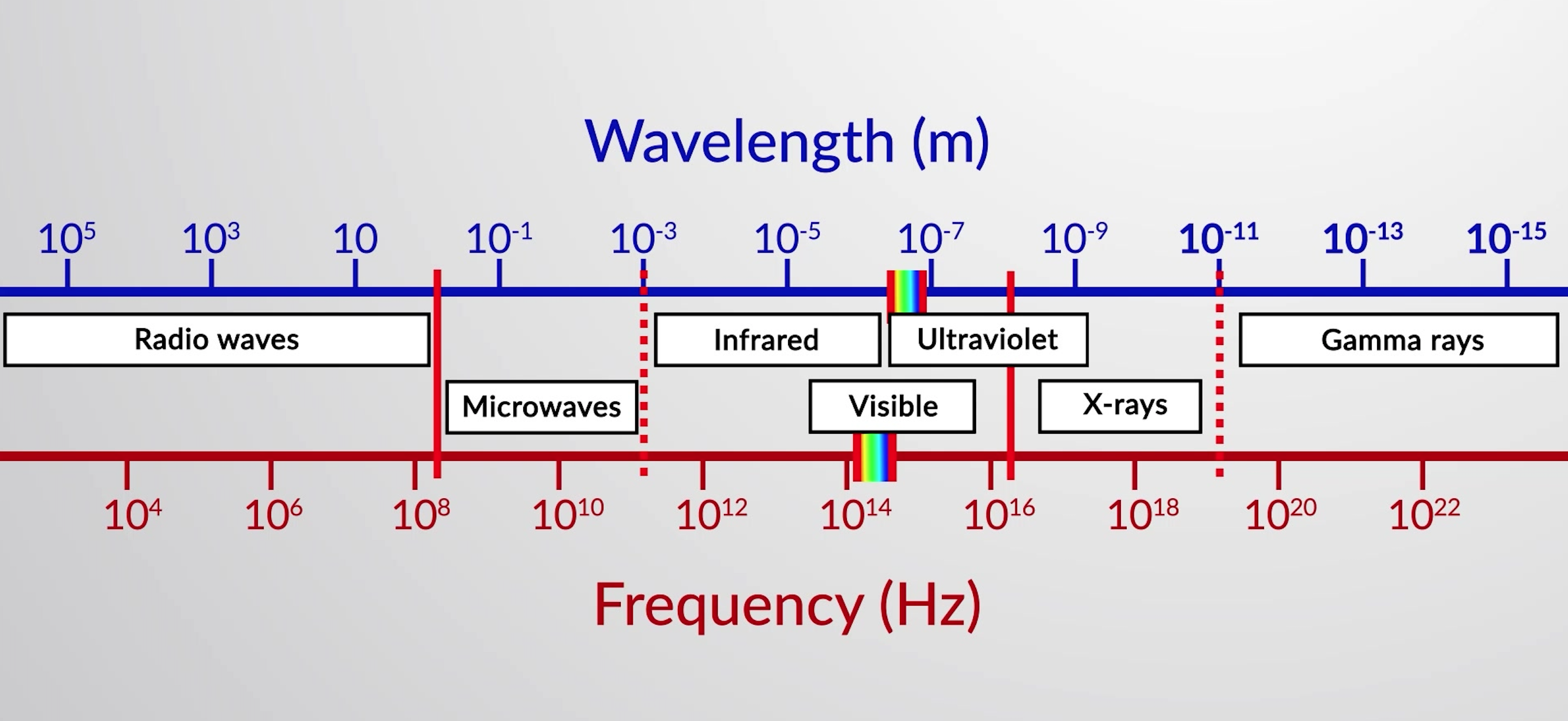
Figura 1: Parti dello spettro elettromagnetico sono mostrate in ordine di frequenza crescente e lunghezza d'onda decrescente.
I tipi di onde elettromagnetiche sono onde radio, microonde, ultravioletti, visibili, infrarossi, raggi X e raggi gamma.
Le onde radio hanno le lunghezze d'onda più lunghe, le frequenze più basse, e trasportano la minima quantità di energia. Sono utilizzati nella tecnologia dei telefoni cellulari, nelle trasmissioni radiofoniche e televisive, nel controllo del traffico aereo, ecc.
Le microonde hanno lunghezze d'onda più corte rispetto alle onde radio. Vengono assorbiti dall'acqua e vengono utilizzati per riscaldare e cucinare il cibo.
Il prossimo è la radiazione infrarossa, che viene emessa da oggetti caldi. Ad esempio, la Terra assorbe energia radiante dal sole ed emette radiazioni infrarosse. Parte della radiazione infrarossa viene assorbita e rimessa dall'atmosfera per mantenere la temperatura media della Terra attraverso l'effetto serra. Gli occhiali per la visione notturna percepisce le radiazioni infrarosse emesse dai nostri corpi.
La luce visibile è solo una piccola porzione di radiazioni elettromagnetiche che vanno da 740 a 390 nm. Gli occhi umani possono vedere solo questa piccola gamma di lunghezze d'onda. La luce visibile consiste principalmente di sette componenti di colore, tra cui rosso, arancione, giallo, verde, blu, indaco e viola.
La radiazione ultravioletta ha lunghezze d'onda che vanno da 400 a 10 nm. La luce solare è la fonte più familiare di radiazioni UV. Trasporta abbastanza energia che, con un'esposizione eccessiva, provoca scottature solari.
I raggi X possono passare attraverso molte sostanze, rendendole un importante strumento di imaging. I dentisti usano i raggi X per scopi diagnostici e la sicurezza aeroportuale li utilizza per visualizzare i componenti in una valigia.
I raggi gamma hanno lunghezze d'onda più piccole, alte frequenze ed energie. I raggi gamma sono rilasciati da reazioni nucleari ed elementi radioattivi presenti in natura.
I raggi X e i raggi gamma sono le forme più energetiche di radiazione elettromagnetica. Le loro alte energie possono ionizzare atomi e molecole. Le radiazioni ionizzanti possono causare cambiamenti permanenti o danni alle molecole biologiche. Sono usati per distruggere le cellule tumorali.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 6.1: Energia Elettromagnetica.
Dal capitolo 7:

Now Playing
7.2 : Lo spettro elettromagnetico
Struttura elettronica degli atomi
52.3K Visualizzazioni

7.1 : La natura ondulatoria della luce
Struttura elettronica degli atomi
48.1K Visualizzazioni

7.3 : Interferenza e diffrazione
Struttura elettronica degli atomi
30.5K Visualizzazioni

7.4 : Effetto fotoelettrico
Struttura elettronica degli atomi
29.1K Visualizzazioni

7.5 : Il modello di Bohr
Struttura elettronica degli atomi
49.8K Visualizzazioni

7.6 : Spettri di emissione
Struttura elettronica degli atomi
49.4K Visualizzazioni

7.7 : La lunghezza d'onda di de Broglie
Struttura elettronica degli atomi
25.2K Visualizzazioni

7.8 : Il principio dell'incertezza
Struttura elettronica degli atomi
22.9K Visualizzazioni

7.9 : Il modello quantistico-meccanico di un atomo
Struttura elettronica degli atomi
41.7K Visualizzazioni

7.10 : Numeri quantistici
Struttura elettronica degli atomi
34.1K Visualizzazioni

7.11 : Orbitali atomici
Struttura elettronica degli atomi
32.9K Visualizzazioni

7.12 : Il principio di esclusione di Pauli
Struttura elettronica degli atomi
33.8K Visualizzazioni

7.13 : Le energie degli orbitali atomici
Struttura elettronica degli atomi
23.6K Visualizzazioni

7.14 : Il principio di Aufbau e la regola di Hund
Struttura elettronica degli atomi
43.7K Visualizzazioni

7.15 : Configurazione elettronica di atomi multielettronici
Struttura elettronica degli atomi
37.8K Visualizzazioni