9.8 : Polarità di legame, momento di dipolo e carattere ionico percentuale
Polarità del legame
Il valore assoluto della differenza di elettronegatività (ΔEN) di due atomi legati fornisce una misura approssimativa della polarità che ci si può aspettare nel legame e, quindi, nel tipo di legame. Quando la differenza è molto piccola o zero, il legame è covalente e non polare. Quando è grande, il legame è covalente polare o ionico. I valori assoluti delle differenze di elettronegatività tra gli atomi nei legami H-H, H-Cl e Na-Cl sono rispettivamente 0 (non polare), 0,9 (covalente polare) e 2,1 (ionico).
Il grado in cui gli elettroni sono condivisi tra gli atomi varia da completamente uguale (legame covalente puro) a per niente (legame ionico).
- Per esempio, gli atomi H e F in HF hanno una differenza di elettronegatività di 1,9, e gli atomi N e H in NH3 una differenza di 0,9, ma entrambi questi composti formano legami che sono considerati covalenti polari.
- Allo stesso modo, gli atomi di Na e Cl nel NaCl hanno una differenza di elettronegatività di 2,1, e gli atomi Mn e I in MnI2 hanno una differenza di 1,0, ma entrambe queste sostanze formano composti ionici.
La migliore guida al carattere covalente o ionico di un legame è considerare i tipi di atomi coinvolti e le loro posizioni relative nella tavola periodica.
- I legami tra due non metalli sono generalmente covalenti.
- Il legame tra un metallo e un nonmetale è spesso ionico.
Alcuni composti contengono legami covalenti e ionici. Gli atomi negli ioni poliatomici, come OH–, NO3−e NH4+, sono tenuti insieme da legami covalenti polari. Tuttavia, questi ioni poliatomici formano composti ionici combinandosi con ioni della carica opposta. Ad esempio, il nitrato di potassio, KNO3, contiene ilcatione K + e il poliatomico NO3− anione. Pertanto, il legame nel nitrato di potassio è ionico, risultante dall'attrazione elettrostatica tra gli ioni K+ e NO3−, così come covalente tra gli atomi di azoto e ossigeno in NO3−.
Polarità molecolare e momento di dipolo
Come discusso in precedenza, i legami covalenti polari collegano due atomi con diverse elettronegatività, lasciando un atomo con una carica positiva parziale (δ+) e l'altro atomo con una carica negativa parziale (δ–), poiché gli elettroni vengono tirati verso l'atomo più elettronegativo. Questa separazione della carica dà origine a un momento di dipolo obbligazionario. La grandezza di un momento di dipolo di legame è rappresentata dalla lettera greca mu (μ) ed è data dalla formula mostrata qui, dove Q è la grandezza delle cariche parziali (determinata dalla differenza di elettronegatività) e r è la distanza tra le cariche:
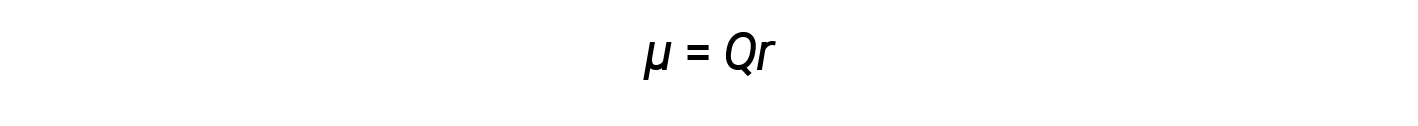
Questo momento di legame può essere rappresentato come un vettore, una quantità che ha sia direzione che magnitudine. I vettori di dipolo sono mostrati come frecce che puntano insieme al legame dall'atomo meno elettronegativo verso l'atomo più elettronegativo. Un piccolo segno più è disegnato sull'estremità meno elettronegativa per indicare l'estremità parzialmente positiva del legame. La lunghezza della freccia è proporzionale alla grandezza della differenza di elettronegatività tra i due atomi.
Un'intera molecola può anche avere una separazione della carica, a seconda della sua struttura molecolare e della polarità di ciascuno dei suoi legami. Se esiste una tale separazione di carica, si dice che la molecola sia una molecola polare (o dipolo); in caso contrario, si dice che la molecola non sia polare. Il momento del dipolo misura l'estensione della separazione netta della carica nella molecola nel suo complesso. Il momento del dipolo è determinato aggiungendo i momenti di legame nello spazio tridimensionale, tenendo conto della struttura molecolare.
Per le molecole biatomiche, c'è un solo legame, quindi il momento del dipolo del legame determina la polarità molecolare. Le molecole biatomiche omonucleari come Br2 e N2 non hanno alcuna differenza nell'elettronegatività, quindi il loro momento di dipolo è zero. Per molecole eteronucleari come il CO, c'è un piccolo momento di dipolo. Per HF, c'è un momento di dipolo più grande perché c'è una maggiore differenza di elettronegatività.
Quando una molecola contiene più di un legame, la geometria deve essere presa in considerazione. Se i legami in una molecola sono disposti in modo tale che i loro momenti di legame si annullino (la somma vettoriale è uguale a zero), allora la molecola non è polare. Questa è la situazione della CO2. Ognuno dei legami è polare, ma la molecola nel suo insieme non è polare. Dalla struttura di Lewis, e usando la teoria VSEPR, lamolecola di CO 2 è determinata come lineare con legami C=O polari sui lati opposti dell'atomo di carbonio. I momenti di legame si annullano perché sono puntati in direzioni opposte. Nel caso della molecola d'acqua, la struttura di Lewis mostra ancora una volta che ci sono due legami con un atomo centrale, e la differenza di elettronegatività mostra ancora una volta che ognuno di questi legami ha un momento di legame diverso da quello dizero. In questo caso, tuttavia, la struttura molecolare è piegata a causa delle coppie solitarie su O, e i due momenti di legame non si annullano. Pertanto, l'acqua ha un momento di dipolo netto ed è una molecola polare (dipolo).
Questo testo è adattato da Openstax, Chemistry 2e, Chapter 7.2: Covalent Bonding and Openstax, Chemistry 2e, Chapter 7.6 Molecular Structure and Polarity.
Tags
Dal capitolo 9:

Now Playing
9.8 : Polarità di legame, momento di dipolo e carattere ionico percentuale
Legame chimico: concetti di base
28.5K Visualizzazioni

9.1 : Tipi di legami chimici
Legame chimico: concetti di base
75.3K Visualizzazioni

9.2 : Simboli di Lewis e regola dell'ottetto
Legame chimico: concetti di base
62.6K Visualizzazioni

9.3 : Legame ionico e trasferimento di elettroni
Legame chimico: concetti di base
41.2K Visualizzazioni

9.4 : Il ciclo Born-Haber
Legame chimico: concetti di base
21.6K Visualizzazioni

9.5 : Tendenze nell'energia dei reticoli: dimensione e carica degli ioni
Legame chimico: concetti di base
23.7K Visualizzazioni

9.6 : Legame covalente e strutture di Lewis
Legame chimico: concetti di base
48.7K Visualizzazioni

9.7 : Elettronegatività
Legame chimico: concetti di base
67.0K Visualizzazioni

9.9 : Strutture di Lewis di composti molecolari e ioni poliatomici
Legame chimico: concetti di base
34.4K Visualizzazioni

9.10 : Risonanza
Legame chimico: concetti di base
53.1K Visualizzazioni

9.11 : Cariche formali
Legame chimico: concetti di base
32.2K Visualizzazioni

9.12 : Eccezioni alla regola dell'ottetto
Legame chimico: concetti di base
27.5K Visualizzazioni

9.13 : Energie di legame e lunghezze di legame
Legame chimico: concetti di base
24.9K Visualizzazioni

9.14 : Legami nei metalli
Legame chimico: concetti di base
46.8K Visualizzazioni