13.5 : Integrazione della legge cinetica: la dipendenza della concentrazione dal tempo
Mentre la legge sui tassi differenziali mette in relazione il tasso e le concentrazioni dei reagenti, una seconda forma di legge sui tassi chiamata legge sui tassi integrati mette in relazione le concentrazioni di reagenti e il tempo. Le leggi integrate sui tassi possono essere utilizzate per determinare la quantità di reagente o di prodotto presente dopo un certo periodo di tempo o per stimare il tempo necessario affinché una reazione proceda in una certa misura. Ad esempio, una legge integrata sui tassi aiuta a determinare il periodo di tempo in cui un materiale radioattivo deve essere immagazzinato affinché la sua radioattività decadi a un livello sicuro.
Usando il calcolo, la legge del tasso differenziale per una reazione chimica può essere integrata rispetto al tempo per dare un'equazione relativa alla quantità reagente/prodotto al tempo trascorso della reazione.
Reazioni di primo ordine
L'integrazione della legge del tasso per una semplice reazione di primo ordine (tasso = k[A]) si traduce in un'equazione che descrive la variazione della concentrazione reagente con il tempo:
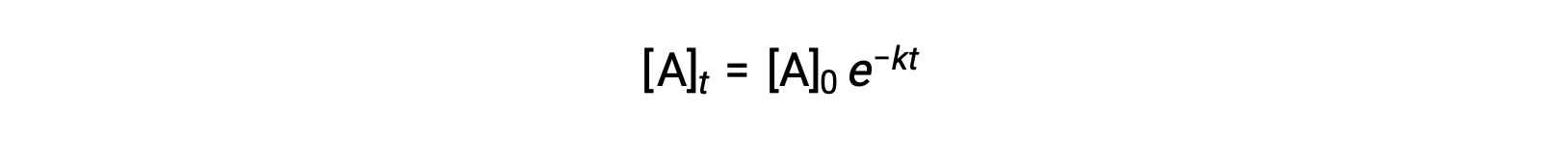
Qui, [A]t è la concentrazione di A in qualsiasi momento t, [A]0 è la concentrazione iniziale di A, e k è la costante di tasso del primo ordine. Per comodità matematica, questa equazione è riarrangiata in un formato che mostra una dipendenza lineare della concentrazione sul tempo che assume la forma diun'equazione in linea retta ( y = mx + b):
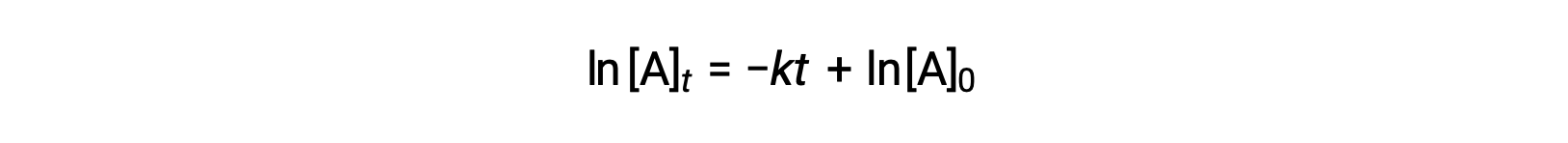
L'equazione suggerisce che un grafico di ln[A]tcontro t per una reazione di primo ordine è una linea retta con una pendenza di −k e un'intercetta ydi ln[A]0. Se un insieme di dati sulla velocità viene tracciato in questo modo ma non si verifica una linea retta, la reazione non è di primo ordine in A.
Reazioni di secondo ordine
La legge differenziale dei tassi per una semplice reazione di secondo ordine è rate = k[A]2, e la legge integrata sui tassi è:
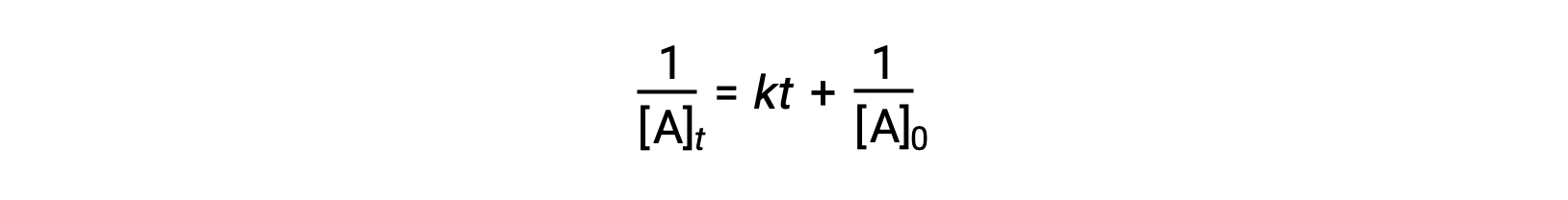
La legge sui tassi integrata del secondo ordine assume anche la forma dell'equazione per una linea retta. Secondo l'equazione, un grafico di 1/[A]t contro t per una reazione di secondo ordine è una linea retta con una pendenza di k e un'intercetta y di 1/[A]0. Se la trama non è una linea retta, allora la reazione non è di secondo ordine.
Reazioni di ordine zero
Per le reazioni di ordine zero, la legge del tasso differenziale è tasso = k. Una reazione di ordine zero mostra una velocità di reazione costante, indipendentemente dalla concentrazione dei suoi reagenti. La cinetica di ordine zero è osservata per alcune reazioni solo in determinate condizioni specifiche. Queste stesse reazioni mostrano diversi comportamenti cinetici quando le condizioni specifiche non sono soddisfatte, e per questo motivo, a volte viene usato il termine pseudo-zero-ordine più prudente.
La legge del tasso integrato per una reazione di ordine zero è anche una funzione lineare, che assume la forma di y = mx + b:
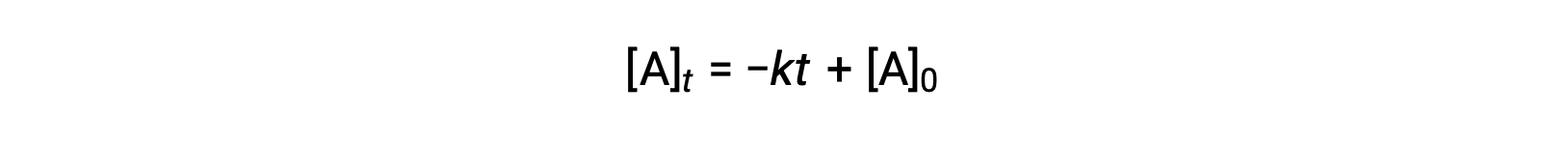
Un grafico di [A] contro il tempo t per una reazione di ordine zero è una linea retta con una pendenza di −k e un'intercetta ydi [A]0.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 12.4: Leggi integrate sui tassi.
Dal capitolo 13:

Now Playing
13.5 : Integrazione della legge cinetica: la dipendenza della concentrazione dal tempo
Cinetica chimica
34.3K Visualizzazioni

13.1 : Velocità di reazione
Cinetica chimica
51.0K Visualizzazioni

13.2 : Misurazione della velocità di reazione
Cinetica chimica
24.3K Visualizzazioni

13.3 : Concentrazione e legge cinetica
Cinetica chimica
29.9K Visualizzazioni

13.4 : Determinazione dell'ordine di reazione
Cinetica chimica
54.9K Visualizzazioni

13.6 : Emivita di una reazione
Cinetica chimica
34.2K Visualizzazioni

13.7 : Dipendenza dalla temperatura dalla velocità di reazione
Cinetica chimica
81.0K Visualizzazioni

13.8 : Diagramma di Arrhenius
Cinetica chimica
38.4K Visualizzazioni

13.9 : Meccanismi di reazione
Cinetica chimica
25.2K Visualizzazioni

13.10 : Fasi di determinazione della velocità
Cinetica chimica
31.6K Visualizzazioni

13.11 : Catalisi
Cinetica chimica
26.5K Visualizzazioni

13.12 : Enzimi
Cinetica chimica
80.5K Visualizzazioni