Una reazione chimica reversibile rappresenta un processo chimico che procede sia in avanti (da sinistra a destra) che in retromarcia (da destra a sinistra). Quando i tassi delle reazioni avanti e indietro sono uguali, le concentrazioni del reagente e delle specie di prodotto rimangono costanti nel tempo e il sistema è in equilibrio. Una doppia freccia speciale viene utilizzata per enfatizzare la natura reversibile della reazione. Le concentrazioni relative di reagenti e prodotti nei sistemi di equilibrio variano notevolmente; alcuni sistemi contengono per lo più prodotti in equilibrio, alcuni contengono per lo più reagenti, e alcuni contengono quantità apprezzabili di entrambi.
Equilibrio dinamico nelle reazioni chimiche
Si consideri la decomposizione reversibile del tetrossido di dinitrogeno incolore per produrre biossido di azoto marrone, descritto dall'equazione:
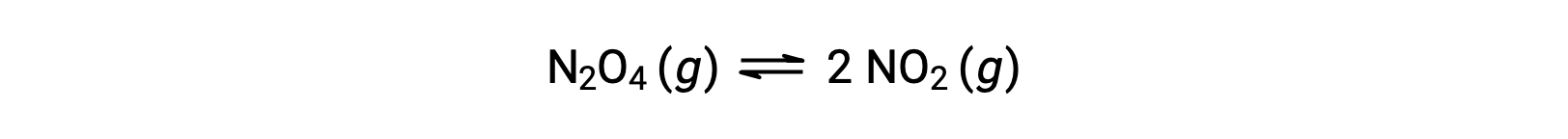
All'inizio della reazione(tempo = 0), la concentrazione del reagente N 2 O4 è finita e quella del prodotto NO2 è zero, quindi la reazione in avanti procede ad una velocità finitamentrela velocità di reazione inversa è zero. Con il passare del tempo, N2O4 viene consumato e la sua concentrazione diminuisce, mentre viene prodotto NO2 e la sua concentrazione aumenta. La concentrazione decrescente del reagente rallenta la velocità di reazione in avanti e l'aumento della concentrazione del prodotto accelera la velocità di reazione inversa. Questo processo continua fino a quando le velocità di reazione avanti e indietro diventano uguali, momento in cui la reazione ha raggiunto l'equilibrio. È importante sottolineare che gli equilibri chimici sonodinamici; una reazione all'equilibrio non si è "fermata", ma sta procedendo nelle direzioni avanti e indietro alla stessa velocità. Pertanto, all'equilibrio, le concentrazioni di N2O4 e NO2 non cambiano più perché il tasso di formazione di NO2 è esattamente uguale al tasso di consumo di NO2e il tasso di formazione di N2O4 è esattamente uguale al tasso di consumo di N2O4.
Equilibri omogenei ed eterogenei
Un equilibrio omogeneo è quello in cui tutti i reagenti e i prodotti (e tutti i catalizzatori, se del caso) sono presenti nella stessa fase, sia acquosa che gassosa, come illustrato dai seguenti esempi:
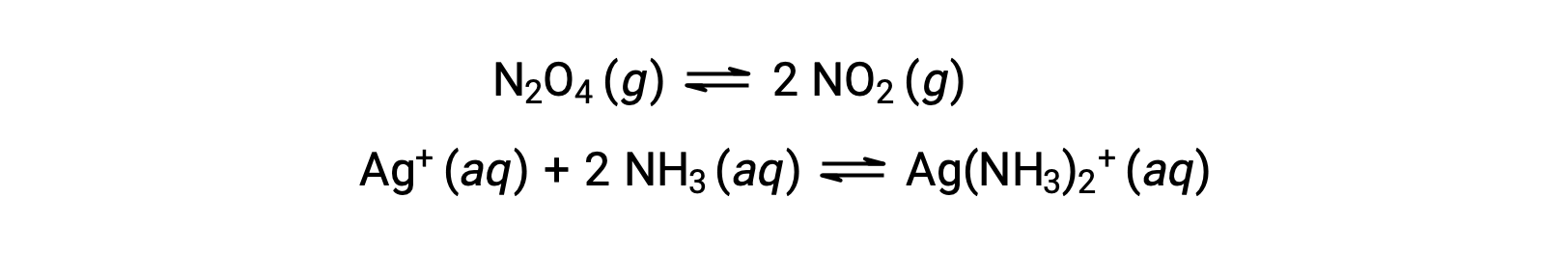
Un equilibrio eterogeneo coinvolge reagenti e prodotti in due o più fasi diverse, come illustrato dal seguente esempio:
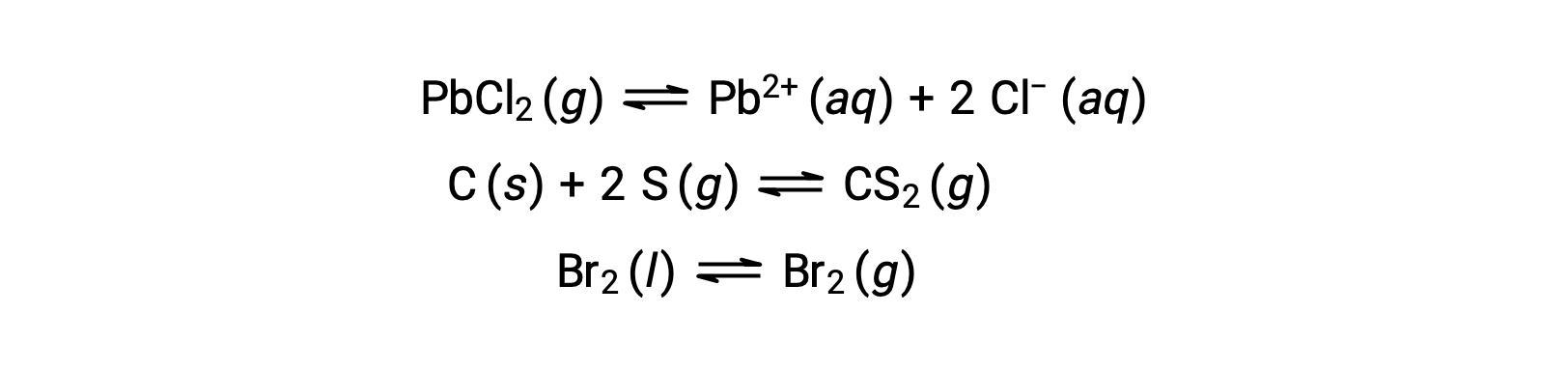
Questo testo è stato adattato da Openstax, Chemistry 2e, Section 13.1 Chemical Equilibria.
Dal capitolo 14:

Now Playing
14.1 : Equilibrio dinamico
Equilibrio chimico
48.5K Visualizzazioni

14.2 : La costante di equilibrio
Equilibrio chimico
45.0K Visualizzazioni

14.3 : Equilibri per reazioni gassose e reazioni eterogenee
Equilibrio chimico
23.2K Visualizzazioni

14.4 : Calcolo della costante di equilibrio
Equilibrio chimico
29.8K Visualizzazioni

14.5 : Quoziente di reazione
Equilibrio chimico
47.1K Visualizzazioni

14.6 : Calcolo dell' equilibrio di concentrazione
Equilibrio chimico
46.0K Visualizzazioni

14.7 : Principio di Le Chatelier: cambiare la concentrazione
Equilibrio chimico
56.3K Visualizzazioni

14.8 : Principio di Le Chatelier: variazione del volume (pressione)
Equilibrio chimico
33.2K Visualizzazioni

14.9 : Principio di LeChatelier: cambiare la temperatura
Equilibrio chimico
28.2K Visualizzazioni

14.10 : La teoria del piccolo x
Equilibrio chimico
45.3K Visualizzazioni