Equilibri omogenei per reazioni gassose
Per le reazioni in fase gassosa, la costante di equilibrio può essere espressa in termini di concentrazioni molare (Kc) o di pressioni parziali (Kp) dei reagenti e dei prodotti. Una relazione tra questi due valori K può essere semplicemente derivata dall'equazione del gas ideale e dalla definizione di molarità. Secondo l'equazione del gas ideale:
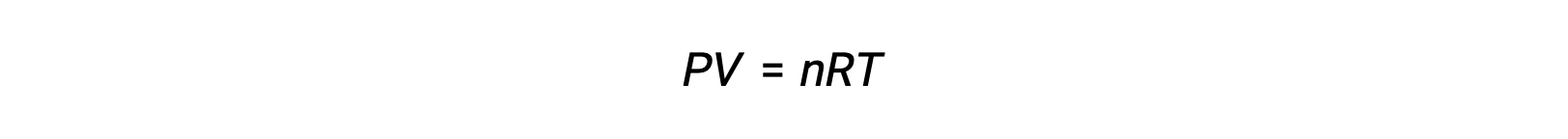
La concentrazione molare o molarità è data dal numero di talpe divise per il volume:
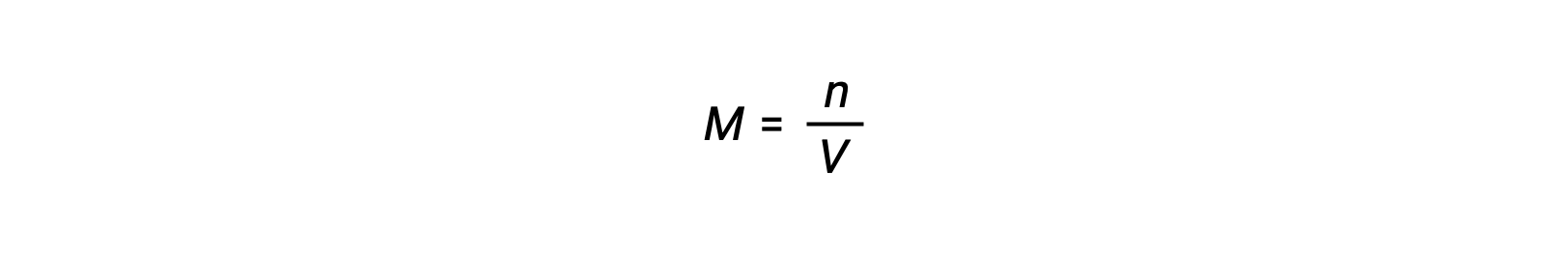
Così
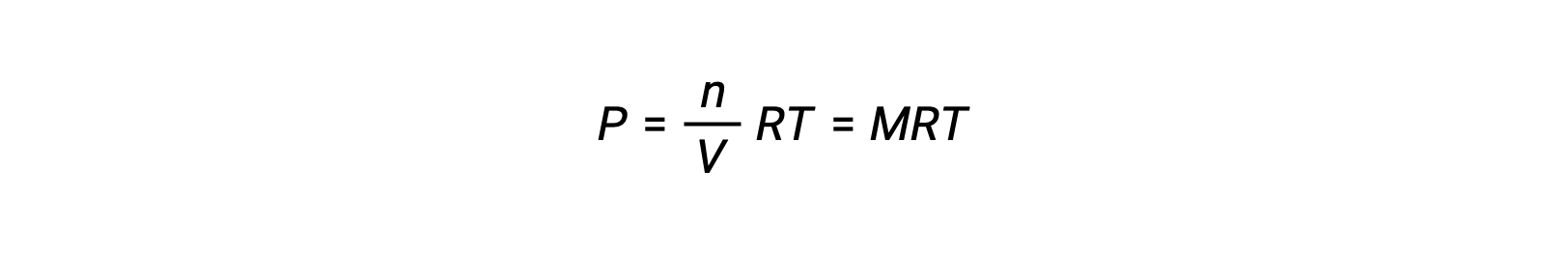
dove P è pressione parziale, V è volume, n è numero di talpe, R è la costante del gas, T è temperatura, e M è concentrazione molare.
Per la reazione gas-fase: m A + n B ⇌ x C + y D
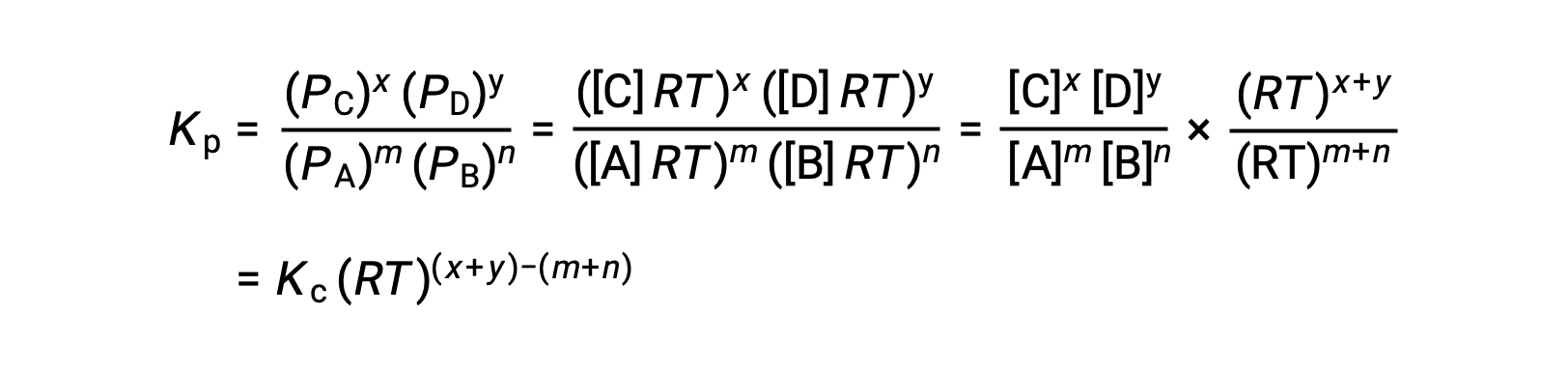
E così, la relazione tra Kc e KP è
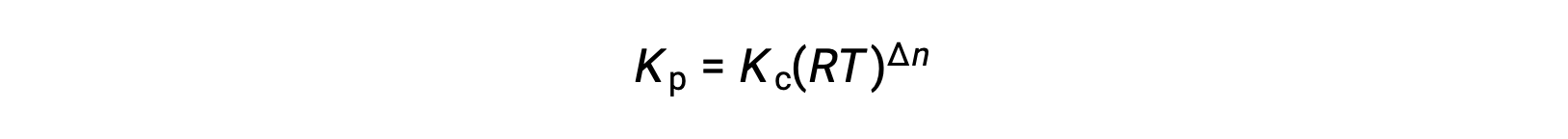
dove Δn è la differenza nelle quantità molare del prodotto e dei gas reagenti, in questo caso:
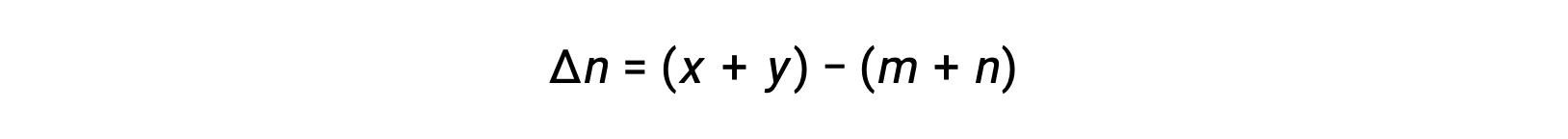
Questo testo è stato adattato da Openstax, Chemistry 2e, Section 13.2 Equilibrium Constants.
Dal capitolo 14:

Now Playing
14.3 : Equilibri per reazioni gassose e reazioni eterogenee
Equilibrio chimico
23.2K Visualizzazioni

14.1 : Equilibrio dinamico
Equilibrio chimico
48.5K Visualizzazioni

14.2 : La costante di equilibrio
Equilibrio chimico
45.0K Visualizzazioni

14.4 : Calcolo della costante di equilibrio
Equilibrio chimico
29.8K Visualizzazioni

14.5 : Quoziente di reazione
Equilibrio chimico
47.1K Visualizzazioni

14.6 : Calcolo dell' equilibrio di concentrazione
Equilibrio chimico
46.0K Visualizzazioni

14.7 : Principio di Le Chatelier: cambiare la concentrazione
Equilibrio chimico
56.3K Visualizzazioni

14.8 : Principio di Le Chatelier: variazione del volume (pressione)
Equilibrio chimico
33.2K Visualizzazioni

14.9 : Principio di LeChatelier: cambiare la temperatura
Equilibrio chimico
28.2K Visualizzazioni

14.10 : La teoria del piccolo x
Equilibrio chimico
45.3K Visualizzazioni