Gli ioni idronio e idrossido sono presenti sia in acqua pura che in tutte le soluzioni acquose, e le loro concentrazioni sono inversamente proporzionali come determinato dal prodotto ionico dell'acqua (Kw). Le concentrazioni di questi ioni in una soluzione sono spesso determinanti critici delle proprietà della soluzione e dei comportamenti chimici degli altri soluti. Due diverse soluzioni possono differire nelle loro concentrazioni di ioni idronio o idrossido di un milione, miliardi o addirittura trilioni di volte. Un mezzo comune per esprimere quantità che possono estendersi su molti ordini di grandezza è usare una scala logaritmica. Il pH di una soluzione è quindi definito come mostrato qui, dove [H3O+] è la concentrazione molare di ioni idronio nella soluzione:
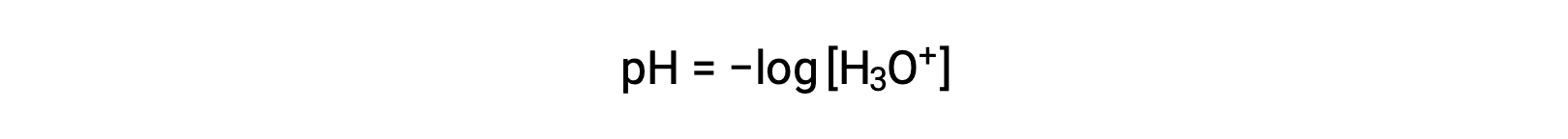
Riordinando questa equazione per isolare la molarità ionica dell'idronio si ottiene l'espressione equivalente:
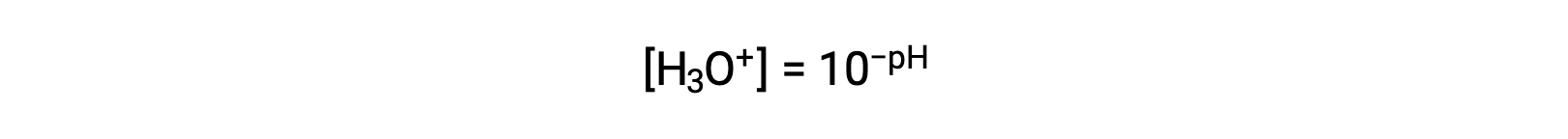
Allo stesso modo, la molarità ionico idrossido può essere espressa come p-funzione o pOH:
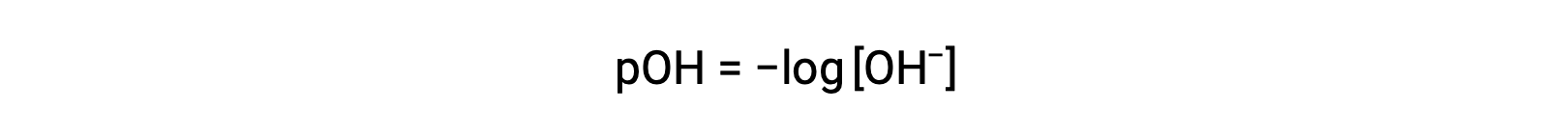
O
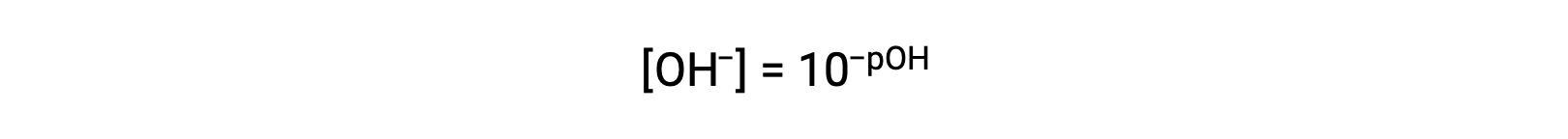
Infine, la relazione tra queste due concentrazione di ioni espressa come funzioni p è facilmente derivata dall'espressione KW:
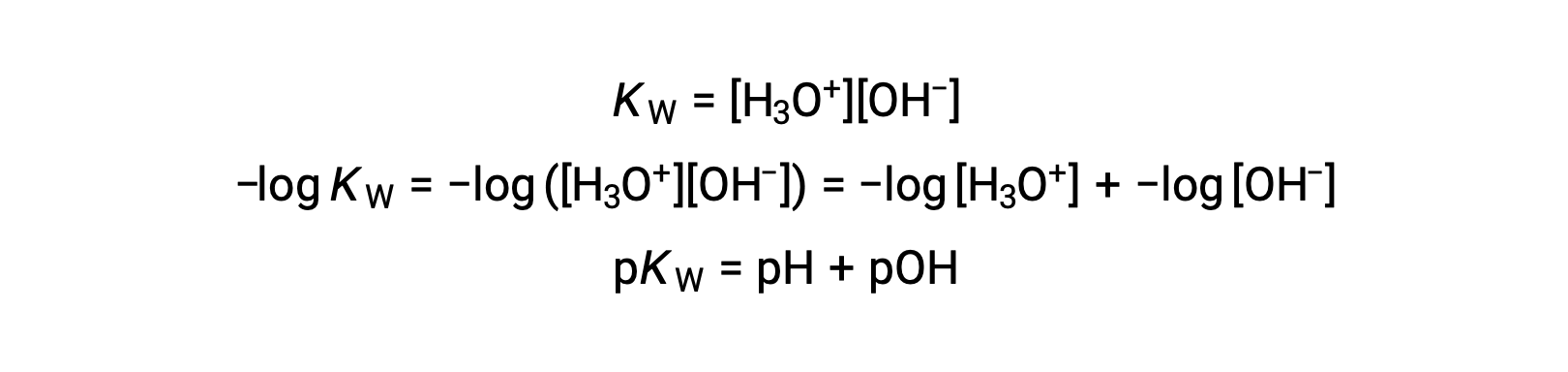
A 25 °C, il valore di KW è 1,0 × 10−14, e così:
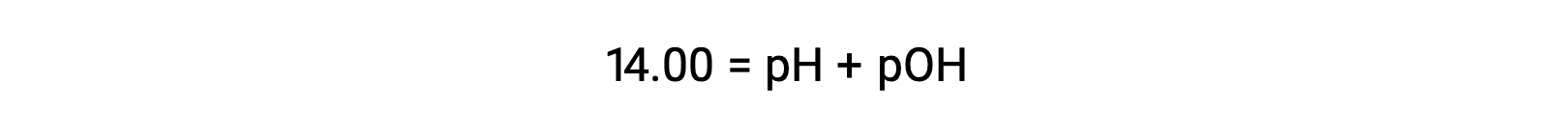
La molarità ionico di idronio in acqua pura (o qualsiasi soluzione neutra) è di 1,0 × 10−7 M a 25 °C. Il pH e il pOH di una soluzione neutra a questa temperatura sono quindi:
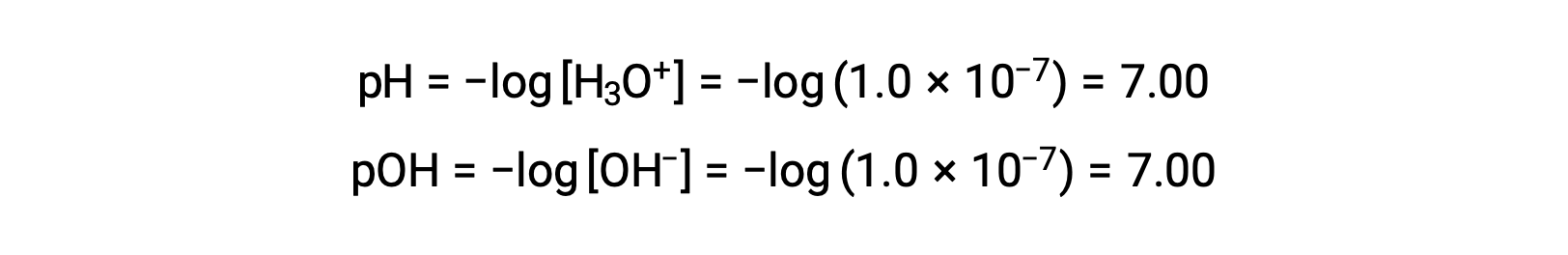
E così, a questa temperatura, le soluzioni acide sono quelle con molarità ioniche di idronio superiori a 1,0 × 10−7 M e molare di ioni idrossido inferiori a 1,0 × 10−7 M (corrispondenti a valori di pH inferiori a 7,00 e valori di pOH superiori a 7,00). Le soluzioni di base sono quelle con molarità ionici di idronio inferiori a 1,0 × 10−7 M e molare di ioni idrossido superiori a 1,0 × 10−7 M (corrispondenti a valori di pH superiori a 7,00 e valori di pOH inferiori a 7,00).
Poiché la costante di autoionizzazione KW dipende dalla temperatura, queste correlazioni tra i valori di pH e gli aggettivi acidi/neutri/di base saranno diverse a temperature diverse da 25 °C. Ad esempio, la molarità dell'idronio dell'acqua pura a 80°C è di 4,9 × 10−7 M, che corrisponde ai valori di pH e pOH di:
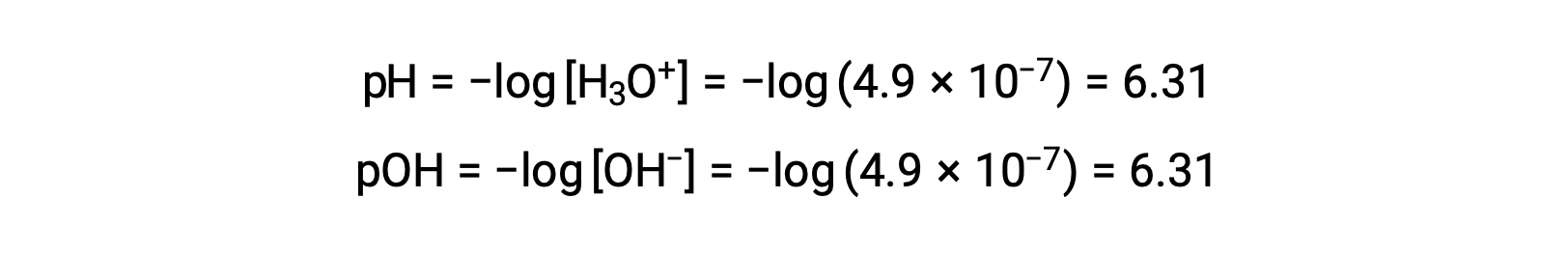
A questa temperatura, le soluzioni neutre mostrano pH = pOH = 6,31, le soluzioni acide presentano pH inferiore a 6,31 e pOH maggiore di 6,31, mentre le soluzioni di base presentano pH maggiore di 6,31 e pOH inferiore a 6,31. Questa distinzione può essere importante quando si studiano determinati processi che si verificano ad altre temperature, come le reazioni enzimatiche negli organismi a sangue caldo a una temperatura intorno ai 36 - 40 °C. Salvo diversa indicazione, si presume che i riferimenti ai valori di pH siano quelli a 25 °C.
Questo testo è adattato da Openstax, Chemistry 2e, Sezione 14.2: pH e pOH.
Dal capitolo 15:

Now Playing
15.4 : Scala del pH
Acidi e basi
66.8K Visualizzazioni

15.1 : Acidi e basi di Bronsted-Lowry
Acidi e basi
88.1K Visualizzazioni

15.2 : Forze acido / base e costanti di dissociazione
Acidi e basi
59.1K Visualizzazioni

15.3 : Acqua: un acido e una base Bronsted-Lowry
Acidi e basi
48.6K Visualizzazioni

15.5 : Punti di forza relativi delle coppie coniugate acido-base
Acidi e basi
44.4K Visualizzazioni

15.6 : Soluzioni forti di acidi e basi
Acidi e basi
30.6K Visualizzazioni

15.7 : Soluzioni di acidi deboli
Acidi e basi
36.9K Visualizzazioni

15.8 : Soluzioni di basi deboli
Acidi e basi
21.9K Visualizzazioni

15.9 : Miscele di acidi
Acidi e basi
19.3K Visualizzazioni

15.10 : Ioni come acidi e basi
Acidi e basi
22.7K Visualizzazioni

15.11 : Determinazione del pH delle soluzioni saline
Acidi e basi
42.7K Visualizzazioni

15.12 : Acidi poliprotici
Acidi e basi
28.3K Visualizzazioni

15.13 : Forza acida e struttura molecolare
Acidi e basi
30.2K Visualizzazioni

15.14 : Acidi e Basi di Lewis
Acidi e basi
42.4K Visualizzazioni