Alcune sostanze organiche cambiano colore in soluzione diluita quando la concentrazione di ioni idronio raggiunge un valore particolare. Ad esempio, la fenolftaleina è una sostanza incolore in qualsiasi soluzione acquosa con una concentrazione di ioni idronio maggiore di 5,0 × 10−9 M (pH < 8.3). In soluzioni più basilari in cui la concentrazione di ioni idronio è inferiore a 5,0 × 10−9 M (pH > 8,3), è rossa o rosa. Sostanze come la fenolftaleina, che può essere utilizzata per determinare il pH di una soluzione, sono chiamate indicatori acido-base. Gli indicatori acido-base sono acidi organici deboli o basi organiche deboli.
L'equilibrio in una soluzione dell'indicatore acido-base metila arancione, un acido debole, può essere rappresentato da un'equazione in cui usiamo HIn come semplice rappresentazione per la complessa molecola di arancio metile:
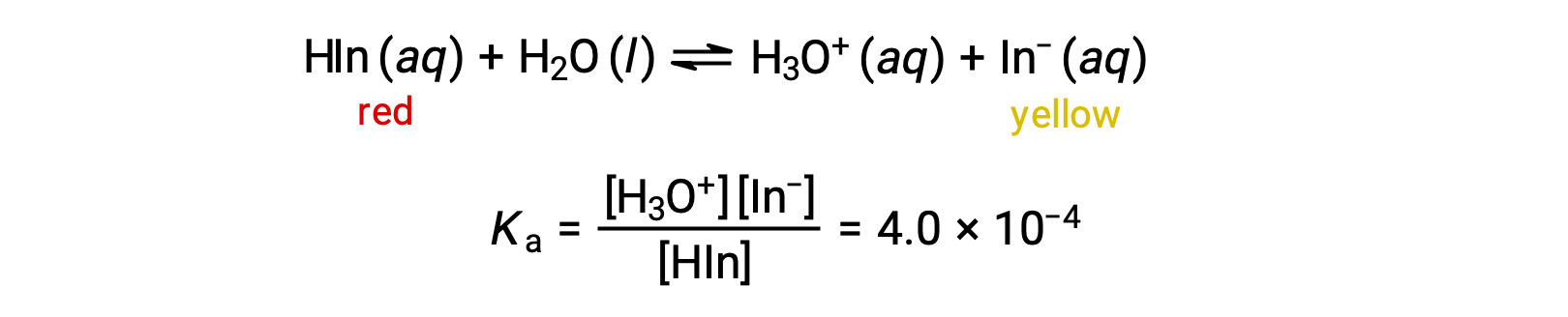
L'anione di arancio metile, In−, è giallo, e la forma nonionizzata, HIn, è rossa. Quando aggiungiamo acido a una soluzione di arancio metilico, l'aumento della concentrazione di ioni di idronio sposta l'equilibrio verso la forma rossa non ionizzata, secondo il principio di Le Châtelier. Se aggiungiamo la base, spostiamo l'equilibrio verso la forma gialla. Questo comportamento è completamente analogo all'azione dei buffer.
Il colore percepito di una soluzione indicatore è determinato dal rapporto tra le concentrazioni delle due specie In− e HIn. Se la maggior parte dell'indicatore (tipicamente circa il 60−90% o più) è presente come In−, il colore percepito della soluzione è giallo. Se la maggior parte è presente come HIn, il colore della soluzione appare rosso. L'equazione di Henderson-Hasselbalch è utile per comprendere la relazione tra il pH di una soluzione indicatore e la sua composizione (quindi, colore percepito):
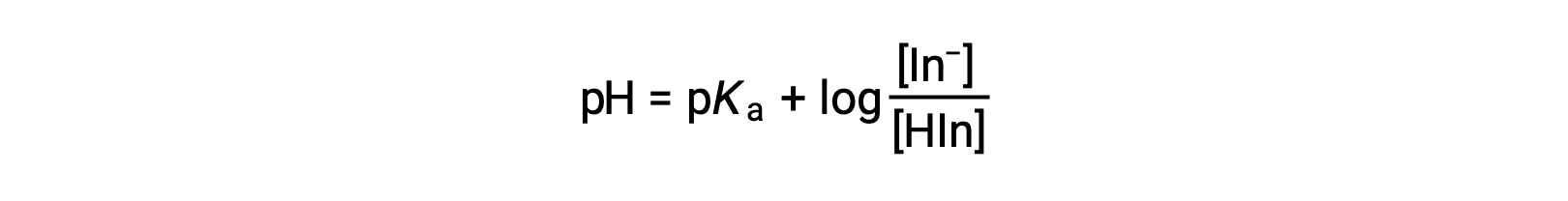
Nelle soluzioni in cui pH > pKa, il termine logaritmico deve essere positivo, indicando un eccesso della forma di base coniugata dell'indicatore (soluzione gialla). Quando pH > pKa, il termine log deve essere negativo, indicando un eccesso dell'acido coniugato (soluzione rossa). Quando il pH della soluzione è vicino all'indicatore pKa, sono presenti quantità apprezzabili di entrambi i partner coniugati e il colore della soluzione è quello di una combinazione additiva di ciascuno (giallo e rosso, che produce arancione). L'intervallo di variazione del colore (o intervallo di pH) per un indicatore acido-base è definito come l'intervallo di valori di pH su cui si osserva una variazione di colore, e per la maggior parte degli indicatori questo intervallo èapprossimativamente pKa ± 1.
Ci sono molti diversi indicatori acido-base che coprono una vasta gamma di valori di pH e possono essere usati per determinare il pH approssimativo di una soluzione sconosciuta per processo di eliminazione. Indicatori universali e carta per pH contengono una miscela di indicatori e mostrano colori diversi a diversi pH.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.7: Titolazioni acido-base.
Dal capitolo 16:

Now Playing
16.8 : Indicatori
Equilibri acido-base e di solubilità
47.5K Visualizzazioni

16.1 : Effetto ionico comune
Equilibri acido-base e di solubilità
40.5K Visualizzazioni

16.2 : Buffer
Equilibri acido-base e di solubilità
162.9K Visualizzazioni

16.3 : Equazione di Henderson-Hasselbalch
Equilibri acido-base e di solubilità
67.5K Visualizzazioni

16.4 : Calcolo delle variazioni di pH in una soluzione tampone
Equilibri acido-base e di solubilità
52.1K Visualizzazioni

16.5 : Efficacia del buffer
Equilibri acido-base e di solubilità
48.1K Visualizzazioni

16.6 : Calcoli di titolazione: acido forte - base forte
Equilibri acido-base e di solubilità
28.7K Visualizzazioni

16.7 : Calcoli di titolazione: acido debole - base debole
Equilibri acido-base e di solubilità
43.2K Visualizzazioni

16.9 : Titolazione di un acido poliprotico
Equilibri acido-base e di solubilità
95.3K Visualizzazioni

16.10 : Equilibrio di solubilità
Equilibri acido-base e di solubilità
51.0K Visualizzazioni

16.11 : Fattori che influenzano la solubilità
Equilibri acido-base e di solubilità
32.7K Visualizzazioni

16.12 : Formazione di ioni complessi
Equilibri acido-base e di solubilità
22.9K Visualizzazioni

16.13 : Precipitazione di ioni
Equilibri acido-base e di solubilità
27.3K Visualizzazioni

16.14 : Analisi qualitativa
Equilibri acido-base e di solubilità
19.7K Visualizzazioni

16.15 : Curve di titolazione acido-base
Equilibri acido-base e di solubilità
125.2K Visualizzazioni