5.3 : Acidi e basi: Ka, pKa e forze relative
Questa lezione approfondisce un aspetto critico delle forze relative di acidi e basi. La forza di un acido viene valutata dalla dissociazione dell'acido nella sua base coniugata e in uno ione idronio in acqua. La completa dissociazione di un acido forte è confermata da una concentrazione molto elevata di ioni idronio. Di conseguenza, un processo di dissociazione incompleto afferma un acido debole. Pertanto, in queste reazioni l'equilibrio si trova nella direzione in avanti per gli acidi forti e all'indietro per gli acidi deboli.
Di conseguenza, la forza acida è definita dalla concentrazione di molecole di acido non dissociate e ioni idronio. Sebbene l'acido debole possa essere stimato tramite la costante di equilibrio (Keq), esso è costante per una soluzione diluita e la variazione della concentrazione di acqua è trascurabile. Questa osservazione porta ad una costante di equilibrio modificata nota come costante di acidità o costante di dissociazione, Ka. Per definire la costante di acidità, cioè una scala di acidità, consideriamo la generica reazione acido-base:
Figura 1: Dissociazione di un acido generico in acqua
Qui, HA denota l'acido generico e A− denota la sua base coniugata. La seguente espressione rappresenta la costante di acidità per questa reazione.
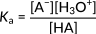
Figura 2: Costante di acidità per una generica dissociazione acida
Questa relazione si concentra sulla concentrazione di ioni idronio nel numeratore. Di conseguenza, un aumento di questi ioni porta ad un aumento della costante di acidità e ad un acido più forte. Negli acidi organici, tipicamente, el magnitudo di Ka è distribuita su diversi ordini. Pertanto, la forza dei diversi acidi è espressa in termini di valori di pKa, calcolati come logaritmo negativo di Ka:
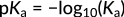
Figura 3: Espressione di pKa
Qui il segno meno indica la relazione inversa tra il valore pKa e l'acidità. Come chiarito con l'acido benzoico rispetto all'acido bromidrico, un valore pKa più alto equivale a un valore Ka più basso, che indica un acido più debole.
Per estensione del principio sopra esposto, i valori pKa possono anche stabilire la forza di una base. Poiché la dissociazione di una base forma un acido coniugato, un acido coniugato più forte corrisponde a una base più debole. Ad esempio, considera il metanolo rispetto all'etilammina. L'acido coniugato del metanolo con un valore pKa di -3,8 è più acido dell'acido coniugato dell'etilammina con un valore pKa di 10,6. Quindi, il metanolo è una base più debole dell'etilammina.