È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutazione bidimensionale Prove di cristallizzazione delle proteine di membrana per piccoli studi di biologia strutturale di Cristallografia Electron
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Valutazione bidimensionale (2D) prove di cristallizzazione per la formazione degli array ordered proteine di membrana è un compito molto critico e difficile in cristallografia elettroni. Qui si descrive il nostro approccio nello screening per l'individuazione e cristalli 2D di proteine di membrana prevalentemente piccole nel range di 15 - 90kDa.
Abstract
Cristallografia elettroni si è evoluto come un metodo che può essere utilizzato in alternativa o in combinazione con tridimensionale cristallizzazione e cristallografia a raggi X per lo studio struttura-funzione domande di proteine di membrana, così come proteine solubili. Screening per bidimensionali (2D) i cristalli di microscopia elettronica a trasmissione (EM) è un passaggio fondamentale nella ricerca, l'ottimizzazione e selezione dei campioni ad alta risoluzione di raccolta dati da Cryo-EM. Qui si descrivono le tappe fondamentali nell'identificazione grandi e ordinato, così come piccoli array 2D, che possono potenzialmente fornire informazioni critiche per l'ottimizzazione delle condizioni di cristallizzazione.
Grazie alla collaborazione con diversi ingrandimenti a EM, dati su una serie di parametri critici si ottiene. Ingrandimento inferiore fornisce dati preziosi sulle dimensioni e morfologia della membrana. A maggiore ingrandimento, dimensioni possibili cristallo ordine e 2D sono determinati. In questo contesto, è descritto come CCD e online-trasformate di Fourier sono utilizzati a più alto ingrandimento per valutare proteoliposomi per l'ordine e la dimensione.
Mentre cristalli 2D di proteine di membrana sono più comunemente coltivate mediante ricostituzione con la dialisi, la tecnica di screening è ugualmente applicabile per i cristalli di prodotto con l'aiuto di monostrati, nativo cristalli 2D, e ha ordinato gli array di proteine solubili. Inoltre, i metodi qui descritti sono applicabili alla proiezione di cristalli 2D di ancora più piccoli così come proteine di membrana più grande, dove proteine più piccole richiedono la stessa quantità di cura per l'identificazione come il nostro esempio e il reticolo di proteine più grandi potrebbero essere più facilmente identificabili nelle prime fasi dello screening.
Protocollo
1. Preparazione della griglia di prove di cristallizzazione 2D
- Carbonio rivestite 400-maglia di rame EM griglie sono preparati da macchia negativa. Acetato di uranile è usato frequentemente e offre una lunga macchia in termini di conservazione della soluzione per diversi mesi prima di utilizzarlo così come idoneità conservazione a lungo termine delle reti. Al contrario, altre macchie negative come formiato di uranile, fornendo colorazione eccellente, devono essere appena fatto 1. Per la preparazione veloce di un gran numero di griglie da utilizzare per lo screening dei processi di cristallizzazione 2D, una versione modificata di colorazione negativa viene utilizzato. Un volume di 2 ml di campione è pipettato su una griglia di carbonio coperto EM e incubate per 60 s. Questo è seguito da blotting dal bordo con un pezzo strappato di Whatman # 4 carta da filtro (Figura 1; video), e poi 2 ml di acetato di uranile 1% vengono applicate immediatamente, che sono ancora una volta cancellati dal bordo della griglia dopo 30 s. Toccando la griglia sul bordo con il bordo strappato della carta da filtro garantisce la rimozione ottimale di liquido senza rimuovere proteoliposomi. Inoltre, l'essiccazione al bordo della griglia assicura una migliore conservazione del film di carbonio. Si deve prestare attenzione nella preparazione e gestione delle reti, nella rottura del film di carbonio delicato previene l'adesione del campione e può comportare una rappresentazione inesatta del campione. Mentre i volumi campione tradizionalmente più grandi su 5 microlitri erano e sono normalmente utilizzati per la preparazione della griglia, preziosi campioni possono essere salvati, riducendo il volume a 2 microlitri o meno 2.
- Per produrre il più grande possibile membrane, alcuni dei nostri campioni richiedono alte concentrazioni di glicerolo o saccarosio (10-20%) di essere presenti nel buffer di dialisi. Questo può avere un effetto negativo sulla preparazione della griglia, come il glicerolo o saccarosio è altamente viscosi e impedisce di acetato di uranile da penetrare correttamente nel buffer, e quindi incompleto colorazione delle membrane. Di conseguenza, un reticolo possibile sarà oscurato. In entrambi i casi il buffer può essere scambiato per centrifugazione dei campioni e sostituzione con glicerolo / saccarosio senza buffer (non mostrato), o le griglie possono essere lavati con tampone o glicerolo / saccarosio senza buffer in una sola per diversi cicli prima di colorazione negativa simile a una tecnica usata per la Cryo-EM 3,4.
2. Valutare Prove di cristallizzazione 2D di EM
- A seconda del tipo di supporto del campione, o uno o più griglie vengono caricati. Un ingrandimento di 2-10K, che sarà denominato qui come ingrandimenti intermedi, consente una prima impressione di distribuzione media e l'estensione della dispersione delle membrane, la morfologia e le dimensioni, che è preso atto nel notebook laboratorio 5. Aree idonee vengono registrati come una panoramica rappresentativa, con l'aiuto di una telecamera CCD o, se una camera CCD non è disponibile, su pellicola.
- Basso ingrandimento nel range di circa 400-800x è utilizzato nei momenti in cui una panoramica di tutto il campione / griglia è voluta. Pur non essendo impiegato con ogni griglia, basso ingrandimento fornisce preziose informazioni di aiuto nella valutazione della preparazione della griglia, in termini di diversi aspetti: sia le macchie negativo e il potenziale rottura parziale del film di carbonio, la concentrazione del campione sulla griglia di partenza, e forse non uniforme distribuzione proteoliposome. Quadrati della griglia individuo potrebbe essere visto con il binocolo o macchina fotografica CCD. Con un po 'EM è possibile salvare posizioni di particolare interesse, che possono essere richiamati per un controllo in seguito a più alto ingrandimento.
- Una volta che una zona della griglia di interesse è stato identificato sia a basso ingrandimento o intermedi, l'ingrandimento è cambiato a circa 50K-60K. A seconda membrana, cristallo e cellule dimensioni dell'unità, se noto, ingrandimenti più bassi 30K e 80K alto come vengono utilizzati. La gamma di ingrandimento di 30-80K sarà indicato come alto ingrandimento a scopo di screening per cristalli 2D. Messa a fuoco avviene sia nella messa a fuoco delle basse dosi di set-up, con conseguente passaggio di immagine / foto impostazione, o in prossimità dell'area di interesse.
- In caso di ambiguità se l'area di interesse è infatti una membrana, il campione è controllato per il carbonio-film nelle dimensioni dei proteoliposomi, mica, o altri artefatti. A tal fine, bordi rivelano pieghevole e morfologia tipiche.
- Ora l'area di interesse viene ispezionato con una telecamera CCD. Una immagine CCD viene raccolto a 30K-80K ingrandimento, a seconda delle dimensioni della membrana, di proteine o di cellule dimensioni dell'unità, o conosciuta zona cristallina. Il reticolo di una proteina di membrana più piccolo e / o per lo più idrofobiche non è necessariamente visibile dalla valutazione visiva delle immagini CCD stesso. Sia l'intera immagine viene utilizzata per un gioco-trasformata di Fourier (FT, o fast FT-FFT). Questo FT conterrà una notevole quantità di rumore, tuttavia, se l'array ordinato è piccolo. Così, un formato ridotto immagine scatola consentirà una migliore rapporto segnale-rumore di un smaller cristallo e più facile identificazione. A tal fine, la casella viene spostato sopra l'immagine e un FT dal vivo è valutata.
L'intensità / luminosità del fascio viene regolata tenendo basse dosi di condizioni per il campione, così come le impostazioni della fotocamera CCD in mente. A seconda della camera CCD utilizzato, la gamma del FT dal vivo è regolata per l'identificazione ottimale degli array ordinato. Un valore troppo alto può oscurare punti grazie ai contributi del rumore, e un valore troppo basso di gamma impedirà più deboli macchie di essere identificati. Questi punti deboli potrebbe essere dovuto alla minore array cristallino con macchie sul Financial Times appena al di sopra del livello di rumore.
Mentre i dati a più alta risoluzione sono stati raccolti su un piccolo numero di campioni 6, comunemente la risoluzione dei cristalli 2D negativamente macchiato è limitata o non devono essere obbligati ad essere migliore di risoluzione di circa 15 bis. Con un defocus di circa -400 nm, non più di 1-3 ordini di spot dovrebbero essere facilmente identificabili. I campioni non sono generalmente valutati per la risoluzione, come Cryo-EM raccolta dati darà un'indicazione corretta della massima risoluzione ottenibile. Nitidezza di spot e mosaicity possibili sono noti però.
- Membrane differenti, così come morfologie membrana, vengono valutati per ordine ad alto ingrandimento. Questo è particolarmente critico all'inizio o fasi intermedie di processi di cristallizzazione in 2D, come proteoliposomi più piccoli e non grandi o patch di membrana può contenere le aree più promettenti. Percentuali molto basse di cristalli 2D richiederà l'acquisizione di immagini e FT, o diffrazione ottica, di un gran numero di immagini in quanto l'identificazione iniziale di array ordinati frequentemente portare a rapido miglioramento delle dimensioni e qualità 2,4,7.
3. Rappresentante Risultati
Proteoliposomi idealmente ordinato visualizzare facilmente riconoscibile, macchie nitide. Cristalli grandi e ben ordinata sono facilmente identificabili dal online-FT di immagini CCD o diffrazione ottica del microscopio.
L'esempio mostra cristalli 2D di una proteina di membrana piccolo di 18kDa che sono fino ad alcuni micron di dimensione. Macchie sul FT sono facilmente identificabili e taglienti. Il movimento del live-FT box mostra che il reticolo è continuo senza mosaicity. Il reticolo di una proteina più grande, con un dominio più esteso solubili possono essere identificati sul piccolo schermo della EM. Raccolta di immagini CCD e FT è necessario per fornire un mezzo di una migliore valutazione e per ottenere informazioni su, ad esempio, mosaicity possibile (mostra FT). Quando calcolo di una FT di un proteoliposome che non viene imposta, il rumore può essere inizialmente scambiato per spot. Mentre la casella per il live-FT è spostato, però, gli spot spariranno. D'altra parte, piccoli array, con cristallinità discutibile, avranno i loro angoli ancora ferma quando il live-FT si muove anche di poco sopra la zona dell'immagine. Inoltre, questi piccoli cristalli possono essere riconosciute dal solito hanno le stesse dimensioni delle celle unità, e le distanze tra i punti in FTS può essere misurato in vari modi, ad esempio con un cerchio di una dimensione specifica. Cristalli di lipidi mostra una morfologia distinta reticolo e FT.
Non è raro incontrare precipitazioni nelle prove iniziali. Qui la precipitazione delle proteine senza ricostituzione deve essere distinto da aggregati lipidici piccola. I campioni che sembrano essere precipitati a basso ingrandimento spesso si rivelano essere aggregati lipidici se visto a più alto ingrandimento. A fronte di ispezione a 30-50K, i bordi di queste strutture scuro rivela loro di essere composto da membrane senza precipitazione delle proteine. Queste osservazioni sono importanti quanto gli aggregati lipidici potrebbe essere aumentata per dimensioni a membrane grandi i seguenti esperimenti.
Scarsi risultati in campioni di valutazione sono talvolta collegati ad una bassa concentrazione di membrana che impedisce un adeguato screening e veloce. Questo può spesso essere superato con l'uso di una concentrazione di proteine per la cristallizzazione 2D con la dialisi. In alternativa, le membrane può essere lasciata riposare per alcuni giorni sul fondo della provetta Eppendorf durante la conservazione. In alcuni casi un rapido assestamento, o quasi istantanea delle membrane si verifica e pipettaggio dal fondo del tubo si tradurrà in una maggiore densità di membrana sulla griglia. Un'altra opzione è molto più veloce centrifugazione (a 3000-8000 giri per 1-3 minuti) di campioni con successivi prelievi dal fondo del tubo.
I campioni in condizioni ottimali conterrà una grande percentuale di cristalli 2D. Non è necessario puntare per un aspetto omogeneo delle membrane, come la raccolta più grande e cristalli ben ordinata 2D sono selezionati visivamente per i dati. Questi tipi di campioni sarà facilmente riconosciuta quando le prove di cristallizzazione si ripetono così come quando i campioni sono utilizzati perCryo-EM raccolta di dati, per un numero massimo di immagini ad alta risoluzione.
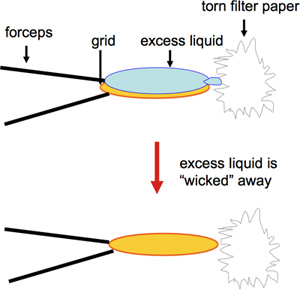
Figura 1. La figura mostra assorbente il bordo della griglia con un pezzo strappato di Whatman # 4 carta da filtro.
Discussione
Corretta valutazione dei campioni esige un'attenta valutazione di un numero sufficiente di membrane. Per esempio, i campioni con più basso del 2% array cristallino di oltre 180 proteoliposomi ripreso ha dato delle informazioni critiche per l'ottimizzazione rapida delle condizioni di cristallizzazione 2D 7.
Quando precipitazione delle proteine si verifica, una griglia potrebbe essere abbandonata dallo screening ulteriormente dopo l'ispezione a basso ingrandimento...
Riconoscimenti
Ringraziamo i nostri collaboratori per la fornitura di campioni di proteine di valore, che ha contribuito ad alcune delle nostre esperienze e le osservazioni relativi metodi. Günther Schmalzing gentilmente fornito l'opportunità di FR di aderire a questo progetto. Barbara Armbruster, Jacob Brink e Deryck Mills Si ringraziano per il loro aiuto eccezionale e di ingresso delle apparecchiature. Il finanziamento è stato fornito dal NIH concedere HL090630.
Materiali
| Name | Company | Catalog Number | Comments |
| 400-mesh copper TEM grids coated with carbon film | |||
| forceps: regular and anti-capillary | Dumont #5 and Dumont N5AC or similar | ||
| Micropipette and pipette tips | |||
| Whatman #4 filter paper | |||
| 1% uranyl acetate | |||
| Dialysis sample to be screened for 2D crystals | |||
| Glycerol/sucrose-free dialysis buffer | Optional | ||
| JEOL-1400 transmission electron microscope (TEM) | similar 80 – 120kV TEM equipped with an Lab6 or tungsten filament and film and/or CCD cameras (Gatan Orius SC1000 and/or UltraScan1000 CCD cameras and Gatan Digitial Micrograph software package or Tietz cameras (TVIPS)) |
Riferimenti
- Johansen, B. V. Bright field electron microscopy of biological specimens V. A low dose pre-irradiation procedure reducing beam damage. Micron. 7, 145-156 (1976).
- Schmidt-Krey, I. Electron crystallography of membrane proteins: Two-dimensional crystallization and screening by electron microscopy. Methods. 41, 417-426 (2007).
- Wang, D. N., Kühlbrandt, W. High-resolution electron crystallography of light-harvesting chlorophyll a/b-protein complex in three different media. J Mol Biol. 217, 691-699 (1991).
- Schmidt-Krey, I., Rubinstein, J. L. Electron cryomicroscopy of membrane proteins: specimen preparation for two-dimensional crystals and single particles. Micron. , (2010).
- Schmidt-Krey, I., Mutucumarana, V., Haase, W., Stafford, D. W., Kühlbrandt, W. Two-dimensional crystallization of human vitamin K-dependent γ-glutamyl carboxylase. J Struct Biol. 157, 437-442 (2007).
- Trachtenberg, S., DeRosier, D. J., Zemlin, F., Beckmann, E. Non-helical perturbations of the flagellar filament: Salmonella typhimurium SJW117 at 9.6 Å resolution. J Mol Biol. 276, 759-773 (1998).
- Zhao, G., Johnson, M. C., Schnell, J. R., Kanaoka, Y., Irikura, D., Lam, B. K., Austen, K. F., Schmidt-Krey, I. Two-dimensional crystallization conditions of human leukotriene C4 synthase requiring a particularly large combination of specific parameters. J Struct Biol. 169, 450-454 (2010).
- Cheng, A., Leung, A., Fellmann, D., Quispe, J., Suloway, C., Pulokas, J., Abeyrathne, P. D., Lam, J. S., Carragher, B., Potter, C. S. Towards automated screening of two-dimensional crystals. J Struct Biol. 160, 324-331 (2007).
- Vink, M., Derr, K. D., Love, J., Stokes, D. L., Ubarretxena-Belandia, I. A high-throughput strategy to screen 2D crystallization trials of membrane proteins. J Struct Biol. 160, 295-304 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon