È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In vivo Near Infrared fluorescenza (NIRF) intravascolare Imaging Molecolare della placca infiammatoria, un approccio multimodale per Imaging di aterosclerosi
In questo articolo
Riepilogo
Noi dettaglio un nuovo fluorescenza nel vicino infrarosso (NIRF) catetere per 2-dimensionale di imaging intravascolare molecolare della biologia della placca In vivo. Il catetere NIRF può visualizzare fondamentali processi biologici come l'infiammazione segnalazione sulla presenza di fluorocromi attivabili e mirata placca avido NIR. Il catetere utilizza clinica requisiti di progettazione e di potere, ed è mirato per applicazioni in arterie coronarie umane. Lo studio di ricerca che segue descrive una strategia di imaging multimodale che utilizza un romanzo In vivo NIRF catetere intravascolare di immagine e quantificare placca infiammatoria nel proteoliticamente attivo atheromata coniglio infiammata.
Abstract
The vascular response to injury is a well-orchestrated inflammatory response triggered by the accumulation of macrophages within the vessel wall leading to an accumulation of lipid-laden intra-luminal plaque, smooth muscle cell proliferation and progressive narrowing of the vessel lumen. The formation of such vulnerable plaques prone to rupture underlies the majority of cases of acute myocardial infarction. The complex molecular and cellular inflammatory cascade is orchestrated by the recruitment of T lymphocytes and macrophages and their paracrine effects on endothelial and smooth muscle cells.1
Molecular imaging in atherosclerosis has evolved into an important clinical and research tool that allows in vivo visualization of inflammation and other biological processes. Several recent examples demonstrate the ability to detect high-risk plaques in patients, and assess the effects of pharmacotherapeutics in atherosclerosis.4 While a number of molecular imaging approaches (in particular MRI and PET) can image biological aspects of large vessels such as the carotid arteries, scant options exist for imaging of coronary arteries.2 The advent of high-resolution optical imaging strategies, in particular near-infrared fluorescence (NIRF), coupled with activatable fluorescent probes, have enhanced sensitivity and led to the development of new intravascular strategies to improve biological imaging of human coronary atherosclerosis.
Near infrared fluorescence (NIRF) molecular imaging utilizes excitation light with a defined band width (650-900 nm) as a source of photons that, when delivered to an optical contrast agent or fluorescent probe, emits fluorescence in the NIR window that can be detected using an appropriate emission filter and a high sensitivity charge-coupled camera. As opposed to visible light, NIR light penetrates deeply into tissue, is markedly less attenuated by endogenous photon absorbers such as hemoglobin, lipid and water, and enables high target-to-background ratios due to reduced autofluorescence in the NIR window. Imaging within the NIR 'window' can substantially improve the potential for in vivo imaging.2,5
Inflammatory cysteine proteases have been well studied using activatable NIRF probes10, and play important roles in atherogenesis. Via degradation of the extracellular matrix, cysteine proteases contribute importantly to the progression and complications of atherosclerosis8. In particular, the cysteine protease, cathepsin B, is highly expressed and colocalizes with macrophages in experimental murine, rabbit, and human atheromata.3,6,7 In addition, cathepsin B activity in plaques can be sensed in vivo utilizing a previously described 1-D intravascular near-infrared fluorescence technology6, in conjunction with an injectable nanosensor agent that consists of a poly-lysine polymer backbone derivatized with multiple NIR fluorochromes (VM110/Prosense750, ex/em 750/780nm, VisEn Medical, Woburn, MA) that results in strong intramolecular quenching at baseline.10 Following targeted enzymatic cleavage by cysteine proteases such as cathepsin B (known to colocalize with plaque macrophages), the fluorochromes separate, resulting in substantial amplification of the NIRF signal. Intravascular detection of NIR fluorescence signal by the utilized novel 2D intravascular NIRF catheter now enables high-resolution, geometrically accurate in vivo detection of cathepsin B activity in inflamed plaque.
In vivo molecular imaging of atherosclerosis using catheter-based 2D NIRF imaging, as opposed to a prior 1-D spectroscopic approach,6 is a novel and promising tool that utilizes augmented protease activity in macrophage-rich plaque to detect vascular inflammation.11,12 The following research protocol describes the use of an intravascular 2-dimensional NIRF catheter to image and characterize plaque structure utilizing key aspects of plaque biology. It is a translatable platform that when integrated with existing clinical imaging technologies including angiography and intravascular ultrasound (IVUS), offers a unique and novel integrated multimodal molecular imaging technique that distinguishes inflammatory atheromata, and allows detection of intravascular NIRF signals in human-sized coronary arteries.
Protocollo
Nel modello animale in vivo: Generazione di aterosclerosi aortoiliaco Sperimentale
1) L'angiografia basale e denudazione Balloon
- Prima di chiedere al basale angiografia e denudazione palloncino, un coniglio bianco neozelandese è nutriti con una colesterolo alto (1%) la dieta per 1 settimana. Questo animale è utilizzato per rilevanza traslazionale come 1) la aorto-iliache navi conigli sono dello stesso calibro come umano arterie coronarie (2,5-3.5mm) e 2) l', iperlipidemici pallone-infortunio modello genera aterosclerosi infiammato cuscinetto simili cellule infiammatorie (macrofagi ) e molecole (catepsine) come l'aterosclerosi umana.
- A seguito di alimentazione colesterolo, l'animale viene anestetizzato con propofol e ketamina. Un one-inch linea mediana ventrale incisione del collo è realizzato con con una dimensione di 15-bisturi lama. Utilizzando tecniche di dissezione smussa, i muscoli sotto la fascia sul lato destro della trachea è esposto. Il muscolo sternocephalicus sinistra è divisa lungo il raccordo del tessuto connettivo, e il diritto arteria carotide comune è esposto. L'arteria è separato dal nervo vago. Anelli di sutura prossimale e distale sono immessi sul arteria per consentire retrazione e occlusione. A 1 a 2mm smussati arteriotomia è fatto attraverso il quale un 5 Francese (diametro esterno 1,67 millimetri) guaina vascolare è inserita ed eparina (1000μ/mL, ~ 150units/kg) viene somministrato intra-arteriosa attraverso la guaina.
- Mezzo di contrasto (Ultravist) viene quindi iniettato (da 1 a 2 ml) per un periodo di 2 secondi per ottenere un angiogramma controllo dell'aorta distale ed entrambe le arterie iliache.
- Le arterie e aorta ileofemorale vengono feriti da denudazione endoteliale. Utilizzando metodi di fluoroscopia standard, un catetere 3FR embolectomia di Fogarty è posizionato in arteria distale ileofemorale e gonfiato con 0,3-0,5 cc di contrasto (50% contrast/50% salina) o aria. Il catetere viene poi ritirato prossimalmente nel suo stato gonfiato a distanza lungo l'iliaca destra e l'aorta distale fino al decollo della arteria renale sinistra. Dopo la denudazione pallone, l'angiografia è ripetuto per documentare pervietà del vaso. A seguito di angiografia, guaine e tutti i cateteri vengono rimossi e il prossimale dell'arteria carotide comune è la legatura, il muscolo e fascia sono suturate con una sutura 4 / 0 riassorbibile, e l'incisione cutanea è chiuso con un 4 / 0 non riassorbibile sutura.
- L'animale è poi permesso di recuperare con la somministrazione di una dose di antibiotico (cefazolina, 0,5 grammi IM). Farmaci per il dolore tra 0,01 mg / kg IM buprenorfina (due volte al giorno se necessario). Gli animali sono poi proseguito l'1% del colesterolo per 4 settimane post-palloncino denudazione. Alla 5 ° settimana, gli animali sono passati ad una dieta colesterolo 0,3%.
Integrato multi-modale Imaging di Coniglio Atheromata
2) Etichettatura di proteoliticamente attivo placca infiammata con nanosensori iniettabili, angiografia, ecografia intravascolare (IVUS), e in vivo intravascolare NIRF immagini di Coniglio Ateroma
- Otto settimane dopo un trauma palloncino e 24 ore prima di imaging, il coniglio viene iniettato per via endovenosa con 500 nmol / kg Prosense/VM110 (PerkinElmer) tramite vena orecchio.
- Ventiquattro ore dopo l'iniezione, gli animali sono anestetizzati e l'accesso arterioso è ottenuto tramite sinistra arteria carotide comune (vedi punto 1.2). Intra-arteriosa eparina viene somministrato (150 unità / kg). Baseline angiografia è ottenuto come sopra.
- Un catetere IVUS è caricato su una clinica in grado coronarica 0,014 filo pollici e inserito nel fodero. Utilizzando guida fluoroscopica, la punta radiopaca del filo è posizionato distalmente in arteria iliaca destra. Il catetere IVUS è poi avanzato in arteria iliaca prossimale utilizzando una tecnica standard clinico monorotaia.
- A 100 pullback mm è iniziato e le immagini vengono registrate. Ricostruzione longitudinale della nave si ottiene e placca luminale è identificato.
- Il catetere NIRF 11,12 viene caricato sul filo di 0,014 pollici (monorotaia sistema) e il catetere viene accuratamente inserito nella guaina e la testa di imaging è posizionato distalmente in arteria iliaca destra.
- Multipli pullbacks automatizzati (1 mm / sec pullback longitudinale, 30 colpi al minuto) sono eseguite e segnali di fluorescenza all'interno delle zone di aterosclerosi sono noti. Le immagini vengono registrate e il successivo trattamento con scala appropriata e finestre a seconda della distanza del segnale viene raggiunto.
3) L'eutanasia e l'isolamento di ex vivo aorto-iliaca del tessuto
- L'eutanasia è compiuta con 1cc di agente eutanasia (soluzione di 390mg di sodio fenitoina sodio pentobarbital e 50 mg), per via endovenosa, iniezione singola.
- L'albero arterioso è perfuso con soluzione fisiologica 0,9% fino alla vena cava inferiore è chiaro di sangue. Aterosclerotica delle arterie aorta e iliache sono identificati e sezionati libero dai tessuti circostanti. Inoltre, piccoli pezzi di 2 x 2 cm di liver, rene, milza e cuore sono anche ottenuti.
- Ex vivo NIRF imaging con il catetere intravascolare NIRF immagini può essere fatto in questa fase. La nave è allungata e il catetere NIRF è reinserito in aorta prossimale fino a quando la testa di imaging è posizionato a livello dell'arteria iliaca destra o di biforcazione. Multipli pullbacks automatici vengono eseguiti come sopra (vedi 2.6).
4) ex vivo fluorescenza Riflettanza Imaging (FRI) di aorta e le arterie iliache sezionato
- Tessuto sezionato viene inserito in 10-20 cc di soluzione fisiologica e trasportati per le analisi ven (Kodak Image Stazione 4000MM Pro, Carestream Health, Inc.).
- Aorta, vasi iliaci sono allungate per approssimare in tempo reale lunghezze e le immagini sono ottenute a più lunghezze d'onda [luce bianca, canale verde fluorescente (ex 495 nm, em 515 nm), Cy5 (ex 565 nm, em 670 nm) e Cy7 (ex 650 nm, em 760 nm)] canali. Una serie di tempi di esposizione sono utilizzati per ogni lunghezza d'onda (0.1-30sec) e le immagini acquisite vengono esportati come DICOM o 16-bit TIFF i file non in scala per ulteriori analisi. Come controlli positivi e negativi, organi (fegato, milza, rene e cuore) sono esposte a canali simili e tempi di esposizione.
- Aree di segnale aumentato nel vicino infrarosso canale (780nm +) sono noti aterosclerotiche nelle arterie.
5) Integrazione del tessuto per l'analisi Sezioni e immunoistochimica
- Aree di normale (non feriti tessuto, cioè l'arteria iliaca sinistra) e le aree di placca sono identificati e piccoli anelli di 5-10 mm di tessuto sono incorporati in ottobre (temperatura di taglio ottimale) dei media. I blocchi sono conservati a -80 C fino al sezionamento.
- Le tecniche standard per le analisi immunoistochimiche e di sezionamento vengono eseguite. Ematossilina ed eosina, Ram-11 e catepsina B colorazione vengono eseguite.
Analisi e integrazione di immagini multimodali (angiografia, IVUS, NIRF e ven.)
6) Elaborazione di immagini NIRF e VEN
- File DICOM contenenti dati di immagini da NIRF e VEN (prese al vicino canale dell'infrarosso da 780 nm) pullback sono trattati con MATLAB e software OsiriX, rispettivamente. Windowing corretto per visualizzare gamma completa di intensità del segnale è ottenuto. Immagini finali sono esportati come file TIFF.
- I file vengono importati nel software standard di elaborazione delle immagini (Keynote può essere utilizzato). Le immagini sono allineati sulla base di punti di riferimento (cioè vertebre su angiogramma, biforcazione iliaca, e dell'arteria renale). Aree di nave normale e placca sono identificati.
- Regioni di interesse (ROI) sono tracciate manualmente (per il tessuto normale e aree di placca) e media intensità di segnale sono acquisite con OsiriX e MATLAB, rispettivamente, sia per ven e immagini NIRF. Per guida appropriata tracciamento, l'immagine IVUS longitudinale della nave viene utilizzato e l'identificazione della nave normale e targa sono facilmente identificabili.
- Obiettivo da sfondo (TBR) rapporti sono calcolati per le zone della placca.
Rappresentante dei risultati:
Al termine del protocollo di cui sopra, siamo in grado di identificare e caratterizzare le aree di attività aumentata della proteasi catepsina nella placca infiammatoria all'interno della aorta e vasi iliaci. L'iniezione di un nanosensore attivabili (Prosense/VM110) ci permette di identificare la placca proteoliticamente attivo. Questi appaiono come segnali luminosi o zone di intensa quando ripreso utilizzando ven nel canale vicino infrarosso (750 nm). Il pullback NIRF correlazione con l'intensità del segnale è aumentato del venerdì e allineamenti con IVUS anatomiche che permettono di registrazione dei segnali NIRF. TBR targa calcolato è ottenuto da venerdì e NIRF erano simili (vedi Figura 3: media NIRF TBR 4.2, significa ven TBR 2,9). Analisi immunoistochimica della placca luminosa conferma la presenza intensa di RAM-11 e l'attività della catepsina B in aree di placca (dati non riportati).
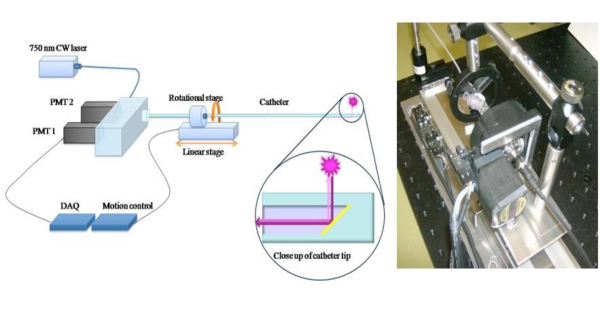
Figura 1. Schematica del catetere 2D NIRF Per estendere il potenziale clinico di un approccio 1D NIRF rilevamento 6, abbiamo costruito un romanzo in 2-D NIRF-catetere per l'imaging intravascolare. 11,12 La fuoriserie catetere è costituito da una fibra ottica (125 micron di diametro alloggiati in tubo di polietilene: 2.9F), che illumina con una sorgente laser a 750 nm di eccitazione. La luce laser è emessa ad un angolo di 90 gradi rispetto all'asse della fibra. Il sistema utilizza due motori automatici (rotazionale e traslazionale) per consentire la concomitante immagini a 360 gradi e pullback longitudinale per ottenere vere immagini 2D. Le immagini utilizzate con il permesso di riferimento 11.
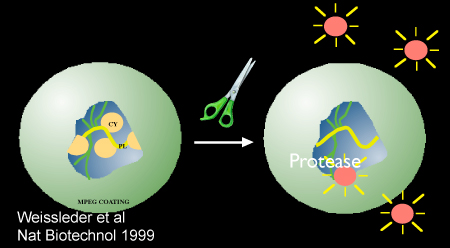
Figura 2. Schematico dimostrando proteasi-mediata attivazione dei nanosensori, Prosense/VM110. Immagine usata con il permesso di riferimento 10.

Figura 3. In vivo ed ex TBRs placca in vivo (target a rapporti di sfondo)
Discussione
Infiammata placche ad alto rischio o vulnerabili sono probabilmente responsabili della maggior parte degli infarti del miocardio. L'identificazione delle targhe precedenti l'inizio dei sintomi ha importanti implicazioni cliniche, sia nel predire gli esiti e guidare la terapia medica. Tradizionali modalità di imaging delle arterie coronariche, come l'angiografia a raggi X in genere si concentrano sulla caratterizzazione dei restringimenti del lume, piuttosto che illumina i profili biologici sottostanti ad al...
Divulgazioni
FAJ - Consulente Ex, VisEn medica; onorari, Boston Scientific
Riconoscimenti
Il supporto per questo lavoro è stato fornito dal National Institutes of Health concedere R01 # 108229 HL, American Heart Association Scientist Development Grant # 0830352N, Howard Hughes Medical Institute Career Development Award, Ventures Broadview, Settimo programma quadro della Comunità europea (FP7/2007-2013 in borsa accordo # 235689), e il MGH William Schreyer Fellowship.
Materiali
| Name | Company | Catalog Number | Comments |
| Prosense 750 | Visen Medical | VM110 | 500 nmol/kg IV injection |
| Heparin Sodium | APP Pharmaceuticals | 401586D | |
| Cephazolin | NovaPlus | 46015683 | |
| Lidocaine HCL 2% | Hospira Inc. | NDC 0409-4277-01 | |
| Buprenorphine | Bedford Laboratories | NDC 55390-100-10 | |
| Ketamine | Hospira Inc. | NDC 0409-2051-05 | |
| High Cholesterol Diet 1% | Research Diets | C30293 | |
| HIgh Cholesterol Diet 0.3% | Research Diets | C30255 |
Riferimenti
- Andersson, J., Libby, P. Adaptive immunity and atherosclerosis. Clin Immunol. 134, 33-46 (2010).
- Calfon, M. A., Vinegoni, C. Intravascular near-infrared fluorescence molecular imaging of atherosclerosis: toward coronary arterial visualization of biologically high-risk plaques. Journal of Biomedical Optics. 15, 011107-011107 (2010).
- Chen, J., Tung, C. -. H. In Vivo Imaging of Proteolytic Activity in Atherosclerosis. Circulation. 105, 2766-2771 (2002).
- Jaffer, F. A., Libby, P. Molecular Imaging of Cardiovascular Disease. Circulation. 116, 1052-1061 (2007).
- Jaffer, F. A., Libby, P. Optical and Multimodality Molecular Imaging: Insights Into Atherosclerosis. Arterioscler Thromb Vasc Biol. 29, 1017-1024 (2009).
- Jaffer, F. A., Vinegoni, C. Real-Time Catheter Molecular Sensing of Inflammation in Proteolytically Active Atherosclerosis. Circulation. 118, 1802-1809 (2008).
- Kim, D. -. E., Kim, J. -. Y. Protease Imaging of Human Atheromata Captures Molecular Information of Atherosclerosis, Complementing Anatomic Imaging. Arterioscler Thromb Vasc Biol. 30, 449-456 (2010).
- Libby, P. Inflammation in atherosclerosis. Nature. 420, 868-874 (2002).
- Naghavi, M., Libby, P. From Vulnerable Plaque to Vulnerable Patient: A Call for New Definitions and Risk Assessment Strategies: Part I. Circulation. 108, 1664-1672 (2003).
- Weissleder, R., Tung, C. -. H. In vivo imaging of tumors with protease-activated near-infrared fluorescent probes. Nat Biotech. 17, 375-375 (1999).
- Razansky, R. N., Rosenthal, A. Near-infrared fluorescence catheter system for two-dimensional intravascular imaging in vivo. Optics Express. 18, 11372-11381 (2010).
- Jaffer, F. A., Calfon, M. A. Two-Dimensional Intravascular Near-Infrared Fluorescence Molecular Imaging of Inflammation in Atherosclerosis and Stent-Induced Vascular Injury. Journal of the American College of Cardiology. 57, 2516-2526 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon