È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazione accurata e semplice della citochina pro-infiammatoria IL-1β utilizzando un intero saggio stimolazione del sangue
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Descriviamo un immunodosaggio semplice per misurare la produzione di citochine pro-infiammatorie, come IL-1 beta di produzione, in pazienti con fenotipi autoinfiammatorie. Attivando le cellule in colture di sangue intero con i modelli molecolari patogeni associati, in particolare con lipopolisaccaride, la secrezione di citochine possono essere convenientemente valutati in surnatanti di sangue intero.
Abstract
Processi infiammatori derivanti dalla secrezione di mediatori solubili da parte delle cellule immunitarie, portare a varie manifestazioni in pelle, le articolazioni e altri tessuti così come omeostasi citochina alterato. Il sistema immunitario innato ha un ruolo cruciale nel riconoscere gli agenti patogeni e altri stimoli endogeni pericolo. Una delle principali citochine rilasciate dalle cellule del sistema immunitario innato è interleuchina (IL) -1. Quindi, utilizziamo un intero saggio stimolazione del sangue per misurare la secrezione di citochine infiammatorie e in particolare della citochina pro-infiammatoria IL-1β 1, 2, 3.
I pazienti con disfunzioni genetiche del sistema immunitario innato che causano sindromi autoinfiammatorie mostrano una versione esagerata di IL-1β matura sulla stimolazione con LPS solo. Al fine di valutare la componente immunitaria innata di pazienti che presentano patologie infiammatorie associate, usiamo un immunodosaggio specifico per rilevare le risposte immunitarie cellulari ai modelli molecolari patogeni associati (PAMPs), come il gram-negativi endotossine batteriche, lipopolisaccaride (LPS ). Queste PAMPs sono riconosciuti dai recettori di riconoscimento dei patogeni (PRR), che si trovano sulle cellule del sistema immunitario innato 4, 5, 6, 7. Un segnale primario, LPS, in concomitanza con un segnale secondario, ATP, è necessario per l'attivazione del inflammasome, un complesso multiproteico che i processi pro-IL-1β alla sua maturazione, forma bioattivi 4, 5, 6, 8, 9, 10.
Il test di sangue intero richiede la manipolazione minima del campione per valutare la produzione di citochine rispetto ad altri metodi che richiedono l'isolamento e la coltura intensiva del lavoro di popolazioni di cellule specifiche. Questo metodo si differenzia da altre analisi del sangue intero stimolazione; piuttosto che diluire i campioni con un rapporto di RPMI mezzi di comunicazione, eseguiamo un globulo bianco contare direttamente dal sangue intero diluito e, quindi, stimolare un determinato numero di globuli bianchi nella cultura 2. I risultati di questo test particolare sangue intero dimostrare una nuova tecnica utile a chiarire coorti di pazienti affetti da pathophysiologies autoinfiammatorie.
Protocollo
1. Raccolta di sangue intero
- Ottenere un minimo di 10 ml di sangue periferico di individui affetti così come età e sesso controlli appaiati sano. Il sangue venoso devono essere raccolti in provette di sodio eparina vacutainer raccolta, piuttosto che utilizzare altri anticoagulanti quali EDTA, e capovolta diverse volte per garantire la corretta miscela con l'eparina sodica. Si noti che 10 ml è il volume minimo di sangue intero richiesta per i campioni placcatura in duplice copia a questo particolare dosaggio.
- I campioni devono essere trattati il più presto possibile dopo la raccolta per i migliori risultati. Tuttavia, sangue eparinato può essere conservato a temperatura ambiente in condizioni di luce fioca fino a 24 ore fino a pronto per essere lavorato (2).
2. Preparazione di sangue intero
- Centrifugare tutti i campioni di sangue a 3000 rpm (con freno disattivato) per dieci minuti a temperatura ambiente. Senza disturbare il buffy coat, il plasma può essere raccolto dalla parte superiore e conservati per altri scopi sperimentali. I campioni di plasma può essere temporaneamente conservati a -20 ° C o -80 ° C per una conservazione a lungo termine
- Una volta al plasma viene raccolta, lavare i campioni di risospendere l'globuli rossi del sangue (globuli rossi) e pellet di buffy coat con i livelli di free (incompleto) RPMI 1640 i media (a temperatura ambiente). Pipetta delicatamente il composto nei tubi di raccolta e trasferimento in una provetta da 50 ml.
- Volume fino a 50 ml con incompleto terreni di coltura RPMI 1640 e capovolgere delicatamente i tubi per creare una miscela omogenea. Centrifugare i campioni a 3000 giri (con freno disattivato) per dieci minuti. Fare in modo non vi è netta separazione, aspirare il surnatante, facendo attenzione a non disturbare il buffy coat. Ripetete questa procedura 2-4 volte a garantire che tutti i contaminanti e citochine legati vengono rimossi prima della stimolazione.
- Dopo l'ultimo lavaggio, risospendere il pellet di globuli rossi e buffy-coat in modo che il volume totale è di 20 ml (per 10 ml di sangue intero inizialmente disegnato) con RPMI 1640 incomplete media. Il volume totale può essere regolato in base al volume di sangue inizialmente disegnato.
- Utilizzando la visione Cellometer, sangue diluito può essere contato senza globuli rossi lisi scegliendo l'opzione di globuli bianchi nel sangue contare utilizzando arancio di acridina (AO). Aggiungere una parte di sangue diluito con una AO parte e carico 20 l di miscela 1:1 in una camera di conteggio e getta. La concentrazione finale di AO dopo la diluizione devono essere 1μg/mL.
- Regolare di conseguenza con incompleto RPMI 1640 i media ad una concentrazione di cellule finale di x 2.0 10 6 cellule / ml.
3. La stimolazione di sangue intero
- Il test richiede un minimo di quattro condizioni (ogni redatta in duplice copia): non stimolato, l'aggiunta di LPS da solo, l'aggiunta di ATP da sola, e infine LPS più ATP cumulabili. Aggiungere 1 ml di preparato 2,0 x 10 6 cellule / ml di sangue intero diluito nel pozzo appropriata di un 24-pozzetti di coltura tissutale.
- Il stimolanti deve essere ricostituito e portato a temperatura ambiente prima di iniziare il saggio stimolazione. Liofilizzato LPS e ATP deve essere ricostituito secondo le istruzioni del produttore. Dopo la ricostituzione, LPS e ATP può essere ulteriormente diluito ad una concentrazione adeguata magazzino utilizzando incompleta RPMI 1640 media.
- Aggiungi LPS al LPS solo così come la LPS più ATP bene in modo che la concentrazione finale di lavoro di LPS è di 1 mg / ml. Il tempo di stimolazione totale è di 3 ore. Tuttavia, il sangue intero viene stimolato con LPS per 2 ore e 40 minuti. I campioni devono essere collocati in un incubatore a 37 ° C e 5% di CO 2.
- L'ATP è aggiunto durante i restanti 20 minuti di stimolazione periodo di 3 ore. Aggiungi ATP alla sola ATP e la LPS e ben ATP e campioni posto in incubatrice. La concentrazione di lavoro finale di ATP è 2mm.
- Dopo l'incubazione periodo di 3 ore, da raccogliere surnatanti aliquoting ogni campione in una provetta per microcentrifuga da 1,5 ml e successivamente campioni centrifugazione a 10000 rpm per 2 minuti a temperatura ambiente. Trasferire il surnatante in un'altra serie di provette da 1,5 microcentrifuga.
- I campioni possono essere analizzati immediatamente o conservati temporaneamente a -20 ° C o -80 ° C per la conservazione a lungo termine.
4. Dosaggio delle citochine
- I campioni che vengono congelati necessità di equilibrare a temperatura ambiente prima dell'analisi. Le concentrazioni di citochine IL-1βcan essere valutato utilizzando una varietà di metodi. Utilizziamo il Bio-plex citochine pro umano x-plex test con il Bio-Plex 200 sistema, secondo le istruzioni del produttore. In questo protocollo ci sono specificamente misura di IL-1β, tuttavia, utilizziamo questo saggio citochina multiplex al fine di misurare simultaneamente citochine multipli in un test con il vantaggio di utilizzare un piccolo volume del campione.
5. Rappresentante Risultati
Analisi di IL-1β produzione alla stimolazione di successo con LPS e ATP mostra un farese la risposta dipende dal numero di cellule di essere stimolato. Abbiamo scoperto che x 2.0 10 6 cellule / ml è una concentrazione sufficiente per produrre una concentrazione ottimale e misurabile di IL-1β e di altre citochine (Figura 2).
Saggi di sangue intero sono utili nello studio di pazienti che presentano con manifestazioni autoinfiammatorie. Questi pazienti possono mostrare un difetto nel sistema immunitario innato, che può essere caratterizzata da iperproduzione di IL-1β (rispetto ai controlli) sulla stimolazione con LPS da solo (Figura 3).
Figura 1. Un'immagine rappresentativa della colorazione AO per nucleate globuli bianchi utilizzati per determinare la concentrazione cellulare in acqua contenente campioni di sangue intero.
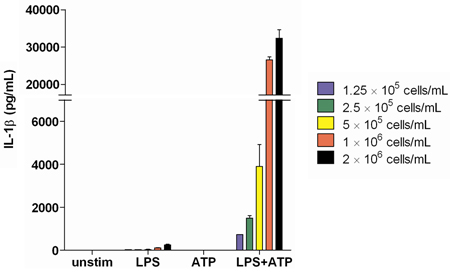
Figura 2. IL-1β produzione misurata in surnatanti di sangue intero da un donatore sano sulla stimolazione con LPS a concentrazioni cellulari in aumento. I campioni sono stati analizzati in triplicato.
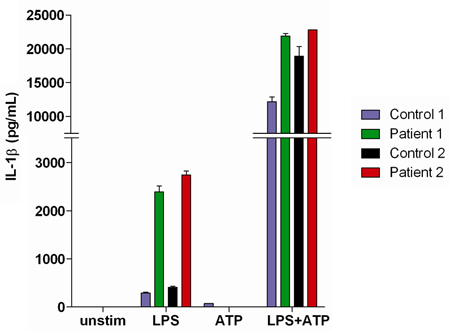
Figura 3. Rappresentante risultati di IL-1β secrezione misurata in surnatanti di sangue intero da due controlli sani normali e due pazienti che si presentano con manifestazioni autoinfiammatorie IL-1β-associate.
Discussione
Il test sangue intero descritto è un metodo semplice che più da vicino riproduce condizioni fisiologiche rispetto ad altre tecniche che richiedono l'isolamento delle cellule e l'elaborazione del campione esteso e manipolazione. Questo metodo utilizza la Visione Cellometer con AO per contare i globuli bianchi nel sangue e, quindi, fornisce un modo per standardizzare accuratamente i campioni in base ai numeri cell.
E 'da notare che per questa analisi, sangue intero devono essere ...
Divulgazioni
Riconoscimenti
Questa ricerca è stata sostenuta dal Programma di Ricerca Intramural dell'Istituto Nazionale di artrite e malattie muscolo-scheletriche e della pelle del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Sodium Heparin Blood Collection Tubes | BD Biosciences | 366480 | |
| RPMI 1640 Media | GIBCO, by Life Technologies | 21870-100 | |
| Acridine Orange | Invitrogen | A3568 | |
| Cellometer Vision | Nexcelom Bioscience | Contact company for instrument information | |
| Cellometer Cell Counting Chambers | Nexcelom Bioscience | CHT4-SD100 | |
| 24-well Tissue Culture Plate | Corning | 3524 | |
| Ultra Pure E. coli K12 LPS | Invitrogen | tlrl-eklps | |
| Adenosine 5´-tripohasphate disodium salt hydrate | Sigma-Aldrich | A26209 | |
| Bio-plex 200 system | Bio-Rad | Contact company for instrument information | |
| Bio-Plex Pro human cytokine x-plex assay | Bio-Rad | x-plex assays are custom made according to specified cytokines of interest |
Riferimenti
- Martinon, F., Mayor, A., Tschopp, J. The inflammasomes: guardians of the body. Annu Rev Immunol. 27, 229-265 (2009).
- Thurm, C. W., Halsey, J. F. Measurement of cytokine production using whole blood. Curr Protoc Immunol. 66, 7-18 .
- Mariathasan, S. Cryopyrin activates the inflammasome in response to toxins and ATP. Nature. 440, 228-232 (2006).
- Gabay, C., Lamacchia, C., Palmer, G. IL-1 pathways in inflammation and human diseases. Nat Rev Rheumatol. 4, 232-241 (2010).
- Franchi, L., Elgenbrod, T., Muñoz-Planillo, R., Nuñez, G. The inflammasome: a caspase-1-activation platform that regulates immune responses and disease pathogenesis. Nat Immunol. 3, 241-247 (2009).
- Sims, J. E., Smith, D. E. The IL-1 family: regulators of immunity. Nat Rev Immunol. 2, 89-102 (2010).
- Haug, R., Joø, G. B., Westvik, A. B., Kierulf, P. Chemokine production and pattern recognition receptor (PRR) expression in whole blood stimulated with pathogen-associated molecular patterns (PAMPs. Cytokine. 32, 304-315 (2005).
- Netea, M. G. Differential requirement for the activation of the inflammasome for processing and release of IL-1bin monocytes and macrophages. Blood. 113, 2324-2335 (2009).
- Latz, E. The inflammasomes: mechanisms of activation and function. Curr Opin Immnol. 22, 28-33 (2010).
- Masters, S. L., Simon, A., Aksentijevich, I., Kastner, D. L. Horror autoinflammaticus: the molecular pathophysiology of autoinflammtory disease. Annu Rev Immunol. 27, 621-668 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon