Method Article
Tecniche asettiche di laboratorio: Trasferimenti Volume con pipette sierologiche e Micropipettatrici
In questo articolo
Riepilogo
Quando si lavora in un laboratorio, è indispensabile ridurre al minimo le fonti di contaminazione. Una tecnica asettica si riferisce a procedure che permettono il trasferimento di culture e di reagenti, evitando il contatto con superfici non sterili. Pipette sierologiche e Micropipettatrici sono utilizzati per misurare i volumi precisi, senza compromettere la sterilità delle soluzioni utilizzati a fini sperimentali.
Abstract
I microrganismi sono ovunque - nell'aria, nel suolo, e il corpo umano, nonché su superfici inanimate come i banchi di laboratorio e tastiere di computer. L'ubiquità dei microbi crea una copiosa fornitura di potenziali contaminanti in un laboratorio. Per assicurare il successo sperimentale, il numero di contaminanti sulle superfici degli impianti e di lavoro deve essere minimizzata. Comune tra molti esperimenti in microbiologia sono tecniche che comportano la misurazione e il trasferimento delle colture contenenti cellule batteriche o particelle virali. Per farlo senza contatto con superfici non sterili o contaminazione dei media richiede sterili (1) preparare uno spazio di lavoro sterile, (2) definiscono con precisione e con precisione di lettura degli strumenti per il trasferimento asettico di liquidi, e (3) correttamente manipolare strumenti, culture, fiaschi e bottiglie tubi all'interno di un campo sterile. L'apprendimento di queste procedure richiede per la formazione e la pratica. In un primo momento, le azioni dovrebbero essere lento, deliberato e controllato con l'obiettivo di essere per t asettichetecnica a tiristori affermata a diventare una seconda natura quando si lavora al banco. Qui vi presentiamo i passi per misurare i volumi che utilizzano pipette sierologiche e Micropipettatrici all'interno di un campo sterile creato da un becco Bunsen. I volumi vanno da microlitri (ul) a millilitri (ml) a seconda dello strumento utilizzato. I liquidi comunemente trasferite includono brodo sterile o soluzioni chimiche, nonché colture batteriche e le scorte fagi. Seguendo queste procedure, gli studenti dovrebbero essere in grado di:
- I lavori all'interno del campo sterile creato dalla fiamma del bruciatore Bunsen.
- Usare pipette sierologiche senza compromettere la sterilità dello strumento.
- Aspirare liquidi con pipette sierologici, precisamente lettura volumi calibrati allineando il menisco formato dal liquido alle tacche sul pipetta.
- Conservare le bottiglie di cultura, fiaschi, tubi e dei loro rispettivi tappi sterili durante i trasferimenti liquidi.
- Identificare le diverse applicazioni di peduncolo di plastica rispetto al vetro sierologicaettes.
- Precisione le limitazioni statali per Micropipettatrici.
- Proprio ed esattamente impostare volumi Micropipettatrici.
- Saper usare correttamente la prima tappa e la seconda su un micropipettatore per aspirare e trasferire volumi corretti.
Protocollo
1. Preparare un lavoro sterile
- Prima di iniziare le procedure di sterilizzazione nella vostra area di lavoro, lavarsi accuratamente le mani con sapone antisettico e acqua calda.
- Assicurati di ri-lavarsi le mani ogni volta che si sospetta di avere la contaminazione dai tuoi manipolazioni sperimentali.
- Sgombrare il campo da tutti i materiali che ingombrano l'area di lavoro sul banco di laboratorio. Rimozione di un pre-umidificata salvietta disinfettante dal serbatoio e pulire l'intera area. Lasciare evaporare il disinfettante - non asciugare con un panno!
- Utilizzare disinfettanti come alcool (isopropanolo o 70% etanolo) o composti fenolici (o-fenilfenolo).
- Per evitare aerosol, o la produzione di una nebbia sottile che contiene le cellule batteriche, e la diffusione di contaminanti microbici, evitare di erogazione disinfettante da una bottiglia squeeze.
- Essiccazione dei microrganismi è uno dei modi più efficaci per decontaminare le superfici.
- Anche se qualcuno ha recentemente usato il banco di laboratorio e il banco è stato pulito con disinfettante, iniziare sempre il tempo di laboratorio pulendo giù per la panchina.
- Dopo che il disinfettante si è asciugato completamente, utilizzare un dispositivo di accensione per accendere il bruciatore Bunsen. Regolare la fiamma in modo che un cono blu può essere visto nel mezzo della fiamma. La fiamma sta producendo una corrente ascensionale, o correnti di convezione d'aria in cui l'aria calda sale in alto e lontano dal fuoco (Figura 1). Come il calore aumenta, microrganismi e particelle di polvere sono costretti verso l'alto e lontano dall'area di lavoro immediato. Lavorare lentamente, con attenzione, e volutamente sempre all'interno di questo settore creato dal becco Bunsen, indicato come un campo sterile. Tenere il becco Bunsen durante l'intera procedura.
- La punta del cono blu è la parte più calda della fiamma.
- Fare attenzione a non disturbare la corrente ascensionale da movimenti rapidi che cambiare drasticamente l'IAr correnti in tutto il banco di laboratorio. Creazione di una corrente ascensionale con il becco Bunsen riduce al minimo la possibilità di microrganismi e di polvere che cadono sulla panchina o in bottiglie aperte, tubi o flaconi nell'area di lavoro.
- Disporre tutte le forniture necessari per la procedura sul banco di laboratorio presso il campo sterile. Assicurarsi che tutti i materiali sono adeguatamente etichettati.
- Forniture possono includere pipette sierologiche e Micropipettatrici cultura, tubi sterili, flaconi, bottiglie sterili supporti contenenti brodo, microprovette sterili, consigli micropipettatore, rastrelliere per tubi, colture di cellule batteriche, e le scorte fagi.
- Mezzi liquidi deve essere sterilizzato in autoclave a 121 ° C per almeno 15 minuti l'impostazione liquido. Grandi volumi di media (> 1L) richiedono tempi più autoclave. Labware deve essere sterilizzato in autoclave a 121 ° C per almeno 30 minuti a gravità (secco) impostazione.
- In generale, soluzioni sterili possono essere conservati a 4° C per un massimo di 5 mesi. Si noti che il tempo di conservazione è notevolmente ridotta per le soluzioni contenenti componenti instabili, come gli antibiotici - controllare sempre le raccomandazioni del costruttore.
2. Trasferimento di liquidi con pipette sierologiche
- Pipette sierologiche vengono in molti formati e opzioni: in plastica o vetro, monouso o riutilizzabili, collegato o scollegato. Questi sono calibrati per garantire volumi da uno ml 0,1 a 25 ml.
- Dimensioni comuni per pipette sierologici sono 5 ml, 10 ml e 25 ml e deve essere utilizzato per il trasferimento dei liquidi asettici di 0,1 ml o più (pannello A di figura 2). Ci sono anche grandi pipette sierologiche in grado di fornire volumi fino a 100 ml, tuttavia, il focus di questo protocollo è sui più comuni, pipette di dimensioni più piccole.
- Pre-sterilizzati pipette con un tappo di cotone idrofilo sono necessari per microbiologia e esperimenti di coltura dei tessuti. La spina non deve essere rimosso dal alp della pipetta, che è progettato per funzionare come una barriera per l'eccessivo riempimento pipetta.
- Le diverse applicazioni richiedono pipette di plastica rispetto vetro sierologici. Il vetro è necessaria per solventi organici. In entrambi i casi può essere utilizzato quando si esegue BSL-1 esperimenti sul banco di laboratorio. Solo in plastica possono essere utilizzati quando si lavora in un armadio biosicurezza con BSL-2 organismi in cui un becco Bunsen non possono essere utilizzati. Inoltre si raccomanda che la plastica essere utilizzato per applicazioni che implicano il trasferimento di agar fuso.
- Pipette sierologiche sono di due tipi: TC ("contenere") o TD ("to deliver"). Pipette TC consegnare tutto il volume, anche la punta, e deve essere "spenta" o risciacquato per ottenere il volume specificato. Pipette TD sono tarati per lasciare un po 'piccola nella punta che non dovrebbe essere consegnato. Assicuratevi di controllare l'etichetta sul corpo della pipetta vicino alla cima di accertare quale tipo si tratta (Figura 3). Il più comunemente usati sono pipette TD, che sono marredazione con doppi anelli in alto.
- Prendete una pipetta di plastica sterile sierologico (chiamato anche una pipetta di trasferimento volumetrico) e rimuovere con attenzione la custodia di carta alla fine con il tappo di cotone idrofilo da peeling via come la buccia di una banana - non rimuovere il manicotto intera, proteggendo la punta di la pipetta che verrà in contatto con il liquido da trasferire. Toccare solo la parte superiore della pipetta (al di sopra delle tacche) con le mani.
- Mai andare in una soluzione sterile con una pipetta utilizzata, anche se grande attenzione è stata presa per mantenere sterile.
- Pipette di vetro sierologici sono in genere memorizzati in contenitori di metallo (pannello B della figura 2). Allentare la parte superiore del barattolo poi attentamente rimuovere il tappo, e la fiamma le estremità aperte del tappo e contenitore. Posizionare il tappo verso il basso, su un fianco, sulla panchina disinfettati. Togliere una pipetta dalla bomboletta tenendolo orizzontalmente e scuotendo delicatamente in modo che le cime di uno o due pipettates sporgere circa un pollice e può essere facilmente comprensibile. Adagiare il contenitore su un fianco e togliere una pipetta, ma stare attenti a non toccare le altre pipette nel contenitore. Non toccare la punta inferiore della pipetta con le mani, ed evitare il contatto della punta con altre superfici non sterili.
- Applicare un aiuto pipetta come una lampada, pompa, o pistola all'estremità superiore della pipetta sierologica. Rimuovere la custodia di carta dalla pipetta di plastica. Tenere la pipetta di aiuto con la mano destra.
- Se si utilizza una pipetta di vetro, passare il terzo inferiore della pipetta attraverso il cono blu nella fiamma del bruciatore Bunsen per 1-3 secondi. Ruotarla di 180 ° pipetta che passa attraverso la fiamma. Pipette di plastica e tubi non può essere fiammata.
- Se mancini, tenere l'aiuto della pipetta con la mano sinistra ed effettuare manipolazioni successive di bottiglie della cultura e tubi con la mano destra.
- La contaminazione tende a verificarsi con pipette di plastica per la revoca della finale inches della pipetta dal manicotto perché la punta sterile entra in contatto con la parte del manicotto toccati con le mani.
- Togliere il tappo della bottiglia contenente i media sterili. Non posizionare il tappo sul banco di laboratorio, ma tenerlo tra il dito anulare e il palmo della mano destra, mentre manipolare l'aiuto della pipetta con il pollice, indice e il medio della stessa mano (Figura 4). Tenendo la bottiglia un angolo di 45 °, passare il bordo della bottiglia attraverso la fiamma del bruciatore Bunsen, creando un campo sterile attorno alla bottiglia aperta.
- Anche se meglio evitare, se si deve mettere il tappo verso il basso, mettere a faccia in giù su una superficie disinfettata. Con un tappo rivolto verso l'alto, vi è una maggiore possibilità di contaminazione da movimenti di oggetti o mani, creando correnti d'aria che causano microrganismi e particelle di polvere di scendere alla superficie interna del tappo.
- Lo scopo della fiamma non è sterilizzare, ma per riscaldare l'apertura of la bottiglia e creare correnti di convezione dell'aria e lontano dall'apertura (cioè, updraft). L'aria calda sale aiuta a prevenire le particelle di polvere e altri contaminanti di entrare nella bottiglia.
- Tenere il contenitore sterile aperto per il minor tempo possibile. È importante mantenere i punti di entrata di microrganismi presenti nell'aria al minimo tutta la procedura.
- Evitare di tossire, starnutire, parlare, e altri movimenti involontari, mentre i contenitori sterili sono aperti.
- Non passano le mani e le dita sopra la parte superiore di un campo sterile (ad esempio, bottiglie aperte o fiaschi, l'interno di tubi e tappi di bottiglia), una volta passati attraverso la fiamma del bruciatore Bunsen.
- Lavorare sempre con una fiamma libera all'apertura di provette sterili o bottiglie. Non più di un tubo, flacone, o pallone aperto sul banco alla volta. Flaming deve essere effettuata immediatamente dopo l'apertura e chiusura poco prima di tubi, bottiglie e fiaschi.
- Posizionare la punta del serolpipetta ogical nella bottiglia contenente il supporto sterili quindi aspirare, o prelevare il campione asettico, dalla bottiglia. Utilizzare l'aiuto pipetta per controllare il flusso del campione nella pipetta. Proprio leggere il volume aspirato nella pipetta allineando il menisco formato sulla parte superiore della colonna di liquido alle tacche sul pipetta calibrata (Figura 5).
- NON BOCCA Pipettare! Utilizzare sempre un aiuto pipetta (pompa, bulbo, o pistola).
- Prestare attenzione alla sequenza di numeri nella determinazione del volume aspirato. I numeri possono essere stampati punta a versa migliori, o vice, o più volte in entrambe le direzioni.
- Durante la lettura del volume, tenere sempre la pipetta in posizione verticale, perpendicolare al terreno, e visualizzare il menisco del liquido morti-on a livello degli occhi.
- Pipette sierologiche sono solo accurato come il più piccolo incremento marcato, che in genere è 0,1 ml per 5 ml e 10 ml e pipette 0,2 ml per 25 ml pipette. Iof maggiore precisione è necessaria, una pipetta sierologica può essere utilizzato in combinazione con una micropipetta.
- Passare il bordo della bottiglia attraverso il becco Bunsen ancora una volta, quindi rimettere il coperchio della bottiglia. Impostare la bottiglia dei media da parte.
- Non ti bruciano con il bruciatore Bunsen in fretta per chiudere la bottiglia.
- Tenere una provetta o del matraccio con la mano sinistra. Togliere e tenere il coperchio, come descritto al punto # 4. Creare un campo sterile mediante esposizione alla fiamma il bordo del tubo o pallone in Bunsen.
- Erogare i media la pipetta nella provetta o del matraccio. Controllare il flusso del campione in modo che non schizzare del tubo o pallone.
- Volumi può essere misurata in modo tale che l'intero volume viene consegnato e la pipetta scarichi completamente, o un volume specifico si ottiene facendo un punto-punto di consegna (un volume di marcatura all'altro).
- Passare il bordo del tubo o matraccio attraverso la bruciatura Bunsener la fiamma, ancora una volta, poi rimettere il tappo. Impostare il tubo o pallone da parte. Rimuovere l'aiuto della pipetta, e gettare la pipetta nel contenitore dei rifiuti corretto.
- Sierologici pipette di plastica usa e getta, mentre il vetro pipette sierologiche possono essere sterilizzati e utilizzati di nuovo. Il corretto smaltimento richiede pipette di plastica essere posto in un contenitore designato diesis (scatola rigida allineato con il sacchetto di plastica di smaltimento), mentre pipette di vetro inizialmente deve essere immerso in un contenitore con una soluzione di candeggina al 10% per disinfettare le superfici interne ed esterne. Poi le pipette di vetro devono essere accuratamente lavato con detergenti laboratorio, risciacquato con acqua distillata, e sterilizzato in autoclave.
- Queste stesse procedure devono essere seguite quando inoculando media con una coltura batterica o brodo fago o quando si eseguono diluizioni seriali.
3. Liquidi trasferimento tramite Micropipettatrici
- Misurare con precisione e dispensare volumi minuto può essere accomplisparso utilizzando Micropipettatrici (anche indicato come Pipetman; Pannello A di figura 6). Questi strumenti sono disponibili in diverse dimensioni, ciascuno con un intervallo di volume specifico: per la P2, P10 0,2-2 pl per ul 1-10, 2-20 per il P20, P200 microlitri per 20-200 microlitri e P1000 per 200-1000 microlitri.
- Trattare Micropipettatrici con cura, in quanto sono strumenti di precisione. Non lasciarli sdraiati sul banco di laboratorio incustodito dove possono essere buttato giù e danneggiati. Non permettere pipette di venire a contatto con sostanze chimiche corrosive.
- Per i volumi superiori a 1000 ml, usare una pipetta sierologica.
- Anche se lavora all'interno del campo sterile creato dal becco Bunsen, non Micropipettatrici di fiamma, tubi di plastica e suggerimenti. I tubi e suggerimenti devono essere pre-sterilizzati. Le Micropipettatrici possono essere puliti con un pre-umidificata salvietta disinfettante prima dell'uso.
- A volumetro numerico indicante il volume erogato può essere impostato ruotando la manopola di regolazione. Adjust il volume prima di passare al # 3.
- MAI ruotare la manopola di sopra del range PREVISTO!
- Per ottenere la massima precisione quando diminuisce l'impostazione del volume sul micropipettatore, comporre lentamente verso il basso la rotella, facendo attenzione a non oltrepassare la tacca.
- Per ottenere la massima precisione quando si aumenta l'impostazione del volume sul micropipettatore, ruota la manopola pollice in su, passando per il voto di laurea desiderato di 1/3 di giro. Poi, lentamente, verso il basso comporre la rotella per raggiungere il volume desiderato, facendo attenzione a non oltrepassare la tacca.
Il volumetro mostra tre numeri. A seconda della micropipetta, i numeri vengono interpretati in modo diverso. Si noti che ogni micropipetta è solo accurato come il più piccolo segno di laurea.
P2: per volumi compresi tra 0,2-2,0 ul. Il numero superiore indica il volume in microlitri. Il secondo numero indicates decimi di microlitro (0,1 pl), e il terzo numero rappresenta centesimi di microlitro (0,01 pl). Ogni tacca corrisponde un incremento di uno-due millesimi (0,002 microlitri) di un microlitro.
P10: Per i volumi tra 1,0-10,0 ul. Il numero superiore è per decine di microlitri, questo di solito è impostato a "0" e deve essere impostato su "1" con gli altri due numeri impostati a "0" quando erogazione 10,0 ul. Il numero medio denota volume in microlitri. Il terzo numero indica decimi di microlitro (0,1 pl). Ogni tacca corrisponde un incremento di uno-due centesimi (0,02 pl) di un microlitro.
P20: Per i volumi tra 2,0-20,0 ul. Il numero di top in nero è di decine di microlitri, questo deve essere impostato a "2" con gli altri due numeri impostati a "0" quando erogazione 20,0 ul. Il secondo numero in nero indica il volume in microlitri. Il terzo numero in rosso indica dieciths di un microlitro (0,1 pl). Ogni tacca corrisponde un incremento di uno-due centesimi (0,02 pl) di un microlitro.
P200: Per i volumi tra 20,0-200 ul. Il numero è alto per centinaia di microlitri, questo deve essere impostato a "2" con gli altri due numeri impostati a "0" quando dispensare 200 ul. Il numero medio indica il volume erogato in decine di microlitri, e il terzo numero indica il volume in microlitri. Ogni tacca corrisponde un incremento di due decimi (uno 0,2 microlitri) di un microlitro.
P1000: Per i volumi tra 200-1000 microlitri. Il numero superiore è per le migliaia di microlitri, questo di solito è impostato a "0" e deve essere impostato su "1" con gli altri due numeri impostati a "0" quando erogazione 1000 ml. Il numero medio è per centinaia di microlitri. Il numero in basso è per decine di microlitri. Ogni tacca corrisponde un incremento di due (2 pl) microlitri.
- Prestazioni controllare: Questi strumenti dovrebbero essere tarati annualmente, assicurando accuratezza e precisione sono mantenuti a rimanere entro il ± 5% delle specifiche. Utilizzare una bilancia analitica per misurare l'acqua, facendo attenzione che le impostazioni minime e massime corrispondono al volume desiderato. Ad esempio, utilizzare un P1000 ai trasferimenti 200 microlitri di acqua ad un piatto di pesare sulla bilancia. Poiché l'acqua ha una densità di 1, quindi 1 ml di acqua è pari a 1 grammo (g). Così, 200 pl (0,2 ml) di acqua dovrebbe essere pari a 0,2 g. Inoltre, assicurarsi che la punta non perde e può mantenere il volume desiderato fino erogato con sistema a stantuffo.
- Micropipettatrici deve essere utilizzato con punte di plastica usa e getta in ogni momento. Montare una punta ben sull'estremità della canna della micropipetta. Premere verso il basso e ruotare leggermente per garantire una chiusura ermetica.
- Suggerimenti sono di solito confezionati in contenitori di plastica che possono essere sterilizzati in autoclave. Aprire la finestra di punta per recuperare una punta, Quindi chiudere la finestra di punta per ridurre al minimo il contatto con agenti contaminanti presenti nell'aria.
- Alcuni suggerimenti sono filtri simili a spine di lana il cotone pipette sierologiche. Questi suggerimenti sono spesso più costosi di quelli normali punte e quindi sono utilizzati per applicazioni specializzate. Per esempio, quando si misura chimici volatili come il cloroformio o liquidi radioattivi come 32 P-DNA marcato, con punte filtro aiuta a prevenire la canna del micropipettatore dall'ottenere contaminata.
- Mantenere la micropipetta in posizione verticale.
- Mantenere la micropipetta in posizione verticale impedisce la fuoriuscita di liquidi all'interno e contaminando la canna della micropipetta.
- Il micropipettatore ha tre posizioni: (1) posizione di riposo, (2) La prima tappa, e (3) Seconda tappa (Figura 6, pannello B). Lo strumento dispone di due soste sistema a stantuffo. La prima tappa ha due funzioni. Il primo è quello di disegnare nel volume desiderato di liquido nella whe puntan rilasciare lo stantuffo dalla fermata prima posizione di riposo. La seconda funzione è quella di erogare la maggior parte del liquido dalla punta quando lo stantuffo dalla posizione di riposo alla prima fermata. Inoltre premendo lo stantuffo per rinuncia del secondo arresto di qualsiasi liquido resta nella punta.
Premere il pulsante sullo stantuffo dalla posizione di riposo alla prima fermata. Air pari al volume dell'impostazione vengono spostate. - Immergere la punta nel liquido mentre si tiene premuto il pulsante per la prima tappa.
- Non toccare la stessa micropipettatore ai lati di flaconi e boccette, altrimenti le superfici interne di queste navi saranno contaminati. Solo le punte sono sterili.
- Rilasciare il pulsante lentamente per aspirare il liquido nella punta. Fermare una volta che il pulsante è tornato in posizione di riposo. Aspetta un momento così liquido può essere aspirato nella punta.
- Il volume di liquido nella punta sarà uguale al volume of l'impostazione della micropipetta.
- Liquidi viscosi, come quelli contenenti glicerolo richiedono più tempo per entrare la punta.
- Rimuovere il puntale dal liquido, e ispezionare visivamente la punta per confermare che il liquido elaborato ha raggiunto il livello previsto nella punta e non ci sono bolle d'aria nella punta.
- Se necessario, espellere il liquido e serrare manualmente le punte sui micropipettatore. Aspirare il liquido e riprovare.
- Posizionare la punta ad un angolo (10 ° a 45 °) contro la parete del tubo ricevente il liquido. Per espellere il liquido, lentamente, premere il pulsante sullo stantuffo alla prima fermata. Aspetta un momento, poi premere il pulsante alla seconda fermata di espellere ogni residuo di liquido nella punta.
- Lo stantuffo troppo velocemente il liquido viene espulso per imbrattare o produrrà bolle indesiderabili nel tubo.
- Prima di rilasciare lo stantuffo in posizione di riposo, rispostare la punta dal liquido.
- Eliminare i puntali in designato contenitore per rifiuti taglienti premendo il pulsante di espulsione sulla micropipettatore.
4. Ripulire lo spazio di lavoro
- Al termine di un esperimento che richiede l'uso della tecnica asettica, spegnere il bruciatore Bunsen, quindi mettere da parte tutte le forniture e reagenti. Pulire le superfici esterne da laboratorio (bottiglie, scatole, pipette Micropipettatrici punta) con un pre-umidificata salvietta disinfettante per garantire contaminanti non vengono trasferiti al percorso di archiviazione.
- Luogo contaminati vetro e di prodotti di rifiuti pericolosi nella presa corretto smaltimento. Rifiuti di laboratorio comprende da laboratorio come guanti, pipette, suggerimenti e tubi. Non infettiva rifiuti pericolosi viene generato quando si eseguono esperimenti con i non-organismi patogeni (BSL-1), mentre i rifiuti pericolosi infettiva viene generato quando si utilizzano organismi patogeni (BSL-2 o superiore). Rifiuti infettivi devono essere befor autoclavato o disinfettatie viene scartato. Seguire le linee guida di sicurezza di laboratorio descritte nel BMBL (5 ° ed.) Così come quelli forniti da OSHA e istituzionale di igiene ambientale e servizi di sicurezza.
- Pulire la intera area di lavoro sul banco di laboratorio con un pre-umidificata disinfettante dal contenitore, permettendo ancora una volta il disinfettante evaporare.
- Lavare accuratamente le mani con sapone antisettico e acqua calda prima di lasciare il laboratorio.
5. Risultati rappresentativi
Un esempio applicativo di utilizzando pipette sierologiche per trasferire liquidi è mostrata in Figura 7. Queste pipette sono spesso utilizzate in laboratorio per microbiologia preparare supporti per l'inoculazione con colture batteriche. Ad esempio, flaconi sterili prima sono riempiti con un volume specificato di brodo di coltura, in questo caso Luria Broth (LB), quindi un piccolo numero di cellule (ad esempio E. coli) vengono aggiunti ai media. Utilizzo di un p sierologicaipette, prima il brodo deve essere trasferite asetticamente dalla bottiglia supporto al pallone. In questo caso, 25 ml di LB stati aggiunti ad una beuta da 125 ml sterile usando una pipetta 25 ml sierologico. Successivamente, il brodo deve essere inoculato con E. coli cellule. Qui, 10 pl di cellule sono state trasferite asetticamente usando un micropipettatore P20 da un pallone cultura precedentemente crescente al 25 ml di LB fresco. Il pallone viene incubata in una camera di crescita per un determinato periodo di tempo, permettendo alle cellule per replicare (in questo esempio, le cellule di E. coli sono state incubate per una notte a 37 ° C su una piattaforma oscillante). Il risultato è una coltura torbido cellula batterica che può essere utilizzato per successivi esperimenti.
Pipette sierologiche può anche essere utilizzato per trasferire mezzi originariamente forniti in una bottiglia di provette, o tra provette, come avviene quando si effettua diluizioni di una coltura batterica. Se una tecnica asettica non è mantenuto in tutti questi tipi di manipolazioni dei media , Allora le culture diventerà contaminato e successivi esperimenti con quelle culture sarà rallentata, perché freschi, culture incontaminate dovranno essere preparati. Gli errori si verificano perché un campo sterile, non viene mantenuta durante tutta la procedura. Ad esempio, si può dimenticare di disinfettare il banco di laboratorio o fiamme il bordo di una bottiglia di cultura o tubo. Si può toccare la punta della pipetta o impostare il tappo di una bottiglia o provetta sul banco invece di tenerlo in mano. Procedura corretta è fondamentale per mantenere la contaminazione dei mezzi e culture al minimo. Figura 8A fornisce un esempio di una coltura pura rispetto contaminata di E. coli in una provetta contenente 5 ml di LB. Il pannello a sinistra mostra la visualizzazione di una cultura uniforme torbidità multa tipica di un puro E. coli cultura. Al contrario, il pannello di destra mostra una cultura contaminata in cui le caratteristiche di crescita discostano da quelli previsti per questo ceppo batterico.
"> Errori tecnici possono verificarsi durante la manipolazione pipette sierologiche con conseguente trasferimento di volumi non corretti di media tra le provette. Ad esempio, si può leggere il volume della pipetta in modo non corretto (cioè, in alto rispetto al fondo del menisco) o si può espellere il supporto completamente da una pipetta TD, che è stato progettato per lasciare un po 'piccola nella punta non deve essere consegnato. Quando si esegue un punto-punto di consegna dei mezzi di comunicazione, è possibile utilizzare i marchi di calibrazione sbagliate e distribuire il volume corretto. figura 8B mostra un esempio di provette con volumi corretti rispetto errato di supporto. Il tubo a sinistra contiene 3,5 ml di LB misurata con una pipetta da 5 ml sierologica. Lo studente condotto un punto-punto di consegna del supporto in cui è stato elaborato a LB al segno graduazione 5,0 ml e distribuito alla tacca 1,5 ml. Il tubo a destra contiene 2,5 ml di LB misurata con una pipetta della stessa dimensione, poiché lo studente che ha eseguito il punto-punto di consegna di mezzi incorrectly è dispensato dal marchio 5,0 ml a 2,5 ml marchio. Questo errore si tradurrà in una coltura batterica che sarà ad una concentrazione più elevata del previsto, causando diluizioni successive non essere corretto. Questa propagazione di errori può risultare in un esperimento fallito che avrebbe bisogno di essere ripetuta con le concentrazioni cellulari corretti.Un esempio applicativo di utilizzo Micropipettatrici per trasferire liquidi è mostrato in Figura 9. Questi pipettatori vengono utilizzati per una varietà di esperimenti di biologia molecolare, microbiologia compresa preparazione dei campioni per PCR e elettroforesi su gel o inoculando supporto sterili o buffer con piccole quantità (inferiori a 1,0 ml) di cellule batteriche o particelle fagiche. Nell'esempio fornito, l'allievo trasferito 12,5 pl di tampone TE in una provetta da microcentrifuga 1,8 ml (tubo sinistro nel pannello A; nota che il colorante è stato aggiunto al tampone per facilitare la visualizzazione del liquido all'interno dei tubi da microcentrifuga chiare).Questa procedura richiede il primo studente a selezionare il micropipettatore corretta, in questo caso un P20, e successivo per impostare il volumetro al volume corretto (pannello B). Una punta è stato usato che contiene un tappo di cotone idrofilo al fine di evitare possibili contaminazioni che possa essere espulso dal cilindro della micropipetta di raggiungere il campione tampone nella punta. Questa precauzione non è necessaria se si fa attenzione quando aspirazione di liquidi nelle punte, lo stantuffo lentamente in modo che il liquido non bagna nella canna pipettatore. Gli errori tecnici possono verificarsi che provocano il trasferimento di volumi errate. Ad esempio, è possibile selezionare la micropipettatore sbagliato per il lavoro o impostare la volumetro sul micropipettatore corretto per un volume corretto. Prima di immergere la punta nel buffer, si può spingere lo stantuffo passato la prima fermata, provocando un eccesso di tampone di essere trascinati in punta quando viene rilasciato lo stantuffo. In alternativa, non si può immergere la punta abbastanza lontano nel buffer, per cui l'aria viene aspiratala punta al posto del tampone. Si può dimenticare di spingere lo stantuffo alla seconda fermata durante l'erogazione del buffer in provetta provoca inferiore al volume desiderato di essere liberato dalla punta. Il tubo di destra nel Pannello A di figura 9 mostra una provetta contenente il volume di tampone corretta rispetto al tubo sulla sinistra. Invece di erogazione 12,5 microlitri di buffer, lo studente erogato 125 microlitri. In questo caso, anche se i numeri siano identici sul volumetro, la micropipettatore errato è stato selezionato per il processo (lo studente usato un P200 invece di un P20, pannello B), con conseguente erogazione di un volume sostanzialmente maggiore di tampone. Se questa soluzione è stata utilizzata per preparare una miscela di reagenti per un'applicazione come la PCR, allora questo errore modificare la concentrazione finale di tutti i reagenti successivamente aggiunti al tubo stesso. Di conseguenza, è improbabile che l'esperimento avrà successo, poiché le procedure di biologia molecolare talecome PCR richiedono tutti i componenti di essere a concentrazioni specifiche per la reazione di funzionare correttamente.
Perché non è sempre possibile garantire Micropipettatrici (in particolare l'interno della botte) sono sterili, soluzioni madre possono essere contaminati causando anche a fallire gli sforzi di risoluzione dei problemi durante l'esecuzione di esperimenti. Se si utilizza Micropipettatrici al trasferimento di soluzioni sterili, si raccomanda vivamente che le aliquote delle soluzioni madre (media, buffer, acqua) sono realizzati con tecnica asettica con pipette sierologiche. È comune per mantenere lavorare soluzioni madre in 15 ml o 50 ml provette sterili coniche. Questi sono spesso più facili da manipolare durante il funzionamento una micropipetta e può essere sostituito con un'aliquota fresca di soluzione madre se contaminato durante i trasferimenti di volume.
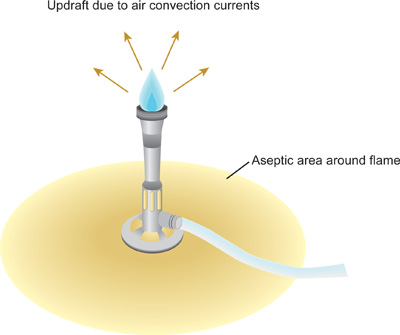
Figura 1. Campo sterile creato da corrente ascensionale della fiamma del bruciatore Bunsen. Per minquesto strumento sarà ottimizzata contaminazione delle soluzioni sterili e culture, è fondamentale che tutte le manipolazioni essere condotti all'interno del campo sterile. I cerchi di tubi di coltura in vetro e flaconi dovrebbe essere passato attraverso la punta del cono blu, la parte più calda della fiamma. Tubi di plastica e suggerimenti non può essere fiammato - questi dovrebbero essere pre-sterilizzati con metodi alternativi prima dell'uso.

Figura 2. Pipette sierologiche utilizzato per il trasferimento asettico di liquidi. (A) Da sinistra a destra sono disegni di 25 ml, 10 ml, pipette e 5 ml. (B) Pipette sierologiche possono essere di plastica o vetro. Pipette di plastica sono usa e getta (un tempo di utilizzo) e in genere sono confezionate singolarmente in buste di carta e plastica in cui tutte le superfici interne sono sterili (lato sinistro). Pipette di vetro possono essere utilizzati più volte a condizione che siano puliti e sterilizzati tra usa, i quali in genere vengono memorizzati in contenitori di metallo (a destralato).

. Figura 3 Pipette sierologiche sono di due tipi: TC ("contenere") o TD ("to deliver"). Mostrato è l'etichetta esplicativa di una pipetta da 5 ml TD.

Figura 4. Una tecnica asettica. Quando aspirazione di liquidi da una bottiglia, fiasco, o tubo con tappi, mai mettere il tappo in panchina. Al contrario, tenere il cappello in mano come gli aiuti pipetta durante la manipolazione del recipiente contenente il liquido con la mano opposta, come mostrato.
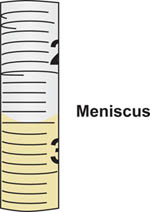
Figura 5. Menisco costituito al momento di elaborare il liquido nella pipetta sierologica. Il volume corrisponde alla tacca sulla pipetta dove il fondo del menisco allinea. In questo esempio, il menisco si allinea con il 2,5 ml gradua zione marchio.
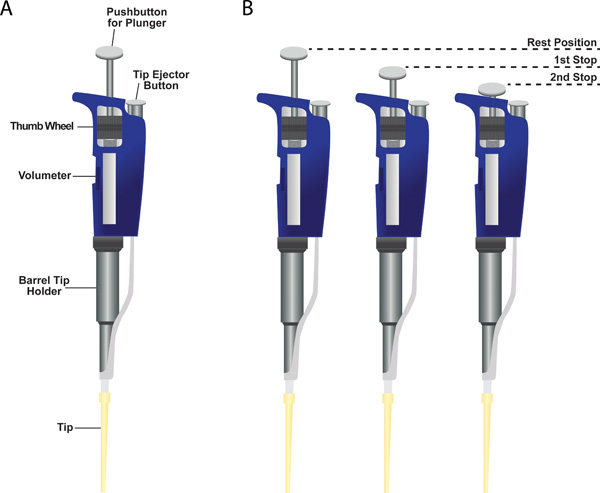
Figura 6. Micropipettatore canale singolo. (A) mostrato è un micropipettatore campione con una punta di plastica fissato al fondo del supporto punta canna. Indicati sono i luoghi del volumetro, la rotella per cambiare l'impostazione volumetro, il titolare punta a botte, il pulsante di espulsione dei puntali, e il pulsante per lo stantuffo. (B) Due-stop su un sistema a stantuffo micropipettatore.

Figura 7. Usando pipette sierologiche per trasferire i media in sterili 125 palloni da ml. Il pallone sinistra ha 25 ml di mezzo LB (solo), mentre il pallone destra è una coltura di E. coli derivanti da inoculo LB con cellule poi incubando la notte a 37 ° C. Si noti come i media il pallone sulla destra è torbida a causa della crescita delle cellule.
e 8 "src =" / files/ftp_upload/2754/2754fig8.jpg "/>
Figura 8. Usando pipette sierologici di trasferire i file multimediali in provette sterili. (A) Il tubo di sinistra contiene 5 ml di un puro E. cultura coli, mentre il tubo di destra contiene 5 ml di una coltura contaminata cellula batterica. Si notino le differenze nelle caratteristiche di crescita tra le due culture. Anche se entrambi sono torbido, la cultura di destra è stata contaminata con un fungo o di altri microrganismi presenti nell'aria dando la cultura di un colore e consistenza diversa da quella prevista per E. coli cellule. (B) Il tubo della cultura di sinistra contiene 3,5 ml di LB mentre il tubo di destra contiene solo il 2,5 LB ml. Questa differenza di volume dovuta ad un errore commesso durante lo svolgimento di un punto-a-punto di consegna dei supporti ai tubi.

Figura 9. UsinMicropipettatrici g per trasferire buffer in microprovette sterili. (A) La provetta sinistra contiene solo 12,5 pl di tampone TE, mentre il tubo di destra contiene 125 microlitri. Si noti che un colorante è stato aggiunto al tampone per facilitare la visualizzazione del liquido all'interno dei tubi da microcentrifuga chiare. (B) La volumetro sinistra è un micropipettatore P20, mentre il volumetro destra è da un micropipettatore P200. Un errore comune è la selezione della micropipettatore sbagliato. Anche se i numeri sono impostati in maniera identica sul volumetro P20 e P200, la selezione dei risultati micropipettatore sbagliati nel trasferimento di volumi non corretti.

Figura 10. Cappa a flusso laminare utilizzata per prevenire la contaminazione delle soluzioni e delle culture. Mostrato è un armadio biosicurezza approvato per il lavoro con BSL-2 organismi.
Discussione
Una tecnica asettica si riferisce ad una serie di procedure di routine fatte per evitare soluzioni sterili e culture subisca contaminazioni da microrganismi indesiderati in laboratorio. Tali tecniche sono essenziali per esperimenti che richiedono cellule in crescita. Sebbene un ambiente di lavoro che è completamente sterile non può essere realizzato, procedure come la disinfezione di superfici di laboratorio, creando un campo sterile utilizzando un becco di Bunsen, limitando l'esposizione di colture livellate e mezzi per l'aria, sterilizzazione materiali quali flaconi e pipette di vetro, ed evitando il contatto con strumenti sterili non sterili superfici riduce la possibilità di contaminazione soluzioni e culture in un esperimento. L'obiettivo è che queste procedure precauzionali per diventare una seconda natura, questo viene con l'allenamento e la pratica mentre si lavora in un laboratorio.
Trasferimenti di volume con soluzioni sterili e culture che utilizzano strumenti quali pipette sierologiche e microfonoropipettors sono uno dei molti tipi di tecniche di routine eseguite in laboratorio. Diverse applicazioni sperimentali richiedono strumenti in grado di trasferire volumi distinti, ma precise e accurate. Pipette sierologiche vengono utilizzati nei laboratori di microbiologia per preparare colture cellulari che richiedono preparazioni dei media che coinvolga volumi millilitro, mentre Micropipettatrici sono essenziali per esperimenti di biologia molecolare che hanno bisogno solo quantità microlitro di soluzioni. Quando una tecnica asettica è praticata con questi strumenti, la contaminazione è ridotto al minimo durante i trasferimenti di volume indipendentemente dalla quantità di liquido o del tipo di esperimento.
Anche se non discusse in questo protocollo, un altro mezzo comunemente usati per prevenire la contaminazione è quello di lavorare all'interno di una cappa a flusso laminare (Figura 10). Questa apparecchiatura è fondamentale per la cultura dei tessuti e per gli esperimenti condotti con microrganismi classificati come BLS-2 o superiore. Una cappa a flusso laminare contiene un (HEPA alta efficienzaParticulate Air) filtro che rimuove gli agenti contaminanti presenti nell'aria dal dell'aria che fluisce nella cappa evitando aria non filtrata dalla stanza di permeare di lavoro. Da notare, un becco Bunsen non può essere utilizzato all'interno di una cappa a flusso laminare in quanto il calore della fiamma interrompe il flusso d'aria indispensabili per la funzionalità della cappa.
È spesso utile per verificare la qualità della vostra tecnica asettica durante l'esecuzione di esperimenti. Per confermare soluzioni e terreni di coltura non vengano contaminati durante le manipolazioni sperimentali, sempre preparare un controllo negativo. Per esempio, se la preparazione di tubi di brodo di crescita di colture batteriche, non inoculare un tubo lasciando solo supporto sterili. Incubare il terreno accanto alle provette inoculate poi ispezionare tubo di controllo non inoculato per i segni di contaminazione quali torbidità dalla crescita di cellule indesiderate involontariamente introdotto nel tubo. Se il tubo di controllo è contaminato, il tubo sperimentales probabilmente sono contaminati come pure, e l'esperimento dovrà essere ripetuto. Queste misure precauzionali dovrebbe essere fatto con ogni esperimento.
Divulgazioni
Non ho nulla da rivelare.
Riconoscimenti
Un ringraziamento speciale a Cori a Sanders Designs IROC per la preparazione di illustrazioni e di Kris Reddi presso la UCLA per la creazione di colture di esempio per le figure. Il finanziamento per questo progetto è stato fornito dal HHMI (HHMI Grant No. 52006944).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| LB Broth | Difco | 244620 | Ricetta disponibile anche in riferimento 6 |
| TE Buffer: | |||
| EDTA sale disodico diidrato | Sigma | E5134 | |
| Trizma-HCl | Sigma | T-3253 | |
| CiDecon | Decon Laboratories, Inc. | 8504 | Disinfettante |
| Etanolo | Fisher Scientific | A406 | Per l'uso come disinfettante, preparare 70% (v / v) con acqua distillata |
Riferimenti
- Barker, K. At the Bench: A Laboratory Navigator. , Cold Spring Harbor Laboratory Press, Cold Spring Harbor. New York. (1998).
- Biosafety in Microbiological And Biomedical Laboratories (BMBL). , 5th Ed, US Department of Health and Human Services (DHHS), Centers for Disease Control and Prevention (CDC) and National Institutes of Health (NIH), U.S. Government Printing Office. Washington DC. Available from: http://www.cdc.gov/biosafety/publications/bmbl5/index.htm (2009).
- Bykowski, T., Stevenson, B. Aseptic Technique. Current Protocols in Microbiology. Appendix 4, Appendix 4D(2008).
- Coté, R. J. Aseptic Technique for Cell Culture. Current Protocols in Cell Biology. Chapter 1, Unit 1.3(2001).
- Grimes, S. E. A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. RAP Publication. AC802/E, 12-13 (2002).
- Guzman, K. Pipetting: A Practical Guide. The American Biology Teacher. 63 (2), 128-131 (2001).
- Jordan, T., et al. RESEARCH: National Genomics Research Initiative Phage Resource Laboratory Manual. , Howard Hughes Medical Institute. (2008).
- Sambrook, J., Russell, D. W. Molecular Cloning - A Laboratory Manual. , 3rd Ed, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. 978-087969576 (2001).
- Seidman, L. A., Moore, C. J. Basic Laboratory Methods for Biotechnology: Textbook and Laboratory Reference. , Prentice Hall, Inc. Upper Saddle River, New Jersey. (2000).
- Pipettes, Calibration & Repair Service - Pipette.com [Internet]. , Available from: http://pipette.com/public/staticpages/guidetopipetting.aspx (2012).
- On-Line Resources for Biology: Table of Contents [Internet]. , Available from: http://abacus.bates.edu/~ganderso/biology/resources/index.html (2012).
- PIPETMAN P User's Guide. , Gilson Inc. Available from: http://www.gilson.com/Resources/LT801120_a_eng_030209%20BD.pdf (2012).
- Sterile Technique - Laboratory Wiki [Internet]. , Available from: http://lab.wikia.com/wiki/Sterile_Technique (2012).
- Air displacement pipette - Wikipedia, the free encyclopedia [Internet]. , Available from: http://en.wikipedia.org/wiki/Air_displacement_pipette (2012).
- Disinfectant - Wikipedia, the free encyclopedia [Internet]. , Available from: http://en.wikipedia.org/wiki/Disinfectant (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon