Method Article
Ex infezione Vivo del tessuto Live con virus oncolitici
In questo articolo
Riepilogo
Virus oncolitici sono promettenti per la terapia del cancro. La possibilità di accertare la infectability di campioni di tessuto ottenuti da pazienti dal vivo prima del trattamento è un vantaggio unico di questo approccio terapeutico. Questo protocollo descrive come processo di tessuti per Ex vivo con il virus oncolitici e la successiva quantificazione virale.
Abstract
I virus oncolitici (OVS) sono nuove terapie che replicano in modo selettivo e uccidere le cellule tumorali 1. Diversi studi clinici che hanno valutato l'efficacia di una varietà di piattaforme tra cui oncolitici HSV, reovirus, e OVS Vaccinia come trattamento per il cancro sono attualmente in corso 2-5. Una caratteristica chiave del virus oncolitici è che possono essere geneticamente modificati per esprimere transgeni giornalista che permette di visualizzare l'infezione dei tessuti al microscopio o bio-luminescenza di imaging 6,7. Questo offre un vantaggio unico dal momento che è possibile infettare i tessuti ex vivo da pazienti prima della terapia al fine di accertare la probabilità di successo viroterapia oncolitica 8. A tal fine, è fondamentale campione adeguato di tessuto per compensare l'eterogeneità del tessuto e valutare la vitalità dei tessuti, in particolare prima di infezione 9. E 'anche importante seguire la replicazione virale mediante transgeni giornalista se espresso dalla piattaforma oncolitici così come da titolazione diretta dei tessuti dopo omogeneizzazione al fine di discriminare tra infezione abortiva e produttivo. L'oggetto di questo protocollo è quello di affrontare questi temi e descrive qui 1. Il campionamento e la preparazione del tessuto tumorale per la coltura delle cellule 2. La valutazione della vitalità del tessuto utilizzando il colorante metabolica Alamar blu 3. Infezione ex vivo dei tessuti coltivati con il virus vaccinico che ha espresso GFP o lucciola luciferasi 4. Rilevamento di espressione del transgene mediante microscopia a fluorescenza o con un sistema di imaging in vivo (IVIS) 5. Quantificazione del virus mediante test placca. Questo metodo completo presenta numerosi vantaggi quali la facilità della lavorazione dei tessuti, l'indennizzo per l'eterogeneità del tessuto, il controllo della vitalità del tessuto, e la discriminazione tra l'infezione abortiva e le ossa in buona fede replicazione virale.
Protocollo
1. Lavorazione dei tessuti
- Per ottenere risultati migliori, questo protocollo deve essere effettuata utilizzando un tessuto isolato appena depositato in DMEM mezzi di comunicazione contenente il 10% FBS, 1% Pennicilin / streptomicina soluzione, e lo 0,1% Amphothericin soluzione B immediatamente dopo l'intervento chirurgico prima della lavorazione. Se ciò non fosse possibile, i tessuti possono essere lasciati durante la notte in questo mezzo a 4 gradi prima della lavorazione.
- Prima della lavorazione del campione, sterilizzare pinze di metallo e lame monouso depositando in una soluzione di etanolo al 70% per almeno 5 minuti. Anche preparare un 24-pozzetti con 2 ml di DMEM supporti contenenti il 10% FBS, 1% Pennicilin / streptomicina soluzione, e lo 0,1% Amphothericin B.
- Raccogliere il campione di tessuto in una cappa flusso laminare coltura cellulare con pinze sterilizzate e depositare il tessuto in una teglia da 15 centimetri vuota Petri, mantenendo il coperchio sul lato, lato sterile alto.
- Nel cofano coltura cellulare, usare un mm 2 biopsia pugno di ottenere differenti core da una varietà di aree all'interno del tessuto come in Figura 1. Depositare i nuclei nel coperchio del petri 15 cm con l'aiuto di pinze, lasciando abbastanza spazio tra ciascun core in modo che possano essere facilmente tagliato lungo l'asse orizzontale.
- Dividi ogni core in 4 / 4 anche utilizzando una lama di rasoio sterile come in Figura 1.
- Utilizzando una punta di pipetta, mettere ogni trimestre da un nucleo centrale in un dato ben diverso da A1 ad A4 come in figura 1, già contenente 1,5 ml di DMEM contenente 10% FBS, 1% Pennicilin / streptomicina soluzione, e lo 0,1% Amphothericin soluzione B . Ripetere l'operazione per ogni core. Questo dovrebbe consentire il campionamento rappresentativo del tumore, riducendo al minimo i pregiudizi in un ben determinato / condizione. Per una migliore rappresentazione, aumentare il numero di core.
2. Valutazione della vitalità del tessuto
- A seguito di lavorazione dei tessuti, aggiungere 25μl Alamar blu per bene # # A1 e A2, come mostrato in figura 1 e incubare per 1 ora a 37 gradi in un incubatore umidificato con 5% di CO 2.
- In seguito a incubazione con Alamar blu, togliere 3 volte 100 ul da ogni A1 e A2 bene e il trasferimento a 6 diversi pozzetti di una piastra da 96 pozzetti. Leggi il segnale usando un lettore di fluorescenza piastra (530 eccitazione, 590 di emissione) e conservare i dati per il record.
- Dopo Alamar segnale blu è stato letto, il trasferimento di tutti i pezzi di tessuto con una punta di pipetta, da ben A1 a C1 che contiene DMEM 10% FBS + PS + AmphoB. Fare attenzione a non trasferire una quantità eccessiva di supporti da ben A1.
- Infettare pozzi A3 e A4, rispettivamente con 10 6 PFU di GFP-esprimere e luciferasi che esprimono virus vaccinia diluita in 25 l di media. Bene A2 può essere infettato da un virus che che esprime un transgene dato anche del tutto assenti.
- 72 ore dopo, aggiungere 25 microlitri di Alamar blu per pozzi C1 e D1 e ripetere il passo 2,2
3. Visualizzazione di espressione GFP transgene mediante microscopia fioritura
- Rimuovere tutti i supporti coltura cellulare che copre i pezzi di tessuto al fine di tener buone foto a fluorescenza.
- Utilizzando un microscopio a fluorescenza capace dissezione, in primo luogo prendere una immagine a contrasto di fase con una risoluzione appropriata
- Passa alla modalità fluorescenza e scattare una foto utilizzando il filtro appropriato per visualizzare il transgene di interesse, in questo caso GFP.
- Utilizzare un filtro a fluorescenza per un'altra lunghezza d'onda il più possibile uno da quello del transgene di interesse (come RFP) per scattare una foto di fluorescenza di fondo
4. Visualizzazione di espressione luciferasi utilizzando un sistema di imaging in vivo (IVIS)
- Assicurarsi che il IVIS viene inizializzato prima di iniziare.
- In A4 pozzi e B4, aggiungere 5 ml di substrato luciferina 10 mg / ml, mescolare bene e incubare per 5 minuti a temperatura ambiente.
- Impostare il tempo di esposizione IVIS a 5 secondi e scatta una foto del vostro pozzi. Se l'immagine è satura, ripetere con il tempo di esposizione più bassi. Se non vi è alcun segnale, aumentare il tempo di esposizione.
- Utilizzando il software di imaging IVIS, è possibile rimuovere lo sfondo utilizzando il segnale da ben B4 e selezionare la regione di interesse per quantificare il segnale luminescente.
5. Valutare i titoli virale mediante saggio placca
- Prima di quantificare i titoli virale, i tessuti devono prima essere omogeneizzato per liberare particelle virali. Questo può essere fatto alcuni mesi più tardi nei campioni di tessuto infetto vengono conservati a -80
- Pesare il campione che deve essere omogeneizzato utilizzando una bilancia analitica. In questo caso, useremo il campione raccolto da A2 bene.
- Posizionare il tessuto è in polistirolo da 5 ml a fondo rotondo tubo falcon e aggiungere 1 ml di PBS. Omogeneizzare il tessuto utilizzando un omogeneizzatore tessuti. Se necessario, memorizzare il omogenato a -80 per la valutazione dei titoli virale in un secondo momento.
- Al virus vaccinia titolo, piastra prima 1 milione di cellule U2OS in un 6-pozzetti ed incubare una notte in un grado 37, 5% di CO 2 umideified tale che hanno raggiunto circa il 95% confluenza del giorno successivo incubatrice.
- Utilizzare siero media liberi di fare diluizioni seriali del virus, avendo cura di cambiare punte tra un passo e diluizione. Di solito facciamo 1 su 10 diluizioni e utilizzare 100 l per il trasferimento in 900 microlitri. Quanti diluizioni sono fatte dipende la resa dei virus attesi.
- In seguito a fare le diluizioni, rimuovere i mezzi di copertura delle celle U20S placcato poi aggiungere 500 ml di virus diluito magazzino (per ogni diluizione) per infettare le cellule U2OS. Incubare le cellule per 1 minuto un'ora a 37 gradi Celsius in un 5% di CO 2 incubatore umidificato.
- Durante questo tempo, scaldare il 2 X concentrato DMEM contenente 20% FBS, e la soluzione del 3% CMC in un bagno d'acqua 37 gradi.
- Dopo l'incubazione 1 ora, togliere i mezzi di copertura cellule infettate U2OS. Mescolare 01:01 volumi del 3% CMC: 2X DMEM, 20% FBS insieme, utilizzando 2 ml di questa miscela per coprire tutti i pozzetti delle cellule infette U2OS.
- Mettere le cellule indietro in un grado 37 5% CO 2 umidificata incubatore per altre 48 ore.
- Dopo 48 ore, aggiungere 2 ml di metanolo-acido acetico fissativo in cima alla sovrapposizione CMC in ogni pozzetto e incubare a temperatura ambiente per 10 minuti in una cappa di coltura cellulare.
- Scartare la sovrapposizione fisso e lavare resto fuori dei pozzi con acqua di rubinetto.
- Macchiare le cellule fisso U2OS con 2 ml di una soluzione di Coomassie blu per bene e incubare per 30 minuti a temperatura ambiente a bassa velocità su un piatto shaker.
- Rimuovere il Coomassie macchia dai pozzetti e lavare i piatti con l'acqua del rubinetto. Lasciare asciugare off con coperchio per circa un'ora.
- Le placche risultante virale può essere facilmente visualizzato in figura 2C. Le piastre possono essere conservate indefinitamente in questa fase.
- Conte placche al passaggio di diluizione, dove tra 10 e 100 placche sono visibili.
- Moltiplicare il numero di placche contati dalla diluizione utilizzata e moltiplicare il numero risultante da 2 a dare un titolo a PFU / ml. Per esempio, se 25 placche sono conteggiati nel pozzo dove è stato utilizzato un milione di volte di diluizione, il titolo del campione iniziale non diluita è 25 moltiplicato per 1 milione moltiplicato per 2 o 50 milioni di PFU / ml. Dividere ulteriormente questo numero per il peso inizialmente misura per il campione di segnalare i titoli in PFU / g
6. Rappresentante dei risultati:
Al fine di stabilire con precisione se un campione ottenuto chirurgicamente tessuto normale / tumorale è o non è infettabili con il virus, si deve prima assicurarsi che il campione di tessuto è almeno fattibile. Fig. 1A mostra che la redditività può essere valutata utilizzando un colorante metabolica (Alamar blu) e che il tessuto sia normali che tumorali possono rimanere metabolicamente attivo per un periodo di almeno 72 ore. Ciò suggerisce che i tessuti in coltura ex vivo in grado di supportare la replicazione virale. Un vantaggio significativo di virus oncolitici è che possono essere ingegnerizzati per esprimere transgeni terapeutici o di imaging. Fig. 2D-E mostra che GFP o luciferasi possono essere rilevati dai tessuti infetti ex vivo, sostenendo ulteriormente che questi tessuti sono vitali e anche infettabili. Anche se l'espressione del transgene aumento è generalmente associata con la replicazione virale, non necessariamente equivale a un ciclo produttivo di vita virale che porta alla auto-amplificazione e diffusione, che è pensato per essere importante per l'attività terapeutica. Per questo motivo, è necessario stabilire se si produce più virus di quello che è stato utilizzato per infettare inizialmente il tessuto. Fig. 2B mostra che al momento quantificazione virale mediante test placca, più virus si ottiene dopo 72 ore, l'infezione dei tessuti raccolti immediatamente dopo l'infezione. Nel complesso, questi dati mostrano che il tessuto tumorale asportato chirurgicamente possono rimanere vitali nelle cellule in coltura per un periodo di almeno 72 ore, durante le quali la replicazione virale tempo possono essere supportati.

Figura 1. Panoramica del tessuto campionamento / sezionamento protocollo. Campione di tessuto viene processato rimuovendo diverse 2 core mm che vengono successivamente divisa in quattro quartieri che sono distribuiti in modo casuale nei pozzetti A1-A4. I codici colore indicano i reagenti utilizzati in ogni pozzetto. Il grigio-grigio quadrati all'interno dei pozzi rappresentano ogni trimestre dal 6 core singolo dipinto. Il tessuto in pozzetto A1 è trasferito ad un nuovo pozzo (C1) con i media dopo l'iniziale lettura Alamar blu. Una seconda lettura è fatta al termine della incubazione di 72 ore con i virus. Wells A4 e B4 sono integrate con Luciferin dopo l'incubazione 72 ore post-infezione
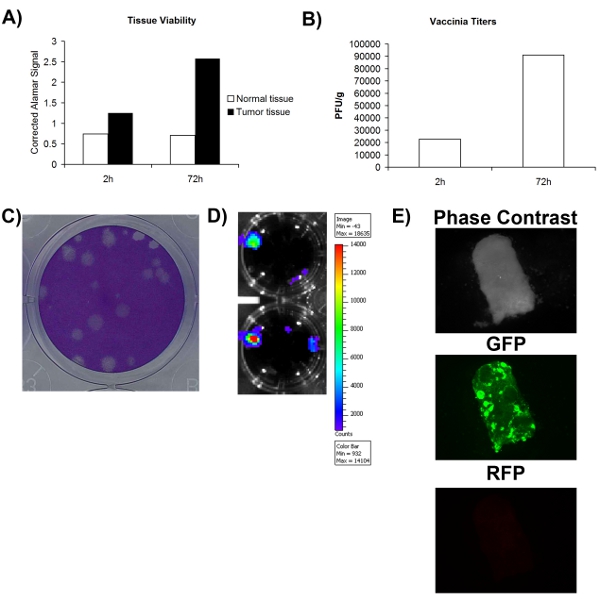
Figura 2. Vitalità e infectability di tessuto prelevato dai pazienti. A) la vitalità del tessuto, come misurato dal segnale di Alamar blu a 2 ore e 72 ore dopo la raccolta. Asse Y rappresenta il vuoto corretto Alamar segnale blu. B) titolo di vaccinia virusraccolti per grammo di campioni di tessuto 2 e 72 ore dopo l'infezione. C) Esempio di placche virus vaccinia sulle cellule U2OS di colorazione Coomassie. D) del segnale di luminescenza ottenuta dal paziente VV-luciferasi con infezione da tessuto ripreso con IVIS. E) le immagini di microscopia a fluorescenza di campione di tessuto del paziente infettato con VV-GFP.
Discussione
Uno dei passi fondamentali in questo protocollo è di ottenere campioni di tessuto fresco. Se il campione è messo in coltura cellulare a seguito di una lunga attesa in sala operatoria in un supporto inadeguato (es. PBS), questo può compromettere la vitalità del tessuto e prevenire infectability. Da segnalare, il tessuto normale è intrinsecamente più incline a questi effetti di tessuti tumorali. Un altro punto critico è il numero di core sono utilizzati per esempio il tessuto e la consistenza delle loro dimensioni. Incoerenze nelle dimensioni porterà alla variabilità tra campioni dei pazienti, in quanto fattori come l'ipossia tissutale e la superficie infectectable varierà a seconda delle dimensioni dei nuclei e quartieri core. Anche se questo può essere parzialmente risolto utilizzando affettatrici tessuto, uno dei vantaggi del metodo presentato qui è che è relativamente facile, meno inclini alla contaminazione, e ampiamente applicabile ad una varietà di tipi di tessuto, compresi i tessuti molli o viscoso che non sono facilmente riconducibili al taglio dei tessuti. In particolare, il numero di core può essere aumentato al fine di ottenere una migliore rappresentazione dei tessuti. Inoltre, il core può essere tagliato in più pezzi (es. 5-8) per ospitare altri saggi potenziale per essere condotti in parallelo come il DNA, l'RNA, o l'estrazione di proteine. Tuttavia, il numero di pezzi in cui i core possono essere tagliati a dimensioni riproducibile dipenderà la dimensione effettiva del core, che possono essere modificati utilizzando carotieri diverse dimensioni. Opzionalmente, un modo per aiutare ottenere pezzi di tessuto riproducibile dimensioni è quello di uniformare la lunghezza dei nuclei con un righello prima di ulteriori suddividendoli in piccoli pezzi. Il protocollo può naturalmente essere modificata per ospitare altri virus e abbiamo trovato che i tessuti possono essere vitali e supporto della replica per un massimo di 6 giorni. Il protocollo può essere ulteriormente estesa ad altre misure di viralmente-espresso transgeni tra cytrokines. A seguito di infezione, i tessuti possono anche essere inclusi in paraffina per l'ulteriore sezionamento e colorazione con metodi immunoistochimici, che permette un ulteriore affinamento della istologia dei tessuti e come si riferisce alle infezioni virali 10-12.
Divulgazioni
Riconoscimenti
Vorremmo ringraziare il Dott. Hesham Abdelbary per fornire umano campioni chirurgici per i dati presentati in Fig. 2.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| Alta glucosio DMEM | Hyclone | SH30243.01 | |
| Siero bovino fetale | NorthBio Inc. | NBSF-701 | |
| Amphothericin soluzione B | Sigma Aldrich | A2942 | Usa a 0,1% |
| Pennicilin-Streptomicina | Sigma Aldrich | P4333 | Usa all'1% |
| Alamar Blu | Invitrogen | DAL1025 | |
| D-Luciferin Sale di potassio | Prodotti Imaging Molecolare | D-Luciferin Sale di potassio di 1 g | Risospendere in PBS a 10 mg / ml e filtrare su filtro di 0,22 micron |
| MEM polvere | Gibco | # 41500018 | Fare nella metà del volume suggerisce di fare 2X MEM e filtro 0,22 micron del filtro prima dell'uso |
| Carbossimetilcellulosa (CMC) | Sigma Aldrich | C9481 | Fare una soluzione al 3% in acqua deionizzata e autoclave. Si noti che in polvere può richiedere un certo tempo per sospendere di nuovo |
| Coomassie Brilliant Blue R | Sigma Aldrich | B7920 | |
| 2 millimetri Biopsia pugno | Miltex | MX-33-31 | |
| Double Edge Blades Prep | Personna Medical Care | 74-0002 | |
| Disection microscopio a fluorescenza | Leica | modello M205 FA | |
| Imaging in vivo del sistema (IVIS) | Caliper Life Sciences | IVIS ® serie 200 | |
| Tessuto Tearor | Biospec prodotti | modello 985370-395 |
Riferimenti
- Parato, K. A., Senger, D., Forsyth, P. A., Bell, J. C. Recent progress in the battle between oncolytic viruses and cancer. Nat Rev Cancer. 5, 965-976 (2005).
- Renouf, L. C., Thway, K., Sibtain, A., McNeish, I. A., Newbold, K. L., Goldsweig, H., Coffin, R., Nutting, C. M. Phase I/II study of oncolytic HSV GM-CSF in combination with radiotherapy and cisplatin in untreated stage III/IV squamous cell cancer of the head and neck. Clin Cancer Res. 16, 4005-4015 (2010).
- Lal, R., Harris, D., Postel-Vinay, S., de Bono, J. Reovirus: Rationale and clinical trial update. Curr Opin Mol Ther. 11, 532-539 (2009).
- Park, B. H., Hwang, T., Liu, T. C., Sze, D. Y., Kim, J. S., Kwon, H. C., Oh, S. Y., Han, S. Y., Yoon, J. H., Hong, S. H., Moon, A., Speth, K., Park, C., Ahn, Y. J., Daneshmand, M., Rhee, B. G., Pinedo, H. M., Bell, J. C., Kirn, D. H. Use of a targeted oncolytic poxvirus, JX-594, in patients with refractory primary or metastatic liver cancer: a phase I trial. Lancet Oncol. 9, 533-542 (2008).
- Breitbach, C. J., Reid, T., Burke, J., Bell, J. C., Kirn, D. H. Navigating the clinical development landscape for oncolytic viruses and other cancer therapeutics: no shortcuts on the road to approval. Cytokine Growth Factor Rev. 21, 85-89 (2010).
- Boeuf, F. L. e. Synergistic interaction between oncolytic viruses augments tumor killing. Mol Ther. 18, 888-895 (2010).
- Silva, N. D. e., Atkins, H., Kirn, D. H., Bell, J. C., Breitbach, C. J. Double trouble for tumours: exploiting the tumour microenvironment to enhance anticancer effect of oncolytic viruses. Cytokine Growth Factor Rev. 21, 135-141 (2010).
- Diallo, J. S. A high-throughput pharmacoviral approach identifies novel oncolytic virus sensitizers. Mol Ther. 18, 1123-1129 (2010).
- Cooke, S. L. Intra-tumour genetic heterogeneity and poor chemoradiotherapy response in cervical cancer. Br J Cancer. , (2010).
- Pennington, K., Chu, Q. D., Curiel, D. T., Li, B. D. L., Mathis, J. M. The Utility of a Tissue Slice Model System to Determine Breast Cancer Infectivity by Oncolytic Adenoviruses. J Surg Res. , 1-6 (2010).
- Hochberg, M. Tropism of herpes simplex virus type 1 to non-melanoma skin cancers. Br J Dermatol. , (2010).
- Kuip, H. v. a. n. d. e. r. Short term culture of breast cancer tissues to study the activity of the anticancer drug taxol in an intact tumor environment. BMC Cancer. 6, 86-86 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon