È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un In Vitro Sistema per studio dormienza tumorale e l'interruttore di crescita metastatica
In questo articolo
Riepilogo
Un modificato 3-D in vitro del sistema è presentato in cui caratteristiche di crescita di diverse linee cellulari tumorali in membrana basale ricostituita in correlazione con il comportamento inattivo o proliferativa delle cellule tumorali in un sito secondario metastatico In vivo.
Abstract
Recidiva del tumore al seno spesso segue un lungo periodo di latenza in cui non ci sono segni di cancro e metastasi non può diventare clinicamente evidente solo molti anni dopo la rimozione del tumore primario e la terapia adiuvante. Una probabile spiegazione di questo fenomeno è che le cellule tumorali hanno seminato siti metastatici, resistenti alle terapie convenzionali, e rimangono inattivi per lunghi periodi di tempo 1-4.
L'esistenza di cellule tumorali dormienti presso le sedi secondarie è stato descritto in precedenza come le cellule quiescenti solitaria che non proliferano nè apoptosi 5-7. Inoltre, queste cellule solitarie ha dimostrato di diffondere dal tumore primario in una fase iniziale di 8-10 progressione della malattia e di soggiornare crescita arrestato nel midollo osseo dei pazienti ', il sangue e linfonodi 1,4,11. Pertanto, la comprensione dei meccanismi che regolano dormienza o il passaggio ad uno stato proliferativo è fondamentale per scoprire nuovi obiettivi e interventi per prevenire la recidiva di malattia. Tuttavia, svelando i meccanismi che regolano il passaggio dalla dormienza alla crescita del tumore metastatico è stata ostacolata dalla mancanza di sistemi di modelli disponibili.
in vivo ed ex vivo sistemi modello per studiare la progressione metastatica delle cellule tumorali sono state descritte in precedenza 1,12-14. Tuttavia questi sistemi modello non hanno fornito in tempo reale ed in maniera meccanicistica intuizioni alta velocità in quello che fa scattare l'emergenza di solitario cellule tumorali dormienti a proliferare come malattia metastatica. Abbiamo recentemente sviluppato un sistema in vitro 3D per modellare le caratteristiche di crescita in vivo delle cellule che presentano inattive (D2.OR, MCF7, K7M2-AS.46) o proliferativa (D2A1, MDA-MB-231, K7M2) comportamento metastatico in vivo. Abbiamo dimostrato che le cellule tumorali che presentano dormienza in vivo in un sito metastatico rimanere quiescente quando coltivate in un 3-dimensione (3D) estratto membrana basale (BME), mentre le cellule altamente metastatico in vivo facilmente proliferare nella cultura 3D dopo variabile, ma relativamente breve periodi di quiescenza. È importante sottolineare che utilizzando il 3D nel sistema modello in vitro, abbiamo dimostrato per la prima volta che la composizione ECM svolge un ruolo importante nella regolazione delle cellule tumorali dormienti se passerà ad uno stato proliferativo e lo hanno confermato in studi in vivo 15-17. Quindi, il modello di sistema descritte nella presente relazione fornisce un metodo in vitro per dormienza modello di tumore e lo studio della transizione alla crescita proliferativa indotta dal microambiente.
Protocollo
1. Cultura della manutenzione delle cellule dormienti e linee cellulari del tumore metastatico
- Crescere le cellule tumorali dormienti (D2OR / MCF7/K7M2-AS.46) e metastatico (D2A1 / MDA-MB-231 / K7M2) in piastre di cm 10 di coltura contenente Media Dulbecco Modified Eagle (DMEM) glucosio e il 10% di siero fetale bovino ( FBS) e antibiotici. Una volta che le cellule raggiungono il 70-80% confluenza, procedere con il test seguente.
2. Proliferazione delle cellule saggio delle cellule tumorali dormienti (riposo) e metastatico (proliferazione) coltivate in un 3D-BME sistema
Coltura di cellule dormienti / metastatico nel sistema 3D
- Scongelare la crescita Cultrex fattore ridotto Estratto membrana basale (BME) a 4 ° C frigo una notte prima di effettuare il test. Si noti la BME devono essere gestiti su ghiaccio in ogni momento.
- Il giorno successivo, posto a 96 pozzetti su un vassoio di ghiaccio all'interno di una cappa laminare. Cappotto di ogni bene con 50-100μl di BME ghiaccio a freddo con un distributore con una siringa. Assicurarsi che non bolle si formano nei pozzetti. Posizionare la piastra da 96 pozzetti rivestiti con BME in un incubatore umidificato al 5% di CO 2 a 37 ° C per 30 minuti.
- Nel frattempo aspirare i media dalle cellule dormienti o metastatico e tumori (preparato in sezione 1). Sciacquare piastre di coltura con 10 ml di tampone fosfato salino, pH 7,4 (PBS). Aspirare il PBS e aggiungere 2 ml tripsina pre-riscaldato a 37 ° C, a piastre di coltura. Incubare le piastre in un CO umidificata 5% 2 a 37 ° C, per 5 min.
- Trasferire le cellule in una provetta da 15 ml conica contenente 5 ml di glucosio ad alta DMEM supplementato con 10% FCS e antibiotici e contare le cellule.
- Spin il numero totale delle cellule di essere coltivate in una centrifuga coltura di tessuti ad una velocità di 1500 g, a temperatura ambiente per 5 min. Nel nostro test ci prepariamo 2X10 3 celle / e per ciascuna linea cellulare o punto di tempo da esaminare. Tuttavia, questo può variare a seconda delle linee cellulari utilizzate.
- Con attenzione aspirare il surnatante. Si noti, nella maggior parte dei casi il pellet non è visibile. Pertanto, lasciare nessuno indietro media. Toccare il fondo del tubo 15 ml coniche con le dita per assicurare che una sospensione di singole cellule è ottenuta. Risospendere il pellet con glucosio DMEM bassa con antibiotici integrata con il 2% FCS BME + 2% (test di media). 100 l di media test deve essere aggiunto per ogni 2x10 3 celle. Triturare le cellule molte volte con una pipetta da 5 ml per garantire che una sospensione singola cella è mantenuta.
- Piatto un 100μl della miscela di cellule per pozzetto in cima al piatto ben 96 BME rivestito. Per la valutazione di fondo (nella sezione 2.8) piastra in 100μl aggiunta per pozzetto di solo i supporti saggio sulla parte superiore della piastra 96 pozzetti BME rivestito. Incubare il colto Piastre a 96 pozzetti in un umidificata al 5% CO 2 incubatore a 37 ° C. Le cellule devono essere ri-alimentato ogni 4 giorni con i mezzi di test.
Proliferazione saggio:
- Saggio di proliferazione delle cellule: aggiungi ai pozzi al momento desiderato punti 20 microlitri della cella titolo 96 acquosa Un kit Soluzione saggio proliferazione delle cellule. Incubare in un umidificata al 5% CO 2 incubatore a 37 ° C per 2 ore. L'utilizzo di un record di piastre Elisa Reader l'assorbanza a 490nm. Per la valutazione di fondo e la sottrazione, aggiungere 20μl della cellula titolo 96 acquosa Un kit Soluzione saggio la proliferazione delle cellule di rivestimento pozzi pre con BME e solo sovrapposti con i media del saggio. L'utilizzo di un record di piastre Elisa Reader l'assorbanza a 490 nm.
3. Colorazione di immunofluorescenza per le molecole di segnalazione cellulare in sospeso (riposo), le cellule tumorali e / o metastatico (proliferazione) delle cellule tumorali
Coltura di cellule dormienti / metastatico nel sistema 3D per la colorazione immunfluorescence
* Il protocollo che segue è una modifica di un protocollo di cultura 3D pubblicato da Debnath J et al 18.
- Preparare BME come descritto nella sezione 2.1. Il giorno seguente: posto un 8-camera di sistema vetrino su un vassoio di ghiaccio all'interno di una cappa laminare. Cappotto ogni pozzetto con 50ul del freddo BME utilizzando un 200μl Pipetman. Assicurarsi BME si diffonde in modo uniforme e senza bolle si formano nei pozzetti. Posizionare gli 8 vetrino da camera rivestita con BME in un CO umidificata 5% 2 a 37 ° C per 20 min.
- Raccolta e cellule dormienti o metastatico dalla sezione 1 e preparare alla cultura, come descritto nella sezione 2.3-2.4. Raccogliere il numero totale di cellule da coltura in un tubo da 15 ml. Prepariamo 5 x10 3 celle / e per ciascuna linea cellulare e il punto di tempo per essere esaminato. Spin giù le cellule in una centrifuga di coltura ad una velocità di 1500 g, a temperatura ambiente per 5 min. Aspirare il supernate attenzione. Si noti che il pellet non è visibile, e quindi lasciare un po 'mezzi alle spalle. Toccare il fondo del tubo 15 ml coniche con le dita per assicurare che una sospensione singola cella si ottiene.Risospendere il pellet con i media del saggio. 400μl dei media test deve essere aggiunto per ogni 5x10 3 celle. Triturare le cellule più volte con pipetta 5 ml. Questo passaggio è molto importante per garantire che la sospensione singola cellula è mantenuta.
- 400μl targa della miscela di cellule per pozzetto in cima ad ognuna delle 8 camere rivestite con BME. Incubare la coltura 8 camere di vetro sistema di scorrimento in una umidificata al 5% CO 2 incubatore a 37 ° C. Le cellule devono essere ri-alimentato ogni 4 giorni con i mezzi di test.
Immunofluorescenza:
- Nei punti di tempo desiderato, aspirare lo strato superiore del supporto e aggiungere 200μl del fissativo contenente 4% paraformaldeide (PFA), 5% di saccarosio e lo 0,1% Triton X-100 e incubare a temperatura ambiente per 5 minuti. Aspirare il fissativo e aggiungere 200μl del 4% PFA contenente 5% di saccarosio e incubare a temperatura ambiente per 25 minuti.
- Aspirare il fissativo; aggiungere 400 ml di tampone fosfato (PBS) in ciascun pozzetto. Incubare per 10 minuti a temperatura ambiente. Aspirare il PBS e aggiungere 400 μ PBS contenente 0,05% di Tween 20 per 10 minuti a temperatura ambiente.
- Bloccare le cellule fissate a temperatura ambiente con 200μl di asino o di siero al 10% o al 3% BSA per 1 ora (blocco soluzione da utilizzare devono essere determinati empiricamente per ogni anticorpo primario).
- Aspirare la soluzione di saturazione e aggiungere 200μl di anticorpo primario (diluizione deve essere determinato empiricamente per ogni anticorpo primario da utilizzare). Diluire l'anticorpo primario nel siero asino al 10% se il 10% asino siero è stato utilizzato per bloccare o diluire l'anticorpo primario nel 3% BSA se il 3% soluzione BSA blocco è stato utilizzato. Incubare con l'anticorpo primario overnight a 4 ° C.
- Aspirare l'anticorpo, lavare i pozzetti con 400μl di PBS per 15 minuti e ripetere due volte. Aspirare il PBS e aggiungere 200μl di asino anti-rispettive-IgG coniugato con rodamina rosso (diluizione deve essere determinato empiricamente), coprire gli 8 scivolo da camera con foglio di alluminio e incubare per 1 ora a temperatura ambiente.
- Lavare i pozzetti con 400μl di PBS (3x15 minuti ogni lavaggio). Aspirare il PBS. Montato con Vectashield montaggio media con DAPI. Diapositive a secco per 40 minuti a temperatura ambiente al buio. I vetrini possono essere conservati per 1 settimana a 4 ° C. Conservare i vetrini al buio. Immagine diapositive mediante microscopia confocale.
4. Rappresentante dei risultati:
Un esempio di analisi di proliferazione delle D2.0R dormienti e D2A1 metastatica delle cellule tumorali in coltura 3D è mostrato nella Figura 1A. Cellule D2.0R sono dormienti (quiescenti) attraverso l'intero periodo di sperimentazione della cultura 14 giorni mentre il altamente metastatico D2A1 cellule rimangono inattivi solo per 4-6 giorni, quindi cominciano a proliferare. Durante la fase iniziale dormiente, molte cellule rimangono solitarie in 3-D cultura (Figura 1B; giorno 4), mentre le altre cellule non proliferanti forma pluricellulare sferoidi. Il passaggio di D2A1 cellule da una latente allo stato proliferativo in 3-D cultura (Figura 1B; giorno 12) è associata a cambiamenti drammatici nella morfologia cellulare. Quindi, questo test può essere usato per testare quale fattore / s può scatenare D2.0R cellule dormienti di uscire dal loro stato sospeso e quale fattore / s D2A1 può impedire alle cellule di transizione dal loro stato dormiente. Figura 2 è un esempio di un agente prevenire D2A1 cellule di transizione da uno stato dormiente a proliferativa. Come illustrato nella figura 2, i trattamenti di D2A1 cellule con un inibitore specifico della chinasi catena leggera della miosina (ML-7) mantenuto D2A1 cellule in uno stato inattivo.
Segnalazione cellulare nelle cellule dormienti e proliferanti tumorali in coltura nel sistema 3D può essere studiato da immunofluorescenza per le molecole di segnalazione cellulare. Come illustrato in figura 3 un significativo aumento della fosforilazione della catena leggera della miosina in D2A1 cellule (colorazione rossa), seguita dalla riorganizzazione del f-actina, filamenti di actina che formano le fibre di stress (colorazione verde) si verifica durante il passaggio dalla dormienza (1-4 giorni) per proliferazione (giorno 7). Tuttavia, bloccando l'attività della chinasi della catena leggera della miosina in D2A1 cellule shRNA o farmaco specifico (ML-7) conserva D2A1 cellule in uno stato inattivo e provoca l'inibizione della fosforilazione di miosina catena leggera e f-actina organizzazione delle fibre di stress (Figura 4).
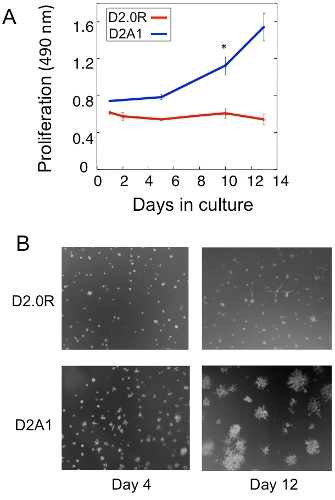
Figura 1. Modello in vitro per lo studio solitario dormienza delle cellule tumorali e l'interruttore di crescita metastatica. A) La proliferazione delle D2.0R sospeso e metastatico D2A1 in 3-D Cultrex BME, n = 8 (media ± SE). Risultati rappresentativi di tre esperimenti (* p ≤ 0,05). B) immagini di microscopia ottica e D2.0R D2A1 cellule in coltura in 3-D Cultrex x20 ingrandimento BME.Figura modificata da Barkan et al 17.
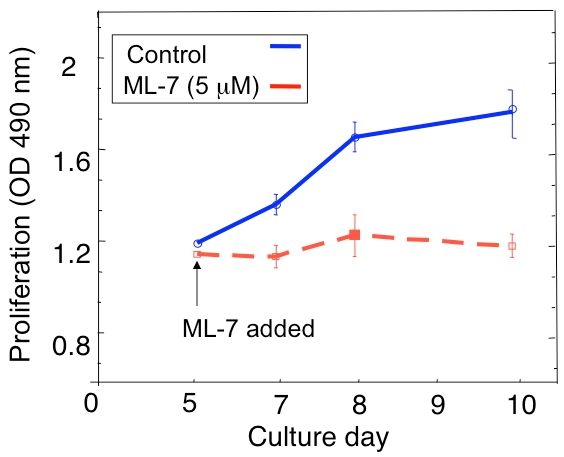
Figura 2. Impedendo il passaggio di cellule dal D2A1 dormienza (quiescenza) alla proliferazione nel sistema cultura 3D attraverso l'inibizione della chinasi catena leggera della miosina (MLCK). Durata di D2A1 proliferazione delle cellule in coltura in 3-D Cultrex BME, n = 8 (media ± SE). Le cellule sono state trattate (controllo), o trattati con un inibitore specifico della MLCK (ML-7, 5 mM) per 48 ore al giorno a partire cultura 5. Figura modificata da Barkan et al 17.
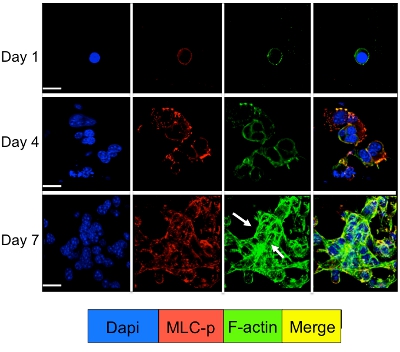
Figura 3. Fosforilazione della catena leggera della miosina seguito da f-actina riorganizzazione durante il passaggio di cellule dal D2A1 dormienza alla crescita proliferativa. D2A1 cellule sono state coltivate in 3-D Cultrex BME l'8 scivolo camera di vetro. Le cellule sono state fissate e colorate con DAPI (blu) per la localizzazione nucleare, falloidina (verde) per f-actina e con un anticorpo contro la forma fosforilata della catena leggera della miosina (MLC-p) (rosso), come indicato in vari momenti. Fusione di f-actina, e MLC-p colorazione (giallo). Espressione di MLC-p è stata aumentata durante la transizione di D2A1 cellule dal letargo (giorni1-4) alla crescita proliferativa (giorno 7) seguito dalla formazione di fibre di stress l'actina (frecce). Microscopia confocale, ingrandimento x63. Bianco bar equivale a 20 micron. Figura modificata da Barkan et al 17.
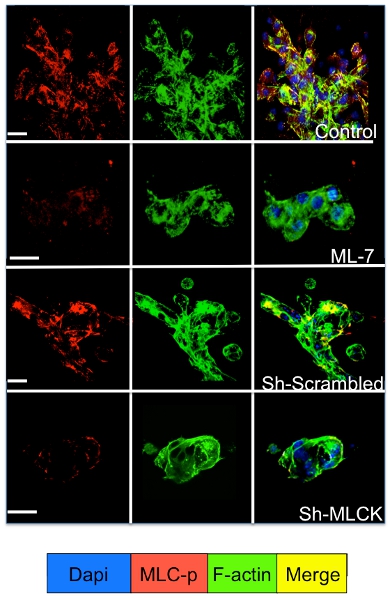
Figura 4. . Inibizione della chinasi catena leggera della miosina (MLCK) mediata f-actina formazione delle fibre di stress in cellule D2A1 D2A1 Le cellule sono state trattate (controllo), o trattati con inibitori per MLCK (ML-7, 5 micron), per 48 ore il giorno di inizio della cultura 5, o trattati con strapazzate o MLCK shRNA e colorate per la forma fosforilata della catena leggera della miosina (MLC-p) (rosso), f-actina (verde), e nuclei (blu). Fusione di f-actina, e MLC-p colorazione (giallo). Microscopia confocale, ingrandimento x63. Bianco bar equivale a 20 micron.
Discussione
I meccanismi alla base che mantengono le cellule tumorali disseminate in uno stato inattivo o risultato nella loro transizione verso una crescita metastatica rimangono in gran parte sconosciuti. Questo fenomeno è stato estremamente difficile da studiare nei pazienti umani 4,12 e pochi modelli preclinici sono stati sviluppati per risolvere questo problema. Tuttavia, alcuni in vivo ed ex-vivo sistemi modello per la dormienza tumorale sono state caratterizzate (recensione a 1,12). T...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questa ricerca è stata sostenuta in parte dal programma di ricerca intramurale del National Cancer Institute.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
|---|---|---|---|
| DMEM glucosio | Invitrogen | 11965-118 | |
| DMEM glucosio | Invitrogen | 11885-092 | |
| Siero fetale bovino (FBS) | Invitrogen | 10091-148 | |
| Fattore di crescita ridotto 3-D Estratto di Basement Cultrex membrana | Trevigen Inc. | Concentrazione di proteine tra 14-15mg/ml | |
| D2.0R e D2A1 linee cellulari | 5,19 | ||
| K7M2 e K7M2AS1.46 cellule | 20 | ||
| MCF-7 e MDA-MB-231 cellule di cancro al seno | ATCC | ||
| Una camera di vetro 8 sistema di scorrimento | (Lab-TEK, Thermo scientifico) | 177402 | |
| Titolo cellula 96 acquosa Una cellula soluzione proliferazione kit di analisi | Promega | G3580 | |
| Vectashield montaggio medio con DAPI | Vector Laboratories Inc. | H-1200 | |
| Normale asino siero | Jackson ImmunoResearch | 017-000-121 | |
| Lettore di piastra ELISA | Bio-Tec | Record 490nm | |
| Microscopio confocale | Zeiss-LSM-510 | Ingrandimento x63 |
Riferimenti
- Aguirre-Ghiso, J. A. Models, mechanisms and clinical evidence for cancer dormancy. Nat Rev Cancer. 7, 834-846 (2007).
- Pantel, K., Woelfle, U. Micrometastasis in breast cancer and other solid tumors. J Biol Regul Homeost Agents. 18, 120-125 (2004).
- Naumov, G. N. Ineffectiveness of doxorubicin treatment on solitary dormant mammary carcinoma cells or late-developing metastases. Breast Cancer Res Treat. 82, 199-206 (2003).
- Klein, C. A. Framework models of tumor dormancy from patient-derived observations. Curr Opin Genet Dev. , (2010).
- Naumov, G. N. Persistence of solitary mammary carcinoma cells in a secondary site: a possible contributor to dormancy. Cancer Res. 62, 2162-2168 (2002).
- Townson, J. L., Chambers, A. F. Dormancy of solitary metastatic cells. Cell Cycle. 5, 1744-1750 (2006).
- Chambers, A. F., Groom, A. C., MacDonald, I. C. Dissemination and growth of cancer cells in metastatic sites. Nat Rev Cancer. 2, 563-572 (2002).
- Pantel, K. Differential expression of proliferation-associated molecules in individual micrometastatic carcinoma cells. J Natl Cancer Inst. 85, 1419-1424 (1993).
- Demicheli, R. Tumour dormancy: findings and hypotheses from clinical research on breast cancer. Semin Cancer Biol. 11, 297-306 (2001).
- Braun, S. A pooled analysis of bone marrow micrometastasis in breast cancer. N Engl J Med. 353, 793-802 (2005).
- Pantel, K., Alix-Panabieres, C., Riethdorf, S. Cancer micrometastases. Nat Rev Clin Oncol. 6, 339-351 (2009).
- Goss, P. E., Chambers, A. F. Does tumour dormancy offer a therapeutic target. Nat Rev Cancer. 10, 871-877 (2010).
- Mendoza, A. Modeling metastasis biology and therapy in real time in the mouse lung. J Clin Invest. 120, 2979-2988 (2010).
- Naumov, G. N. A model of human tumor dormancy: an angiogenic switch from the nonangiogenic phenotype. J Natl Cancer Inst. 98, 316-325 (2006).
- Barkan, D. Metastatic growth from dormant cells induced by a col-I-enriched fibrotic environment. Cancer Res. 70, 5706-5716 (2010).
- Barkan, D., Green, J. E., Chambers, A. F. Extracellular matrix: A gatekeeper in the transition from dormancy to metastatic growth. Eur J Cancer. , (2010).
- Barkan, D. Inhibition of metastatic outgrowth from single dormant tumor cells by targeting the cytoskeleton. Cancer Res. 68, 6241-6250 (2008).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30, 256-268 (2003).
- Morris, V. L. Mammary carcinoma cell lines of high and low metastatic potential differ not in extravasation but in subsequent migration and growth. Clin Exp Metastasis. 12, 357-367 (1994).
- Khanna, C. The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis. Nat Med. 10, 182-186 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon