È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
L'uso di una trappola ottica per lo Studio delle interazioni ospite-patogeno per Dynamic Imaging Live Cell
In questo articolo
Riepilogo
Un metodo è descritto per selezionare individualmente, manipolare e agenti patogeni immagine dal vivo utilizzando una trappola ottica accoppiato ad un microscopio a disco rotante. La trappola ottica fornisce il controllo spaziale e temporale di organismi e li adiacenti alle cellule ospite. Microscopia a fluorescenza cattura le interazioni intercellulare perturbazione con minimo di cellule.
Abstract
Immagini dinamiche delle cellule vive permette la visualizzazione diretta in tempo reale delle interazioni tra le cellule del sistema immunitario 1, 2, tuttavia la mancanza di controllo spaziale e temporale tra la cellula fagocitica e microbo ha reso focalizzato osservazioni sulle interazioni iniziale di risposta dell'ospite ad agenti patogeni difficili. Storicamente, gli eventi di contatto intercellulare come la fagocitosi 3 sono stati ripreso miscelando due tipi di cellule, e poi continuo la scansione del campo visivo per trovare serendipitous contatti intercellulari nella fase appropriata di interazione. La natura stocastica di questi eventi rende questo processo noioso, ed è difficile osservare gli eventi in anticipo o in fugace contatto cellula-cellula da questo approccio. Questo metodo richiede trovando le coppie di cellule che sono sul punto di contatto, e osservando loro fino a quando consumato il loro contatto, o non. Per far fronte a queste limitazioni, usiamo trapping ottico come un non-invasivo, il metodo non distruttivo, ma veloce ed efficace per posizionare le cellule in coltura.
Trappole ottiche o pinzette ottiche, sono sempre più utilizzati nella ricerca biologica per catturare e manipolare le cellule fisicamente e altri micron di particelle di dimensioni in tre dimensioni 4. Pressione di radiazione è stato osservato e applicato ai sistemi pinzetta ottica nel 1970 5, 6, e fu usato per controllare campioni biologici nel 1987 7. Da allora, pinzette ottiche hanno maturato in una tecnologia per sondare una varietà di fenomeni biologici 8-13.
Descriviamo un metodo 14 che avanza dal vivo imaging cellulare, integrando una trappola ottica con la filatura microscopia confocale disco con controllo di temperatura e umidità per fornire squisita controllo spaziale e temporale di organismi patogeni in un ambiente fisiologico per facilitare le interazioni con le cellule ospiti, come determinato dal operatore. Live, gli organismi patogeni come Candida albicans e Aspergillus fumigatus, che può causare potenzialmente letale, infezioni invasive nei soggetti immunocompromessi 15, 16 (ad esempio l'AIDS, chemioterapia, pazienti e organo trapianto), erano intrappolati otticamente con tecniche non distruttive intensità laser e si è trasferito adiacente al macrofagi, in grado di fagocitare l'agente patogeno. Alta risoluzione, filmati luce trasmessa e fluorescenza basato stabilito la capacità di osservare gli eventi iniziali della fagocitosi nelle cellule viventi. Per dimostrare l'applicabilità ampio in immunologia, primario cellule T sono stati intrappolati e manipolati per formare sinapsi con anti-CD3 microsfere rivestite in vivo, e time-lapse imaging di formazione di sinapsi è stato ottenuto. Fornendo un metodo per esercitare avere un controllo spaziale di agenti patogeni vivono rispetto alle cellule immunitarie, le interazioni cellulari possono essere catturate al microscopio a fluorescenza con perturbazione minima di cellule e può produrre una potente visione prime risposte dell'immunità innata e adattativa.
Protocollo
1. Condizioni di coltura di agenti patogeni per l'intrappolamento ottico
- Crescere A. fumigatus (B-5233/RGD12-8) su un semi-solido agar contenente SBD (Sabouraud destrosio) 30 ° C per 3 giorni.
- Crescere C. albicans (SC5314) in YPD (Lievito peptone destrosio) coltura liquida contenente 100 mg / ml ampicillina notte in un incubatore shaker a 30 ° C.
2. Preparazione di agenti patogeni per l'etichettatura fluorescente
- Raccolta desiderata quantità di agenti patogeni e trasferire in una provetta 1,5 ml di reazione.
- Aggiungere 300 ml di tampone fosfato (PBS) al tubo di reazione.
- Sonicare miscela per 30 secondi.
- Centrifugare a 4000 rpm per 1 minuto.
- Aspirare il surnatante, lasciando pellet indisturbato.
- Ripetere (2,4) e (2,5) altre due volte.
- Risospendere in 500μL di PBS.
3. L'etichettatura dei patogeni con colorante fluorescente
- Sciogliere 1 mg di colorante di interesse (ad esempio Alexa Fluor 488, Alexa Fluor 647) in 100 microlitri dimetilformammide (DMF) (concentrazione di 10 mg / mL).
- Aggiungere 3 ml di miscela colorante di provette contenenti agenti patogeni lavato.
- Ruotare o scuotere campione a 37 ° C per 1 ora.
- Lavare campione con PBS 3X per centrifugazione a 4000 rpm per 1 minuto.
- Risospendere in 300 ml di PBS.
4. Raccolta di cellule T da sangue intero
- Ottenere sangue intero (fresco).
- Sangue caldo, PBS + 2% di siero fetale bovino (FBS), e HISTOPAQUE a temperatura ambiente.
- Aggiungi CD4 + Cocktail RosetteSep umani cellule T di arricchimento a 50 microlitri / ml di sangue intero.
- Ruotare il campione e incubare per 20 minuti a temperatura ambiente.
- Diluire il campione con un uguale volume di PBS + 2% FBS e mescolare delicatamente.
- Strato diluito campione in cima HISTOPAQUE, riducendo al minimo la miscelazione
- Centrifugare per 20 minuti a 1200 xg a temperatura ambiente con il freno.
- Rimuovere le cellule arricchito.
- Lavare le cellule con PBS arricchito 2x soluzione + 2% FBS.
- Lisare i globuli rossi per 2 minuti con il rosso del buffer di lisi dei globuli
- Aggiungere 10 ml di PBS + 2% FBS e centrifugare cellule lisate rossi del sangue a 1500 rpm per 5 minuti
- Aspirare il surnatante, attenti a non disturbare il pellet
- Risospendere in mezzi IMDM contenente il 10% di siero fetale bovino
5. Preparazione dei macrofagi RAW 264.7 in camera di diapositive
- Preparare DMEM (Dulbecco modificato medio di Eagle) per contenere il 10% FBS, 1% di penicillina / streptomicina e 1% di L-glutammina.
- Mezzi di caldo, tripsina, e PBS in bagno caldo a 37 ° C.
- Lavare 2x piastra con PBS
- Aspirare il PBS tra ogni lavaggio.
- Aggiungere 5 ml di tripsina piastra a copertura della superficie (per una tavola 10 coltura di tessuti cm).
- Incubare per 5 min a 37 ° C.
- Bussare dolcemente lato della piastra di staccare le cellule dalla superficie della piastra. Fare attenzione a non spruzzi tripsina al di fuori della piastra.
- Aggiungere 5 ml o quantità equivalente di media tripsina.
- Aspirare miscela in un tubo di reazione.
- Centrifugare a 1000 xg per 3 minuti.
- Mezzi di aspirare, attento a non disturbare il pellet.
- Risospendere in 10 ml di media.
- Aggiungere 400 l di media per ciascuna camera della diapositiva camera.
- Aggiungere 5 ml di sospensione cellulare per ogni camera.
- Crescere durante la notte in incubatore a 37 ° C con 5% di CO 2.
6. L'aggiunta di agenti patogeni a campione
- Pipettare 5-10 microlitri di agenti patogeni etichetta di interesse (dai passi 1-3) nella camera.
- Mescolare accuratamente pipeting su e giù, attenzione a non toccare il fondo della camera di disturbare i macrofagi aderito.
7. Caricamento dei campioni sul filatura microscopio confocale disco (in video, scorrere i componenti)
- Accendere tutti i componenti di filatura microscopio confocale disco.
- Allineare microscopio per l'imaging DIC.
- Rimuovere il vetrino della camera da incubatrice.
- Inserire scivolare in camera fase specializzati.
- Rimuovere superiore della slitta da camera (necessario per l'imaging DIC).
8. Preparazione per la cattura ottico (in video, scorrere componenti e come è integrata nel microscopio)
- Attivare otturatore per trappola ottica.
- Accendere il laser a infrarossi.
- Otturatore aperto (il laser) a trappola ottica.
- Conferma di scatto di fronte a laser IR è chiusa da verificare con la carta di IR.
9. La selezione e la manipolazione di agenti patogeni con trappola ottica
- Focus su macrofagi su vetrino aderito.
- Trova patogeni liberamente fluttuanti in soluzione adiacente al macrofagi.
- Spostare stadio tale che l'agente patogeno è in prossimità della trappola.
- Otturatore aperto e coinvolgere la trappola.
- Spostare campione di portare macrofagi in contatto con la trappola stazionarioped patogeno.
- Immagine con microscopio confocale filatura del disco, sia in DIC, fluorescenza, o combinazione di entrambi. Tipicamente, cattura avviene in DIC, e imaging in tempo reale si fa con fluorescenza.
10. Rappresentante dei risultati:
Per esercitare il pieno controllo spaziale e temporale dei patogeni e perline in una in vivo e in vitro l'ambiente, abbiamo progettato una custom-built apparato cattura integrato su un disco rotante microscopio confocale (schema mostrato in fig. 1). A piena forza, il laser fornito 350 mW di potenza e dopo l'accoppiamento della luce con le diverse componenti ottici nell'apparato trappola ottica, ~ 80 mW di energia a scopo TIRF, misurata con un misuratore di potenza, è stato utilizzato per formare la trappola nella camera.
Al fine di posizionare un oggetto nella camera relativa all'oggetto in trappola, il palco è stato spostato mentre si tiene l'oggetto intrappolato fermo con il laser cattura. Il palco è stato spostato a velocità abbastanza lento, in modo che la forza di trascinamento sulla particella intrappolata non superare il valore massimo di cattura.
Popolazioni separate di C. albicans (tipico dimensioni - ~ 5 micron) sono stati etichettati con ciascuno dei tre colori (AF488, AF568 e AF647, corrispondenti a verde, blu e rosso in figura, rispettivamente) per illustrare l'imaging con più canali di fluorescenza allo stesso tempo otticamente cattura l'agente patogeno. Un singolo C. albicans era intrappolato e si trasferì in un modello quadrato con un gruppo di lievito altre, come indicato dalle frecce grigie, dimostrando la capacità di catturare e manipolare la posizione specifica di un agente patogeno single scelto dall'operatore anche in un ambiente affollato (Fig. 2A) .
Per illustrare ulteriormente la versatilità di questo sistema per intrappolare le morfologie forma diversa esposti da parte di organismi patogeni, la pinzetta ottica è stato anche in grado di contenere e di situare una C. particelle albicans con un pseudoife. Il C. albicans etichettati con AF647 (rosso) è stato spostato lungo una traiettoria, come indicato dalla freccia bianca e posto accanto alle cellule GFP-LC3-RAW fluorescenti (Fig. 2B). La parte di lievito di C. albicans è stato intrappolato come pseudoife trainati lungo.
Abbiamo anche posizionato Aspergillus fumigatus accanto a una cella RAW macrofagi del mouse in modo da analizzare il quadro tempo assoluto della fagocitosi con questa linea cellulare particolare e patogeno (Fig. 3A). Una volta che il patogeno entra in contatto con la cellula, la trappola è spento, e time-lapse imaging è impiegato per osservare gli eventi successivi cellulare (Fig. 3B). La trappola ottica è stato utilizzato anche per catturare primarie T-cellule isolate dal sangue e diretto adiacente perle rivestite con anticorpi anti-CD3 in modo che il T-cellule a formare una sinapsi immunologica con il tallone (Fig. 4), mostrano le ulteriori versatilità per intrappolare e manipolare direttamente le cellule immunitarie.
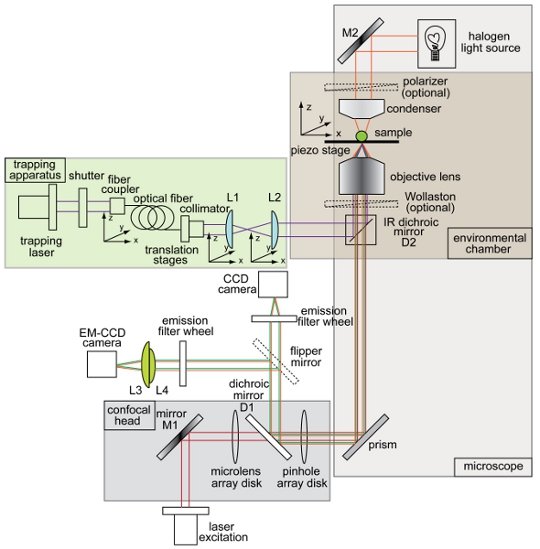
Figura 1. Panoramica e schematica unita trappola ottica e filatura di configurazione disco microscopio confocale. Strumento di layout che mostra il fascio di cattura (viola), campo chiaro percorso di illuminazione per imaging (arancione), fascio di eccitazione di fluorescenza (rosso), emissione di fluorescenza (verde), charge-coupled device (CCD) videocamera, moltiplicando elettrone-Charge Coupled Device (EM- CCD) fotocamera, specchi dicroici (D1 e D2), specchi (M1 e M2) e lenti (L1, L2, L3, L4). Tutti gli altri componenti del sistema-trappola microscopio confocale sono etichettati in figura.
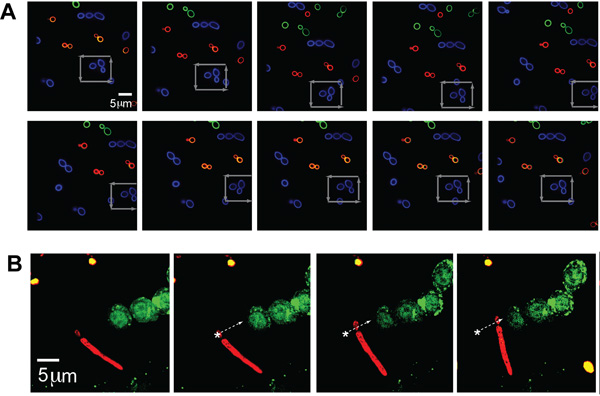
Figura 2. (A) le immagini di fluorescenza intrappolati e manipolati C. albicans. Un intrappolato fluorescenza marcata (Alexa Fluor 488 (AF488), blu), organismo in un campo di altri fluorescenza marcata C. albicans (AF568, AF647 e verde, rosso). Il palco viene spostato tutto il intrappolato, particella blu CA come indicato dalle frecce grigie. (B) Trapped pseudo-ife forma di C. albicans accanto alla GFP-LC3 cellule RAW. Fluorescente forma psuedohyphal di CA (rosso, AF647) otticamente intrappolati e si è trasferito adiacente alla GFP-LC3 espresso macrofagi RAW. L'organismo di certificazione è spostata lungo la traiettoria, come indicato dalla freccia bianca.

Figura 3. Cattura e il posizionamento di A. fumigatus accanto a una cellula fagocitaria RAW. (A) le immagini di un campo chiaro A. intrappolato fumigatus, come indicato dalla freccia bianca, spostati e posizionati lungo il percorso come indicato dalla freccia rossa. L'agente patogeno intrappolati è leggermente fuori fuoco a causa della trappola spingendo l'organismo leggermente al di sopra del piano focale. A. fumigatus è spostato fino a quando non viene inserito adiacente alla cella desiderata RAW. (B) Flul'imaging orescence di fagocitosi di A. fumigatus da cellule RAW. Dopo che il patogeno intrappolati è collocato accanto a una cella RAW, il processo di fagocitosi è attivato. Al 30 s, la membrana della cellula RAW inizia a cambiare e formare una coppa intorno alla particella. A 60 s, la coppa è completamente formato. Dal '90 al 150s, A. fumigatus è inghiottito, e di 180 s, la particella è completamente interiorizzato

Figura 4. Intrappolando primario delle cellule T per formare sinapsi con perline rivestito anti-CD3. DIC immagini di un primario delle cellule T mosso dalla trappola ottica ad una posizione vicino ad un tallone rivestito con anticorpi anti-CD3. La cella costituisce quindi una sinapsi immunologica, che non può essere facilmente individuabile nelle immagini.
Access restricted. Please log in or start a trial to view this content.
Discussione
In questo lavoro si usa una trappola ottica di catturare patogeni con dimensioni tra i 3 micron - 5 micron. Anche se gli agenti patogeni di interesse al nostro laboratorio hanno tipicamente queste dimensioni, il sistema di pinzetta ottica qui descritto è flessibile per intrappolare una vasta gamma di formati. In realtà le trappole ottiche sono stati utilizzati per catturare le particelle che vanno da singoli atomi alle cellule di circa 10 micron di diametro. Inoltre, questo sistema di intrappolamento ottico è in grad...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Riconoscimenti
Questo lavoro è stato sostenuto dal Massachusetts General Hospital Dipartimento di Medicina fondi interni (JMT, MKM, MLC, JMV), National Institute of Biomedical Imaging e Bioingegneria concedere T32EB006348 (CEC), Center del Massachusetts General Hospital per finanziare Biologia Computazionale e Integrative sviluppo e AI062773 ( RJH), borse di studio AI062773, DK83756, e DK 043351 (RJX), NSF 0.643.745 (MJL), NIH R21CA133576 (MJL) e Istituto Nazionale di allergie e malattie infettive (NIAID) dei National Institutes of Health (NIH) AI057999 (JMV ). Ringraziamo Nicola C. Yoder per le discussioni utili, e Feltri Carlo (RPI, Inc.) per l'assistenza tecnica.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| A. fumigatus | Ceppo albino, B-5233/RGD12-8, dono di KJ Kwon-Chung, NIH | ||
| C. albicans | SSY50-B mutante, dono di Eleftherios Mylonakis, MGH; SC5314 ceppo, dono di Gerald Fink, Whitehead Institute | ||
| Alexa Fluor 488 | Invitrogen | A20000 | |
| Alexa Fluor 647 | Invitrogen | A20006 | |
| dimetilformammide | Sigma | D4551 | |
| Sangue fresco | Dono di RJW Heath, MGH, HMS | ||
| Nikon microscopio invertito | Nikon | Modello Ti-E | |
| Laser trapping, ChromaLase | Blue Sky di ricerca | CLAS-106-STF02-02 | |
| Eccitazione laser a fluorescenza | Coerente | Modello Innova 70C | |
| Basette per i componenti cattura | Thorlabs | MB1224, MB1218 | |
| Ottica aria tavolo | Tecnico Manufacturing Corporation | ||
| Otturatore elettronico con comando a pedale | Uniblitz | Acquistato da Associates Vincent, Rochester, NY | |
| Fibra ottica monomodale | Oz Ottica | PMJ-3S3S-1064-6 | |
| Fibra posizionatore | Thorlabs | PAF-X-5-C | |
| Fibra collimatore | Oz Ottica | HPUCO-23-1064-P-25AC | |
| Lenti per telescopio | Thorlabs | AC254-150-B | Lunghezza focale di 150 mm |
| Fasi di traduzione (x, y, z) | Newport | M-461-XYZ | |
| IR specchio dicroico | Chroma | ET750-sp-2P8 | |
| Della lente dell'obiettivo (100X) | Nikon | NA = 1.49, immersione in olio, obiettivo TIRF | |
| Testa confocale | Yokogawa | CSU-XI | |
| Polarizzatore | Nikon | MEN51941 | |
| Prisma Wollaston | Nikon | MBH76190 | |
| EM-CCD | Hamamatsu | C9100-13 | |
| CCD (ORCA ER) | Hamamatsu | C4742-80-12AG | |
| Ruota portafiltri | Ludl | 99A353 | |
| Ruota portafiltri | Sutter | LB10-NWE | |
| Chambered coprioggetti | Lab-Tek/Nunc | 155409 | |
| Dynabeads | Invitrogen | 111-51D | Rivestiti con anti-CD3 |
| Medio Dulbecco modificato Eagle (DMEM) | Invitrogen / Gibco | 10313 | |
| Penicillina / streptomicina | Invitrogen / Gibco | 15140-122 | |
| L-glutammina | Invitrogen / Gibco | 25030-081 | |
| Siero fetale bovino (Hyclone) | ThermoScientific | SH30071.03 |
Riferimenti
- Grakoui, A. The immunological synapse: A molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Monks, C. R. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Stuart, L. M., Ezekowitz, R. A. Phagocytosis and comparative innate immunity: Learning on the fly. Nat Rev Immunol. 8, 131-141 (2008).
- Neuman, K. C., Block, S. M. Optical trapping. Rev Sci Instrum. 75, 2787-2809 (2004).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proc Natl Acad Sci USA. 94, 4853-4860 (1997).
- Ashkin, A. Acceleration and trapping of particles by radiation pressure. Phys Rev Lett. 24, 156-159 (1970).
- Ashkin, A., Dziedzic, J. Optical trapping and manipulation of viruses and bacteria Science. Nature. 235, 1517-1520 (1987).
- Khalil, A. S. Single M13 bacteriophage tethering and stretching. Proc Natl Acad Sci USA. 104, 4892-4897 (2007).
- Khalil, A. S. Kinesin's cover-neck bundle folds forward to generate force. Proc Natl Acad Sci USA.. 105, 19247-19252 (2008).
- Li, Z. Membrane tether formation from outer hair cells with optical tweezers. Biophys J. , 1386-1395 (2002).
- Kim, S. The αβ T cell receptor is an anisotropic mechanosensor. J Biol Chem. 284, 31028-31028 (2009).
- Mohanty, S., Mohanty, K., Gupta, P. Dynamics of interaction of RBC with optical tweezers. Opt. Express. 13, 4745-4751 (2005).
- Tam, J. Control and manipulation of pathogens with an optical trap for live cell imaging of intercellular interactions. PLoS One. 5, e15215-e15215 (2010).
- Lin, S. J., Schranz, J., Teutsch, S. M. Aspergillosis case-fatality rate: Systematic review of the literature. Clin Infect Dis.. 32, 358-366 (2001).
- Wey, S. B. Hospital-acquired candidemia - the attributable mortality and excess length of stay. Arch. Intern. Med. 148, 2642-2645 (1988).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon