Method Article
Cellulare Imaging in diretta di Bacillus subtilis E Streptococcus pneumoniae Utilizzando automatico Time-lapse Microscopia
In questo articolo
Riepilogo
Questo protocollo offre un passo-passo procedura per monitorare il comportamento singola cellula dei batteri diversi nel tempo con modalità automatizzate fluorescenza microscopia time-lapse. Inoltre, forniamo le linee guida su come analizzare le immagini di microscopia.
Abstract
Nel corso degli ultimi anni gli scienziati è diventato sempre più consapevole che i dati medi ottenuti da esperimenti popolazione microbica base non sono rappresentativi dello stato di comportamento, o fenotipo delle cellule singole. A causa di questa nuova visione del numero di studi singola cellula aumenta continuamente (per una rassegna recente si veda 1,2,3). Tuttavia, molte delle tecniche applicate singola cellula non consentono il monitoraggio dello sviluppo e il comportamento di una specifica cella singola nel tempo (ad esempio, citometria a flusso o microscopia standard).
Qui, fornire una descrizione dettagliata di un metodo di microscopia utilizzato in diversi studi recenti 4, 5, 6, 7, che consente i seguenti e la registrazione (fluorescenza) singole cellule batteriche di Bacillus subtilis e Streptococcus pneumoniae attraverso la crescita e la divisione per molte generazioni. I film risultante può essere usato per costruire alberi filogenetici lignaggio da ripercorrere la storia di una singola cella all'interno di una popolazione che ha avuto origine da un antenato comune. Questo time-lapse metodo di microscopia a fluorescenza non può essere utilizzato solo per studiare la crescita, la divisione e la differenziazione delle cellule individuali, ma anche per analizzare l'effetto della storia delle cellule e ascendenza su specifici comportamento cellulare. Inoltre, microscopia time-lapse è ideale per esaminare le dinamiche di espressione genica e localizzazione di proteine durante il ciclo cellulare batterica. Il metodo spiega come preparare le cellule batteriche e di costruire il vetrino da microscopio per consentire la conseguenza di singole cellule in un microcolony. In breve, le singole celle sono macchiati di un semi-solida superficie costituita da terreno di coltura integrata con agarosio su cui crescono e si dividono con un microscopio a fluorescenza all'interno di una camera a temperatura controllata ambientale. Le immagini vengono acquisiti a intervalli specifici e vengono poi analizzati utilizzando il software open source ImageJ.
Protocollo
1. Preparazione di B. subtilis culture
- Inoculare le cellule da -80 ° C scorte in 10 ml microscopia time-lapse (TLM) media (62 mM K 2 HPO 4, 44mm KH 2 PO 4, 15 mM (NH 4) 2 SO 4, 6,5 mM citrato di sodio, 0,8 mm MgSO 4, 0,02% di acidi casamino, glucosio 27,8 mM, 0,1 mM di L-triptofano, il pH è stato impostato su 7 utilizzando una soluzione di KOH) integrato con gli antibiotici, se necessario.
- Crescere le cellule durante la notte in un dibattimento in pallone (30 ° C, 225 giri al minuto).
- La mattina seguente, diluire le cellule 1:10 in pre-riscaldato medio chimica definita (CDM) (62 mM K 2 HPO 4, 44mm KH 2 PO 4, 15 mM (NH 4) 2 SO 4, 6,5 mM citrato di sodio, 0,8 mM MgSO 4, 2,2 mm di glucosio, 2,1 mM acido L-glutammico, 6 mM L-triptofano, 7,5 mM MnCl 2, 0,15 mix di metallo x (50x preparare magazzino mix MT (rif 8) che contiene: 0,2 M MgCl 2, 70 mM CaCl 2, 5 mM MnCI 2, 0.1 mM ZnCl 2, 0,2 mm-tiamina cloridrato, 2 mM HCl, 0,5 mM FeCl 3 (aggiungere scorso)) senza antibiotici.
- Crescere la B. cellule subtilis a metà esponenziale fase (30 ° C, 225 giri al minuto). Di solito, questo dura circa quattro ore. Soprattutto, preparare il vetrino agarosio un'ora prima di raggiungere le cellule metà fase esponenziale (vedi punto 2).
- Misurare l'assorbanza della cultura a 600 nm (A 600) e diluire le cellule di un approssimativo A 600 di 0,035 usando CDM. Questo OD assicura che le cellule singole con spazi adeguati sono macchiati sul vetrino per microscopia time-lapse.
2. Preparazione del campione microscopio (vedi anche Figura 2)
Un'ora prima di raggiungere le cellule metà esponenziale crescita, preparare il vetrino come segue:
- Pulire due vetrini microscopio (ad esempio Knittel vetro, 7,6 x 2,6 cm) con il 70% di etanolo e acqua.
- Prendete un telaio gene (ABgene; 1,7 x 2,8 cm) e rimuovere con attenzione uno dei fogli di plastica dal telaio gene senza causare lo smontaggio della copertura in plastica sul lato opposto del telaio gene.
- Applicare il telaio gene nel bel mezzo di uno dei vetrini dal primo contatto favorendo su un solo lato, seguita da attacco guidato del telaio gene rimanente con un unghia. Evitare bolle d'aria mentre si collega il telaio gene al vetrino.
- Utilizzare un forno a microonde per sciogliere 150 mg (1,5%) ad alta risoluzione, basso punto di fusione agarosio (Sigma) in 10 ml di CDM. L'agarosio deve essere completamente sciolto per ottenere sfondo minimo richiesto per il time-lapse esperimenti di microscopia. Se necessario, integrare le agarosio-CDM con induttore o altri composti in questo momento
- Trasferire 500 microlitri del caldo agarosio-CDM nel bel mezzo della cornice gene. Assicurarsi che tutta l'area compresa (i confini) è interamente coperta.
I passi seguenti (2,6-2,10) devono essere effettuate rapidamente per evitare l'essiccamento eccessivo della agarosio-CDM. - Collocare la seconda diapositiva vetro sul agarosio-CDM telaio gene riempito. Cercate di evitare bolle d'aria. Porre i vetrini inserita in posizione orizzontale per 45 minuti a 4 ° C in frigorifero per consentire l'agarosio-CDM a solidificare a sufficienza.
- Far scorrere delicatamente dal vetrino superiore di vetro. Utilizzare una lama di rasoio per tagliare strisce agar di ~ 5 mm di larghezza all'interno della cornice gene, su cui le cellule saranno cresciute. Un massimo di tre strisce possono essere utilizzate per vetrino, separate da ~ 4 mm di spazio su entrambi i lati. Questi spazi saranno dotate di aria che è essenziale per la B. subtilis crescita. Se quattro diversi ceppi devono essere seguite nel tempo, due strisce possono essere fatte e essere tagliati a metà per portare a quattro quadrati di piccole dimensioni. Rimuovere qualsiasi supporto residuo solido.
- Rimuovere con cautela il coperchio seconda e ultima plastica dal telaio gene per esporre il lato adesivo del telaio gene
- Celle di carico singola (dal punto 1.5) sul terreno solido senza toccarlo con la punta della pipetta. Utilizzare 2,5 microlitri di una striscia intera, o 1 ml per una piccola piazza. Sempre inizio in alto del pad agarosio e che il liquido di disperdersi ugualmente sulla sua area di crescita assegnato girando la diapositiva su e giù. La slitta è pronta, non appena i bordi del liquido diventa ondulato e il movimento del liquido non è più visibile quando si gira la diapositiva.
- Posizionare un vetrino pulito slittamento microscopio copertina (24 x 50 mm) sul telaio del gene da una parte all'altra (evitare bolle d'aria). Assicurare l'attaccamento completa applicando pressione sul vetrino lungo la cornice gene con l'unghia. Se la polizza di copertura è posto sulle cellule senza permettere loro di asciugare abbastanza a lungo, le cellule tendono a crescere sopra l'altro durante l'esperimento. Anche fare attenzione a non aspettare troppo a lungo prima di applicare la polizza di copertura, dal momento che l'agarosio sarà poi troppo secco.
- Preriscaldare il vetrino per 1 ora a 30 ° C. Se la diapositiva would direttamente essere messi in pre-riscaldato camera ambientale (vedi punto 3.1) del microscopio, le fluttuazioni della temperatura potrebbe causare problemi di messa a fuoco nelle prime ore di questo esperimento.
3. Time-lapse microscopia a fluorescenza (vedi anche figura 3 e Film 1)
- Pre-riscaldare la camera ambientale in tempo (nelle nostre mani almeno 2 ore prima dell'inizio dell'esperimento) al fine di evitare problemi di messa a fuoco automatica dopo aver iniziato l'esperimento. Il tempo necessario dipende dalla camera ambientale utilizzati e l'impianto di riscaldamento e il microscopio.
- Selezionare l'obiettivo del caso, filtri e specchi dicroici secondo le vostre set-up sperimentale. Per gli esperimenti lungo assicurarsi che un filtro UV è posta tra la sorgente luminosa e il campione. Inoltre, se possibile, bloccare una parte della luce di eccitazione usando filtri a densità neutra per minimizzare l'esposizione.
Le seguenti apparecchiature (fornite da DeltaVision, UK) è stato utilizzato per il time-lapse esperimenti di microscopia pubblicato de Jong et al 2010 5:. IX71 microscopio (Olympus), CoolSNAP HQ2 fotocamera (Princeton Instruments), 300W Xenon Light Source, 60x luminoso campo dell'obiettivo (1,25 NA), GFP filterset (Chroma, eccitazione a nm 470/40, 525/50 emissione nm), mCherry filterset (Chroma, eccitazione a nm 572/35, 632/60 emissione nm). Messa a fuoco automatica è stata effettuata utilizzando la luce diascopica e utilizzando la routine di messa a fuoco automatica presente nel software di Softworx Deltavision. Va notato che ci sono ora una serie di sistemi di autofocus altri che sono adatti anche come la Focus Zeiss definito, il Perfetto sistema di messa a fuoco Nikon e la messa a fuoco Leica Adaptive Control.
- Programma l'esperimento secondo il vostro set-up sperimentale. E 'saggio per determinare la quantità di luce necessaria per i costrutti specifici, così come le impostazioni di messa a fuoco automatica per altri time-lapse microscopi o batteri prima che l'esperimento vero e proprio. Tempi di esposizione più breve e meno quantità di luce di eccitazione ridurrà al minimo lo sbiancamento e la fototossicità. Utilizzare la luce diascopica per la routine messa a fuoco automatica.
Le seguenti impostazioni sono state utilizzate per il time-lapse esperimenti di microscopia pubblicato de Jong et al 2010 5:. Istantanee per i film sono stati presi ad intervalli di 8 o 12 minuti con il 10% APLLC LED bianco esposizione alla luce e 0,05 s campo per immagini luminose, 10% di luce allo xeno e 0,5 s di esposizione per il rilevamento GFP, e il 32% di luce allo Xenon e 0,8 s di esposizione per il rilevamento mCherry, rispettivamente. Dati grezzi sono stati memorizzati utilizzando softWoRx 3.6.0 (Applied Presicion). L'autofocus è stato programmato per lo 0,06 micron passi e una gamma totale di 1,2 micron.
- Posizionare il vetrino preparato (sezione 2) nel pre-riscaldato camera ambientale del microscopio e monitorare la conseguenza di singole cellule in un monostrato microcolony a 30 ° C.
Suggerimenti specifici:
- Selezionare le celle singole che si trovano nel bel mezzo del pad agar. I bordi delle agar pad asciugano più facilmente. Conservare il X, Y, Z posizione utilizzando il software del microscopio.
- Grandi movimenti della fase del X, Y e Z potrebbero turbare l'agarosio e di conseguenza ostacolare l'identificazione di cellule dalla routine di messa a fuoco automatica. In generale, per minimizzare X, Y, Z movimento, non selezionare più di 10 posizioni per esperimento, anche se una diapositiva contiene ceppi multipli.
- Dopo aver selezionato la prima cella, solo regolare la Z-fuoco con il software. Da questo punto, non alterano la messa a fuoco sul corpo utilizzando il microscopio "Z-manopola" a meno che questo è digitalmente codificato. Garantire che, dopo ogni routine messa a fuoco automatica la nuova X, Y, Z posizione viene memorizzata dal software.
- Controllare se le impostazioni di messa a fuoco automatica sono appropriate per l'esperimento, prima di iniziare la corsa. L'uso del microscopio a contrasto di fase potrebbe migliorare la routine autofocus rispetto all'utilizzo campo chiaro o microscopia DIC, a causa di maggior contrasto. Tuttavia, l'anello di fase in contrasto di fase obiettivi li rende meno sensibili (circa il 10%) nella raccolta di luce di fluorescenza. Così, per debole campioni fluorescenti, un obiettivo senza anello di fase è più adatto.
- Controllare se le celle selezionate sono ancora a fuoco ogni mezz'ora, fino a quando l'esperimento è in esecuzione in modo stabile. Quando le cellule a questo punto sono fuori fuoco, regolare manualmente. A causa di variazioni di temperatura, nonché campioni male secca, questo potrebbe essere necessario durante le prime ore. Inoltre, a causa di un migliore contrasto, l'autofocus funziona meglio quando più cellule si trovano nel campo visivo.
- Dopo l'esperimento è terminato, separare i diversi canali di film e sicuro come file separati (contrasto di fase cioè, GFP, mCherry) se richiesto (pacchetti di acquisizione certo metterà tutti i canali in un unico file impilati). Per la pubblicazione, le immagini possono essere rafforzata deconvoluzione in 2D, che è particolarmente noieful per gli studi di localizzazione delle proteine. Deconvolve le immagini utilizzando il software del microscopio o con un pacchetto commerciale come Huygens ( www.svi.nl ).
- Analizzare i dati utilizzando ImageJ ( http://rsbweb.nih.gov/ij/ ) (utilizzare le materie prime, i file di immagine non elaborati per questo) e Microsoft Excel o Sigma Plot. Stack può per esempio essere salvato come. "Avi" filmato in ImageJ. Una descrizione dettagliata di come la fluorescenza di singole cellule possono essere misurati nel tempo è riportata qui sotto.
4. L'analisi dei dati delle dinamiche attività promotore con ImageJ
Prendiamo atto che altri pacchetti software sono disponibili buone che sono specializzati in analisi time-lapse immagini di microscopia, come BHV Software 9, 4, Schnitzcell 10, PSICIC 11, Microbo e-Tracker 12, ma qui ci concentriamo sulla confezione liberamente disponibile ImageJ.
- Scarica ImageJ ( http://rsbweb.nih.gov/ij/ ) e (se necessario) il plugin corretto per aprire il tuo (stacked) file. Per esempio, i filmati registrati utilizzando un microscopio deltavision può essere aperto solo in ImageJ con il plugin apertura deltavision. Copiare il DV-plugin nella cartella plugin di ImageJ e avviare il programma. Cambia la capacità di memoria a modificare il file / opzioni / memoria e le discussioni al 1250. Questo permette di lavorare con file più grandi, come quelli ottenuti da filmati time-lapse.
- Per valutare la storia delle cellule di una singola cella, aprire il film originale contrasto di fase di una microcolony e scorrere fino all'ultimo fotogramma di interesse nel film. Selezionare l'opzione "segmentata linee" pulsante di selezione del menu.
- Tracciare una linea in background e premere il tasto "CTRL" + "T". Si aprirà la regioni di interesse (ROI) manager. (Il corrispondente valore di fluorescenza di fondo può essere utilizzato per sottrarre manualmente lo sfondo -.. Vedi sotto alternativa, utilizzare il fondo attuale sottrazione di routine all'interno di ImageJ) anche tracciare una linea nella cella di interesse e aggiungere il ROI al gestore ROI. Dal momento che stiamo indagando promotore-GFP fusioni in questo caso di studio e la GFP è diffusa in tutto il citoplasma, la cellula intera dovrebbe avere simili valori di fluorescenza di ogni singolo pixel per tutta la lunghezza della cellula. Scorrere un fotogramma indietro nel tempo e selezionare un nuovo ROI nella stessa cella di interesse. Salva questo ROI terzo e continuare con la procedura fino a quando il ROI corrispondente nel primo fotogramma del film è stato salvato.
Essere consapevoli del fatto che la fluorescenza delle cellule figlie può variare notevolmente dopo la divisione cellulare. Utilizzare un colorante membrana che può essere applicata con proteine fluorescenza prodotta dalle cellule (come la combinazione del rosso membrana colorante FM 5-95 ® (Invitrogen) e GFP) per visualizzare la formazione del setto. In questo caso il canale corrispondente a fluorescenza e non il film contrasto di fase dovrebbe essere usato per seguire le cellule nel tempo. In alternativa, si può stare sul sicuro, selezionando ROI in una sola metà di una cella. - All'interno del direttore ROI, fai clic su "Salva". Se la fine del file è ". Roi", allora si roi è selezionato nella lista, e solo questo sarà salvato. Se la fine del file è ". Zip", quindi l'insieme sarà salvato (obbligatorio).
- Chiudere il film contrasto di fase e aprire il film originale di fluorescenza (es. GFP). Fare clic su "mostra tutti" e "misura" nel gestore ROI. Una nuova finestra si aprirà (Risultati). Copiare i risultati in un foglio Excel e sottrarre la fluorescenza media per ogni singola cellula dalla fluorescenza di fondo del mezzo. La fluorescenza risultante rete può essere rilevata in tempo per rivelare l'attività di promotore della cellula di interesse nel tempo.
- In alternativa, la fluorescenza di tutte le cellule di un microcolony possono essere analizzati in un tempo specifico punto. A tale scopo selezionare e salvare ROI per lo sfondo e ogni singola cellula in una cornice come sopra descritto, copiare i valori di fluorescenza di Excel e produrre istogrammi utilizzando la funzione "istogramma" nel menu "tool".
- Per ottenere le immagini da singoli fotogrammi per la pubblicazione, selezionare il frame di interesse, selezionare "immagine" - "duplicare l'immagine" e cambiare il tipo di immagine su "RGB" o "8-bit", selezionando "immagine" - "tipo" - "colore RGB" o "8-bit". Salvare il fotogramma duplicato come ". Tiff". Le immagini RGB/8-bit può essere aperto da programmi di disegno tradizionali come CorelDraw o Adobe Illustrator. Se necessario, le illustrazioni possono essere adattati con "immagine" - "regolare" - "luminosità / contrasto" o di "immagine" - "regolare" - "finestra / livello" in ImageJ.
5. La produzione di film per la pubblicazione con ImageJ
- Aprire il contrasto di fase originale e il film fluorescenza corrispondente (s) in ImageJ come descritto sopra. Selezionare il pulsante rettangolare selezioni (1 ° a sinistra) e disegnare un rettangolo ROI nel primo fotogramma in modo tale, che il microcolony via di sviluppo è racchiuso dal throu ROIGhout tutto il film. Selezionare "immagine" - "crop" e sicuro questa versione ridotta del film con un nuovo nome. Selezionare lo stesso ROI attraverso il gestore del ROI nel film fluorescenza e procedere come prima.
- Per combinare i filmati sia in orizzontale o in verticale, selezionare "plugin" - "combinatore stack". Se lo si desidera, un stampatore tempo possono essere aggiunti tramite "plugin" - "stamper tempo". Salva la pila combinato una volta come ". Dv" o ". Tiff" e una volta come ". Avi" o di un filmato quicktime.
Adattamenti protocollo alternativo per Streptococcus pneumoniae (figura 4 e Movie 2):
6. Preparazione di S. pneumoniae culture
- Crescere S. cellule pneumoniae (ceppo capsulato D39 13, o ceppo non incapsulata R6 14 come culture in piedi in C + Y media 15 a 37 ° C fino a quando un OD in A 600nm di circa 0,4 viene raggiunto. Centrifugare le cellule per 2 min a 14000 rpm e risospendere il pellet di cellule in un volume fresco di C + medio Y contenente 14,5% glicerolo (v / v), che si tradurrebbe in un A 600 nm di esattamente 0,4. Aliquotare le cellule e conservarle a -80 ° C per un uso futuro.
- Per la microscopia time-lapse, prendere un 'aliquota di prima colta S. pneumoniae cellule. Inoculare 4 ml di fresca C + Y medio 1:100 con le cellule dal aliquota C ° -80. Crescere le cellule fino a metà esponenziale fase ad un diametro esterno di A 600 nm di 0,1 - 0,2. Di solito, questo richiede circa 2 ore quando si utilizzano le cellule da -80 ° C aliquote.
7. Preparazione del campione microscopio
- Preparare un vetrino come descritto sopra per la B. subtilis, ma fare in modo che l'agarosio contiene complesso C + Y medio. Dal S. pneumoniae è un microaerophile, le bolle d'aria tra le strisce di agarosio deve essere inferiore a B. subtilis (~ 1 mm di spazio su entrambi i lati).
- Misurare l'assorbanza della cultura a 600 nm (A 600), diluire la crescita esponenziale delle cellule S. pneumoniae in un approssimativo di 0,05 A 600 in C + Y e medie usare questa diluizione per caricare la diapositiva agarosio.
8. Time-lapse microscopia a contrasto di fase
Regolare le impostazioni microscopio per S. pneumoniae: utilizzare la microscopia a contrasto di fase dal S. pneumoniae è difficile identificare con campo chiaro microscopia. Continua il protocollo come descritto per B. subtilis (seguire i passi 2,9-3,7). S. pneumoniae cellule possono essere coltivate sia a 30 ° C o 37 ° C (che crescono più velocemente a 37 ° C).
9. Rappresentante dei risultati:
Il time-lapse experiment fluorescenza è stata effettuata con successo, se i batteri sono cresciuti in un monostrato microcolony, che si trova completamente all'interno del campo visivo, alla fine dell'esperimento (vedi Figura 5A-C). Se le cellule sono cresciuti l'uno sopra l'altro, non è solo impossibile risalire con precisione la loro storia, ma anche i livelli di fluorescenza di cellule sovrapposte non può essere misurata correttamente. Le cellule tendono a crescere sopra l'altro, se le cellule non erano macchiato sufficientemente asciutto (passo 2,9) o se la composizione media ha bisogno di essere regolato per ottenere una crescita più lenta. Se un microcolony cresciuto fuori di vista, allora la distribuzione di segnali di fluorescenza in una colonia non può essere determinato. Cause di "movimento microcolony" può essere insufficiente essiccazione di cellule macchiato (passo 2,9), o se il software non è stato programmato per monitorare il microcolony durante lo sviluppo. Inoltre, è importante che le patch locale aumento della fluorescenza non sono rilevabili nel mezzo di questa oscura i segnali di fluorescenza provenienti dalle cellule (vedi Figura 5D-F). Problemi di fondo relativi possono derivare da composti media, bolle d'aria o indisciolto grumi agarosio. Per visualizzare questo, mostriamo in fig. Segnali di fondo 5F di questa diapositiva specifica quando l'immagine è stata scattata con eccitazione / emissione di filtri per il rosso coloranti fluorescenti. Come si è visto, luminose macchie autofluorescenti presenti che potrebbero ostacolare l'imaging. Per evitare che tali macchie, assicurarsi che l'agarosio è completamente sciolto e non ci sono bolle d'aria quando si posiziona il vetrino sul vetrino da microscopio.
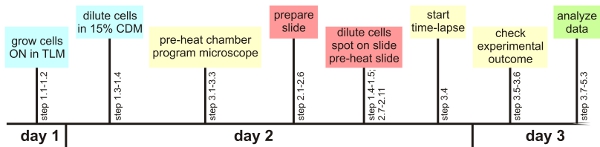
Figura 1: Panoramica Sperimentale

Figura 2: Preparazione del campione microscopio
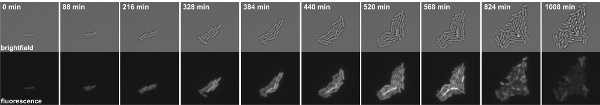
Figura 3: Time-lapse microscopia a fluorescenza di B. cellule subtilis asilo ad un kinB-GFP P fusione. Le istantanee sono tratte da film 1. I pannelli in alto: in campo chiaro, pannelli in basso: canale GFP.
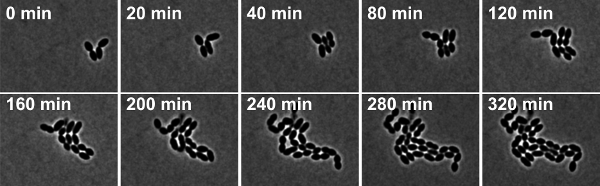
FicoURE 4: Time-lapse a contrasto di fase microscopia di S. pneumoniae ceppo selvatico R6. Le istantanee sono tratte da film 2.
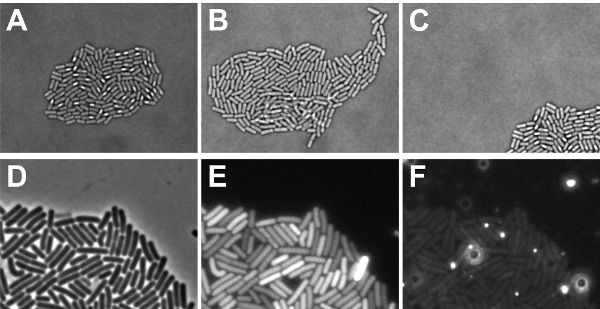
Figura 5: Illustrazione di possibili (time-lapse) esiti microscopia. AC dimostra fattori che devono essere considerati per i dati ottenuti con diascopica impostazioni di luce. (A) Micrografia Brightfield di un monostrato microcolony (esito positivo) di sporulanti B. cellule subtilis (B) l'immagine di un campo chiaro B. subtilis microcolony in cui alcune cellule sono cresciuti l'uno sopra l'altro (esito negativo) (C) l'immagine di un campo chiaro B. sporulanti subtilis microcolony che è cresciuta fuori dal campo di messa a fuoco (esito negativo). DF fattori mostrano che devono essere considerati per i dati ottenuti con episcopica impostazioni di luce (D) contrasto dell'immagine fase di B. subtilis cellule in fase esponenziale rappresentato per la visualizzazione in cui i segnali di fluorescenza in E e F provengono da (E) GFP segnali delle celle indicate alla nota D. che i segnali di fondo sono simili in ogni pixel (esito positivo). Si noti inoltre che il tempo di esposizione potrebbe essere molto in quanto una cella mostra un segnale saturi (esito negativo) (F) I segnali ottenuti tramite il canale rosso delle cellule mostrato in D. Nota che il fondo contiene aree con aumento dei livelli di fluorescenza rossa (negativo risultato).
Movie 1. Time-lapse microscopia a fluorescenza di B. cellule subtilis asilo ad un kinB-GFP P fusione. Le istantanee sono state scattate a intervalli di 8 min. A sinistra: campo chiaro, a destra: GFP canale. Clicca qui per guardare il film.
Movie 2. Time-lapse a contrasto di fase microscopia di S. pneumoniae ceppo selvatico R6. Le istantanee sono state scattate a intervalli di 10 min. Clicca qui per guardare il film.
Discussione
A differenza di molte altre tecniche singola cellula, il time-lapse metodo di microscopia a fluorescenza qui descritto può essere usato per seguire la storia di una cella specifica in relazione ai suoi antenati, il suo comportamento, e gli eventi divisione. In combinazione con i promotori bersaglio fluorescente o proteine, specifica attivazione della via di sviluppo può essere seguito in tempo e la localizzazione delle proteine e la dinamica delle proteine può essere monitorato durante lo sviluppo dei batteri.
Come indicato sopra, gli studi concentrandosi su diverse specie batteriche possono essere eseguite da adattare le condizioni di crescita a seconda delle esigenze di un batterio specifico. Le uniche limitazioni che abbiamo incontrato sono legati alle condizioni di crescita e la dimensione del campione. A causa di un ambiente sigillato, le condizioni di media non può essere modificato durante l'esperimento. Inoltre, un massimo di quattro ceppi per esperimento può essere monitorato in modo efficiente.
Considerando a pochi passi critico, l'unico metodo di analisi delle cellule qui descritto può essere facilmente applicato con qualsiasi microscopio automatizzato. Di seguito, una panoramica di tali passaggi critici sarà dato. Informazioni dettagliate si possono trovare nel testo principale generali di redazione:. E 'consigliabile controllare le impostazioni di messa a fuoco automatica richieste per un batterio specifico prima dell'esperimento. Allo stesso modo, approssimativo impostazioni ottimali per la visualizzazione della fluorescenza deve essere determinato in anticipo, se possibile. Inoltre, a seguito di un pronto time-line consente di avere tutto il materiale pronto per l'uso nel tempo (pre-riscaldamento della camera di microscopio, la programmazione delle impostazioni microscopio, preparazione del vetrino uno ora prima che le cellule sono in fase di crescita desiderata, vedi figura 1) . crescita di B. subtilis in TLM e CDM: TLM e CDM sono chimicamente supporto definito la fame nel quale B. subtilis si sviluppa solo lentamente. Il periodo di tempo in cui vengono coltivate le cellule del supporto potrebbe essere prolungata a seconda del ceppo specifico. La crescita lenta impedisce alle cellule di accumulano l'uno sull'altro Preparazione del campione microscopio:. Bolle d'aria tra la struttura del gene, il vetrino e la polizza di copertura devono essere prevenuti contro l'essiccamento estensivo del agarosio-based media. Lo stesso vale per il medio / coperchio interfaccia slittamento. E 'fondamentale lasciare le pile a secco a sufficienza, per evitare che il nuoto e / o di crescita dello strato più Time-lapse microscopia a fluorescenza:. Pre-riscaldamento della diapositiva e la camera ambientale è fondamentale per prevenire problemi di messa a fuoco automatica più importanti. Le cellule dovrebbero essere selezionati nel bel mezzo di un tampone agar, dato che questi hanno la più alta possibilità di soggiornare in campo e mettere a fuoco durante l'esperimento (a condizione che il campione è stato asciugato abbastanza bene). Un massimo di 10 posizioni per esperimenti funziona ancora correttamente. Dopo aver selezionato la prima cella di interesse solo utilizzare il software per regolare la messa a fuoco (vedi testo per i dettagli). Verificare se le cellule sono ancora a fuoco durante le prime ore della sperimentazione in intervalli di 30 min. Analisi: E 'importante controllare prima di procedure di analisi estese se lo sfondo del mezzo ha valori simili nei canali di fluorescenza. Piccole particelle di polvere, i componenti di media, lenti sporche o piccoli grumi agarosio può contribuire ad un aumento della fluorescenza a livello locale, rendendo il film difficili o impossibili da analizzare guasti:. Se le cellule crescono uno sopra l'altro, questo potrebbe indicare che sia stato il coprioggetto attaccato troppo presto o che il mezzo non è adatto per la crescita di monostrati microcolony. Se le cellule di interesse continuamente muoiono prematuramente, mentre altre cellule sul vetrino divide felicemente, si potrebbe desiderare di controllare se si inserisce il filtro UV in posizione. Si potrebbe anche contribuire a diminuire il tempo di esposizione o l'intensità della luce durante gli esperimenti a lungo.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Il lavoro nel gruppo di JWV è supportata da un Marie-Curie dell'UE reintegrazione Fellowship, una sovvenzione Sysmo2 (NWO-ALW/ERASysBio), un orizzonte di finanziamento (ZonMW) e da una borsa di studio VENI (NWO-ALW). Il gruppo di OPK è supportato da diversi concede STW (NWO), un SYSMO1 (IGdeJ) e SYSMO2 sovvenzione, FSE Eurocores SynBio concedere (SynMod) e dal Centro di Genomica Kluyver di Fermentazione Industriale e l'Istituto superiore per Alimenti e la Nutrizione.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| Gene Telaio | ABgene | AB-0578 | 1,7 x 2,8 centimetri |
| ad alta risoluzione a bassa fusione agarosio | Sigma | A4718 | |
| fodera grande | parecchi | 24 x 50 mm | |
| se lo si desidera, membrana tintura, ad esempio, FM 5-95 | Invitrogen | T23360 | coloranti membrana altri sono disponibili anche: http://probes.invitrogen.com/media/pis/mp34653.pdf |
| Time-lapse microscopio con camera ambientale | parecchi | vedi i dettagli per il nostro dispositivo in sezioni corrispondenti |
Riferimenti
- Veening, J. W., Smits, W. K., Kuipers, O. P. Bistability, epigenetics, and bet-hedging in bacteria. Annu. Rev Microbiol. 62, 193-193 (2008).
- Dubnau, D., Losick, R. Bistability in bacteria. Mol Microbiol. 61, 564-564 (2006).
- Locke, J. C., Elowitz, M. B. Using movies to analyse gene circuit dynamics in single cells. Nat. Rev. Microbiol. 7 (5), 383-383 (2009).
- Veening, J. W. Bet-hedging and epigenetic inheritance in bacterial cell development. Proc. Natl. Acad. Sci. U. S. A. 105 (11), 4393-4393 (2008).
- de Jong, I. G., Veening, J. W., Kuipers, O. P. Heterochronic phosphorelay gene expression as a source of heterogeneity in Bacillus subtilis spore formation. J. Bacteriol. 192 (8), 2053-2053 (2010).
- Veening, J. W., Murray, H., Errington, J. A mechanism for cell cycle regulation of sporulation initiation in Bacillus subtilis. Genes Dev. 23 (16), 1959-1959 (2009).
- Eberhardt, A. Cellular localization of choline-utilization proteins in Streptococcus pneumoniae using novel fluorescent reporter systems. Mol Microbiol. 74 (2), 395-395 (2009).
- Vasantha, N., Freese, E. Enzyme changes during Bacillus subtilis sporulation caused by deprivation of guanine nucleotides. J Bacteriol. 144 (3), 1119-1119 (1980).
- Stewart, E. J. Aging and death in an organism that reproduces by morphologically symmetric division. PLoS. Biol. 3, 45-45 (2005).
- Rosenfeld, N. Gene regulation at the single-cell level. Science. 307 (5717), 1962-1962 (2005).
- Guberman, J. M. PSICIC: noise and asymmetry in bacterial division revealed by computational image analysis at sub-pixel resolution. PLoS. Comput. Biol. 4 (11), 1000233-1000233 (2008).
- Montero, L. l. o. p. i. s. . P. Spatial organization of the flow of genetic information in bacteria. Nature. 466, 77-77 (2010).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. J Exp. Med. 79, 137-137 (1944).
- Hoskins, . Genome of the bacterium Streptococcus pneumoniae strain R6. J Bacteriol. 183, 5709-5709 (2001).
- Martin, B. The recA gene of Streptococcus pneumoniae is part of a competence-induced operon and controls lysogenic induction. Mol Microbiol. 15, 367-367 (1995).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon