È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In uncoating vitro di HIV-1 Cores
In questo articolo
Riepilogo
Uncoating è un passo essenziale nella fase iniziale del ciclo di vita di HIV-1 ed è definito come lo smontaggio del guscio capside e il rilascio del complesso ribonucleoproteina virale (vRNP). In questo studio dimostriamo tecniche per isolare nuclei intatti da HIV-1 virioni e per quantificare la loro uncoating In vitro.
Abstract
Il genoma dei retrovirus è racchiuso in un capside circondato da un involucro lipidico. Per i lentivirus, come l'HIV-1, la conchiglia conica capside è composto di proteine CA disposti come un reticolo di esagono. Il capside è chiuso da 7 pentameri alla fine ampio e 5 alla parte più stretta del cono 1, 2. Racchiuso in questa shell capside è il complesso ribonucleoproteina virale, e insieme costituiscono il nucleo.
In seguito alla fusione della membrana virale con la membrana della cellula bersaglio, di HIV-1 è rilasciata nel citoplasma. Il capside poi smonta il rilascio gratuito CA in forma solubile 3 in un processo denominato uncoating. La posizione intracellulare e la tempistica di HIV-1 uncoating sono poco conosciuti. Singolo aminoacido sostituzioni in CA che alterano la stabilità del capside anche compromettere la capacità del virus HIV-1 di infettare le cellule 4. Ciò indica che la stabilità del capside è fondamentale per HIV-1. HIV-1 uncoating è stata difficile da studiare a causa della mancanza di disponibilità di test sensibile e affidabile per questo processo. Qui si descrive un metodo quantitativo per lo studio in vitro utilizzando uncoating nuclei isolati da infezioni HIV-1 particelle. L'approccio prevede l'isolamento dei nuclei per sedimentazione di virioni concentrati attraverso uno strato di detergente e in un gradiente di saccarosio lineare, al freddo. Per quantificare uncoating, i nuclei isolati sono incubati a 37 ° C per diversi intervalli di tempo e poi pellet da ultracentrifugazione. Il grado di uncoating è analizzato da quantificare la frazione di CA nel surnatante. Questo approccio è stato impiegato per analizzare gli effetti delle mutazioni virale HIV-1 la stabilità del capside 4, 5, 6. Dovrebbe anche essere utile per studiare il ruolo dei fattori cellulari di HIV-1 uncoating.
Protocollo
1. La produzione di HIV-1 particelle
Prima di procedere, è necessario ottenere l'autorizzazione e seguire le indicazioni dall'ufficio biosicurezza del tuo istituto di lavorare in un impianto di biosicurezza approvato per infettivo. È necessario assicurarsi che cura e precauzioni di sicurezza sono seguite durante la lavorazione nel laboratorio di biosicurezza.
La produzione di HIV-1 particelle è di solito eseguita da trasfezione transiente di cellule 293T con HIV-1 DNA provirale utilizzando un metodo di fosfato di calcio transfezione 7, 8. Alta riserve di virus titolo cresciuto da colture di cellule T infette sono adatti.
- Cultura 293T cellule di coltura Dulbecco modificato (DMEM), contenente 10% siero fetale bovino (FBS), integrato con gli antibiotici [penicillina (100 UI / ml) e streptomicina (100 mg / ml)] a 37 ° C, CO 5% 2 .
- Staccare le cellule dai piatti quasi confluenti con 0,25% tripsina-EDTA e semi di 2x10 6 cellule in 9 ml per 100 millimetri piatto cultura un giorno prima di trasfezione. 100 semi di sei piatti della cultura mm per la produzione di virioni. Se la preparazione concentrata di core è necessario, più i piatti potevano essere teste di serie per la trasfezione.
- Il giorno dopo, il monostrati cellulari dovrebbero essere circa il 25% confluenti e pronti per la trasfezione. Per sei piatti a base di cellule da transfettate, portare 120 g di DNA provirale fino ad un volume di 2,7 ml con acqua sterile. Per aggiungere questa miscela 0,3 ml di 2,5 M CaCl 2 e 3 ml di 2XBBS, e mescolare correttamente pipettando su e giù diverse volte. Lasciare l'impasto a riposare a temperatura ambiente per 10-20 minuti.
- Aggiungere 1 ml di gocce miscela risultante al centro di ogni piatto, mentre agitando delicatamente per mescolare. Porre le capsule durante la notte (~ 16 ore) in un incubatore a 35 ° C e 3% di CO 2.
- Aspirare il terreno di coltura e delicatamente aggiungere 5 ml di PBS.
- Aspirare il PBS e aggiungere 5 ml di terreno fresco. Coltivare le cellule in incubatore a 37 ° C e 5% di CO 2 per ulteriori 24-48 ore.
- Raccogliere il surnatante di coltura contenente particelle virali, trasferirlo in una provetta da centrifuga da 50 ml. Combinare i surnatanti da tutti i piatti e centrifugare a 1500 xg per 5 minuti a pellet di cellule e detriti. Filtrare il surnatante con 0,45 micron pori di dimensioni filtri siringa. Si devono prendere precauzioni per ridurre al minimo la formazione di aerosol durante il lavoro con il virus vivo. Ciò include l'uso di tubi conici con O-ring o coperture rotore durante la fase di centrifugazione. Se ciò non fosse possibile, i tappi a vite dei tubi devono essere confezionate con parafilm.
2. Concentrazione di HIV-1 virioni da ultracentrifugazione
- Mettere il supernatante della coltura (30 ml) in una provetta per centrifuga polyallomer 38,5 ml (per rotore Beckman SW32Ti o equivalente). Delicatamente alla base il surnatante contenente virus con 5 ml di soluzione di saccarosio al 20% in PBS utilizzando una pipetta da 5 ml.
- Centrifuga per 3 ore a32000 rpm a 4 ° C (175.000 xga r max) a particelle virali pellet.
- Rimuovere il surnatante tramite aspirazione, facendo attenzione a non disturbare il pellet sul fondo della provetta. Aggiungere 0,5 ml di 1XSTE tampone (10 mM Tris-HCl [pH 7,4], 100 mM NaCl, 1 mM EDTA) al tubo e posto a 4 ° C per 1 ora per allentare il pellet. Utilizzando un ampio tunnel 1 punta di pipetta ml pipettare delicatamente su e giù per un paio di volte per staccare il pellet dal fondo della provetta. Successivamente, trasferire il pellet sciolto in una provetta da microcentrifuga da 1,5 ml, avendo cura di evitare la formazione di schiuma. Incubare a 4 ° C per un altro 1-3 ore per consentire le macchie di piccoli virus a disperdersi. Durante questo periodo, preparare il gradiente di saccarosio come descritto al punto 3.1.
- Pipettare delicatamente la sospensione dei virus su e giù diverse volte e centrifugare a 8.000 giri (6.000 xg) a 4 ° C in una microcentrifuga refrigerata per 1 minuto per rimuovere macchie residue. Tenere il freddo campione durante questo processo.
3. Gradiente di saccarosiocentrifugazione per isolare nuclei
HIV-1 core sono isolati usando un metodo "spin-thru" 9, che è una modifica del metodo precedentemente descritto per la purificazione del virus HIV-2 core 10.
- Preparare un ml 12 lineare 30% al 70% gradiente di saccarosio in 1XSTE tampone in una provetta da centrifuga da 14,5 ml per polyallomer SW32.1Ti rotore. Per preparare gradiente, utilizzare un gradiente di 20 ml ex; posto 6 ml di soluzione di saccarosio al 70% sul lato vicino (vicino alla porta di uscita) e 6 ml di soluzione di saccarosio al 30% sul lato più lontano. Assicurarsi che le bolle d'aria non sono intrappolate nel canale che collega le due camere. Utilizzare il Densi-Flow gradiente Auto ex di pompare il gradiente dal basso verso l'alto della provetta contenente 1 ml di soluzione di saccarosio 85% sul fondo. Posizionare delicatamente il gradiente a 4 ° C fino raffreddato (2-4 ore).
- Utilizzando un ampio tunnel 1 punta di pipetta ml delicatamente la sovrapposizione sfumatura con 0,25 ml di soluzione di saccarosio al 15% in STE contenente l'1% Triton X-100.
- Delicatamente sovrapposizione con 0,25 ml di soluzione di saccarosio 7,5% in STE utilizzando un ampio tunnel 1 punta di pipetta ml. Fare attenzione a non mescolare gli strati.
- Delicatamente sovrapposizione con 0,5 ml di sospensione del virus a partire dal punto 2.4. Questa operazione deve essere eseguita con attenzione per evitare qualsiasi disturbo nel gradiente e la miscelazione degli strati saccarosio underlaid.
- Porre i tubi in pre-raffreddata secchio SW32.1Ti e centrifugare a 32.000 rpm (187.000 xga r max) durante la notte (16-20 ore) a 4 ° C. Per evitare la pausa della centrifuga, non iniziare la centrifugazione fino al vuoto nella centrifuga raggiunge i 250 micron
- Raccogliere 1 ml di frazioni da cima a fondo del gradiente utilizzando la funzione Auto-Densi-Flow di frazionamento di un gradiente. Collocare le provette in ghiaccio immediatamente dopo la raccolta. Miscelare il contenuto dei tubi invertendo alcune volte, e prelevare 50 ml di ogni frazione per la quantificazione mediante test ELISA o saggio di attività della trascrittasi inversa.
4. Localizzazione di HIV-1 coree conservazione dei nuclei
- Prima di eseguire test uncoating, è importante per determinare quali frazioni contengano intatte HIV-1 core. Questo può essere determinato da p24 ELISA o saggio di attività della trascrittasi inversa utilizzando il aliquote di 50 microlitri dal punto 3.6.
- Il recupero di CA associati al core è spesso legata alla stabilità dei nuclei. Misurare il nucleo associato CA p24 ELISA 9 utilizzando un campione da ogni frazione. In alternativa, misurare l'attività della trascrittasi inversa di ogni frazione. Utilizzando entrambi i metodi il picco dovrebbe essere intorno frazione 10.
- In comune le frazioni contenenti i core. Se i core non devono essere utilizzati per uncoating dosaggio immediatamente, un'aliquota i nuclei raggruppati in 0,2-0,3 ml di aliquote, flash-freeze in N2 liquido e conservare a -80 ° C. Nuclei congelati in questo modo sono adatti per l'analisi uncoating. La resa del nucleo-CA è associata in genere 1-2 mg di p24 millilitro o circa il 15% del totale virione associatip24.
5. Analisi cinetica di HIV-1 uncoating
- La quantità di HIV-1 core richiesto per reazione uncoating è di circa 50 ng. Per eseguire il test in vitro uncoating, Prediluire l'aliquota di nuclei con un uguale volume di freddo 1XSTE tampone per ridurre la viscosità della sospensione e per minimizzare gli errori di pipettamento.
- Diluire ulteriormente 100 l di nuclei in 0,15 ml di tampone 1XSTE freddo contenente 10 mcg / ml di BSA in un tubo da 1,5 ml microcentrifuga. Noi integrare il buffer STE con BSA (10 mcg / ml) per minimizzare l'assorbimento di CA alle pareti del tubo. Miscelare invertendo il tubo parecchie volte. Non vortice dei campioni. Incubare le provette in un bagnomaria a 37 ° C per intervalli di tempo (15, 30, 60 e 120 min). I tubi devono essere immersi in bagno d'acqua almeno fino al livello del campione interna al fine di garantire anche il riscaldamento.
- Durante l'incubazione, delicatamente mescolare il contenuto della provetta periodicamente (di solito 5 -10 min) muovendo il tubo. Per un controllo minuti zero, diluire 100 ml di core in 0,15 ml di tampone 1XSTE freddo e incubare in ghiaccio per tutta la durata dell'esperimento (120 min). Il controllo minuti zero dà il valore basale uncoating e viene utilizzato per determinare aumento uncoating di core incubato a 37 ° C per diversi intervalli di tempo.
- Al termine del periodo di incubazione, arrestare il processo di uncoating mettendo le provette in ghiaccio per 10 minuti.
- Centrifugare le provette a 45.000 rpm (TLA-55 rotore; 125.000 xga r max) per 20 minuti a 4 ° C. Questo pellet i nuclei intatti e il libero CA rilasciato a seguito di uncoating di core rimane nel surnatante. Il rotore deve essere preraffreddato a 4 ° C prima di caricare i campioni.
- Trasferire il surnatante a nuovi tubi microcentrifuga preraffreddato preferibilmente usando gel-loading punte conservato a temperatura ambiente. Si prega di notare che il pellet non sarà visibile a occhio nudo, in modo da prendere estrema cura wentre pipettaggio il surnatante. Risospendere il pellet in 250 ml di diluente per campioni ELISA (0,5% Triton X-100 e il 5% dei donatori di siero di vitello in PBS). Per garantire un efficiente scioglimento del pellet, vortice dopo aver aggiunto il diluente per campioni ELISA. Quantificare il contenuto CA del pellet e surnatante utilizzando p24 ELISA, come descritto nella sezione seguente.
- Il grado di uncoating si ottiene calcolando la frazione di CA presenti nel surnatante.
6. Test per CA da p24 ELISA
- Molti kit commerciali ELISA sono disponibili e possono essere utilizzati per quantificare CA. Utilizzare qualsiasi commerciale o "in-house" ELISA e includere norme p24 per determinare la linearità del test. Diluizioni dei campioni devono essere analizzati per accertare l'esattezza.
- Abbiamo sviluppato una casalinga ELISA che usano abitualmente per test di CA. La procedura è adattato da una precedente relazione 11 e viene eseguita utilizzando anticorpi di cattura e rivelatore disponibile presso AID NIHS ricerca e reagente Reference Program.
7. Rappresentante dei risultati:
Un esempio di risultato da ELISA per la determinazione frazioni contenenti core è mostrata in Figura 1. Dopo aver raccolto frazioni (1 ml ciascuna), 50 ml di campione da ogni frazione è stato usato per fare diluizioni seriali e analizzati con il metodo ELISA. La p24 totale ottenuto sommando i valori per dodici frazioni è stata del 14,5 mcg. Come mostrato nelle frazioni figura 8-10 core contenuti. Il valore di p24 per il nucleo contenente frazioni era 2,17 mg. La percentuale di core-associati p24 (14.97%) è stato determinato sulla base del rapporto di valore p24 per le frazioni principali (2,17 mg) per il valore totale p24 (14,5 mg). Frazione 1 o 2 conterrà sempre più alta quantità di p24, che rappresenta CA libero che non è associato con i core. Questa è seguita da una graduale riduzione nei valori di p24 con ogni frazione successiva, poi un forte aumento e, infine, un forte calo nel p24valori. Se ci si prenda cura durante il caricamento del gradiente poi il picco di core-associata CA si trova attorno frazione 10.
Un tipico risultato ottenuto testando la cinetica di uncoating di HIV-1 core è mostrato in Figura 2. Il grafico mostra un tempo-dipendente aumento uncoating di tipo selvaggio di HIV-1 core. La percentuale uncoating valore è stato ottenuto calcolando la frazione di CA presente nel surnatante. Con la pratica, l'analisi è altamente riproducibile ed è utile per determinare la stabilità del core virale in vitro. Si prega di notare che la riproducibilità del dosaggio è fortemente dipendente dalla corretta gestione dei campioni durante la procedura. Dal momento che i nuclei sono termolabile, i campioni devono essere mantenuti a 4 ° C durante tutta la seduta tranne durante il periodo di incubazione.
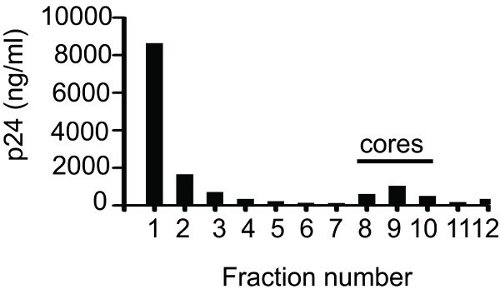
Figura 1 Densità di centrifugazione in gradiente di equilibrioHIV-1 core. Una sospensione di virus concentrati è stato applicato alla parte superiore di una pendenza del 30 al 70% di saccarosio lineari sovrapposti con 1% Triton X-100. A seguito di centrifugazione notte a 187.000 xg e 4 ° C, 1 ml di frazioni sono stati raccolti da cima (Frazione 1) al basso (Frazione 12) e p24 è stata quantificata mediante ELISA.
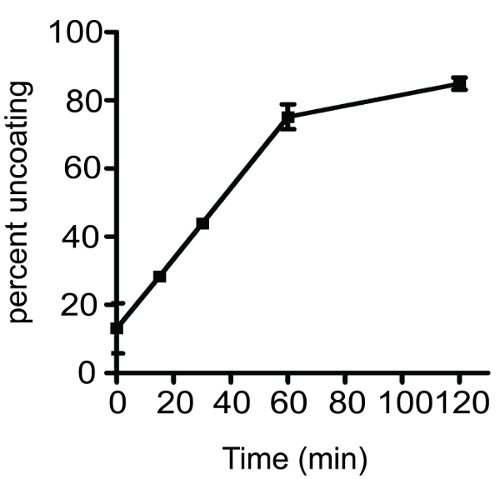
Figura 2 Tempo corso di HIV-1 uncoating in vitro. Purificato da HIV-1 core sono stati diluiti e incubato a 37 ° C per gli intervalli di tempo indicato. Il campione minimo pari a zero è stato incubato in ghiaccio per tutta la durata dell'esperimento. Dopo l'incubazione, i campioni sono stati ultracentrifugati a 125.000 xg per 20 minuti a 4 ° C. Surnatante e pellet sono stati separati e analizzati da p24 ELISA. L'entità della uncoating è stato determinato come descritto nel testo del protocollo. Ogni reazione uncoating è stata effettuata in duplicato, le barre di errore coprono la gamma dei due valori.
Discussione
Il metodo qui descritto per purificare l'HIV-1 core per studiare uncoating in vitro è utile per lo studio di questa fase del ciclo di HIV-1 vita, soprattutto a causa di indisponibilità di un metodo convalidato di analisi uncoating HIV-1 nelle cellule bersaglio. Anche se questo metodo utilizza ultracentrifugazione equilibrio per purificare core, altri ricercatori hanno utilizzato pellettizzazione diretta dopo breve lisi con 1% Triton X-100-12, 13 o cubettatura attraverso un cuscino di saccarosio sovrappo...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
HIV-1 uncoating studi in laboratorio Aiken sono stati sostenuti da sovvenzioni NIH AI40364, AI50423 e AI076121. Diversi materiali chiave, tra cui i reagenti utilizzati nel p24 ELISA, sono state fornite dal NIH AIDS programma di ricerca e di riferimento, Divisione di AIDS, NIAID, NIH.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
| DMEM | Cellgro | 10-013-CV | |
| PBS | Cellgro | 21-031-CV | |
| Triton X-100 | Mallinckrodt Baker Inc | 9002-93-1 | |
| Tween 20 | Acros | 9005-64-5 | |
| 0,25% tripsina-EDTA | Cellgro | 25-053-CI | |
| 2XBBS | Composizione: 50 mM BES [p H 6,95], 280 mM NaCl e 1,5 mM Na 2 HPO 4. Portare il pH a 6,95a temperatura ambiente. Filtro sterilizzare e conservare in aliquote a -20 ° C. | ||
| Rivestimento di anticorpi: anticorpi monoclonali per p24 (183-H12-5C) | NIH AIDS programma di ricerca e reagente di riferimento | 3537 | |
| Anticorpi primari: l'HIV-Ig (iperimmuni siero del paziente umano) | NIH AIDS Research Programma di riferimento e dei reagenti | 3957 | |
Anticorpo secondario: Capra anti-IgG umane, coniugati con perossidasi | Perforare | 31130 | |
| HRP substrato | KPL Inc | 50-76-11 | |
| Immulon 2HB Piastre a 96 pozzetti | Thermo Scientific | 3455 | |
| SW32Ti e SW32.1 rotori Ti e ultracentrifuga compatibile | Beckman Coulter | ||
| TLA-55 rotore e ultracentrifuga da tavolo | Beckman Coulter | ||
| Alta velocità di provette per microcentrifuga | Beckman Coulter | 326823, 358123, 357448 | |
| Auto-Densi di frazionamento di un gradiente di densità di flusso | Labconco Corp. | 4517000 | |
| Gradiente Ex | CBS Scientific Co. Inc. | GM-20 |
Riferimenti
- Ganser, B. K., Li, S., Klishko, V. Y., Finch, J. T., Sundquist, W. I. Assembly and analysis of conical models for the HIV-1 core. Science. 283, 80-83 (1999).
- Li, S., Hill, C. P., Sundquist, W. I., Finch, J. T. Image reconstructions of helical assemblies of the HIV-1 CA protein. Nature. 407, 409-413 (2000).
- Aiken, C. Viral and cellular factors that regulate HIV-1 uncoating. Curr. Opin. HIV. AIDS. 1, 194-199 (2006).
- Forshey, B. M., Schwedler, U. v. o. n., Sundquist, W. I., Aiken, C. Formation of a human immunodeficiency virus type 1 core of optimal stability is crucial for viral replication. J. Virol. 76, 5667-5677 (2002).
- Forshey, B. M., Aiken, C. Disassembly of human immunodeficiency virus type 1 cores in vitro reveals association of Nef with the subviral ribonucleoprotein complex. J. Virol. 77, 4409-4414 (2003).
- Wacharapornin, P., Lauhakirti, D., Auewarakul, P. The effect of capsid mutations on HIV-1 uncoating. Virology. 358, 48-54 (2007).
- Chen, C., Okayama, H. High-efficiency transformation of mammalian cells by plasmid DNA. Mol Cell Biol. 7, 2745-2752 (1987).
- Aiken, C., Prasad, V. R., Ganjam, K. V. . Methods in Molecular Biology. 485, 41-53 (2009).
- Kotov, A., Zhou, J., Flicker, P., Aiken, C. Association of Nef with the human immunodeficiency virus type 1 core. J. Virol. 73, 8824-8830 (1999).
- Kewalramani, V. N., Emerman, M. Vpx association with mature core structures of HIV-2. Virology. 218, 159-168 (1996).
- Wehrly, K., Chesebro, B. p24 antigen capture assay for quantification of human immunodeficiency virus using readily available inexpensive reagents. Methods. 12, 288-293 (1997).
- Welker, R., Hohenberg, H., Tessmer, U., Huckhagel, C., Kräusslich, H. G. Biochemical and structural analysis of isolated mature cores of human immunodeficiency virus type 1. J. Virol. 74, 1168-1177 (2000).
- Briggs, J. A., Wilk, T., Welker, R., Kräusslich, H. G., Fuller, S. D. Structural organization of authentic, mature HIV-1 virions and cores. EMBO J. 22, 1707-1715 (2003).
- Auewarakul, P., Wacharapornin, P., Srichatrapimuk, S., Chutipongtanate, S., Puthavathana, P. Uncoating of HIV-1 requires cellular activation. Virology. 337, 93-101 (2005).
- Accola, M. A., Ohagen, A., Göttlinger, H. G. Isolation of human immunodeficiency virus type 1 cores: retention of Vpr in the absence of p6(gag. J. Virol. 74, 6198-6202 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon