Method Article
Produzione di massa di Aedes aegypti geneticamente modificati per rilasci sul campo in Brasile
In questo articolo
Riepilogo
Per ottenere la soppressione della popolazione di Aedes aegypti utilizzando il sistema RIDL® (Rilascio di insetti che trasportano un letale dominante), è necessario rilasciare un gran numero di zanzare maschili. Ciò richiede l'uso di tecniche e tecnologie di allevamento di massa per fornire sistemi affidabili per ottenere il massimo numero di zanzare maschili di alta qualità.
Abstract
Si stanno cercando nuove tecniche e metodi per cercare di vincere la battaglia contro le zanzare. Recenti progressi nelle tecniche molecolari hanno portato allo sviluppo di nuovi e innovativi metodi di controllo delle zanzare basati sulla tecnica degli insetti sterili (SIT)1-3. Un metodo di controllo noto come RIDL (Release of Insects carrying a Dominant Lethal)4, si basa su SIT, ma utilizza metodi genetici per rimuovere la necessità di sterilizzazione dalle radiazioni5-8. Un ceppo RIDL di Ae. aegypti è stato testato con successo sul campo nel Grand Cayman9,10; è previsto o in corso un ulteriore utilizzo sul campo in altri paesi del mondo.
L'allevamento di massa di insetti è stato stabilito in diverse specie di insetti e a livelli di miliardi a settimana. Tuttavia, nelle zanzare, l'allevamento è stato generalmente eseguito su scala molto più piccola, con la maggior parte dell'allevamento su larga scala eseguito negli anni '70 e '80. Per un programma RIDL è auspicabile rilasciare il minor numero possibile di femmine che mordono e trasmettono malattie. In un programma di allevamento di massa ci sono diverse fasi per produrre i maschi da rilasciare: produzione di uova, allevamento di uova fino alla pupa e quindi selezione dei maschi dalle femmine prima del rilascio. Questi maschi vengono quindi utilizzati per un programma di controllo RIDL, rilasciato come pupe o adulti11,12.
Per sopprimere una popolazione di zanzare utilizzando RIDL un gran numero di adulti maschi di alta qualità deve essereallevato 13,14. Di seguito vengono descritti i metodi per l'allevamento di massa di OX513A, un ceppo RIDL di Ae. aegypti 8, per il rilascioe copre le tecniche necessarie per la produzione di uova e l'allevamento di massa di maschi RIDL per un programma di controllo.
Introduzione
Le zanzare trasmettono molti agenti patogeni che possono causare una serie di malattie nell'uomo e controllare queste zanzare è stata una battaglia in corso per secoli. Le strategie per controllare gli insetti basati su metodi chimici e biologici hanno avuto alcuni notevoli successi, ma in molti casi il controllo non è stato sostenibile a lungo termine. Ad esempio, il Brasile ha raggiunto l'eradicazione dell'Ae. aegypti negli anni '50, ma la zanzara ha rivaso negli ultimi 40-50 anni. Questo può essere attribuito a molte cause, tra cui resistenza agli insetticidi, danni ambientali, scarsa implementazione del programmadi controllo 15-20e la rapida reinvasione senza un monitoraggio o una risposta adeguati.
Si stanno cercando nuove tecniche e metodi per cercare di vincere questa battaglia contro le zanzare. Recenti progressi nelle tecniche molecolari hanno portato allo sviluppo di nuovi e innovativi metodi di controllo delle zanzare basati sulla tecnica degli insetti sterili (SIT)1-3. Un metodo di controllo noto come RIDL (Release of Insects carrying a Dominant Lethal)4 è basato su SIT, ma utilizza metodi genetici per rimuovere la necessità di sterilizzazione dalle radiazioni. Ceppi RIDL sono stati costruiti per diverse specie di parassiti tra cui Ae. aegypti 5-8, Un ceppo RIDL di Ae. aegypti è stato testato con successo sul campo a Grand Cayman9,10; è previsto o in corso un ulteriore utilizzo sul campo in altri paesi del mondo. Sopprimere le popolazioni di zanzare utilizzando IL RIDL richiederà un gran numero di adulti maschi di alta qualità per essereallevati 3,14.
Per un programma SIT si ritiene desiderabile rilasciare solo maschi; le zanzare femminili mordono e trasmettono malattie. Inoltre, i maschi sterili rilasciati possono essere "distratti" dalle femmine rilasciate riducendo l'efficacia del programma. Il rilascio solo maschile ha dimostrato di essere 3-5 volte più efficace del rilascio di sesso misto in esperimenti su vasta scala con moscerini della frutta mediterranei irradiati21.
In un programma di allevamento di massa RIDL, ci sono diverse fasi per produrre i maschi per il rilascio. Il primo è quello di produrre le uova necessarie per la generazione di rilascio (Figura 1). La fase successiva è quello di allevare le uova fino alle pupe o agli adulti, separando le larve dalle pupe e dalle pupe maschili dalle pupe femminili. La separazione su larga scala dei maschi dalle femmine richiede una differenza tra i sessi in una particolare fase della vita adatta per lo smistamento dimassa 22. In Ae. aegypti (e altre specie di zanzare) c'è una significativa differenza di dimensioni tra le pupe maschili e femminili che possono essere sfruttate per le tecniche di separazione sessuale. I maschi RIDL ordinati vengono quindi rilasciati in un programma di controllo come pupe o come adulti11,12.
Di seguito vengono descritti i metodi per l'allevamento di massa di OX513A, un ceppo RIDL di Ae. Aegypti, per il rilascio. I metodi descritti coprono le tecniche necessarie per la produzione di uova e maschi RIDL per un programma di controllo.
Protocollo
Requisiti insetti
1. Panoramica
- L'allevamento di massa ha diverse fasi, ognuna delle quali viene eseguita in un'area distinta dell'unità di allevamento di massa. La figura 1 mostra la fase principale dell'allevamento e dove si verificano nell'impianto di allevamento di massa.
2. Considerazioni sulla biosicurezza per l'insetto
- Il progetto è stato approvato dal comitato di etica animale dell'Università di San Paolo - Brasile e sono stati ottenuti tutti i permessi e le approvazioni necessari.
- Il sistema RIDL utilizza la letalità condizionale; un integratore alimentare (tetraciclina) impedisce l'espressione del sistema RIDL permettendo agli insetti di essere allevati in massa; senza tetraciclina le zanzare muoiono. La tetraciclina non si trova nei siti di riproduzione di E. aegypti in natura, quindi qualsiasi prole prodotta dagli estui non sopravviverà. Ciò aggiunge un ulteriore livello di sicurezza rispetto all'uso di insetti di tipo selvatico (WT) sterilizzati con altrimetodi (cioè radiazioni).
- Usa l'ingresso a doppia porta, i segni "Solo personale autorizzato" e le zanzariere nell'insetto. Tutte le finestre devono essere sigillate per evitare la contaminazione della colonia con insetti WT e aiutare a prevenire le fughe dall'interno dell'insetto.
- Le normative e le autorità locali possono avere requisiti aggiuntivi o alternativi specifici. Contattare le autorità competenti per informazioni/orientamenti in una fase precoce e assicurarsi tutti i permessi e le approvazioni necessari prima di stabilire il ceppo RIDL in una insettiaria.
- L'allevamento di massa insettivo dovrebbe essere utilizzato solo per l'allevamento RIDL. Nessun altro ceppi o insetti dovrebbe essere presente. Questo per evitare la contaminazione del ceppo RIDL e la contaminazione con agenti patogeni che possono influenzare la forma fisica e la sopravvivenza, riducendo la produttività e l'efficacia dei maschi rilasciati.
3. Design insettiario
- La figura 2 mostra un piano dell'insetto utilizzato a Biofábrica Moscamed in Brasile.
- La temperatura di tutti gli ambienti era di 26 °C ± 2) con un'umidità relativa di circa il 70-80% e un ciclo chiaro:scuro di 12:12 ore utilizzando strisce luminose fluorescenti.
- Questo progetto può essere modificato in base a specifici requisiti di spazio, ad esempio la scala del rilascio determinerà le dimensioni complessive. Tuttavia, la produzione, l'allevamento e lo smistamento delle uova, il controllo di qualità (QC) e le versioni devono essere separati in quattro aree distinte: Colonia di produzione di uova, Generazione rilascio, QC e Stoccaggio per adulti per il rilascio.
- La sala della colonia di produzione di uova (circa 20 m2) viene utilizzata per produrre uova per la generazione del rilascio.
- L'area controllo qualità è il luogo in cui vengono condotti esperimenti per controllare le procedure e l'idoneità della linea RIDL, comprese le misurazioni del tasso di schiusa, del numero di pupe, delle dimensioni delle pupe e della misurazione dell'efficacia dello smistamento e della rimozione delle femmine. Vengono inoltre condotti test per la contaminazione da WT verificando la presenza di marcatore di fluorescenza e fenotipo utilizzando saggi offset che misurano la letalità.
- La sala Generazione rilascio (circa 36 m2) richiede spazio adeguato per vassoi e lo smistamento di larve e pupe. I vassoi sono tenuti in rack in alluminio appositamente costruiti. Per l'allevamento e lo smistamento sono necessari un'ampia area di lavoro e un lavandino e un altro grande lavandino è necessario per il lavaggio di vassoi e gabbie. Una trappola filtrante è stata inclusa nell'uscita delle acque reflue dai lavandini per mitigare la fuga delle zanzare viventi attraverso la fogna.
- Tutta l'acqua utilizzata per i vassoi viene smaltita attraverso uno scarico, che ha un compartimento contenente una rete che impedisce la fuga degli insetti in qualsiasi fase dello sviluppo.
- È necessaria un'area per lo stoccaggio degli adulti per il rilascio (Adult Storage for Release, Figura 2) contenente racking per contenere i dispositivi di rilascio mentre gli adulti maturano prima del rilascio.
Metodi di produzione per l'allevamento di massa RIDL:
La colonia di produzione di uova produce le uova utilizzate nella generazione di rilascio (Figura 1) per produrre adulti. Ci sono molte somiglianze nei due metodi di allevamento, ma anche alcune differenze distinte. I processi di allevamento che sono gli stessi per entrambe le procedure sono descritti solo nella sezione Colonia di produzione di uova.
Colonia di produzione di uova
4. Produzione larvale
La colonia di produzione di uova genera uova RIDL OX513A omozigoti8 per la generazione di rilascio. Un controllo di alta qualità garantisce vitalità, idoneità e integrità dello sforzo delle uova fornite.
- Lo stimolo per la schiusa è l'immersione in acqua con un basso livello di ossigeno disciolto. Per ridurre il livello di ossigeno nell'acqua, riscaldare l'acqua fino a quando non bolle e posizionare immediatamente 400 ml in barattoli di vetro da 500 ml (circonferenza di apertura di 74 mm), fissare il coperchio in modo sicuro e lasciare a temperatura ambiente per diverse ore per raffreddare.
- Mettere 1 g di uova in un barattolo di acqua bollita, reseal e attendere un'ora. Trasferire il contenuto su un vassoio con acqua da 2 L e lasciare durante la notte in condizioni insetti.
- Posizionare le larve tratteggiate in un volume noto di acqua e mescolare usando un agitatore magnetico e una pulce per un tempo sufficiente per prendere aliquote; mescolando vigorosamente o per un lungo periodo danneggia le larve e deve essere mantenuta al minimo. Il volume standard utilizzato per schiudere le larve è di 1 L, tuttavia densità di oltre 300 larve / ml sono difficili da contare e possono essere dannose. Pertanto non schiudere più di circa 300.000 uova / L di acqua.
- Determinare la velocità del portello prendendo tre aliquote da 1 ml e posizionando su un foglio di carta assorbente, con una griglia di 1 cm quadrati, sopra una spugna assorbente per assorbire l'acqua in eccesso. Conta il numero di uova tratteggiate e non odiate da tre quadrati cercando il cappuccio mancante di un uovo tratteggiato. Si prevede un tasso di tratteggio intorno all'80-90%.
- Prendere quattro aliquote da 1 ml ciascuna e posizionare in quattro barche di peso nero (le larve sono bianche e quindi più facilmente visibili su uno sfondo nero) e contare il numero di larve vive presenti a occhio; si consiglia l'uso di un contatore. Il numero medio di larve per ml viene quindi utilizzato per calcolare il volume d'acqua da aggiungere su ogni vassoio per ottenere il numero desiderato di larve per vassoio.
- Ci possono essere grandi differenze nella densità alla quale le larve possono essere allevate tra ceppi e specie. È anche auspicabile confrontare le dimensioni maschili adulte ridl con i maschi di tipo selvatico; idealmente si desidera simile ai maschi RIDL di dimensioni maggiori che possono competere con successo con i maschi selvatici. Pertanto per ogni ceppo RIDL è necessario determinare la densità ideale delle larve ed è un compromesso contro i vincoli di spazio per l'allevamento e la scala di produzione. Densità che vanno da 0,1-2,5 larva/ml abbiamo trovato una buona combinazione di produzione e qualità; discusso anche da Medici23.
- Aggiungere le larve ai vassoi. Presso la nostra struttura utilizziamo vassoi di circa 53 cm x 37 cm x 8 cm (L x W x H) e la quantità di acqua richiesta per raggiungere la densità delle larve per la produzione.
- Aggiungere una soluzione stock di tetraciclina (3 mg/ml in acqua) ai vassoi con una diluizione di 1:100 per ottenere la concentrazione finale richiesta di 30 μg/ml.
- Nutrire le larve con cibo per pesci inscaglie (www.sera.de)ogni giorno, che è stato schiacciato in una polvere fine. La tabella 1 mostra il regime di alimentazione tipico in mg di cibo per larve al giorno. Nutrire le larve fino al giorno appropriato di smistamento nelle condizioni insetticide sopra descritte.
5. Smistamento delle larve da pupe e pupe maschili / femminili
- Ordina le larve dalle pupe 8 giorni dopo la schiusa separando le larve dalle pupe. Quindi ordina il sesso delle pupe per i maschi. Un dispositivo noto come separatore di piastre24,25 può ordinare le larve dalle pupe maschili e dalle pupe femminili. La figura 3 illustra l'uso di questo separatore di piastre per separare le larve dalle pupe maschili e femminili.
- Usando un cucchiaio di misura con una rete sul fondo, calibrarlo con 500 pupe o più e usarlo per allevare gabbie e stimare la quantità totale di pupe di maschi e femmine prodotte.
- Il primo giorno di smistamento (giorno 8) la maggior parte delle pupe sono maschi, quindi riposizionare le larve ordinate in un vassoio e retrova fino al giorno seguente quando la maggior parte delle pupe sono femmine(Figura 4).
- Ripetere il processo di smistamento ogni giorno come descritto nei passaggi 2.1-2.3 fino a quando tutte le larve si sono impupate o fino alla fine di una settimana lavorativa.
- Metti 1.000 pupe maschili (usando il cucchiaio di misura) in una gabbia e il giorno 9 aggiungi 3.000 pupe femminili alla stessa gabbia (usiamo tubi in PVC alti 30 cm e di 30 cm adattati con top in rete e un foro di accesso netto, ma 30 cm x 30 cm x 30 cm di gabbia di plastica sono disponibili anche da BugDorm).
- Consentire agli adulti di accoppiarsi per almeno 2 giorni e fornire loro una soluzione di saccarosio (10%) su cotone bagnato ad libitum prima dell'alimentazione del sangue. Raccogli le uova per due settimane (~ due cicli gonotrofici) con due alimenti per il sangue a settimana. Ciò produce in media 143.000 uova da una gabbia di 3.000 femmine (una media di 48 uova / femmina). Per la produzione di 4 milioni di uova alla settimana è necessario allevare circa 28 gabbie ogni settimana.
6. Alimentazione del sangue
- Un sistema di alimentazione a piastre in alluminio fornisce gabbie di sangue due volte a settimana. Una tasca di sangue viene creata sul lato di una piastra di alluminio (10 cm x 10 cm x 3 mm) con Parafilm(Figura 5). Per incoraggiare l'alimentazione, il sangue viene riscaldato posizionando un sacchetto di fagioli riscaldato sopra l'alimentatore di piastre. Il sacchetto di fagioli consisteva di circa 250 g di chicchi di grano in un sacchetto di stoffa, che viene riscaldato per circa 10 secondi in un forno a microonde. Il sangue che usiamo per l'alimentazione proviene da un mattatoio locale; poiché questi animali (principalmente capre e ovini) sono per il consumo umano, vengono testati per evitare la presenza di agenti patogeni.
- Tre giorni dopo l'alimentazione del sangue, viene fornito un sito di ovideposizione per le femmine per deporre le uova. Il sito di ovideposizione è un contenitore di plastica rotondo riempito a circa 1/4 con acqua e carta filtrante che copre l'interno. Due giorni dopo il sito di ovideposizione viene rimosso. Per la massima produzione di uova, assicurarsi che la carta filtrante copra l'intera superficie disponibile all'interno del contenitore e rimanga bagnata.
- Rimuovere la carta uovo e posizionarla sulla carta assorbente per asciugare in condizioni insettiane; le uova richiedono un periodo di condizionamento ad alta umidità (oltre il 70%) almeno 48 ore dopo essere stato deposto. Le uova possono essere lasciate in insettia per un massimo di 3 mesi con una diminuzione minima del tasso di schiusa, purché l'umidità sia mantenutaalta 25.
- La colonia di produzione di uova deve essere di dimensioni sufficienti per fornire il numero di uova richieste su base settimanale per il programma di rilascio. L'impianto sopra descritto può produrre circa 4 milioni di uova con 28 gabbie allestite settimanalmente. Si consiglia di conservare abbastanza uova per garantire almeno 4 settimane di uova per la generazione di rilascio e la colonia di produzione di uova.
Generazione rilascio
7. Produzione larvale
I processi di schiusa, allevamento e smistamento per la generazione del rilascio sono identici al metodo descritto in precedenza per la colonia di produzione di uova. Tuttavia, la scala di produzione è molto più grande e ciò richiede più vassoi e più sforzo.
8. Ordinamento di larve, pupe maschili e pupe femminili
- Lo smistamento di larve, pupe maschili e pupe femminili è identico al metodo descritto per la produzione di uova.
- Dopo aver smistato le pupe maschili è importante verificare la contaminazione femminile prima del rilascio; non dovrebbero esserci più dell'1% di femmine presenti. Prendi tre aliquote di 500 pupe (tre pupe casuali che misurano cucchiai) e conta il numero di pupe femminili presenti. Le femmine possono essere identificate in quanto sono generalmente più grandi dei maschi e dalle differenze nella forma del lobo genitale (Figura 6)27. Se c'è più dell'1% di femmine, dovrebbero essere ricorse e controllate di nuovo.
- Utilizzare solo i maschi del giorno 8 e 9 per il rilascio; autoclave eventuali larve e pupe rimanenti. In Brasile, questi rifiuti devono essere trattati allo stesso modo dei rifiuti medici, ma le normative possono differire in altri paesi. Non utilizzare pupe e larve femminili della generazione di rilascio per la colonia di produzione di uova a causa delle differenze nel controllo di qualità, nell'allevamento e nei rischi di contaminazione da numeri più grandi e un controllo di qualità inferiore.
Adult Storage for Release: Posizionare i maschi in dispositivi di rilascio per emergere e maturare prima del rilascio. I dettagli dei dispositivi di rilascio non sono trattati in questo metodo. Tuttavia, la capacità dei dispositivi di rilascio che usiamo è di circa 1.000 maschi. I dettagli del metodo di rilascio (dispositivo di rilascio e sistema di rilascio) non sono trattati in questo metodo.
Risultati
I risultati attesi per la produzione sono riportati nella figura 4. I maschi si impupano per primi, raggiungendo il picco il giorno 8 e le femmine picco il giorno 9 dopo la schiusa. È importante misurare questa curva di pupa per conoscere il momento migliore per ordinare i maschi dalle femmine.
I risultati di oltre 6 mesi di selezione delle pupe maschili e femminili mostrano che la contaminazione femminile è in media dello 0,02% (grafico 5; SEM = 0,004%). Questo tasso di contaminazione rappresenta solo 400 femmine rilasciate in un mese di rilascio (circa due milioni di maschi). L'attuale produzione di uova a settimana è di 4 milioni. Di questi, 3,5 milioni sono nati per la colonia di uova e la produzione con il resto conservato per il backup. Circa l'11% delle uova viene utilizzato per la colonia di produzione di uova e il resto per la generazione di rilascio. Il tasso di schiusa delle uova è in media dell'87,3% (SEM = 0,5%) e la resa delle pupe maschili dalle larve L1 è in media del 29,5% (SEM = 1,2). Due milioni di larve vengono allevate ogni settimana per la colonia di Generazione rilascio che produce circa 571.000 pupe maschili (SEM = 14.000). La mortalità delle pupe e degli adulti durante l'emergenza e il rilascio è in media del 5%, con il risultato che circa 543.000 (SEM = 13.000) rilasciano zanzare maschili adulte a settimana. Si prevede che la produzione corrente di 4 milioni di uova/settimana potrebbe essere ridotta a ~ 3 milioni / settimana con un'ulteriore ottimizzazione per ridurre le perdite da sprechi e stoccaggio. In totale sono necessari 6 dipendenti per la produzione descritta; quattro che lavorano sulla generazione di rilascio e gli altri due sulla colonia di uova.
Controllo qualità
Il controllo qualità è essenziale per mantenere la qualità degli adulti, l'efficienza dell'allevamento, la manodopera e i costi.
Controllo fenotipo transgene
Per verificare l'espressione genica RIDL vengono eseguiti due controlli, in primo luogo per controllare l'espressione del marcatore di fluorescenza e, in secondo luogo, per controllare l'espressione del tratto di letalità RIDL in assenza di tetraciclina. Tutte le larve dovrebbero esprimere il marcatore fluorescente. Per verificare se il marcatore fluorescente viene espresso come previsto, 2.000 prime larve instar vengono controllate sotto uno stereomicroscopio Leica MZFLIII con filtro DsRed2 (Texas Red) per determinare se sono presenti individui non fluorescenti. Senza tetraciclina il gene RIDL è espresso e ci aspettiamo una sopravvivenza del 3-4% per gli adulti8. Per verificare questo, viene impostato un vassoio aggiuntivo per ogni lotto di rilascio senza tetraciclina. L'unica differenza rispetto all'allevamento normale è che il cibo è ridotto di 2/3 dal giorno 6 perché l'accumulo di cibo in eccesso a causa delle larve morte può causare un eccesso di crescita batterica.
Controllo dell'allevamento
Quattro vassoi della generazione di rilascio vengono scelti casualmente per essere ordinati e conteggiati separatamente. Il numero di pupe maschili e femminili viene registrato ogni giorno da ciascun vassoio(figura 4). Qualsiasi deviazione dal numero previsto di maschi e femmine indica un potenziale problema che potrebbe influenzare la produzione e / o la forma fisica e può essere paragonato alla colonia di uova per aiutare a determinare la fonte dei problemi.
Misurazioni delle pupe
Le dimensioni delle pupe hanno dimostrato di essere correlate con la taglia adulta28. Come controllo di qualità per le dimensioni degli adulti, la larghezza del cefalotorace viene misurata di almeno 30 pupe maschili per ogni giorno di smistamento dalla generazione di rilascio; per la Colonia di Produzione uova vengono misurate anche le pupe femminili. La larghezza media del cefalotorace era di 1,05 mm (SEM 0,005) per i maschi rilasciati e di 1,04 mm (SEM = 0,006) e 1,29 mm (SEM = 0,006) rispettivamente per maschi e femmine Produzione di uova, Colonia; risultati simili sono stati ottenuti per l'allevamento di massa di Ae. albopictus 24.

Figura 1. Fasi di allevamento di massa delle zanzare da utilizzare in un programma RIDL /SIT. La colonia di produzione di uova ha un alto livello di controllo di qualità per garantire la qualità delle uova fornite alla generazione di rilascio. Le uova vengono allevate fino alle pupe nella colonia di rilascio, dove i maschi vengono ordinati dalle femmine. Gli adulti maschi vengono quindi utilizzati per il programma di controllo RIDL.
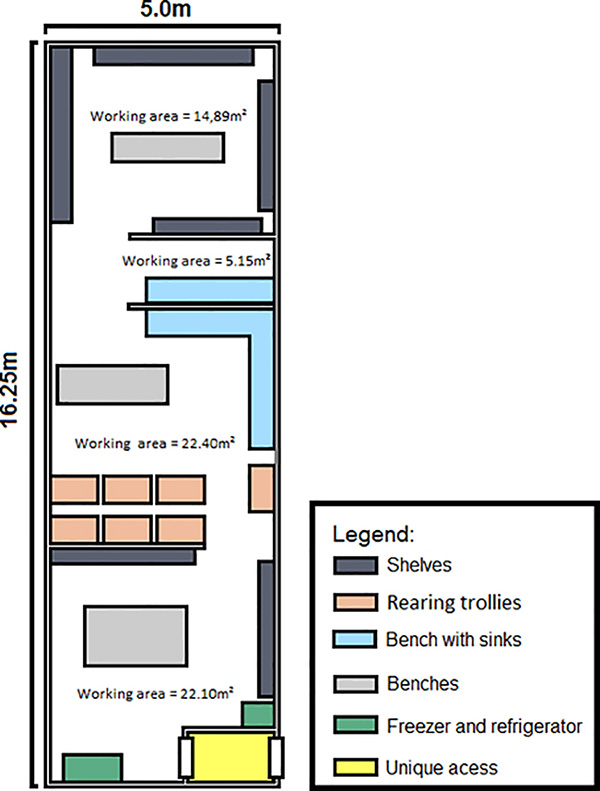
Figura 2. Schema dell'impianto di allevamento per la produzione di maschi RIDL per un programma di rilascio. Le uova di alta qualità vengono continuamente prodotte nella stanza della colonia di produzione di uova e vengono quindi allevate fino alle pupe nella stanza Release Generation. Le larve e le pupe vengono quindi separate e le pupe ordinate per i maschi. I maschi vengono quindi collocati in dispositivi di rilascio e autorizzati a maturare agli adulti per il rilascio nella stanza di stoccaggio e rilascio degli adulti.

Figura 3. Separazione di larve, pupe maschili e pupe femminili utilizzando un separatore di piastre26. Il separatore di piastre utilizza la differenza di dimensioni tra larve, pupe maschili e pupe femminili per ordinare queste tre diverse fasi della vita; le larve tendono ad essere più piccole delle pupe maschili che a loro volta sono più piccole delle pupe femminili. Lo strumento è composto da due lastre di vetro; uno è fissato a un telaio metallico inclinato e l'altro si trova sopra la prima piastra e può essere spostato rispetto al primo utilizzando quattro viti di regolazione(A). Le quattro viti di regolazione consentono di impostare la piastra esterna con un angolo rispetto alla piastra posteriore in modo da formare uno spazio a forma di cuneo tra le piastre, rastremato verso il basso. Larve e pupe vengono versate tra le lastre di vetro(B)e lavate delicatamente con un tubo dell'acqua(C). Regolando l'angolo del piatto, le larve, le pupe maschili e le pupe femminili possono essere separate(D). Con il lavaggio continuo e l'aumento dell'angolo del piatto le larve possono essere prima arrossate (in un setaccio), seguite dalle pupe maschili e infine dalle pupe femminili.
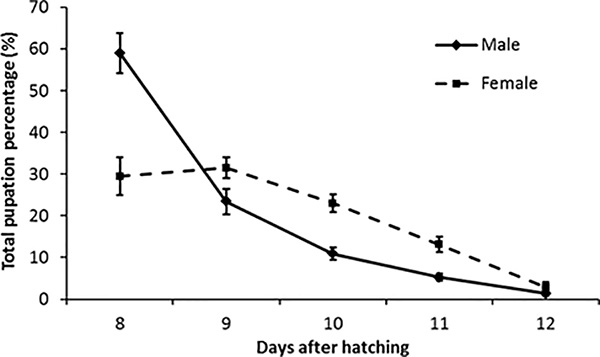
Figura 4. Curve di pupa per ridl ae. aegypti allevati in serie. Questo grafico mostra la percentuale media di pupa per pupe di maschi e femmine RIDL allevati in massa durante l'osservazione di 23 settimane con ~ 135.000 pupe recuperate a settimana. Barre di errore = errore standard della media, n = 23. Nella prima collezione (giorno 8) abbiamo recuperato in media il 59% di pupe maschili e il 30% femminili dalle pupe totali recuperate dai vassoi in 5 giorni.
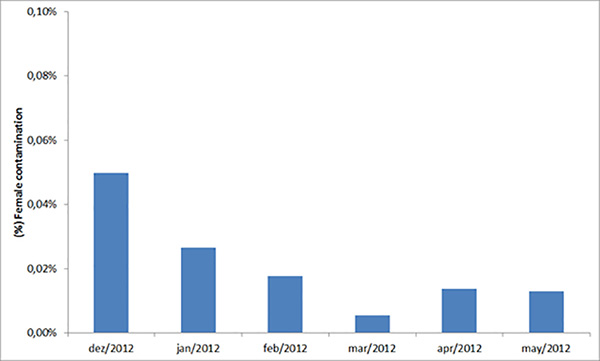
Figura 5. Contaminazione femminile media delle pupe maschili ordinate. Questo grafico mostra la percentuale media mensile di contaminazione femminile durante la cernita maschile il giorno 8 dopo la schiusa su un periodo di sei mesi.

Figura 6. Sistema di alimentazione del sangue a piastre di alluminio. La piastra (B) è coperta con Parafilm (A) e sangue pipettato in una tasca e poi sigillato(D). La piastra viene posta su una gabbia e riscaldata posizionando sopra un sacchetto di fagioli riscaldato(C)(E).
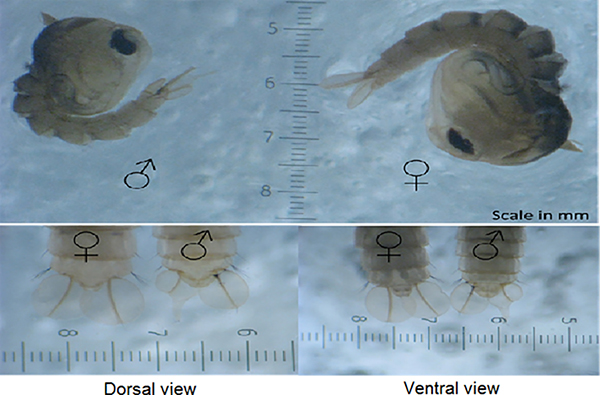
Figura 7. Distinguente maschio e femmina Ae. aegypti pupae. Aegypti pupae può essere sessuato in modo affidabile dalle differenze nella forma del lobo genitale (alla fine dei segmenti addominali pupali appena sotto le pagaie). Inoltre, i maschi tendono anche ad essere più piccoli delle femmine.

La tabella 1. Regime generale di alimentazione per le larve ridl di Ae. aegypti (mg di cibo per larva al giorno). Per calcolare la quantità effettiva di cibo richiesto moltiplicare per il numero totale di larve per vassoio.
Discussione
RIDL è un metodo efficace e sicuro dal punto di vista ambientale per controllare lezanzare 3,29-31. La tecnica è applicabile a un programma integrato di gestione dei parassiti e la maggior parte dei metodi di controllo attuali, tra cui larvicidi, riduzione del sito di riproduzione e adulticidi sono compatibili con questa tecnologia. Questo metodo descrive come produrre fino a 570.000 pupe maschili RIDL a settimana per l'uso nel controllo di Ae. Aegypti e per quanto ne abbiamo conoscenza questa è la prima descrizione della produzione di zanzare transgeniche su questa scala. Alcuni sistemi di produzione comparabili sono stati sviluppati per il tipo selvatico Ae. aegypti negli anni '60 e '7025,tuttavia da allora non c'è stata una produzione comparabile di questa portata. In Brasile circa 11 milioni di maschi sono stati rilasciati da febbraio 2011 a febbraio 2012. Il numero di maschi necessari per controllare una data area dipende da una serie di fattori tra cui le dimensioni della popolazione selvatica, la dispersione dei maschi rilasciati, la sopravvivenza e la competitività degli accoppiamenti dei maschi dopo il rilascio e le condizioni ambientali. Studi precedenti hanno dimostrato che ridl può ridurre una popolazione di zanzare di almeno l'80%9.
È necessario un equilibrio tra l'ottimizzazione dell'allevamento di massa per la scala di produzione e il costo rispetto alla qualità dei maschi. Ad esempio, l'aumento della densità larvale può aumentare la capacità produttiva riducendo lo spazio richiesto, il lavoro e il tempo allapupa 32. Tuttavia, densità troppo elevate di larve possono causare maschi più piccoli e più corti con ridotta capacità diaccoppiamento 32,33. La qualità dei maschi in relazione a un programma SIT sarà infine valutata dalla capacità dei maschi rilasciati di accoppiarsi con le femmine sul campo. È necessaria un'ampia valutazione sul campo per valutare la competitività degli accoppiamenti rispetto alle contropartiselvatiche 9,10. Questo spesso rende poco pratico valutare esattamente quali fattori fanno una zanzara maschio "di alta qualità". Tuttavia, mantenere una produzione e una qualità costanti (nella misura in cui può essere valutata regolarmente) nell'allevamento di massa su larga scala è fondamentale. Ciò richiede un elevato livello di vigilanza e standardizzazione di tutti i processi con piccole fluttuazioni che potenzialmente hanno un impatto significativo. L'aliquota delle larve L1 è un passo critico e illustra questo punto. L'aliquota del numero corretto di larve in vassoi è essenziale per una produzione di buona qualità. Il regime di alimentazione è su misura per un numero specifico di larve. Troppo poche / molte larve si tradurranno in un'alimentazione superiore / sotto, che influenza la sopravvivenza larvale, le dimensioni delle pupe e il tempo di pupa. Se c'è un segreto nell'arte dell'allevamento di massa è quello di garantire che i numerosi piccoli passaggi del ciclo produttivo siano condotti in modo coerente, preciso e con un alto livello di controllo qualità, come descritto in questo documento.
Divulgazioni
Gli autori affiliati a Oxitec hanno una partecipazione lavorativa e/o azionaria in Oxitec Ltd. Oxitec Ltd e l'Università di Oxford detiene proprietà intellettuale relativa all'argomento del presente documento.
Riconoscimenti
Ringraziamo Biofábrica Moscamed Brasil, Fundação de Amparo a Pesquisa do Estado de São Paulo (FAPESP) e Conselho Nacional de Desenvolvimento Científico e Tecnologia (CNPq) per il sostegno finanziario. Ringraziamo anche le seguenti persone per la loro assistenza; Miriam dos Santos, Gildeane Silva, Gessilane dos Santos, Fabio Gonçalves, John Paul Oliveira, Luiza Garziera, José Carlos Valença.
Materiali
| Name | Company | Catalog Number | Comments |
| Vipan Premium | Sera GmbH | 190 | http://www.sera.de/uk/pages/products/product/sera-vipan-3.html |
| Tetracycline | Sigma Aldrich | T7660 | |
| Plate separator | J.W. Hock | 5412 | http://www.johnwhock.com/download/manuals/instr_5412_separator.pdf |
| Parafilm M | Pechiney Plastic packing | PM-996 | |
| Rearing pans for Release generation (53 cm x 38 cm x 8 cm) | Pleion | 0757 | |
| Fluorescent scope | Leica Microsystems | MZ FLIII | http://www.leica-microsystems.com/fileadmin/downloads/Leica%20MZ%20FLIII/Brochures/M1-160-0de.pdf |
| Adult cages | BugDorm | DP1000 | http://bugdorm.megaview.com.tw/bugdorm-1-insect-rearing-cage-30x30x30-cm-pack-of-one-p-29.html |
| Filter paper | CELAB |
Riferimenti
- Dyck, V., et al. Sterilizing Insects with Ionizing Radiation. Sterile Insect Technique. , Springer. Netherlands. 233-268 (2005).
- Dyck, V., Hendrichs, J., Robinson, A. S., Klassen, W., Curtis, C. History of the Sterile Insect Technique.. Sterile Insect Technique. , Springer. Netherlands. 3-36 (2005).
- Alphey, L., et al. Sterile-insect methods for control of mosquito-borne diseases – an analysis. Vector Borne Zoonotic Dis. 10, 295-311 (2010).
- Thomas, D. D., Donnelly, C. A., Wood, R. J., Alphey, L. S. Insect population control using a dominant, repressible, lethal genetic system. Science. 287, 2474-2476 (2000).
- Fu, G., et al. Female-specific insect lethality engineered using alternative splicing. Nat. Biotechnol. 25, 353-357 (2007).
- Fu, G., et al. Female-specific flightless phenotype for mosquito control. Proc. Natl. Acad. Sci. U.S.A. 107, 4550-4554 (2010).
- Gong, P., et al. A dominant lethal genetic system for autocidal control of the Mediterranean fruitfly. Nat. Biotechnol. 23, 453-456 (2005).
- Phuc, H. K., et al. Late-acting dominant lethal genetic systems and mosquito control. BMC Biol. 5 (11), (2007).
- Harris, A. F., et al. Successful suppression of a field mosquito population by sustained release of engineered male mosquitoes. Nat. Biotechnol. 30, 828-830 (2012).
- Harris, A. F., et al. Field performance of engineered male mosquitoes. Nat. Biotechnol. 29, 1034-1037 (2011).
- Bailey, D. L., Lowe, R. E., Dame, D. A., Seawright, J. A. Mass rearing the genetically altered MACHO strain of Anopheles albimanus Wiedemann. Am. J. Trop. Med. Hyg. 29, 141-149 (1980).
- Benedict, M. Q., et al. Colonisation and mass rearing: learning from others. Malar. J.. 8 Suppl 2 (S4), (2009).
- Alphey, L. Re-engineering the sterile insect technique. Insect Biochem. Mol. Biol. 32, 1243-1247 (2002).
- Wise de Valdez,, R, M., et al. Genetic elimination of dengue vector mosquitoes. Proc. Natl. Acad. Sci. U.S.A. 108, 4772-4775 (2011).
- Macoris Mde,, L,, et al. Resistance of Aedes aegypti from the state of Sao Paulo, Brazil, to organophosphates insecticides. Mem. Inst. Oswaldo Cruz. 98, 703-708 (2003).
- Campos, J., Andrade, C. F. Larval susceptibility of Aedes aegypti and Culex quinquefasciatus populations to chemical insecticides. Rev. Saude Publica. 37, 523-527 (2003).
- Gubler, D. J. Resurgent vector-borne diseases as a global health problem. Emerg. Infect. Dis. 4, 442-450 (1998).
- Harris, A. F., Rajatileka, S., Ranson, H. Pyrethroid resistance in Aedes aegypti from Grand Cayman. Am. J. Trop. Med. Hyg. 83, 277-284 (2010).
- Lima, J. B., et al. Resistance of Aedes aegypti to organophosphates in several municipalities in the State of Rio de Janeiro and Espirito Santo. Am. J. Trop. Med. Hyg. 68, Brazil. 329-333 (2003).
- Paris, M., et al. Persistence of Bacillus thuringiensis israelensis (Bti) in the environment induces resistance to multiple Bti toxins in mosquitoes. Pest Manag. Sci. 67, 122-128 (2010).
- Rendon, P., McInnis, D., Lance, D., Stewart, J. Medfly (Diptera: Tephritidae) genetic sexing: large-scale field comparison of males-only and bisexual sterile fly releases in Guatemala. J. Econ. Entomol. 97, 1547-1553 (2004).
- Papathanos, P. A., et al. Sex separation strategies: past experience and new approaches. Malar. J.. 8 Suppl 2 (S5), (2009).
- Medici, A., et al. Studies on Aedes albopictus larval mass-rearing optimization. J. Econ. Entomol. 104, 266-273 (2011).
- Focks, D. A. An improved separator for the developmental stages, sexes and species of mosquito (Diptera Culicidae). J. Med. Entomol. 17, 567-568 (1980).
- Fay, R. W., McCray, E. M., Kilpatrick, J. W. Mass production of sterilized male Aedes aegypti. Mosquito News. 23, 210-214 (1963).
- Christophers, S. R. Aedes aegypti the yellow fever mosquito: Its life history, Bionomics and Structure. , Cambridge University Press. (2009).
- Jones, J. C. A simple method for sexing living Anopheles Larvae (diptera, culicidae). Ann. Entomol. Soc. Am. 50, 104-106 (1957).
- Koenraadt, C. J. M. Pupal Dimensions as Predictors of Adult Size in Fitness Studies of Aedes aegypti (Diptera Culicidae). J. Med. Entomol. 45, 331-336 (2008).
- Alphey, L., Nimmo, D., O'Connell, S., Alphey, N. Insect population suppression using engineered insects. Adv. Exp. Med. Biol. 627, 93-103 (2008).
- Alphey, N., Bonsall, M. B., Alphey, L. Modeling resistance to genetic control of insects. J. Theor. Biol. 270, 42-55 (2011).
- Atkinson, M. P., et al. Analyzing the control of mosquito-borne diseases by a dominant lethal genetic system. Proc. Natl. Acad. Sci. U.S.A. 104, 9540-9545 (2007).
- Bargielowski, I., Nimmo, D., Alphey, L., Koella, J. C. Comparison of life history characteristics of the genetically modified OX513A line and a wild type strain of Aedes aegypti. PLoS One. 6 (e20699), (2011).
- Bargielowski, I., Alphey, L., Koella, J. C. Cost of mating and insemination capacity of a genetically modified mosquito Aedes aegypti OX513A compared to its wild type counterpart. PLoS One. 6 (26086), (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon