È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Candida albicans Biofilm Chip (Ca BChip) per High-throughput screening farmaco antifungino
In questo articolo
Riepilogo
Abbiamo sviluppato una piattaforma ad alta densità microarray costituito da nano-3D di biofilm C. albicans Chiamato Ca BChip. Il profilo suscettibilità di farmaci testati su una Ca BChip è paragonabile a quello tradizionale a 96 pozzetti modello di piastra, suggerendo che il chip funghi è ideale per una vera high-throughput screening di farmaci antifungini.
Abstract
Candida albicans rimane il principale agente eziologico della candidosi, che attualmente rappresenta la quarta più comune infezione nosocomiale sangue negli ospedali degli Stati Uniti 1. Queste infezioni opportunistiche rappresentano una crescente minaccia per un numero crescente di individui compromessi, e portare i tassi di mortalità eccessivamente elevati. Ciò è in parte dovuto al limitato arsenale di farmaci antifungini, ma anche alla comparsa di resistenza agli agenti antifungini più comunemente usati. A complicare ulteriormente trattamento è il fatto che una maggioranza di manifestazioni di candidosi sono associati con la formazione di biofilm, e le cellule all'interno di questi biofilm mostrano livelli aumentati di resistenza agli clinicamente più utilizzati agenti antifungini 2. Qui si descrive lo sviluppo di una alta densità microarray che consiste di C. albicans nano-biofilm, che abbiamo chiamato Ca BChip 3. Brevemente, un micro-distributore robotico viene utilizzato to lievito cellule stampa di C. albicans su una substrato solido. Durante la stampa, le cellule di lievito sono racchiusi in una matrice tridimensionale usando un volume basso quanto 50 nL e immobilizzato su un substrato di vetro con un idoneo rivestimento. Dopo la stampa iniziale, le diapositive vengono incubate a 37 ° C per 24 ore per consentire per sviluppo biofilm. Durante questo periodo le macchie crescere in pienamente sviluppati "nano-biofilm" che visualizzare tipici caratteristiche strutturali e fenotipica associati con mature C. albicans biofilm (complessità vale a dire morfologica, tre l'architettura dimensionale e resistenza ai farmaci) 4. Complessivamente, il BChip Ca è composto di ~ 750 biofilm equivalenti e spazialmente distinto; con il vantaggio supplementari che chip multipli può essere stampato e elaborati contemporaneamente. La vitalità cellulare è stimato misurando l'intensità fluorescente di FUN1 metabolica macchia utilizzando un scanner microarray. Questo chip fungina è l'ideale per use in vero high-throughput screening per la scoperta di nuovi farmaci antifungini. Rispetto agli standard attuali (cioè il 96-well modello piastra microtitolo della formazione di biofilm 5), i principali vantaggi del chip biofilm fungine sono automazione, miniaturizzazione, risparmi nei costi e quantità dei reagenti e dei tempi di analisi, nonché l'eliminazione di lavoro operazioni intensive. Noi crediamo che il chip in modo significativo ad accelerare il processo di scoperta di nuovi farmaci antifungini.
Protocollo
1. Preparazione dei vetrini funzionalizzati
- Collocare i vetrini in un rack scorrevole estraibile, e lavare due volte immergendolo in una vaschetta di colorazione contenente 99% di etanolo (grado istologico). Pulire le diapositive pulire con tovaglioli di carta (assicurando di non generare polvere di carta), e asciugare con un getto di gas azoto compresso.
NOTA: non utilizzare Kim-Wipes per pulire le diapositive in quanto genererebbe polveri sottili di carta.
- Immergere il rack diapositiva contenente i vetrini in una vaschetta di colorazione piena di acido solforico concentrato e incubare a temperatura ambiente per una notte.
NOTA: per evitare il contatto con la pelle, usare guanti resistenti agli agenti chimici e occhiali protettivi mentre si lavora con acidi concentrati e prodotti chimici tossici e corrosivi.
- Sonicare i vetrini per 30 min e lavare con Milli-Q (18 mQ) acqua per 30 minuti, seguite con un altro lavaggio in unoCetona per 5 min. Questo trattamento espone i gruppi silanolici sulla superficie del vetro.
- Ricoprire i vetrini puliti con 2,5% (vol / vol in acqua) di 3-amminopropiltrietossisilano (APTES) soluzione, immergendo il portavetrini in APTES per 30 minuti, lavando 3 volte in acqua Milli-Q per 15 minuti ogni lavaggio, e cottura i vetrini in un forno a 110 ° C per 15 min. Cottura consente reticolazione delle APTES, con conseguente-NH2-funzionalizzazione della superficie.
NOTA: la soluzione APTES in un contenitore di plastica in quanto i depositi APTES preferenzialmente sulle pareti del contenitore in vetro.
- Utilizzando un rivestitore a rotazione, rivestimento i vetrini con 1% (peso / volume in toluene) Polistirene-co-anidride maleica (MA-PS) (Sigma) per ottenere un mono-strato di rivestimento idrofobo 6. Aggiungere 2,0 ml di PS-MA su un vetrino pulito montato su un rivestitore a rotazione e mantello a 3.000 rpm per 30 s. Queste condizioni possono variare a seconda dei parametri di spin di rivestimento come rivestimento cosìluzione, substrato, spessore del rivestimento e governata dalla seguente equazione 7
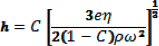
dove h è lo spessore della pellicola di rivestimento, e è il tasso di evaporazione, η, C e ρ sono viscosità, la concentrazione e la densità della soluzione di rivestimento, rispettivamente, ed ω è la velocità angolare.
NOTA: toluene è nocive per inalazione per lungo tempo e l'uso di una cappa aspirante è raccomandato.
- Le slide possono essere memorizzati in un rack scorrevole fino ad un mese secco, privo di polvere condizioni a 2 - 8 ° C.
2. Preparazione degli inoculi Lievito e Encapsulation Collagene
- Preparare una coltura di una notte di C. albicans ceppo SC5314, in lievito Peptone destrosio [YPD; 10 g / L di estratto di lievito, 20 g / L e peptone 20 g / L destrosio] mezzo liquido inoculando una singola colonia di C. albicans in 10 - 20 mL di YPD 8. Incubare cultura in un agitatore orbitale (circa 150 - 200 rpm) a 30 ° C per una notte. Harvest 1 mL Candida albicans cellule di lievito da overnight colture YPD (per centrifugazione a 5.000 rpm per 5-10 minuti) e si lavano due volte per 10 min in 1 mL di soluzione salina tamponata con fosfato sterile (PBS; tampone fosfato 10 mM, 2,7 mM di cloruro di potassio, cloruro di sodio 137 mM, pH 7,4) (Sigma) per lavaggio. Harvest lavato anche cellule per centrifugazione a 1900 rpm per 10 minuti. Risospendere le cellule lavate in 1 mL di tampone di ricostruzione (0,2 N NaOH con soluzione di bicarbonato di sodio 2,2% (peso / vol) e 4,8% (peso / vol) HEPES, pH 7,2).
NOTE: C. albicans è un microrganismo Group Risk 1/BSL1. Ricordate sempre di usare buone tecniche asettiche / sterile per il lavoro con questo microrganismo e seguire le procedure istituzionali per il corretto smaltimento dei materiali a rischio biologico.
- Contare le cellule utilizzando un hemocytOmeter su un microscopio a campo chiaro e regolare ad una densità cellulare di 5 x 10 7 cellule / ml.
- Ulteriori diluire la sospensione dieci volte mediante aggiunta di 10 × RPMI-1640 integrato con L-glutammina e tamponata con morpholinepropanesulfonic (MOPS) acido (pH 7,2).
- Incapsulare le cellule di lievito in collagene mescolando la sospensione cellulare in RPMI-1640 con collagene (1,8 mg / mL) (tipo 1 di coda di ratto, BD Biosciences, Bedford, MA), per ottenere una concentrazione finale di 4 x 10 6 cellule / mL. Mantenere il collagene-sospensione cellulare su ghiaccio per impedire la gelificazione del collagene prima della stampa.
3. Preparazione di Ca BChip
- Pulire e disinfettare tutte le superfici di micro-distributore, tra cui la fonte piastra stazione di lavaggio e la stazione di vuoto, slide piatto vuoto e camera di stampa, pulendo con isopropanolo al 70%.
- Posizionare e tenere sotto vuoto il numero desiderato di PS-MA-rivestite vetrini sul ponte scorrevole del microfonoroarrayer.
- Vortex la sospensione cellulare in collagene vigorosamente e aspirare 100 pl di ben miscelato sospensione in un pozzetto di una piastra a 96 pozzetti, appena prima della stampa. Posizionare questa piastra fonte nella stazione di carico.
- Accendere l'umidificatore per mantenere una umidità relativa del 100% nella camera microarray durante il processo di stampa.
- Stampa 50 nL di sospensione di cellule in una matrice di 48 righe e 16 colonne con punti distanziati di 1,2 mm di distanza utilizzando un microarray spotter (Omnigrid Micro, Inc. Digilab, Holliston, MA) da parte di non-contatto con la deposizione conica coniche 190 consigli orifizio ceramica micron (Digilab).
- Prime, risciacquare e asciugare, aspirare le punte per due volte dopo ogni ciclo di stampa.
- Subito dopo la stampa, posizionare il vetrino in un a tenuta d'aria, camera umidificata (cassette ibridazione, ArrayIt Corporation, Sunnyvale, CA) e incubare a 37 ° C per 24 ore per consentire la formazione di biofilm.
4. Test di sensibilità di PrI biofilm eformed a Ca BChip contro gli agenti antifungini
- Dalle soluzioni di borsa o polvere di farmaci antifungini, preparare una soluzione di lavoro in RPMI-1640. Tipiche concentrazioni massime della soluzione di lavoro sono 1.024 ug / mL per il fluconazolo e 16 ug / mL per amfotericina B 5. Altre concentrazioni possono essere utilizzati per diversi agenti.
- Preparare otto differenti concentrazioni del composto diluendo la soluzione madre in due diluizioni, coprono una gamma con la stima IC 50 del composto nel mezzo.
- Dopo 24 ore di crescita biofilm, utilizzare il micro-distributore per stampare 50 nL di otto differenti concentrazioni dei farmaci, insieme positivo (cioè senza cellule farmaci nei mezzi solo) e negativo (trattato con ipoclorito di sodio per 20 min) controlli, in almeno sei repliche in cima alle biofilm.
NOTA: Mantenere una umidità relativa del 100% per impedire l'essiccamento delle macchie mentre addMOZIONE farmaci.
- Subito dopo l'aggiunta dei farmaci, incubare il chip con i farmaci in una camera umidificata a 37 ° C per 24 ore.
- Lavare i farmaci fuori dal dunking il CaBChip 3-5 volte per 2 minuti ogni volta in PBS e macchia incubando il BChip Ca con 0,5 pM FUN1 a 37 ° C per 30 min 9.
- Lavare la macchia da inzuppare il BChip Ca 3-5 volte in PBS per 1-3 min ogni dunk, e asciugare la BChip Ca utilizzando un flusso di azoto. Per saperne di intensità di fluorescenza utilizzando uno scanner microarray (GenePix 4100A, Axon Instruments, CA) ad una lunghezza d'onda di 532 nm con un guadagno di 380 PMT.
- Impostare l'intensità di fluorescenza del controllo positivo (nessun farmaco) e morti (candeggina trattati) macchie biofilm al 100% e 0%, rispettivamente.
- Determinare l'inibizione percentuale di riduzione della intensità di fluorescenza (F) rispetto alla media dei punti di controllo utilizzando la seguente equazione

dove F, F e F max o sono prime intensità di fluorescenza di farmaco-trattato, no-farmaco di controllo e trattati con macchie di candeggina, rispettivamente. Le impostazioni dello scanner sono stati adeguati per ottenere C max e F o di 30000 e 4000 RFU, rispettivamente.
- Calcolare la concentrazione inibitoria del 50% o IC 50 inserendo la variabile dell'equazione Hill pendenza utilizzando software Prism GraphPad (La Jolla, CA).
5. Risultati rappresentativi
Un rappresentante Ca BChip, costituito da una matrice 48 × 16 di nano-biofilm di C. albicans, è mostrato in Figura 2. La microscopia in campo chiaro mostra una caratteristica architettonica complessiva del nano-biofilm. La digitalizzazione delle immagini al microscopio elettronico della mostra biofilm che le ife fungine sono incorporati nella matrice difibre collagene, che sono circa 2 um e 100 nm di diametro, rispettivamente. Le FUN1 macchiate di immagini di microarray scanner mostrano il lievito e le forme ife, che sono caratteristiche dei biofilm fungine. Le immagini 2D-e 3D-fluorescenza confocale di FUN1 macchiate biofilm può essere visto nelle eterogeneità spaziale, con regioni di cellule metabolicamente attive intercalati nella matrice extracellulare (composto di collagene come il materiale inglobante e probabilmente anche di materiale exopolymeric prodotto dalla cellule biofilm), che non è macchiate di colorante metabolica. Lo spessore del biofilm è stata stimata essere di circa 50 um. Il BChip Ca è stato utilizzato per stimare la suscettibilità di due farmaci antifungini, fluconazolo e amfotericina B, ed i risultati sono mostrati nella Figura 3. Coerentemente con rapporti pubblicati su standard di settore da 96 saggi e piastra, i biofilm sono resistenti contro il fluconazolo 10 e il calcolato IC 50 per amfotericina B è pari a 0,3 mg / ml 11.

Figura 1. Diagramma di flusso per la fabbricazione di Ca BChip.

Figura 2. Un'immagine ad alta thoughput Ca BChip, stampato utilizzando un micro-distributore robotizzato e contenente 768 punti su PS-MA rivestite con diapositive. Ogni spot emisferica è di 50 nL in volume, circa 700 micron di diametro, e con distanza di 1,2 millimetri tra le macchie. Altri prodotti (in senso orario) sono microscopia ottica, scanner microarray, microscopia 2D-e 3D-fluorescenza, e la scansione di immagini al microscopio elettronico dei biofilm individuali sul BChip Ca. La figura SEM ad alto ingrandimento di 25.000 x mostra un filamento ifale larghezza di 2 micron.
Figura 3 "src =" / files/ftp_upload/3845/3845fig3.jpg "/>
Figura 3. Risultati dei test di sensibilità antifungina e determinazione dei valori di IC 50 per (A) fluconazolo e (B) amfotericina B usando Ca BChip. Le immagini al microscopio a fluorescenza di amfotericina B-trattati biofilm sono mostrati in (C). I risultati sono media ± errore standard significa per due chip separati contenenti 10 repliche per ogni condizione.
Discussione
Abbiamo sviluppato un cell-based ad alta densità microarray, Ca BChip, costituito da volumi nanolitri biofilm di Candida albicans. Il microarray è stata stampata su substrati di vetro modificato, che ha consentito per il fissaggio solido di spot gel di collagene, fornendo idrofobicità necessaria per un non-diffusione, gel emisferica 3D. Un singolo Ca BChip può sostituire circa otto piastre a 96 pozzetti, e chip diversi possono essere stampati e trattati allo stesso tempo. Il chip utilizza ...
Divulgazioni
Jose L. Lopez-Ribot e Anand K. equità Ramasubramanian proprio in MicrobeHTS Technologies, Inc., che sta sviluppando agenti antifungini. MicrobeHTS Technologies, Inc. ha fornito alcun sostegno finanziario per questi studi.
Riconoscimenti
Questo lavoro è stato finanziato in parte da finanziamenti della Texas South Management Technology (POCrr 2009,041), l'Istituto per l'integrazione di Medicina e Scienza dal Centro Risorse Nazionale per la Ricerca (UL 1RR025767), e dal National Institute of Dental Research & craniofacciale ( 5R21DE017294).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | |
| 3-amminopropiltrietossisilano (APTES) | Sigma-Aldrich | 440140 | |
| Polistirene-Co-anidride maleica (PS-MA) | Sigma-Aldrich | 426946 | |
| Microscopia diapositive di vetro | Fisher Scientific | 12-549-3 | |
| Coda di tipo Rat collagene I | BD Biosciences | 354236 | |
| Robotic micro-distributore | Omnigrid Micro | MICROSYS4000/4100A | |
| Microarray Scanner | GenePix Personal 4100A | GENEPIX4100A | |
| Ibridazione Cassette | ArrayIt Corporation | AHCXD | |
| FUN1 [2-clororo-4-(2,3-diidro-3-metil-(benzo -1,3-tiazol-2-il)-metilidene)-1-fenil quinoliniumiodide] | Invitrogen Corp. | F-7030 | |
| Fluconazolo | Sicor Pharmaceuticals, Inc. | J02AC01 | |
| Amfotericina B | Sigma | A2411 | |
| RPMI-1640 | Mediatech, Inc. | 50-020-PC | |
| Ceramic Tip 190 micron orifizio | Digilab | 60020441-00 | |
| GraphPad Prism Software | GraphPad Software, Inc. | ||
| GenePix Pro V4.1 | Molecular Devices |
Riferimenti
- Edmond, M. B. Nosocomial bloodstream infections in United States hospitals: a three-year analysis. Clin. Infect. Dis. 29, 239-244 (1999).
- Ramage, G., Bachmann, S., Patterson, T. F., Wickes, B. L., Lopez-Ribot, J. L. Investigation of multidrug efflux pumps in relation to fluconazole resistance in Candida albicans biofilms. J. Antimicrob. Chemother. 49, 973-980 (2002).
- Srinivasan, A., Uppuluri, P., Lopez-Ribot, J., Ramasubramanian, A. K. Development of a High-Throughput Candida albicans Biofilm Chip. PLoS ONE. 6, 19036-19036 (2011).
- Ramage, G., Vandewalle, K., Wickes, B. L., Lopez-Ribot, J. L. Characteristics of biofilm formation by Candida albicans. Rev. Iberoam. Micol. 18, 163-170 (2001).
- Pierce, C. G. A simple and reproducible 96-well plate-based method for the formation of fungal biofilms and its application to antifungal susceptibility testing. Nat. Protoc. 3, 1494-1500 (2008).
- Lee, M. Y. Three-dimensional cellular microarray for high-throughput toxicology assays. Proc. Natl. Acad. Sci. U.S.A. 105, 59-63 (2008).
- Meyerhofer, D. Characteristics of resist films produced by spinning. Journal of Applied Physics. 49, (1978).
- Ramage, G., Vande Walle, K., Wickes, B. L., Lopez-Ribot, J. L. Standardized method for in vitro antifungal susceptibility testing of Candida albicans biofilms. Antimicrob. Agents Chemother. 45, 2475-2479 (2001).
- Chandra, J. Biofilm formation by the fungal pathogen Candida albicans: Development, architecture, and drug resistance. Journal of Bacteriology. 183, 5385-5394 (2001).
- Jabra-Rizk, M. A., Falkler, W. A., Meiller, T. F. Fungal biofilms and drug resistance. Emerg. Infect. Dis. 10, 14-19 (2004).
- Tobudic, S., Lassnigg, A., Kratzer, C., Graninger, W., Presterl, E. Antifungal activity of amphotericin B, caspofungin and posaconazole on Candida albicans biofilms in intermediate and mature development phases. Mycoses. 53, 208-214 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon