È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Endocardite modello sperimentale di meticillino resistente
In questo articolo
Riepilogo
Sperimentale endocardite modello di ratto a causa di meticillino-resistente S. aureus.
Abstract
Infezioni endovascolari, tra cui endocarditi, sono pericolose per la vita sindromi infettive 1-3. Staphylococcus aureus è il più comune in tutto il mondo la causa di sindromi simili a morbilità e mortalità eccessivamente elevato, anche con opportuni trattamenti agente antimicrobico 4-6. L'aumento di infezioni dovute alla meticillina-resistenti S. aureus (MRSA), gli alti tassi di insuccessi terapeutici vancomicina clinici e crescenti problemi di linezolid e resistenza daptomicina avere tutte le complica ulteriormente la gestione dei pazienti affetti da tali infezioni, e ha portato a costi sanitari elevati 7, 8. Inoltre, va sottolineato che studi più recenti con i risultati dei trattamenti antibiotici sono stati basati in ambito clinico, e quindi potrebbe essere influenzata da fattori dell'ospite varia da paziente a paziente. Pertanto, un modello animale rilevante di infezione endovascolare in cui fattori dell'ospite sono simili da animale a animale è piùcruciale per indagare patogenesi microbica, come pure l'efficacia di nuovi agenti antimicrobici. L'endocardite in ratto è una consolidata modello animale sperimentale che si avvicina molto umana endocardite della valvola nativa. Questo modello è stato utilizzato per esaminare il ruolo di particolari fattori di virulenza stafilococco e l'efficacia dei regimi di trattamento antibiotico per endocardite stafilococcica. In questo rapporto, descriviamo il modello sperimentale di endocardite a causa di MRSA che potrebbe essere utilizzato per studiare la patogenesi batterica e risposta al trattamento antibiotico.
Protocollo
1. Preparazione del ceppi di MRSA per l'infezione
- Inoculare un'ansata della cultura MRSA da un tubo di magazzino a -80 ° C ad un sangue di pecora TSA (TSA) piastra (vedi Tabella di reagenti e attrezzature specifiche), e incubare a 37 ° C per il pernottamento.
- Controllare la purezza della cultura sulla piastra di agar sangue (fenotipi di colonie simili) per assicurarsi che non vi è alcuna contaminazione.
- Scegli una colonia dalla piastra di sangue di pecora TSA e inoculare la colonia in 5 ml Trypticase Soy Broth (TSB) in 15 ml snap-provetta.
- Incubare a 37 ° C per una notte con agitazione a 200 rpm.
2. Preparazione Cateteri Chirurgia
Tagliare tubi in polietilene (PE10;. Becton Dickinson, per non 427.401) a 10 lunghezze di cm, e fondere una estremità premendo la punta con una pinza sterile. Lo scopo di sigillare una estremità del catetere è di evitare il sanguinamento durante la cateterizzazione.
3. Pre-surgery Preparazione e Anestesia
- Posizionare ratto Sprague-Dawley (Harlan, Indianapolis, Ind. femmina, 250-300 grammi) in una camera contenente isofluorano-ossigeno miscela di gas (50%: 50%) fino a quando l'anestetico ha effetto (per esempio i muscoli sono rilassati e riflessi pedali sono assenti ), e mantenere animali in uno stato anestetizzato durante l'intervento chirurgico con la miscela di gas.
- Pulire la zona del collo dal mento a poco sotto lo sterno con il Betadine e il 70% di etanolo.
4. Procedura chirurgica
- Utilizzare la tecnica sterile durante l'intervento chirurgico. Praticare un'incisione (1-1,5 cm) in verticale solo attraverso lo strato di pelle del collo sopra lo sterno.
- Utilizzando smussa, separare la fascia di esporre l'arteria carotide destra usando 2 coppie di curve pinze dentate.
- Estrarre delicatamente l'arteria uscire della cavità collo, e posto due lunghezze di 10 cm di sutura in seta sotto l'arteria e legare l'arteria alla fine esposta cefalica, collocare un clip sul artery per prevenire le emorragie.
- Fare un piccolo foro nella parte superiore dell'arteria utilizzando un catetere introduttore (Becton Dickinson, per n. 406.999), inserire un catetere con una pinza attraverso il foro nell'arteria, rimuovere la clip e spingere verso il basso il catetere verso il cuore finché non fanno resistenza è soddisfatta.
- Tie la sutura sciolto intorno alla fine della arteria caudale e fissare il catetere in posizione con la sutura di seta quando il catetere è in posizione come determinato da: i) la lunghezza del catetere inserito (4-5 cm); ii) resistenza ad ulteriore avanzamento e iii) pulsazione del catetere con il battito del cuore. Lasciare il catetere in posizione per il resto dell'esperimento.
- Tagliare sutura eccesso e termina catetere, e assicurarsi che non vi è sanguinamento dal catetere. Infilare le estremità libere sotto la pelle del collo e chiudere la pelle con clips pelle.
- Posizionare il topo in gabbia in un luogo caldo fino recuperato l'anestesia, e di fornire cibo e acqua. Controllare il ratto frequentemente durante edopo il recupero dall'anestesia.
- Questa chirurgia è una "categoria E" procedura. Le procedure elaborate il dolore è alleviato da analgesici da infezioni da MRSA che accompagnano sofferenza agli animali.
5. L'infezione MRSA
- L'infezione può essere effettuata tra 1 e 7 giorni post-intervento chirurgico, ma mantenere coerente all'interno di esperimenti.
- Pulire la coda di ratto con il 70% di etanolo, e iniettare 0,5 ml MRSA in un numero di celle (10 aprile-10 giugno cfu / animale, per la maggior parte dei ceppi di S. aureus). Con 27 ago G 1/2 pollice per via endovenosa dalla vena caudale Attenzione : la cultura appartiene al MRSA livello di biosicurezza 2 (BSL2) e ha moderato potenziale pericolo per il personale e per l'ambiente.
- Mantenere la pressione sul sito fino emostasi si verifica prima di tornare il ratto alla gabbia.
6. Rats Sacrifice e tessuti di Cultura
- Sacrifice ratti mediante iniezione ip di sodio pentobarbital (200 mg/ Kg) dopo 1 a 6 giorni dopo l'infezione.
- Posizionare il topo sulla schiena e pulire il petto con il 70% di etanolo.
- Effettuare una forma di V incisione nel torace sotto sterno, e tagliare la cartilagine di nervature su ciascun lato dello sterno per esporre il cuore.
- Tirare il cuore con delicatezza, e la clip attraverso il tessuto cardiaco in prossimità della aorta e sezionare fino a liberare il cuore.
- Mettere il cuore in una piastra di Petri sterile con all'interno una garza 4x4 pollici, un taglio attraverso la parete interna del ventricolo sinistro e aprire il lato sinistro della camera.
- Controllare visivamente per il posizionamento del catetere. Esaminare e rimuovere vegetazioni della valvola con le forbici e pinze.
- Pesare e omogeneizzare le vegetazioni, e fare diluizioni seriali con PBS per la cultura quantitativa.
7. Risultati rappresentativi
Immediatamente dopo l'inserimento del catetere nell'arteria e spingendo il catetere circa 4-5 cm verso il cuore, una resistenza sarà especed. Se non viene rilevata resistenza, il catetere potrebbe non essere stata inserita correttamente nel lato sinistro della camera cardiaca, che può influenzare il posizionamento del catetere. Un corretto posizionamento del catetere pubblicato precedentemente 9 è mostrato in Figura 1.
Parte dei campioni di infezione da MRSA devono essere colta quantitativa verificare l'esatto numero di organismi vitali per l'infezione batterica e la purezza del campione infezione. Inoltre, i microrganismi recuperati dalla vegetazione dovrebbero essere uguali a quelli utilizzati nella inoculo.
La tabella 1 mostra un esempio di virulenza di un S. ceppo aureus nel modello endocardite ratto che è stato pubblicato in precedenza 9. Tutti gli animali sfidati con inoculi di 10 5 e 10 6 cfu e sacrificato da 3 a 6 giorni dopo infezioni endocardits sviluppati ad alto S. densità aureus in vegetazioni cardiaci, così come reni e milza ( Tabella 1). I ratti con culture valvole sterili sono considerati infetti.
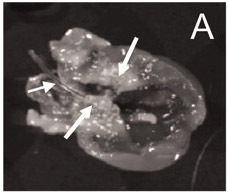
Figura 1. Il catetere è in una posizione corretta (lato sinistro della camera di cuore), e numerose vegetazioni sono visibili in tutto il valvole aortica 9.
| Inoculo (n. animas) | Media log 10 CFU / g di tessuto ± SD in uno: | ||
| Vegetazione | Rene | Milza | |
| 10 6 CFU / animale (9) | 10,36 ± 0,85 | 7,30 ± 0,64 | 6,70 ± 0,57 |
| 10 5 CFU / animale (8) | 9,93 ± 0,53 | 7,14 ± 0,53 | 6,44 ± 0,63 |
| 10 4 CFU / animale (7) | 3,46 ± 0,50 * | 1,81 ± 0,74 * | 1,58 ± 0,59 * |
una scheda SD, la deviazione standard. P <0.001 rispetto al 10 5 o 10 6 CFU-sfidato animali.
Tabella 1. S. densità aureus in vegetazioni cardiache con inoculo differenti nel modello di ratto endocardite 9.
Access restricted. Please log in or start a trial to view this content.
Discussione
Il endocardite ratto è un modello animale importante e ben caratterizzato per studi in vivo nella patogenesi e agenti antimicrobici nel trattamento di infezioni batteriche 9-11. Inoltre, endocardite modello di ratto rappresenta un composito di infezioni acute e sub-acute, e mima da vicino controparte umana e umana endocardite della valvola nativa. Inoltre, accompagnata da un catetere a dimora, rappresenta una infezione classico biofilm associata, un problema comune e difficile nella pratica clinica ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institutes of Health [una sovvenzione di 39.108 R01AI-ASB] e l'American Heart Association [sovvenzioni SDG 0630219N e AID 09GRNT2180065 a YQX].
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| Piastra di agar sangue, sangue di pecora 5% in Soy agar-agar (TSA) | Diagnostica Hardy | A10BX | |
| Trypticase Soy Broth (TSB) | Becton Dickinson | 211825 | |
| Shaking incubatore | Labnet | I5311-DS | |
| Tubi in polietilene | Becton Dickinson | 427401 | |
| Catetere introduttore | Becton Dickinson | 6999 | |
| Isofluorance | Occidentale Medical Suppy, Inc | 2147 | Seguire le informazioni sulla sicurezza e la gestione |
| Strumenti chirurgici | Strumenti Scienza Belle e Strumenti di ricerca biomedica, Inc. | Trova gli strumenti dalle due aziende per le vostre esigenze |
Riferimenti
- Petti, C. A., Fowler, V. G. Staphylococcus aureus bacteremia and endocarditis. Cardiol. Clin. 21, 219-233 (2003).
- Bashore, T. M., Cabell, C., Fowler, V. Update on infective endocarditis. Curr. Probl. Cardiol. 31, 274-352 (2006).
- Fowler, V. G. Jr, Justice, A., Moore, C. Risk factors for hematogenous complications of intravascular catheter-associated Staphylococcus aureus bacteremia. Clin. Infect. Dis. 17, 313-320 (1993).
- Wisplinghoff, H., Bischoff, T., Tallent, S. M., Seifert, H., Wenzel, R. P., Edmond, M. B. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clin. Infect. Dis. 39, 309-317 (2004).
- Hoen, B. Special issues in the management of infective endocarditis caused by gram-positive cocci. Infect Dis. Clin. North Am. 16, 437-452 (2002).
- Moise, P. A., Hershberger, E., Amodio-Groton, M. I., Lamp, K. C. Safety and clinical outcomes when utilizing high-dose (> or =8 mg/kg) daptomycin therapy. Ann. Pharmacother. 43, 1211-1219 (2009).
- Sakoulas, G., Brown, J., Lamp, K. C., Friedrich, L. V., Lindfield, K. C. Clinical outcomes of patients receiving daptomycin for the treatment of Staphylococcus aureus infections and assessment of clinical factors for daptomycin failure: a retrospective cohort study utilizing the Cubicin Outcomes Registry and Experience. Clin. Ther. 31, 1936-1945 (2009).
- Xiong, Y. Q., Willard, J., Kadurugamuwa, J. L., Yu, J., Francis, K. P., Bayer, A. S. Real-time in vivo bioluminescent imaging for evaluating the efficacy of antibiotics in a rat Staphylococcus aureus endocarditis model. Antimicrob. Agents Chemother. 49, 380-387 (2005).
- Peerschke, E. I., Bayer, A. S., Ghebrehiwet, B., Xiong, Y. Q. gC1qR/p33 blockade reduces Staphylococcus aureus colonization of target tissues in an animal model of infective endocarditis. Infect. Immun. 74, 4418-4423 (2006).
- Ganesh, V. K., Rivera, J. J., Smeds, E. A structural model of the Staphylococcus aureus ClfA-fibrinogen interaction opens new avenues for the design of anti-staphylococcal therapeutics. PLoS Pathog. 4, e1000226(2008).
- Boles, B. R., Horswill, A. R. Staphylococcal biofilm disassembly. Trends Microbiol. , (2011).
- Tseng, C. W., Sanchez-Martinez, M., Arruda, A., Liu, G. Y. Subcutaneous Infection of Methicillin Resistant Staphylococcus Aureus (MRSA). J. Vis. Exp. (48), e2528(2011).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon