Method Article
Introduzione alla membrana supportata Solid Sulla Elettrofisiologia
In questo articolo
Riepilogo
Qui vi presentiamo un metodo elettrofisiologico basata su solide membrane supportati con attenzione le sue applicazioni per la caratterizzazione dei trasportatori di membrana elettrogeniche.
Abstract
Il metodo elettrofisiologico che presentiamo si basa su una membrana solida supportato (SSM) costituito da uno strato OCTADECANETIOLO chemisorbita rivestito su un chip del sensore oro e un monostrato fosfatidilcolina in cima. Questo gruppo è montato in un sistema cuvetta contenente l'elettrodo di riferimento, un filo d'argento clorurato.
Dopo adsorbimento di frammenti o proteoliposomi contenenti la proteina di membrana di interesse membrana, uno scambio veloce soluzione è usato per indurre l'attività di trasporto della proteina di membrana. Nel singolo soluzione Exchange Protocol due soluzioni, una non-attivazione e una soluzione di attivazione, sono necessari. Il flusso è controllato da aria pressurizzata e un sistema di valvole e tubazioni all'interno di una gabbia di Faraday.
La cinetica dell'attività di trasporto elettrogenica è ottenuta mediante accoppiamento capacitivo tra la SSM ei proteoliposomi o frammenti di membrana. Il metodo, quindi, produce solo transient correnti. La corrente di picco rappresenta l'attività di trasporto stazionaria. I tempi correnti trasportatori dipendenti possono essere ricostruite attraverso l'analisi del circuito.
Questo metodo è particolarmente adatto per trasportatori procariote o trasportatori eucariotiche da membrane intracellulari, che non possono essere studiati da patch clamp o metodi clamp di tensione.
Introduzione
Qui mostriamo un nuovo approccio elettrofisiologico basato su una solida membrana sostenuta (SSM) per la caratterizzazione di proteine di membrana elettrogeniche.
Il supporto solido costituito da un sottile strato d'oro su un vetrino, il chip del sensore. La superficie d'oro idrofilo viene utilizzato per legare il gruppo tiolico di un reagente alcanethiol. Successivamente, selfassembly di un monolyer fosfatidilcolina completa la formazione della SSM.
Per misurare le reazioni elettrogeniche di proteine di membrana, proteoliposomi o frammenti di membrana sono adsorbite alla SSM (Figura 1). La proteina contenente membrana e la SSM poi formare un sistema a membrana capacitivamente accoppiato. Pertanto, traslocazione carica al membrana contenente proteina può essere rilevata mediante accoppiamento capacitivo attraverso il SSM. Questo metodo produce solo correnti transitorie. La corrente di picco rappresenta l'attività di trasporto stazionaria. Il tempo dipende trasportatore currents possono essere ricostruite attraverso l'analisi del circuito.
Il chip sensore è montato in un sistema cuvetta (Figura 2). La vaschetta ha un volume della cuvetta cilindrica di 17 ml (volume netto con o-ring montato). Un pin di contatto a molla crea il contatto con l'amplificatore. Un connettore di uscita è avvitato alla parte superiore della parte principale e porta l'elettrodo di riferimento, un filo d'argento clorurato.
La cuvetta è montato in una gabbia di Faraday. Esso è collegato ad un percorso di fluido, che viene utilizzato per indurre l'attività di trasporto della proteina di membrana in risposta ad uno scambio veloce soluzione (figura 3). Nel singolo soluzione Exchange Protocol due soluzioni, una non-attivazione e una soluzione di attivazione, sono obbligatori. Il flusso è controllato da aria in pressione mediante un software di controllo valvola su un computer o interruttori manuali su una scatola di interfaccia.
Protocollo
1. Impostazione di un apparato per SSM-based Elettrofisiologia
I dettagli sono forniti in due delle nostre pubblicazioni tecniche, che contengono anche disegni schematici e le fotografie dei nostri cuvette e impostare 1, 2. Diverse configurazioni di scambio di soluzioni e protocolli di flusso sono discussi anche nel nostro documento metodo 2.
Nel seguito si aggiungono alcuni miglioramenti recenti e dettagli tecnici che sono di diretta rilevanza per il video di presentazione.
Controllo della valvola e l'acquisizione dei dati
La scatola contiene una interfaccia di uscita / interfaccia USB commerciale digitale di ingresso analogico (NI 6009 NI USB) e dei driver delle valvole. Esso controlla il flusso della soluzione ed è responsabile per l'acquisizione dati. Le valvole sono normalmente guidati con 12 V. Tuttavia, per una rapida commutazione delle valvole possono essere guidati con una tensione massima di 18 V. Nel video si usa un alimentatore a 12 V.
Il circuito driver di valvola può operare quattro valvole. E 'stato prodotto dalla bottega del Max Planck Institute di Biofisica. Le valvole possono essere controllati da computer o manualmente tramite switch sul pannello frontale. Quest'ultimo è utile per la pulizia-procedure-e vampate di calore. Durante la misura, la scatola di interfaccia è controllato dal computer utilizzando una valvola di controllo e software di acquisizione dati (Surfe 2 software R, IonGate Biosciences).
2. Preparativi
In questa sezione sono indicati i diversi protocolli per la preparazione di un esperimento di elettrofisiologia SSM-based.
2.1 Rendere la soluzione di lipidi per la formazione del SSM
- Miscelare 25 pl octadecilammina (5 mg / ml di cloroformio) e 375 Diphytanoylphosphatidylcholine microlitri (20 mg / ml di cloroformio) in una fiala glas.
- Utilizzando un evaporatore rotante e il flusso continuo di gas azoto, si evapora il cloroformio percirca 30 min.
- Rimuovere il lipide dalle pareti della fiala di vetro agitando con 500 ml di n-decano. La concentrazione di lipidi finale è di 15 mg / ml con 1:60 (w / w) octadecilammina.
- Trasferire la soluzione nella fiala di vetro di stoccaggio. Conservare la soluzione lipidica a -20 ° C.
2.2 clorazione dell'elettrodo di riferimento
Gli elettrodi di riferimento devono essere clorurato ad intervalli regolari per abrasione.
- Togliere il resto del vecchio strato silverchloride utilizzando carta abrasiva fine prima che il processo di clorazione.
- Posizionare il filo d'argento con un elettrodo di platino in una soluzione M di acido cloridrico 1 e cloro per 15 min a 0,5 mA. Dopo aver completato clorazione, il filo di argento cambia colore ad un grigio scuro omogeneo.
2.3 Preparazione del ponte gel di poliacrilammide
- Preparare una soluzione contenente 100 mM KPI a pH = 7, 100 mM KCl e 6% Acrilammide.
- Aggiungere 0,3% APS (10% Archivio) e 0,6% TEMED e poco miscelare la soluzione con una pipetta.
- Immediatamente dopo la miscelazione della soluzione, utilizzare una pipetta per iniettare 30 microlitri della miscela nel contenitore vuoto ponte gel. È importante evitare bolle d'aria durante l'iniezione.
- Durante un tempo di incubazione di 20 min gel polimerizza.
- Dopo la polimerizzazione il ponte gel è memorizzato in soluzione (100 mM pH 7 KPI, 100 mM KCl). Per prolungare la durata di vita del ponte gel la soluzione viene conservata a 4 ° C.
2.4 Preparazione delle soluzioni di misura
A causa della forte interazione dei soluti con il SSM, artefatti elettrici sono generati quando le soluzioni di diversa composizione vengono scambiati. Pertanto, la preparazione delle soluzioni è un passaggio fondamentale. Adottare le seguenti precauzioni durante il processo di preparazione della soluzione per ridurre al minimo gli artefatti di scambio di soluzione.
- Make non attivando e attivando soluzioni da un lotto, regolare il pH e forza ionica.
- Sfondo di sale aiuta a ridurre i tassi di artefatti soluzione.
- Dividere la soluzione lotto in due volumi.
- Aggiungere il composto attivante alla soluzione attivante. Usare un preparato compensativo nella soluzione non-attivante per mantenere l'osmolarità e forza ionica di entrambe le soluzioni il più possibile simili.
- Se le soluzioni sono conservati a 4 ° C, assicurarsi che tutte le soluzioni hanno raggiunto la temperatura ambiente prima di iniziare una misurazione, perché anche piccole differenze di temperatura possono produrre artefatti.
3. Un esperimento Elettrofisiologia SSM-based
Qui vi presentiamo un protocollo tipico per un esperimento elettrofisiologico SSM-based.
3.1 Preparazione del Setup SSM
Mentre l'installazione SSM non è in uso, i tubi sono riempiti con un etanolo al 30%Soluzione / acqua per evitare la crescita batterica.
- Lavare il sistema con acqua pura per eliminare l'etanolo dal tubo prima di montare la cuvetta. Sostituire i contenitori etanolo con contenitori per l'acqua. Utilizzando ad alta pressione (da 0,6 a 1,0 bar) pulire il sistema con 20-30 ml di acqua.
- Ripetere la procedura di pulizia utilizzando un buffer di 100 mM KPI a pH 7.6 o soluzione non attivante.
- Assicurarsi che non rimangano bolle d'aria nel sistema fluido.
3.2 Montaggio della cuvetta
- Fissare un o-ring per l'elettrodo di riferimento
- Prendete il ponte di gel dalla soluzione di storage e collegare l'elettrodo di riferimento.
- Prefill il raccordo di uscita con tampone non-attivante, inserire un o-ring e collegare il ponte gel per completare il gruppo elettrodo di riferimento. Faccia particolare attenzione che non vi siano bolle d'aria al bivio del ponte di gel e la presa di soluzione flusso percorso.
- Preassemblare la parte principale della cuvette aggiungendo il perno di contatto a molla (collegamento all'amplificatore), il tubo di ingresso (collegamento alla valvola terminale), l'anello di tenuta (tenuta per la SSM) e le viti.
- Utilizzando una pinzetta, prendere il chip del sensore dalla soluzione di memorizzazione (10 mM OCTADECANETIOLO in etanolo).
- Usando una pipetta, lavare la soluzione rimanente con ca. 5 ml di etanolo puro.
- Asciugare l'elettrodo sotto azoto.
- Posizionare il chip del sensore con precisione sulla parte di base della cuvetta in modo che il foro di ingresso della parte principale della cuvetta è diretto verso l'area attiva del sensore circolare.
- Aggiungere 1 ml della soluzione lipidica all'area attiva del chip sensore. Accertarsi che lo strato di oro è interamente coperto dalla lipidico.
- Immediatamente dopo l'aggiunta della soluzione lipidica, chiudere la cuvetta aggiungendo la parte principale preassemblato.
- Prima di montare la cuvetta nella gabbia di Faraday, assicurarsi che tutte le superfici siano completamente asciutti.
- Connect dell'amplificatore al pin di contatto a molla e il tubo di ingresso alla valvola terminale. Quindi fissare la provetta con le viti all'interno della gabbia di Faraday.
- Avvitare il raccordo di uscita all'inizio della cuvetta. Infine collegare il tubo di uscita per il raccordo di uscita ed il generatore di tensione all'elettrodo di riferimento.
- Immediatamente dopo il montaggio della cuvetta lavare il sistema con tampone a 0,6 bar. Ciò porta alla formazione spontanea SSM.
3.3 Parametri di membrana di misura
Per verificare la qualità della SSM, capacità e conduttanza sono misurate utilizzando il generatore di funzioni.
- Utilizzando il generatore di funzioni, applicare 100 mV tensione in CC per misurare la conduttanza.
- Calcolare la conduttanza: Il decadimento attuale dimostra la carica del condensatore membrana. Dopo il condensatore è completamente carica i rendimenti attuali misurati la conduttanza della membrana utilizzando la legge di Ohm. Per ragioni di semplicità usiamo la current 1 sec dopo che la tensione è applicata per calcolare la conduttanza G = I / U.
- Applicare una tensione alternata triangolare di 50 mV picco a picco ampiezza e la frequenza di 0,5 Hz per misurare la capacitanza.
- Calcolare la capacità: L'ampiezza della corrente risultante onda quadra rappresenta le correnti di carica del condensatore. La capacità C è uguale alla carica trasferita Q = IΔt diviso ΔU = 100 mV. (ΔU è due volte la tensione applicata di 50 mV perché I è la corrente differenza di pendenza positiva minus negativo della tensione triangolare.)
- Monitorare i parametri elettrici della membrana ripetutamente ogni 10 min per ca. 30 e 40 minuti, fino a raggiungere valori costanti. Lavare con tampone tra Kpi ad alta pressione nell'intervallo da circa 0,6 a 1 bar.
- Stimare la qualità del SSM: Parametri ottimali sono nell'intervallo da 0,1 a 0,2 ns e 2-3,5 nF. Un alto conduttanza sopra 0,8 nS e bassa capacità al di sotto di 1 nF indicache la SSM non si forma correttamente. Un alto capacitanza 4 nF sopra può comportare che la zona attiva non è coperto completamente dal SSM.
- Se i parametri non sono nel range ottimale, la membrana deve essere scartata ed un'altra SSM preparato, utilizzando un chip appena preparato elettrodo.
3.4 Controllo di scambio artefatti soluzione
Dopo che i parametri di membrana sono stati controllati, i buffer di misura dovrebbero essere testati per i tassi di artefatti soluzione.
- Inserire i rispettivi contenitori soluzione del sistema fluido.
- Rimuovere le bolle d'aria dal sistema fluido, utilizzando le valvole manuali.
- Utilizzando il software di acquisizione dati ha scelto il protocollo di flusso che si desidera utilizzare nel vostro esperimento.
- Regolare la pressione a 0,6 bar e avviare la misurazione.
- A parte gli artefatti di commutazione delle valvole meccaniche, idealmente non correnti artefatti dovrebbero essere misurati o dovrebbero essere molto smaller che i segnali della proteina di trasporto previsti. Se si osservano tassi di artefatti soluzione, cercare di ottimizzare le composizioni di buffer e / o la procedura di preparazione prima di continuare l'esperimento.
3.5 Aggiunta del campione di proteine
Di solito proteoliposomi o frammenti di membrana sono conservati congelati a -80 ° C. Per una misurazione è necessaria una aliquota di circa 30 microlitri.
- Sciacquare la SSM con soluzione non attivante.
- Scongelare il campione di proteine in ghiaccio.
- Tre cicli di sonicazione di 10 secondi si alternano a intervalli di 10 secondi di raffreddamento sul ghiaccio. Proteoliposomi sono sonicati utilizzando un bagno di sonicazione. Per i frammenti di membrana è usato un sonicatore punta (50W, 30 kHz, 1 mm di diametro sonotrode, intensità 20%, ciclo di 0,5). Dopo l'ultimo passo sonicazione non mettere il campione torna sul ghiaccio, ma iniettare immediatamente nella cuvetta.
- Svitare il connettore della presa insieme al elettrodo di riferimento asseMBLY.
- Usando una pipetta, aspirare 30 ml del campione di proteine e montare la punta della pipetta alla presa di annoiarvi.
- Aprire la valvola manuale nella via non-attivante al contenitore dei rifiuti e iniettare i liposomi nel volume della cuvetta. Fare attenzione a non iniettare aria nel volume della cuvetta con il sensore.
- Prima di rimuovere la punta della pipetta, chiudere la valvola manuale per evitare l'ulteriore flusso di soluzione.
- Lasciare le proteoliposomi di adsorbimento al SSM per un tempo di incubazione di 1-2 ore. È anche possibile incubare durante la notte.
3.6 Procedura generale di un esperimento SSM-based
- Scaldare i buffer di misura nel tempo, se conservato a 4 ° C. Tutti i tamponi di misura devono essere a temperatura ambiente prima di iniziare la misurazione per evitare artefatti.
- Quando si cambiano le soluzioni, prima pulire i tubi all'interno dei contenitori di soluzione con un tessuto non-fuzzing, quindi inserire le nuove bottiglie.
- Prima di avviare la misurazione, utilizzare le valvole manuali per rimuovere le bolle d'aria, che potrebbero sono evoluti dalla procedura di modifica.
- Regolare la pressione poco prima di iniziare una misurazione. Noi abitualmente uso una pressione di 0,6 bar, che a nostra valvola e tubo specifica configurazione produce una velocità di flusso di 1,0 ml / sec.
- Le prime misurazioni possono essere effettuate direttamente uno dopo l'altro e dovrebbero essere rifiutati fino alla corrente di picco rimane costante. Se le soluzioni differiscono pH un tempo di incubazione per almeno 3 minuti è necessario per regolare il pH interno delle proteoliposomi prima della misurazione.
- Ora il set up è pronto per la misura. Per ridurre il rumore di almeno 3 misurazioni devono essere effettuate e media.
3.7 Misure di controllo
Una carrellata segnale durante una serie di misurazioni potrebbe verificarsi a causa di degradazione della proteina o una perdita di adsorbimento. Ogni esperimento deve SSM iNCLUDE un controllo fatiscente. Questo è fatto da misurazioni ripetute con soluzioni identiche. Il controllo avvitatura minima significa una misurazione all'inizio e uno alla fine dell'esperimento, utilizzando la stessa soluzione.
Si consiglia di fare il controllo della riduzione di attività in condizioni in cui ci si aspetta la massima ampiezza di picco nell'esperimento. Questo rende più facile quantificare la riduzione di attività del segnale.
La carrellata di segnale può essere quantificata da un confronto tra le ampiezze di picco dei due controlli fatiscenti. Il valore percentuale risultante può essere utilizzato per correggere i segnali misurati ipotizzando un tempo di dipendenza lineare della avvitatura.
3.8 Controlli Artefatto
Se possibile, cercare di convalidare i risultati per inibire la proteina di interesse dopo l'esperimento. Segnali rimanenti sono probabilmente tassi artefatti soluzione. I segnali devono poi essere corretti per i manufatti misurati.
3.9 Dopo l'esperimento
- Lavare il sistema con 20-30 ml di acqua pura e 20-30 ml di 30% di etanolo / acqua. La soluzione etanolica evita la crescita batterica quando il sistema non è in uso.
- Dopo questa procedura di pulizia, togliere la pressione dal sistema e spegnere tutti gli strumenti.
- Rimuovere la cuvetta dalla gabbia di Faraday e toglierla. Tutte le parti della cuvetta possono essere pulite con acqua ed etanolo puro, se necessario, utilizzando un bagno sonicatore.
- Posizionare il chip del sensore in un bicchiere di vetro con etanolo puro. Sonicazione il becher per circa 1 a 2 minuti usando un bagno sonicatore.
- Asciugare il chip del sensore sotto azoto.
- Memorizzare il chip sensore lontano dalla luce in una soluzione etanolica Octadecanthiol 10 mM. Dopo un tempo di incubazione di circa 30 min chip del sensore è pronto per il riutilizzo.
Risultati
Fino ad ora, SSM basata elettrofisiologia stato usato per caratterizzare più di 20 trasportatori, principalmente di origine procariotica, es melb 3, 4 e Nhaa PutP 5 (riassunti in 6). Ma anche i trasportatori eucariotiche da membrane intracellulari, come ad esempio ClC7 7 così come i canali ionici, ad esempio il recettore nicotinico 8 sono stati indagati.
Qui vi presentiamo come esempio misurazioni dello zucchero / H + cotrasportatore Lacy da Escherichia coli utilizzando proteoliposomi con almeno il 85% sul dritto orientata Lacy in un LPR 5 9, 10. Ci concentriamo sulle principali fasi che portano ad un modello minimo cinetica di questa proteina di trasporto.
1. Caratterizzazione elettrofisiologica di tipo selvatico Lacy
Il primo passo è la caratterizzazione generale della reazione elettrogenica misurando diversi valori di pH ( > Figura 4), concentrazioni di substrato (Figura 5) e substrati. Per convalidare la tecnica, K valori del pK M e dato in letteratura sono stati riprodotti.
Il pH dipendenza di Lacy mostra due differenti reazioni elettrogeniche. Gli aumenti di corrente capacitiva accoppiata tra pH 5 e pH 8.5, ma anche cambia la sua forma. In ambiente alcalino si osserva trasporto stato stazionario, mentre per valori di pH acido solo una reazione elettrogenico rapida rimane. Per distinguere i segnali di stato stazionario dalle rapide reazioni elettrogeniche abbiamo usato l'analisi del circuito di ricostruire le correnti trasportatore (Figura 6).
A pH 7 il segnale diventa monofasico bifasica. Questo indica anche che ci sono due differenti reazioni elettrogeniche. Stimata dalla carica trasferita (integrale dei segnali), le due reazioni sono circa il 6% e il 94% del electrogenicity totale del ciclo di trasporto.
ove_step "> 2. Assegnazione delle reazioni elettrogenichePer assegnare le due reazioni elettrogeniche a particolari fasi del ciclo di reazione di Lacy, la variante Lacy E325A è stata misurata (Figura 7). Questa variante mostra solo scambio lattosio ma è carente per tutti i modi di trasporto attive, a causa della inibizione del rilascio di protoni. Il segnale di E325A Lacy rappresenta un transitorio veloce ed è costante per tutti i valori di pH misurati. La forma e ampiezza del segnale è simile al segnale di tipo selvatico Lacy in condizioni acide. Inoltre si osserva una piccola fase negativa dopo il picco di corrente diminuisce, che è caratteristico per correnti transitorie rapide misurate in sistemi accoppiati capacitivamente. Perché lattosio vincolante e rilascio non è elettrogenico, il transitorio veloce deve correlarsi con una transizione conformazionale elettrogenico seguendo lattosio vincolante.
È noto che la fase di rilascio protone è tasso Limiting per fatturato Lacy nella modalità di trasporto guidato lattosio gradiente di concentrazione. In questo caso ci aspettiamo un aumento del tasso di trasporto con pH alcalino, in quanto il rilascio di protoni è favorita. Questo è il caso per il trasporto stato stazionario del segnale di tipo selvatico Lacy correlato. Inoltre si potrebbe dimostrare mediante misurazione gradiente di pH che solo il pH interno influenza il trasporto costante stato di Lacy (non pubblicato). Pertanto la reazione di grandi dimensioni elettrogenica potrebbe essere assegnato alla fase di rilascio protone.
3. Misure per l'analisi cinetica
Dopo l'identificazione delle reazioni elettrogeniche e fuori prezzi di trasporto, sono stati determinati utilizzando un programma di installazione SSM con una risoluzione elevata di tempo di circa 4.5 msec. Questo è possibile solo in condizioni, quando una reazione domina il segnale. In questo caso le costanti di velocità possono essere derivate dalle correnti transitorie in esame della risoluzione temporale dei segnali utilizzando un iterativo ai minimi quadrati de algoritmo di convoluzione (Figura 8). Le costanti di velocità determinate così come il modello cinetico minima proposta (Figura 9), infine, sono stati utilizzati per la simulazione della cinetica trasportatore. Le curve simulate riproducono i dati SSM che dimostra ulteriormente il modello cinetico.

Figura 1. Adsorbimento geometria proteoliposomi sul SSM. L'SSM si forma su un chip sensore, un oro rivestito vetrino strutturato. Per misurare le reazioni elettrogeniche di proteine di membrana, proteoliposomi o frammenti di membrana sono adsorbite alla SSM. Le due membrane formano un sistema accoppiato capacitivamente. Questo è il motivo per cui vengono rilevate solo le correnti transitorie.
tp_upload/50230/50230fig2highres.jpg "/>
Figura 2. L'SSM cuvetta porta il chip del sensore e l'elettrodo di riferimento. Il chip sensore è inserito tra la base e la testa cuvetta cuvetta. L'elettrodo di riferimento è isolato dal percorso di flusso da un gel di poliacrilammide ponte salino.
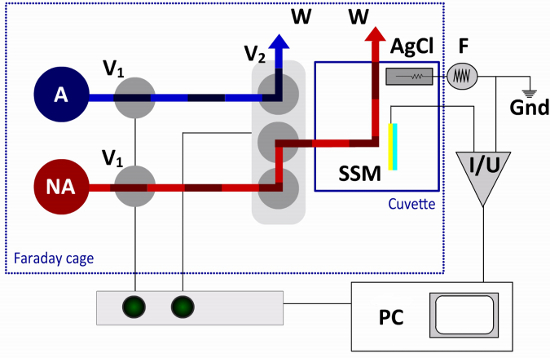
Figura 3. Pathway fluido e circuito elettrico della Setup SSM. Nel protocollo singolo scambio soluzione sono necessari solo un non-attivante (NA) e una attivazione (A) soluzione. Il flusso è controllata da due valvole a due vie (V1) e una valvola terminale (V2). La valvola commuta tra terminali soluzioni non attivanti ed attivando, dirigendo una delle soluzioni alla cuvetta e l'altra soluzione per un contenitore di rifiuti (W). Il chip sensore (SSM) è collegato all'amplificatore (I / U), mentre l'elettrodo di riferimento (AgCl) è collegato al generatore di funzioni (F) nel circuito elettrico esterno. Un computer (PC) e una scatola di interfaccia sono utilizzati per il funzionamento della valvola e acquisizione dati.
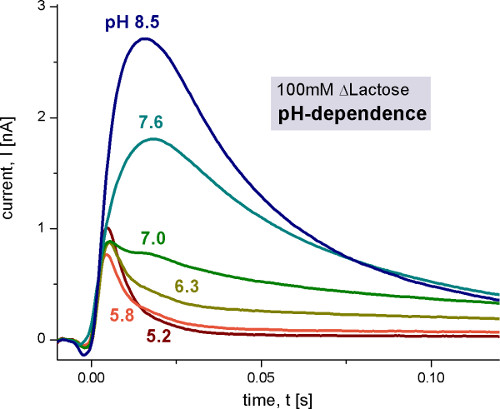
Figura 4. Correnti transitorie misurate con wild-type proteoliposomi Lacy dopo 100 mm lattosio salti di concentramento di diversi valori di pH. La soluzione non-attivante contenevano 100 mM di glucosio, mentre la soluzione attivante conteneva 100 mM lattosio. Tutte le soluzioni sono state preparate in 100 mM tampone fosfato di potassio a pH indicato con 1 mM DTT. Per i dettagli delle condizioni di misura in questa e le seguenti figure si rimanda a 9 e 10.
ftp_upload/50230/50230fig5highres.jpg "/>
Figura 5. Medi correnti di picco normalizzato misurati con wild-type proteoliposomi Lacy dopo salta concentramento lattosio a diverse concentrazioni e dei valori di pH. I valori di K M sono stati ottenuti dai fits iperboliche.
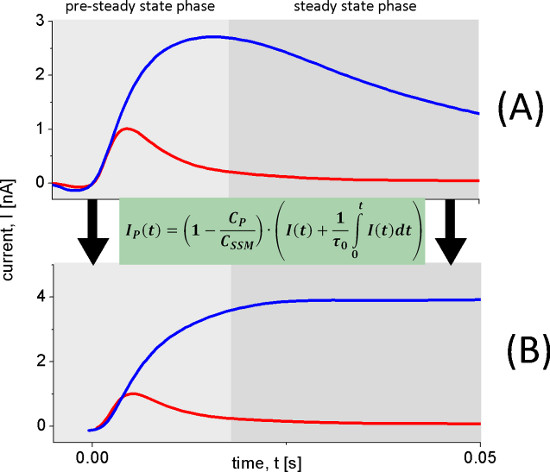
Figura 6. Ricostruzione delle correnti trasportatore. Le correnti transitorie (A) per ricostruire le correnti trasportatore (B) sono stati misurati con la wild-type proteoliposomi Lacy dopo 100 mm lattosio salti di concentramento a pH 8.5 (traccia blu) e pH 5.2 (traccia rossa). A pH 8,5 continuo turnover si osserva mentre a pH 5.2 si verifica una reazione elettrogenico veloce. Questo è chiaramente osservato nel corrente ricostruita (B).
files/ftp_upload/50230/50230fig7.jpg "alt =" Figura 7 "fo: contenuti-width =" 4in "fo: src =" / files/ftp_upload/50230/50230fig7highres.jpg "/>
Figura 7. Transitorio di corrente misurata con E325A proteoliposomi Lacy dopo un salto di 100 mM lattosio concentrazione a pH 5.2. Questa variante Lacy è inibita in fase di rilascio di protoni del ciclo di trasporto e quindi il trasporto-carenti. La piccola componente negativa osservata è caratteristica per correnti transitorie rapide misurate in modo capacitivo sistemi accoppiati ed è causato dalla scarica della capacità di membrana dopo una reazione elettrogenico veloce. Sua costante π0 tempo è determinata dalle capacità e delle conduttanze del sistema (Figura 1).
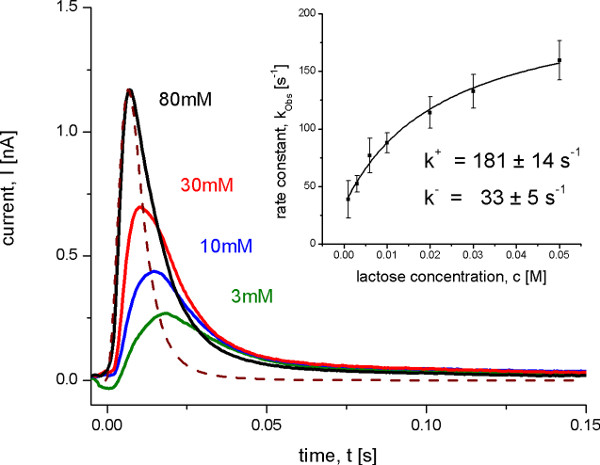
Figura 8. Correnti transitorie misurate con wild-type proteoliposomi Lacy after diversi salti di concentrazione di lattosio a pH 5.2. In queste condizioni nessun trasporto stato stazionario si osserva, ma una transizione conformazionale elettrogenico su lattosio vincolante. La linea tratteggiata mostra la funzione di trasferimento che rappresenta la risoluzione temporale del sistema. L'inserto mostra la determinazione del tasso di on e off costanti dal tasso osservati costanti kobs con una misura iperbolica ai dati. La costante di velocità osservata è stata determinata dalle correnti transitorie con un algoritmo di deconvoluzione iterativi minimi quadrati 10.
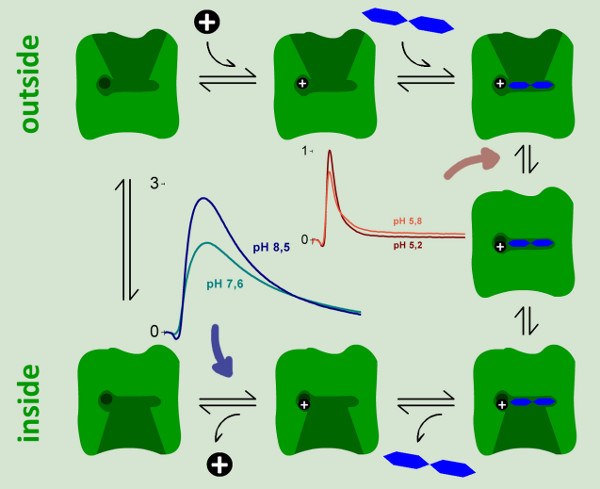
Figura 9. Un modello cinetico per il ciclo di reazione di Lacy. Due passi elettrogeniche potrebbe essere identificato e caratterizzato da misure di SSM. Una reazione fortemente elettrogenico rappresentando ~ 94% dello spostamento carica totale nella reazioneciclo si osserva solo a valori di pH neutro e di base. Potrebbe essere assegnato al passo di rilascio protone (freccia blu). Un passo debolmente elettrogenico viene osservata a pH acido, quando turnover continuo di wild-type Lacy è inibita. Abbiamo assegnato questa reazione ad una transizione conformazionale elettrogenico upon lattosio vincolante, che rappresenta il 6% del dislocamento carica totale nel ciclo di reazione.
Discussione
1. Vantaggi di elettrofisiologia SSM-based rispetto ai metodi convenzionali
Elettrofisiologia SSM-based si è dimostrata un valido strumento della casella degli strumenti elettrofisiologico. E 'particolarmente utile nei casi in cui convenzione elettrofisiologia, e cioè patch clamp e metodi clamp di tensione, non può essere applicato: A parte qualche rara eccezione trasportatori batterici non possono essere studiati usando morsetto di tensione o di metodi di patch clamp a causa delle piccole dimensioni dei batteri e perché sono difficili da esprimere in cellule di mammifero o ovociti. Ma anche fisiologicamente rilevanti trasportatori di mammifero possono essere esaminati. In questo caso elettrofisiologia SSM-based è attraente per i trasportatori di membrane intracellulari e per applicazioni di screening nella scoperta della droga per la sua robustezza e la sua potenzialità per l'automazione.
SSM-basedUsing convenzionale elettrofisiologia, ora risolto caratterizzazione di trasporters è impegnativo. Dal momento che il fatturato dei trasportatori è basso un 'cerotto gigante' o è necessaria la configurazione di un 'intera cellula', che hanno una risoluzione di intrinsecamente bassa volta in un esperimento di scambio soluzione. La complicazione può essere superato utilizzando rilascio substrato fotolitico. Tuttavia, solo un numero limitato di substrati sono adatti per questo approccio. Qui il tasso di rapida soluzione al SSM offre l'opportunità unica di effettuare studi elettrofisiologici con una risoluzione temporale elevata utilizzando substrati arbitrari.
2. Limitazioni e passaggi critici
In contrasto patch clamp e tecniche di voltage clamp, elettrofisiologia SSM-based non può essere usato per applicare un potenziale. Caratterizzazione Transporter è pertanto limitata ai modi, che non si basano su un potenziale di membrana trasportare.
In generale, elettrofisiologia SSM-based ha limitazioni sul tipo di trasportatore (elettrogenica). Ma cl tensioneamp o di patch clamp metodi possono avere vantaggi, se sono necessari componenti intracellulari come proteine leganti per la funzionalità delle proteine.
Limitazioni possono sorgere, se scambio soluzione crea grandi correnti artefatto. Ciò accade quando il substrato interagisce fortemente con la SSM come nel caso di composti lipofili. Controlli artefatto possono essere utilizzati per correggere i segnali misurati. Inoltre elevato background sale in tutti i buffer di misura può essere usato per ridurre gli artefatti. Ma nei casi in cui le dimensioni del manufatto è paragonabile al segnale proteina, è quasi impossibile isolare il segnale correlato proteina dal manufatto. Fortunatamente, alta artefatti sono insoliti in uno scambio soluzione ottimizzata.
Ci sono alcuni passaggi che sono fondamentali per la riuscita realizzazione di un esperimento di elettrofisiologia SSM-based. La preparazione del campione di proteine è la parte più importante. Se si utilizzano proteoliposomi, accertarsi che i reconsprocesso prostituzione produce un ambiente pulito, campione riproducibile di una sufficiente LPR e il trasportatore è orientata in modo corretto. La LPR può essere controllata freeze frattura microscopia elettronica e di orientamento da un esperimento ELISA se gli anticorpi sono disponibili.
Utilizzare solo un SSM che mostra i parametri ottimali per l'incubazione del campione proteico. L'iniezione della proteina è un altro aspetto critico. Sonicazione è essenziale e bolle d'aria deve essere evitato durante l'iniezione. Dopo incubazione le misurazioni campione stesso sono critiche, poiché le bolle d'aria si rimuovere il campione proteina adsorbita dal chip sensore. Quindi togliere sempre le bolle d'aria dopo aver cambiato le soluzioni. Tuttavia una carrellata segnale può verificarsi. Per correggere un eventuale segnale carrellata, è essenziale per realizzare controlli degradate durante l'esperimento.
3. Sistemi specializzati
L'SSM-Setup può essere modificato in base alla sua applicazione. Inoltre tqui sono completamente diverse, configurazioni altamente specializzati disponibili.
C'è la possibilità di misurare segnali proteici in condizioni asimmetriche, ad esempio sotto un gradiente di pH. Per stabilire composizioni tampone asimmetriche dentro e fuori le proteoliposomi una terza soluzione, la soluzione di riposo, deve essere introdotto e questo richiede una configurazione a doppio scambio. Qui è necessaria una valvola supplementare a tre vie di commutazione tra le soluzioni non-attivazione e di riposo.
Per aumentare la risoluzione temporale del sistema abbiamo sviluppato un percorso di flusso alternativo privo della valvola terminale, ma utilizzando un diverso tipo di cuvetta. Qui la giunzione di attivazione e soluzione non attivante si trova all'interno della cuvetta, 3 mm davanti al SSM. Questa configurazione è particolarmente adatta per l'analisi cinetica dei processi di trasporto veloci. Si è potuto dimostrare che una risoluzione di tempo a partire da 2 msec è possibile.
F Commercialeully sistemi automatizzati sono disponibili puntando ad una velocità significativamente più alto per lo screening farmacologico. Unità mobile soluzioni raccoglie e li inserisce sulla superficie del sensore in piastre da 96 pozzetti in un formato standard micropiastra.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Ringraziamo J. Garcia-Celma, io Smirnova e R. Kaback per i contributi per le misure Lacy e E. Bamberg per il supporto e discussioni utili.
Materiali
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Waterbath Sonicator | Bandelin | RK 52 H | |
| Tip Sonicator | Hielscher Ultrasonics GmbH | UP50H | |
| 2-way valve | NResearch, West Caldwell, USA | NR225T011 | |
| Terminal valve | NResearch, West Caldwell, USA | NR225T031 | |
| Manometer | Greisinger electronics | GDH 14 AN | |
| Faraday cage | Max Planck Institute of Biophysics | ||
| Cuvette | Max Planck Institute of Biophysics | ||
| 100 ml solution containers | Kartell | 1623 | |
| O-rings | Seal Science Inc. | ||
| Oscilloscope | Tektronix | TDS 1002 | |
| Reference electrode | Max Planck Institute of Biophysics | ||
| Function generator | Max Planck Institute of Biophysics | ||
| Tubings | SAINT-GOBAIN Performance Plastics | AAC00006 | |
| Sensor chip | Fraunhofer Institut für Schicht und Oberflächentechnik | ||
| Interface box | Max Planck Institute of Biophysics | ||
| Amplifier | Keithley | 427 | |
| Manual cog | Vygon GmbH | 876 | |
| USB analog-to-digital converter | National Instruments | 6009 | |
| Regeants | |||
| 1,2‑Diphytanoyl-sn-glycero-3-Phosphatidylcholine | Avanti Polar Lipids, Inc. | 850356 | |
| Acrylamide/Bis-acrylamide | Sigma Aldrich | A3574 | |
| Ammonium persulfate | Sigma Aldrich | A3678 | |
| D-(+)-Glucose | Sigma Aldrich | G8270 | |
| Dithiothreitol | Sigma Aldrich | 43819 | |
| Ethanol absolut | VWR AnalaR NORMAPUR | 603-002-00-5 | |
| Natural E. coli lipids polar extract | Avanti Polar Lipids, Inc. | 100600 | for LacY reconstitution |
| n-Decane | Sigma Aldrich | D901 | |
| Octadecanethiol | Sigma Aldrich | O1858 | |
| Octadecylamine | Sigma Aldrich | 74750 | |
| Potassium chloride | Merck | 1049360500 | |
| Potassium phosphate dibasic | Sigma Aldrich | P3786 | |
| Potassium phosphate monobasic | Sigma Aldrich | P9791 | |
| Tetramethylethylenediamine | BIO RAD | 1610801 | |
| α-Lactose monohydrate | Sigma Aldrich | L8783 | |
Riferimenti
- Seifert, K., Fendler, K., Bamberg, E. Charge transport by ion translocating membrane proteins on solid supported membranes. Biophys. J. 64, 384-391 (1993).
- Schulz, P., Garcia-Celma, J. J., Fendler, K. SSM-based electrophysiology. Methods. 46, 97-103 (2008).
- Garcia-Celma, J. J., et al. Rapid activation of the melibiose permease MelB immobilized on a solid-supported membrane. Langmuir. 24, 8119-8126 (2008).
- Mager, T., Rimon, A., Padan, E., Fendler, K. Transport mechanism and pH regulation of the Na+/H+ antiporter NhaA from Escherichia coli: an electrophysiological study. J. Biol. Chem. 286, 23570-23581 (2011).
- Zhou, A., et al. Charge translocation during cosubstrate binding in the Na+/proline transporter of E.coli. J. Mol. Biol. 343, 931-942 (2004).
- Ganea, C., Fendler, K. Bacterial transporters: charge translocation and mechanism. Biochim. Biophys. Acta. 1787, 706-713 (2009).
- Schulz, P., Werner, J., Stauber, T., Henriksen, K., Fendler, K. The G215R mutation in the Cl-/H+-antiporter ClC-7 found in ADO II osteopetrosis does not abolish function but causes a severe trafficking defect. PLoS ONE. 5, e12585(2010).
- Schulz, P., Dueck, B., Mourot, A., Hatahet, L., Fendler, K. Measuring ion channels on solid supported membranes. Biophys. J. 97, 388-396 (2009).
- Garcia-Celma, J. J., Smirnova, I. N., Kaback, H. R., Fendler, K. Electrophysiological characterization of LacY. Proc. Natl. Acad. Sci. U.S.A. 106, 7373-7378 (2009).
- Garcia-Celma, J. J., Ploch, J., Smirnova, I., Kaback, H. R., Fendler, K. Delineating electrogenic reactions during lactose/H+ symport. Biochemistry. 49, 6115-6121 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon