Method Article
Istituzione e Ottimizzazione di un programma di installazione High Throughput per studiare
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
In questo articolo video descrive l'alta velocità oleodotto che è stato stabilito con successo per infettare e analizzare un gran numero di embrioni di zebrafish fornire un nuovo potente strumento per il test composto e la scoperta di farmaci utilizzando un intero organismo vertebrato.
Abstract
Zebrafish stanno diventando uno strumento prezioso nella fase preclinica di proiezioni di scoperta della droga come un modello animale intero, con throughput elevato possibilità di screening. Essi possono essere utilizzati per colmare il divario tra test cellulari in fasi precedenti e in validazione vivo in modelli di mammifero, riducendo, in tal modo, il numero di composti di passaggio a esperimenti su modelli più costosi roditori. In questa luce, nel presente manoscritto è descritto un nuovo gasdotto ad alta velocità utilizzando zebrafish in vivo come sistema modello per lo studio di Staphylococcus epidermidis e infezioni marinum Mycobacterium. Questa configurazione consente la generazione e l'analisi di un gran numero di embrioni sincroni omogeneamente infetti. Inoltre la flessibilità della pipeline permette di implementare facilmente altre piattaforme per migliorare la risoluzione dell'analisi quando necessario. La combinazione di zebrafish insieme con l'innovativa ad alta velocità TEnologie apre il campo di prova della droga e la scoperta di nuove possibilità non solo a causa della forza di utilizzare un modello animale intero ma anche a causa del gran numero di linee transgeniche disponibili che possono essere utilizzati per decifrare il meccanismo di azione di nuovi composti.
Introduzione
Ad oggi il pesce zebra (Danio rerio) è stato istituito con successo come un modello efficiente per studiare una varietà di malattie infettive 1. L'embrione zebrafish offre unica possibilità di imaging in vivo per la loro trasparenza e il gran numero di linee transgeniche giornalista esistenti che esprimono proteine fluorescenti. Questa potente combinazione permette di monitorare diversi tipi di cellule immunitarie nel tempo interagendo con agenti patogeni come Mycobacterium marinum, il parente più vicino di M. tubercolosi 2, o Staphylococcus epidermidis, il causativo principale di biomateriale associata infezione 3-5. Diverse vie di infezione possono essere utilizzati in embrioni di zebrafish seconda fini dello studio 6.
Una di queste vie di infezione è l'iniezione tuorlo dei batteri. Il vantaggio principale di questo metodo rispetto agli altri è che tuorlo infection può essere eseguita automaticamente mediante iniezione robotica, riducendo notevolmente il tempo di iniezione e consentendo un'alta riproducibilità dell'infezione 7, 8.
Lavoro precedente, usando l'zebrafish come un alto rendimento nel sistema modello per lo studio in vivo di S. epidermidis e M. infezione marinum ha mostrato di avere successo 7, 8. Questo sistema è in grado di schermare per la progressione della malattia mediante iniezione tuorlo robotico di embrioni precoci e utilizzando fluorescenza lettura come misura per la carica batterica. In accordo con questa nozione, questa configurazione è stato ottimizzato e stabilito un altamente efficiente conduttura ad alta velocità con il potenziale per generare un gran numero di embrioni omogeneo infetti e monitorare la progressione dell'infezione durante il tempo dopo il trattamento con un numero di composti. Con la configurazione stabilita è possibile generare fino a 8.000 embrioni sincroni per schermaredi progressione della malattia, l'elaborazione in questo modo fino a 2.500 embrioni all'ora. Gli embrioni vengono ordinati in base alla loro carica batterica utilizzando un sistema automatizzato, garantendo gruppi omogenei di larve infetti. Inoltre, per convalidare l'installazione, effetti di riferimento noti per prevenire la progressione della tubercolosi nei mammiferi sono stati testati sugli embrioni infetti con M. ceppo marinum E11 o il ceppo più virulento M 9.
Questo studio descrive in dettaglio la conduttura alta velocità che è stata stabilita per essere in grado di generare un gran numero di embrioni infetti e la successiva analisi della progressione batterica durante lo sviluppo e dopo il trattamento composto.
Protocollo
1. Batterici Ceppi e condizioni di crescita
- Preparare S. epidermidis inoculo
- Prendere diverse colonie da S. ceppo epidermidis O-47, contenente un derivato pWVW189 mCherry vettore di espressione (De Boer L. inedito) da un Luria Bertani (LB) agar addizionato con 10 pg / ml di cloramfenicolo e cultura notte a 37 ° C in 25 ml di terreno LB supplementato con 10 mg / ml di cloramfenicolo per midlog palco.
- Centrifugare 1 ml della coltura a 12,000 xg per 1 minuto e successivamente lavarli 3x con 1 ml sterile tampone fosfato salino (PBS) con 0,3% (v / v) Tween-80.
- Misurare la densità ottica a 600 nm (OD 600), e diluire la sospensione batterica per un OD 600 di 0,3 a 2% (w / v) polivinilpirrolidone 40 (PVP 40) in PBS. Nota: Un OD 600 di 0,3 corrisponde a 1,0 x 10 8 unità formanti colonia / ml (cfu / ml).
- Preparare M. marinum inoculo
- Prendere diverse colonie di M. marinum ceppo M o E11 contenente il vettore pSMT3-mCherry esprimono stabilmente mCherry 10 da una piastra di agar Middlebrook 7H10 con il 10% (v / v) Middlebrook OADC supplementato con 50 mg / mL igromicina e coltura durante la notte a 28 ° C in 10 ml di Middlebrook 7H9 brodo con 10% (v / v) Middlebrook ADC arricchimento supplementato con 50 ug / ml igromicina.
- Centrifugare 1 ml della coltura a 12,000 xg per 1 minuto e successivamente lavarlo 3 volte con 1 ml di PBS sterile con 0,3% (v / v) Tween-80.
- Misurare il diametro esterno 600, e diluire la sospensione batterica per un OD 600 di 0,3 a 2% (w / v) in PBS pvp 40. Nota: Un OD 600 di 1 corrisponde a 1,0 x 10 8 UFC / ml.
2. Preparare Zebrafish uova
- Posizionare un massimo di 70 maschi e 50 femmine ty selvaggiope zebrafish separatamente nel grande vaso di allevamento. Nota: posiziona il pesce femmina nella parte inferiore del vaso grande allevamento.
- Rimuovere il separatore il giorno successivo in mattinata, per consentire al zebrafish inizio di allevamento.
- Raccogliere le uova sul fondo del vaso grande allevamento attraverso il collettore uovo in un tubo da 50 ml riempito con acqua uovo (60 mg / ml istante oceano sale marino).
3. Aghi per iniezione
- Ottenere disponibili in commercio custom made aghi di capillari di vetro con un diametro interno di 10 micron.
4. Schema sperimentale di iniezione
- Far bollire 100 ml di 1% (w / v) di agarosio in acqua uovo e fresco fino a circa 40 ° C. Versare agarosio nella piastra microiniettori automatizzata e mettere il timbro 1.024-bene nella agarosio. Nota: Il piatto è pronto da usare quando raffreddato.
- Sul microinjector automatico di funzionamento del software clicca su 'Calibra palco',quindi fare clic su griglia ben '1024 'e posizionare la piastra di agarosio in microinjector e calibrare la piastra facendo clic sullo schermo nella posizione centrale del bene.
- Vai al menu 'ago' e cliccare su 'titolare calibrare aghi'.
- Riempire l'ago di iniezione con una punta microloader con 10 microlitri pvp 40 contenente 100 ufc / nl S. epidermidis o 30 ufc / nl M. marinum, o l'uso pvp 40 come l'iniezione di simulazione.
- Posizionare l'ago nel micro-iniettore automatizzato e calibrare il x, y posizione abbassando o spostando l'ago e cliccando sullo schermo nella posizione dell'ago. Poi calibrare la posizione z dell'ago facendo clic sullo schermo la posizione della punta dell'ago.
- Distribuire le uova sopra la griglia di agarosio utilizzando una pipetta di plastica, e rimuovere l'acqua in eccesso uovo. Posizionare la griglia agarosio nel microinjector automatizzato.
- Vai alla 'injectioMenu n 'e regolare la' pressione di iniezione 'impostazione a 200 hPa, il' tempo di iniezione '0,2 sec e' la pressione Compensation '15 hPa, che è correlato con 1 nl, nel menu delle impostazioni FemtoJet.
- Fare clic su 'Iniettare all' iniettare l'intera piastra.
- Raccogliere le uova dopo iniezione lavandoli in una piastra di Petri (92 x 16 mm), con un massimo di 70 embrioni per piastra di Petri e incubare a 28 ° C.
5. Analisi Flow-citometro
- Preparare il grande flusso di particelle citometro secondo le istruzioni del produttore e riempire la coppa campione e il contenitore del liquido guaina con acqua uovo.
- Al software operativo, andare al menu 'PMT' e utilizzare le seguenti impostazioni: 650 V per il canale 'Red' e 0 V per il 'Green' e canali di 'gialli'. Poi vai al menu 'soglie' e utilizzare le seguenti impostazioni: 'OpticaDensità l 'segnale di soglia: 975 mV (valore COPAS XL: 50) e il' Time Of Flight '(TOF) minimo 320 msec (valore COPAS XL: 800), al fine di ridurre l'influenza di detriti.
- Per l'analisi, senza classificare gli embrioni passare al punto 5.4, per l'analisi e l'ordinamento gli embrioni in una capsula di Petri passare al punto 5.5 o per l'analisi e l'ordinamento gli embrioni in una piastra a 96 pozzetti passare al punto 5.6.
- Mettere gli embrioni in coppa campioni e fare clic su 'Start' per avviare l'analisi. Quando tutti gli embrioni vengono analizzati interrompere l'analisi cliccando su 'stop'. Salvare i dati cliccando su 'negozio tutto'. Nota: Tutti i dati vengono memorizzati come TXT, LMD, DAT, CSV e file BSRT. Seguire il protocollo nella fase 5.7.
- Mettere gli embrioni in coppa campioni e definire al massimo di 70 embrioni per piastra di essere risolto inserendo 70 nel menu 'Ordina'. Porre un piatto di Petri vuota sotto il sorter e clicca su 'ordine manuale'. Quando il Petri di sh è riempito, salvare i dati cliccando su 'negozio tutto'. Nota: Tutti i dati vengono memorizzati come TXT, LMD, DAT, CSV e file BSRT. Seguire il protocollo nella fase 5.7.
- Mettere gli embrioni in coppa campioni e definire al massimo di 1 embrione per pozzetto di essere risolto inserendo 1 nel menu 'Ordina'. Posizionare una piastra a 96 pozzetti vuoto nel supporto targa sinistra e clicca su 'Riempi piatto'. Quando la piastra a 96 pozzetti è riempito, salvare i dati cliccando su 'negozio tutto'. Nota: Tutti i dati vengono memorizzati come TXT, LMD, DAT, CSV e file BSRT. Seguire il protocollo nella fase 5.7.
- Prendi il file TXT per elaborare i dati grezzi, utilizzare le seguenti impostazioni del filtro di dati: 'Stato prescelto': 40, e se si utilizza il modulo tipo 'stato sort':. 6 Quindi utilizzare i numeri dal segnale totale di fluorescenza dalla 'Red 'canale per calcolare la media e l'errore standard della media. Tracciare questi insiemi di dati in bar o dispersione grafici.
- Analizzare e ordina a 3 giorni dopo l'iniezione (dpi), M. marinum embrioni infetti in due gruppi uguali usando il flusso di particelle di grandi citometro (punto 5.5). Trattare un gruppo con un composto di interesse nel suo solvente portante ed altro con carrier solo solvente (controllo). Applicare trattamenti simili per deridere il controllo iniettato a prova di effetti collaterali antibiotici.
- Ripetere a 4 e 5 dpi l'analisi (punto 5.5) e aggiornare l'acqua uova o acqua uovo contenente il composto.
7. High Resolution Imaging
- Anestetizzare gli embrioni con 0,02% (w / v) tamponata 3-aminobenzoico di etile (Tricaine) in acqua uovo 10 minuti prima dell'analisi.
- Preparare il sistema di Screening tecnologia Vertebrati automatizzato ed il campionatore di particelle Large secondo le istruzioni del produttore.
- Selezionare le immagini di riferimento corrispondenti all'età degli embrioni dal 'Imaging - Object211; Menu Setup Detection '.
- Selezionare la quantità di immagini e di orientamento da effettuare da parte del sistema di Screening tecnologia Vertebrati automatizzato dal 'Imaging - Negozio di Auto immagini' menu.
- Posizionare una piastra a 96 pozzetti pieni di embrioni (dal punto 5.6) nel portatarga sinistra del Grande Particle Sampler, e cliccare su 'piatto Run'.
- Quando viene rilevato un embrione e correttamente posizionata; immagine della testa e la coda separatamente con il CLSM usando un obiettivo 10X pianura asciutta e poi unire le immagini utilizzando un software di elaborazione delle immagini.
Risultati
Questi risultati mostrano che l'alta velocità conduttura per studiare S. epidermidis e M. infezione marinum è stato stabilito con successo e che potrà essere estesa ad altri modelli di infezione. In primo luogo, l'uso della grande nave allevamento (Figura 1A), basato sul sistema pubblicato da Adatto et al. (2011) 11, consente di generare un gran numero di uova sincroni in singoli eventi che consentono un elevato controllo del processo di deposizione. Accanto a poter iniettare gran numero di embrioni in un breve periodo di tempo, una versione migliorata del sistema micro-iniezione precedentemente sviluppato automatizzata 7 è stato usato (Figura 1A). Per valutare quale è la migliore fase di sviluppo per l'infezione tuorlo, iniezioni con S. epidermidis e M. marinum sono stati effettuati in tutte le diverse fasi tra 1 e 512 fase cella, secondo la descrizione fatta da Kimmel et al. (1995) 12 .
Iniezioni con 100 cfu S. epidermidis tra lo stadio 16 e 128 cellule fornito il miglior modello di infezione (Figura 2). I batteri proliferavano all'interno del tuorlo per 3 giorni e si diffondono nel corpo da 3 in poi dpi. Esecuzione di iniezioni prima della fase 16 cellule che hanno portato a elevata mortalità da 4 dpi, e dopo la fase di iniezione cella 256 mostra una crescita principalmente batterica all'interno del tuorlo con quasi tutti i batteri diffondono all'interno del corpo dell'embrione. Quantificazione di carica batterica è stata effettuata mediante analisi di fluorescenza utilizzando il flusso di particelle di grandi citometro come descritto da Veneman et al. (2013) 8 (Figura 3).
Le osservazioni hanno mostrato che la fase di sviluppo ottimale per l'iniezione di 30 cfu M. iniezione marinum è compresa tra 16-128 fase cella per il ceppo E11 (Figura 4A) e tra 16-64 palco cella con il M strai più virulenton (Figura 4B). Embrioni iniettati in queste fasi hanno mostrato crescita batterica all'interno del tuorlo e la diffusione dei batteri attraverso l'embrione (Figura 7). L'infezione con entrambi i ceppi in fasi precedenti ha presentato la crescita batterica generalizzata non specifica che porta gli embrioni a morire dopo 4 dpi. D'altra parte, in embrioni iniettati in fasi successive carica batterica è stata limitata al tuorlo.
Avanti, presorting con ampio particelle citofluorimetro (Figura 1B) generato grandi gruppi omogenei di pesci infetti escluso embrioni non o altamente infetti (Figure 5A e 6A). Dopo presorting, M. marinum embrioni infetti sono stati trattati con Rifampicina, un farmaco di prima linea antitubercolari. Studi precedenti hanno dimostrato che il trattamento con rifampicina alla dose di 200 pM riduce efficacemente M. infezione marinum in zebrafish 7, 13. Prendendo advantage del gran numero di embrioni omogeneamente infettati generati con l'alta velocità di installazione, il trattamento con diverse dosi stata eseguita. Embrioni infettate con M. marinum M ceppo e trattate per 48 ore con 12, 24, e 200 pM rifampicina hanno mostrato di ridurre efficacemente l'infezione da micobatteri in modo dose-dipendente (Figura 5B). In vista della riduzione efficiente dell'infezione utilizzando Rifampicina alla dose di 200 pM questa concentrazione è stato usato per gli esperimenti futuri. In linea con il risultato precedente, studiare la progressione della carica batterica utilizzando M. ceppo marinum E11 una significativa riduzione 24 ore e poi dopo trattamento con 200 pM rifampicina è stato osservato (Figura 6B).
Inoltre, se l'imaging alto ingrandimento è richiesto di questi embrioni, essi possono essere visualizzati automaticamente in piastre da 96 pozzetti (Figura 1C), in cui i campioni possono essere analizzati utilizzandoil sistema di Screening tecnologia Vertebrati automatizzato con il Large Particle Sampler montato su un CLSM.
Il sistema di Screening tecnologia Vertebrati automatizzato con il campionatore di particelle Large è un sistema che può essere montato su un CLSM o microscopio stereo. Questo dispositivo consente il caricamento di embrioni vivi o fissi da una piastra a 96 pozzetti o contenitore bulk automaticamente attraverso un capillare di vetro, e la orienta di fronte alla telecamera con l'inclinazione desiderata (ad esempio, dorsale o laterale). Immagini dell'embrione in tutti gli orientamenti possono essere effettuate con la telecamera a bordo o con un CLSM esterno (Figura 7). Gli embrioni saranno successivamente trasferiti nel contenitore di raccolta o di rifiuti.
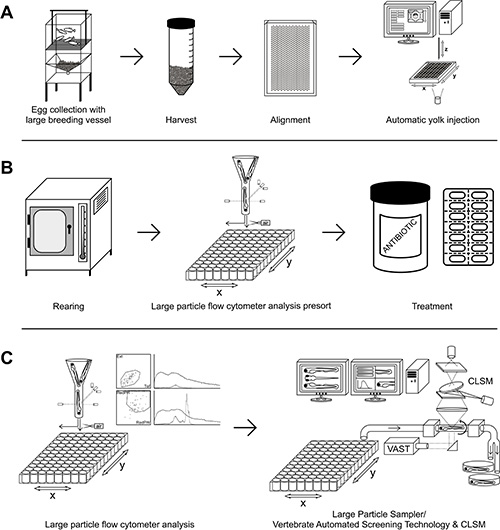
Figura 1. Mainstream outl sperimentaleine. A) I pesci adulti sono messi insieme per accoppiarsi, le uova vengono raccolte, allineati in una piastra di agarosio e iniettato. B) Le uova iniettate sono incubate a 28 ° C e saranno pre-ordinati per possibile trattamento farmacologico. C) Analisi seguenti da grandi flusso di particelle citometro e / o Grande Particle Sampler / Vertebrate Automated Screening di tecnologia con CLSM. Cliccare qui per vedere una versione più grande di questa figura.
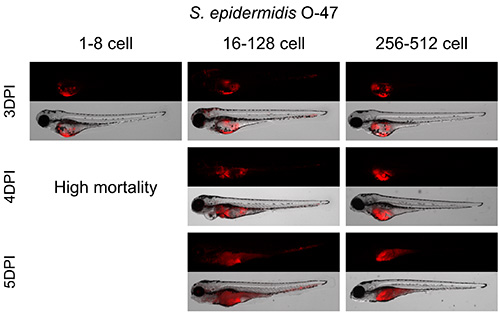
Figura 2. Istituzione del miglior palcoscenico cellulare per S. epidermidis tuorlo d'iniezione. embrioni di zebrafish sono stati iniettati nel tuorlo a diversi stadi di sviluppo 1-512 palco cella con 100 cfu di S. epidermidis. Embrioni iniettati tra 1 and 8 stadio di cellule ha mostrato una crescita batterica nel tuorlo e l'alta mortalità da 4 dpi. Embrioni iniettati tra i 16 ei 128 stadio di cellule hanno mostrato una crescita batterica nel tuorlo e all'interno del corpo a partire da 3 dpi. Embrioni iniettati tra lo stadio 256 e 512 cellule hanno mostrato molti crescita batterica all'interno del tuorlo. Cliccate qui per vedere una versione più grande di questa figura.
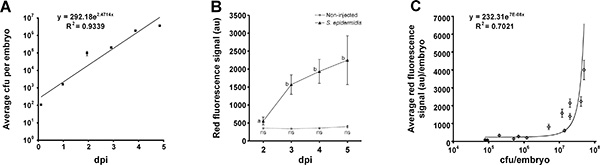
Figura 3. Quantificazione di carica batterica con grande flusso di particelle citometro. 100 cfu di S. epidermidis sono stati iniettati nel tuorlo di embrioni di zebrafish. A) fino a 5 dpi, ogni giorno, gruppi di 10 embrioni sono stati omogeneizzati e placcato direttamente, mostrando la crescita media esponenziale basata su due repliche biologiche (barre di errore= SEM). B) flusso di particelle Large citometro analisi mostra il segnale di media fluorescenza da non-iniettato e S. epidermidis iniettato embrioni. 30-160 embrioni per condizione sono stati analizzati (barre di errore = SEM), lettere differenti indicano differenze statisticamente significative per uno ANOVA seguito dal test di Tukey post-hoc (P <0.001), ns., Non differenze significative C) Correlazione tra cfu e segnale di fluorescenza media di gruppi di 10 S. epidermidis infetto embrioni (barre di errore = SEM). Questa cifra è stata modificata da Veneman et al. (2013) 8. Cliccare qui per vedere una versione più grande di questa figura.
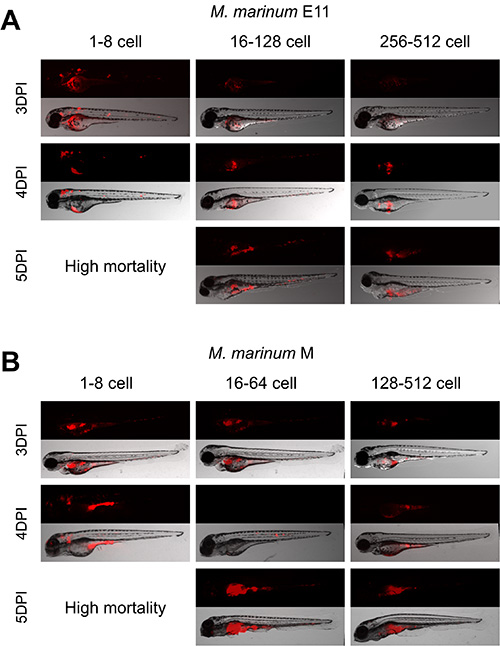
Figura 4. Establishment della fase cellula migliore per M. marinum tuorlo d'iniezione. embrioni di zebrafish sono stati iniettati in tutte le diverse fasi di sviluppo 1-512 palco cella con 30 cfu di M. marinum E11 e il ceppo M. A, B) Embrioni iniettati 1-8 palco cellule ha mostrato simile diffusione e mortalità con entrambi i ceppi. A) Gli embrioni iniettati tra 16-128 palco cella con ceppo E11 ha mostrato la formazione di granulomi e le infezioni sistemiche, mentre quelli iniettato 256-512 stadio di cellule tenuto carica batterica nel tuorlo. B) Embrioni iniettato tra 16-64 palco cella con ceppo M ha mostrato la formazione di granulomi come le strutture e le infezioni sistemiche, mentre quelli iniettati 128-512 stadio di cellule tenuto carica batterica nel tuorlo . cliccate qui per vedere una versione più grande di questa figura.

Figura 5. Trattamento di M. infezione acuta marinum con un anti-tubercolosi farmaco di prima linea. embrioni iniettato tra 16-64 palco cella con 30 cfu di M. ceppo marinum M sono stati eseguiti attraverso la grande particella citofluorimetro a 3 dpi essere ordinati in due gruppi, dopo aver eliminato le non-e / o embrioni altamente infette. A) fluorescenza dei singoli embrioni in entrambi i gruppi. b) embrioni trattati con rifampicina (RIF ) per 48 ore a dosi di 12, 24, e 200 mM sono stati analizzati a 4 dpi; la loro carica batterica si riduce notevolmente. C) profili COPAS rappresentativi di embrioni trattati con DMSO e rifampicina a dosi di 12, 24, e 200 mM per 24 hr. Carico e distribuzione batterica viene indicato dai picchi rossi. Linea blu rappresenta il profilo dell'elemento ordinato (4 dpf zebrafish embryo) da parte dei COPAS. 60-90 embrioni per condizione sono stati analizzati. Ciascun punto di dati rappresenta un individuo embrione. I valori sono indicati come media ± SEM. ns: differenze non significative. Analisi della significatività statistica delle differenze è stata effettuata da un modo ANOVA seguito dal test di posthoc di Tukey. Cliccare qui per vedere una versione più grande di questa figura.
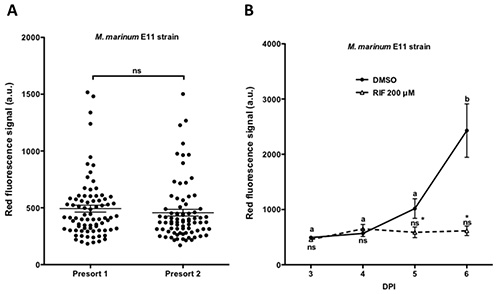
Figura 6. Trattamento di M. infezione cronica marinum con un farmaco di prima linea antitubercolari. embrioni iniettato tra 16-64 palco cella con 30 cfu di M. ceppo marinum E11 sono stati eseguiti attraverso il grande flusso di particelle citometro a 3 dpi essere ordinati in due gruppi, dopo aver eliminato le non-e / o embrioni altamente infetti. A) fluorescenza di singoli embrioni in entrambi i gruppi. B) Embrioni trattati con rifampicina (RIF) a 200 pM per 4 giorni sono stati analizzati mostra una significativa riduzione della carica batterica dopo 1 giorno di trattamento. 90 embrioni per condizione sono stati analizzati. I valori sono indicati come media ± SEM. Lettere diverse indicano differenze significative tra punti di tempo del trattamento stesso. * Indica differenze significative con il gruppo di controllo. ns: differenze non significative. Analisi della significatività statistica delle differenze è stato eseguito da un ANOVA seguita dal test di Tukey POSTHOC. (P <0.05). Figura B) è stato modificato da Spaink et al. (2013) 13. Cliccare qui per vedere una versione più grande di questa figura.
hres.jpg "src =" / files/ftp_upload/51649/51649fig7.jpg "/>
Figura 7. Risultato di M. marinum E11 iniezione tuorlo ripreso con Vertebrati Automated tecnologia di screening e CLSM. confocale pila Z (cucito 3 immagini) di un 5 dpi FLI1-EGFP 14 embrioni. A) Risultati in diretta embrione mostra proliferazione di M. batteri marinum E11 (rosso) in tutto il corpo. B) Fisso 5 dpi fli-EGFP embrione mostra M. batteri marinum E11 (rosso) in tutto il corpo co-localizzazione con leucociti (azzurro) rilevata da L-plastin immunoistochimica 15.
Discussione
La metodologia elevato throughput descritto in questo documento fornisce un facile e costo conduttura efficace per schermare elevato numero di embrioni e larve di pesce con diversi tipi di infezioni. Utilizzando il grande vaso allevamento invece di tradizionali serbatoi singoli o familiari riproduttori facilitato il controllo del processo di deposizione e la generazione di un maggior numero di uova sincroni. Con una versione migliorata del sistema micro-iniezione automatica 7, è possibile iniettare fino a 2.500 uova quasi tutti nella stessa fase cella entro 1 ora. Con questi aggiornamenti e miglioramenti software è fattibile iniettare più uova rispetto al passato è stato possibile che possono essere utilizzati per eseguire droga schermi di grandi dimensioni con la proliferazione batterica come lettura. Tuttavia questo metodo è ancora limitata a tuorlo iniezione, altre vie di iniezione per esempio descritti da Benard et al. (2012) 6, si spera essere incorporato nel sistema di micro-iniezione automatizzata nel prossimo futuro.
Sebbene questi metodi sono raffrontati per lo screening zebrafish, sarebbe utile per applicazioni con altre specie di pesce. Ad esempio, la carpa comune è stato indicato per avere vantaggi per gli schermi di droga. Come zebrafish, ovuli ed embrioni della fase iniziale di carpa comune sono trasparenti, ma con il vantaggio principale delle sue grandi dimensioni escursione di centinaia di migliaia di uova e la disponibilità di linee pure, che offrono un background genetico più costante 16.
L'analisi di grandi quantità di embrioni infetti è fatto con l'alta velocità grande flusso di particelle citometro. Questo dispositivo può sorta analizzato gli embrioni in pozzetti multipli o un piatto di Petri che lo rende particolarmente adatto per testare un gran numero di composti. Se è necessaria una risoluzione di immagini superiore, rispetto alla configurazione è adattato in modo che il grande flusso di particelle citometro tecnologia può essere utilizzata per il pre-screening e successivamente analizzare i campioni a un mezzo attraversomettere a risoluzione più elevata. Questo può essere fatto utilizzando la tecnologia di screening dei vertebrati Automated 17, 18. Questo dispositivo può raccogliere automaticamente embrioni vivi o fissi tra 2 e 7 giorni dopo la fecondazione di un piatto più bene o un contenitore di massa, l'immagine a 360 ° attraverso una capillare utilizzando CLSM o microscopio stereo e gettare di nuovo in 2 contenitori di grandi dimensioni che consentono cernita manuale degli embrioni sulla base sulle immagini microscopiche. Miglioramenti futuri consentiranno l'ordinamento dell'embrione dopo l'imaging nella piastra ben più, rendendo quindi possibile proiettare automaticamente gran numero di singoli embrioni nel tempo con CLSM. Supponendo che in applicazioni future sistema di vaglio Tecnologia Vertebrate automatizzato può anche essere collegato alla grande flusso di particelle citometro tecnologia senza necessità di preventiva larve erogazione in piastre multiple così, porterà ad un ordinamento più avanzato.
Questo articolo descrive l'uno stabilimentod ottimizzazione di una configurazione high throughput studiare S. epidermidis e M. infezione marinum come modello per la scoperta della droga. Ciò dimostra che l'esito di questi batteri iniettati nel tuorlo dipende dallo stadio di sviluppo delle uova al momento dell'iniezione. Iniezione M. marinum E11 a 16-128 fase cella o il ceppo M at 16-64 stadio di cellula porta lo stesso modello di infezione come iniezione nella vena caudale 2, 6. Tuttavia questa configurazione non è limitata alla proliferazione di soli batteri patogeni. E 'stato dimostrato prima che sia possibile iniettare robotically soluzioni contenenti DNA, RNA o Morpholinos per transgenesi, sovraespressione e gene knock-down studi, rispettivamente 13. Inoltre, è stato dimostrato che questa configurazione è utile anche per lo studio della proliferazione delle cellule tumorali e la migrazione. Pertanto questa pipeline presenta un metodo versatile per schermi ad alta produttività di una varietà di meccanismi di segnale nel contestodell'immunità innata, applicata alle malattie infettive e lo sviluppo del cancro. Questi schermi possono essere combinati tra loro per la scoperta di farmaci, ma anche con l'analisi dei possibili effetti tossici dei farmaci applicabili identificati.
Divulgazioni
JS è proprietario di Life Science metodi BV che produce strumenti utilizzati in questo articolo.
Riconoscimenti
Siamo grati a Leonie de Boer e Bas Zaat (Academic Medical Centre) per la fornitura di noi con la S. ceppo epidermidis O-47. Ringraziamo Rico Bongaarts, Francesco Smet e Angela Comas (Unione Biometrica) per assistenza e consulenza con il COPAS XL e l'analisi BioImager VAST. Ringraziamo Davy de Witt, Ulrike Nehrdich, e Laura van Hulst, alla custodia pescare ed altri colleghi di Università di Leiden per utili discussioni. Questa ricerca fa parte del progetto P5.03 IBIZA del programma di ricerca di materiali biomedici istituto, co-finanziato dal Ministero olandese degli Affari economici, e del Programma Mix di Smart (NWOA_6QY9BM) del Ministero olandese degli Affari economici e del Il Ministero dell'Istruzione, della Cultura e della Scienza olandese. Ulteriore supporto è stato ottenuto dal progetto EU ZF-Health (FP7-Health-2009-242048), e RMJ è stato supportato da Marie Curie fellowship come ricercatore esperto nella UE Initial Training Network FishForPharma (PITN-GA-2011-289.209). SJR ricevuto finanziamenti dalla iniziativa sui medicinali innovativi impresa comune in convenzione di sovvenzione n ° 115337, le risorse di cui sono composte contributo finanziario dal Settimo Programma dell'Unione Europea Quadro (FP7/2007-2013) e le società dell'EFPIA in autori contribution.The gentili ulteriormente riconoscere il sostegno finanziario del Fondo dell'Università di Leiden (LUF) per la robotica e da Cyttron, nel programma di sovvenzioni Investeringen Kennisinfrastructuur Besluit, che a sua volta è sostenuta finanziariamente dalla Organizzazione olandese per la ricerca scientifica per le strutture di imaging. L'acquisizione del sistema COPAS è stato in parte sostenuto dalla Divisione di Scienze della Terra e della Vita (ALW) con l'aiuto finanziario della Organizzazione olandese per la ricerca scientifica (NWO, 834.10.004).
Materiali
| Name | Company | Catalog Number | Comments |
| Middlebrook 7H10 agar | BD Bioscience, Franklin Lakes, New Jersey, USA | 262710 | |
| Middlebrook 7H9 broth | BD Bioscience, Franklin Lakes, New Jersey, USA | 271310 | |
| BBL Middlebrook oleic acid albumin dextrose catalase (OADC) enrichment | BD Bioscience, Franklin Lakes, New Jersey, USA | 211886 | |
| BBL Middlebrook albumin dextrose catalase (ADC) enrichment | BD Bioscience, Franklin Lakes, New Jersey, USA | 211887 | |
| LB agar | Sigma-Aldrich, Saint Louis, Missouri, USA | L5542 | Multiple suppliers |
| LB broth | Sigma-Aldrich, Saint Louis, Missouri, USA | L3022 | Multiple suppliers |
| Chloramphenicol | Bio-connect, Huissen, the Netherlands | 16785.03 | Multiple suppliers |
| Hygromycin | Bio-connect, Huissen, the Netherlands | 25966.01 | Multiple suppliers |
| Tween-80 | Sigma-Aldrich, Saint Louis, Missouri, USA | P1754 | Multiple suppliers |
| Polyvinylpyrrolidone40 | Calbiochem, San Diego, California, USA | 529504 | Multiple suppliers |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich, Saint Louis, Missouri, USA | A5040 | |
| Agarose | Sphaero-Q, Gorinchem, the Netherlands | S103 | Multiple suppliers |
| Instant ocean sea salt | Sera Marin, Heinsberg, Germany | 5460 | |
| iSPAWN | Techniplast, Buguggiate, Italy | iSPAWN | |
| Automated microinjection system | Life Science Methods BV, Leiden, the Netherlands | Automated microinjection system | |
| Complex Object Particle Analyzer and Sorter XL (COPAS XL) | Union BioMetrica Inc., Holliston, Massachusetts, USA | COPAS XL | |
| Vertebrate Automated Screening Technology BioImager (VAST BioImager) | Union BioMetrica Inc., Holliston, Massachusetts, USA | VAST BioImager | |
| LP Sampler | Union BioMetrica Inc., Holliston, Massachusetts, USA | LP Sampler | |
| Confocal laser scanning microscope | Leica Microsystems, Wetzlar, Germany | TCS SL | |
| Injection needle 10 µm inner diameter | Qvotek, Mississauga, Canada |
Riferimenti
- Meijer, A. H., Spaink, H. P. Host-pathogen interactions made transparent with the zebrafish model. Curr Drug Targets. 12, 1000-1017 (2011).
- Tobin, D. M., Ramakrishnan, L. Comparative pathogenesis of Mycobacterium marinum and Mycobacterium tuberculosis. Cell Microbiol. 10, 1027-1039 (2008).
- Boelens, J. J., et al. Biomaterial-associated persistence of Staphylococcus epidermidis in pericatheter macrophages. J Infect Dis. 181, 1337-1349 (2000).
- Broekhuizen, C. A., et al. Tissue around catheters is a niche for bacteria associated with medical device infection. Crit Care Med. 36, 2395-2402 (2008).
- Busscher, H. J., et al. Biomaterial-associated infection: locating the finish line in the race for the surface. Sci Transl Med. 4, (2012).
- Benard, E. L., et al. Infection of zebrafish embryos with intracellular bacterial pathogens. J Vis Exp. , (2012).
- Carvalho, R., et al. A high-throughput screen for tuberculosis progression. PLoS One. 6, (2011).
- Veneman, W. J., et al. A zebrafish high throughput screening system used for Staphylococcus epidermidis infection marker discovery. BMC Genomics. 14, 255 (2013).
- Sar, A. M., et al. Mycobacterium marinum strains can be divided into two distinct types based on genetic diversity and virulence. Infect Immun. 72, 6306-6312 (2004).
- Stoop, E. J. M., et al. Zebrafish embryo screen for mycobacterial genes involved in the initiation of granuloma formation reveals a newly identified ESX-1 component. Disease Model., & Mechanisms. 4, 526-536 (2011).
- Adatto, I., et al. A new system for the rapid collection of large numbers of developmentally staged zebrafish embryos. PLoS One. 6, (2011).
- Kimmel, C. B., et al. Stages of embryonic development of the zebrafish. Dev Dyn. 203, 253-310 (1995).
- Spaink, H. P., et al. Robotic injection of zebrafish embryos for high-throughput screening in disease models. Methods. 62, 246-254 (2013).
- Lawson, N. D., Weinstein, B. M. In vivo imaging of embryonic vascular development using transgenic zebrafish. Dev Biol. 248, 307-318 (2002).
- Mathias, J. R., et al. Live imaging of chronic inflammation caused by mutation of zebrafish Hai1. J Cell Sci. 120, 3372-3383 (2007).
- Henkel, C. V., et al. Comparison of the exomes of common carp (Cyprinus carpio) and zebrafish (Danio rerio). Zebrafish. 9, 59-67 (2012).
- Chang, T. -. Y., et al. Fully automated cellular-resolution vertebrate screening platform with parallel animal processing. Lab on a Chip. 12, 711 (2012).
- Pardo-Martin, C., et al. High-throughput in vivo vertebrate screening. Nature Methods. 7, 634-636 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon