Method Article
Appartamento con pavimento Platform aria sollevata: Un nuovo metodo per la combinazione di Comportamento con microscopia o Elettrofisiologia su Awake liberi di muoversi Roditori
In questo articolo
Riepilogo
Questo metodo crea un ambiente familiare tangibile per il mouse per navigare ed esplorare durante microscopiche di imaging o unicellulari registrazioni elettrofisiologiche, che richiedono ferma fissazione della testa dell'animale.
Abstract
E 'ampiamente riconosciuto che l'uso di anestetici generali può minare la pertinenza dei dati elettrofisiologici o microscopiche ottenute dal cervello di un animale vivo. Inoltre, il lungo recupero dall'anestesia limita la frequenza degli episodi ripetuti di registrazione / di imaging in studi longitudinali. Quindi, nuovi metodi che permettano registrazioni stabili da topi Comportarsi non anestetizzati sono tenuti a far avanzare i campi delle neuroscienze cellulari e cognitive. Soluzioni esistenti spaziano dalla mera contenzione fisica ad approcci più sofisticati, come il tapis roulant lineari e sferici usati in combinazione con la realtà virtuale generata dal computer. Qui, un nuovo metodo è descritto in cui un topo testa fissa può muoversi un homecage mobile-aria alzato ed esplorare il suo ambiente in condizioni di senza stress. Questo metodo permette ai ricercatori di effettuare test comportamentali (ad esempio, l'apprendimento, assuefazione o di riconoscimento romanzo oggetto) in contemporanea condue fotoni di imaging microscopico e / o patch-clamp, tutti combinati in un singolo esperimento. Questo video-articolo descrive l'uso del dispositivo di fissaggio testa animale sveglio (homecage mobile), dimostra le procedure di assuefazione animale, ed esemplifica una serie di possibili applicazioni del metodo.
Introduzione
Una tendenza emozionante recente nelle Neuroscienze è sviluppare approcci sperimentali per cellulare e molecolare sondaggio delle reti neuronali nel cervello di veglia, comportandosi roditori. Tali approcci tenere la promessa di gettare nuova luce sui processi neurofisiologici che sono alla base della funzione motoria, integrazione sensomotoria, la percezione, l'apprendimento, la memoria, così come la progressione del pregiudizio, neurodegenerazione e le malattie genetiche. Inoltre, la registrazione dal cervello di animali svegli promettente nello sviluppo di nuovi agenti terapeutici e trattamenti.
Vi è una crescente consapevolezza che l'anestesia, che è stato comunemente usato in esperimenti neurofisiologici, può influenzare i meccanismi di base della funzione cerebrale, che potrebbe condurre alla erronea interpretazione dei risultati sperimentali. Così, la ketamina anestetico ampiamente usato aumenta rapidamente la formazione di nuove spine dendritiche e migliora la funzione sinaptica 1; un altro anestetici comunemente usatiic isoflurano a livelli di anestesia chirurgica sopprime completamente l'attività corticale spontanea nei ratti appena nati e blocca oscillazioni mandrino-burst in animali adulti 2. Attualmente, solo un numero limitato di approcci abilitare esperimenti in topi non anestetizzati mediante due fotoni di imaging microscopico o patch-clamp. Questi approcci possono essere suddivisi in preparazioni liberi di muoversi e di testa-fisso.
L'attrattiva unica di un preparato animale muoversi liberamente è che permette la valutazione del comportamento naturale, compresi i movimenti di tutto il corpo durante la navigazione. Un modo per l'immagine all'interno del cervello di un roditore muoversi liberamente è quello di collegare un microscopio da testa miniaturizzata o fibroscopio 3-5. Tuttavia, i dispositivi miniaturizzati tendono ad avere prestazioni ottiche limitato rispetto alla microscopia a due fotoni obiettivo a base, e non possono essere facilmente combinato con intere registrazioni cella patch-clamp 6.
Il exiSoluzioni sting per la testa di fissazione di un roditore svegli si sono affidati principalmente sia sulla contenzione fisica 7,8 o sulla formazione l'animale a esporre poggiatesta volontaria 9. Un altro approccio popolare è consentire arti dell'animale per spostare appoggiandolo su, ad esempio, un tapis roulant sferico 10; questo approccio è spesso combinato con la realtà virtuale generata dal computer. Esperimenti di elettrofisiologia sui topi testa fissa sono in gran parte utilizzato le registrazioni extracellulari e sono stati utilizzati per studiare regolazione centrale della funzione cardiovascolare 11, effetti dell'anestesia sull'attività neuronale 12, la risposta uditiva del tronco encefalico 13 e di elaborazione delle informazioni 14. Le pionieristiche registrazioni intracellulari / cellule intere negli animali Comportarsi sveglio sono stati eseguiti negli anni 2000 e si sono concentrati su attività neurale legati alla percezione e movimento 15-20. Intorno allo stesso tempo, sono stati pubbli i primi studi di imaging microscopici sui topi svegliaccertata, dove microscopia a due fotoni è stato utilizzato nella corteccia sensoriale di ratti fisicamente trattenuto 7 e su topi in esecuzione su un tapis roulant sferico 21.
Vivo studi di microscopia e di elettrofisiologia successive hanno dimostrato che un preparato fissazione testa può essere combinato con successo con paradigmi comportamentali basati sui movimenti degli arti anteriori, il riconoscimento degli odori, sbattere, e leccare 8,22-25. Topi immessi sul tapis roulant sferico possono essere addestrati per navigare l'ambiente visivo virtuale generato da un computer 10,26. Registrazioni intracellulari / extracellulari dimostrato che, in un animale testa fissa navigazione tale ambiente virtuale, attivazione delle cellule di posizione ippocampali può essere rilevata 27. In un ambiente visivo virtuale, i topi mostrano normale movimento legate theta ritmo nel potenziale campo locale e theta fase di precessione durante il movimento attivo 27. Recentemente, il activit spaziale e temporaley modelli di popolazioni neuronali sono stati registrati otticamente in topi durante la lavorazione compiti di decisione memoria in un ambiente virtuale 28.
Pur avendo abilitato ricerca d'avanguardia, il design tapis roulant sferico ha diverse limitazioni intrinseche. In primo luogo, l'animale deve spostare su una superficie illimitato di una palla di aria alzato rotante, che pone ostacoli materiali come muri o barriere. Questa limitazione è solo in parte compensato dalla "realtà virtuale" generati dal computer, perché input visivo è probabilmente meno efficace su topi e ratti rispetto all'ingresso sensoriale tattile (ad esempio, baffo tasto o leccare), che queste specie naturalmente affidano on. In secondo luogo, la notevole curvatura della superficie della sfera può essere scomodo per i topi di laboratorio utilizzati per camminare su un pavimento piatto nelle loro gabbie. Infine, il diametro pura della palla (almeno 200 mm nei topi e 300 mm per ratti) rende la dimensione verticale della sfericaDispositivo tapis roulant relativamente grande. Questo rende difficile conciliare treadmill sferica con la maggioranza di configurazioni microscopia disponibili in commercio, e spesso richiede la costruzione di una nuova configurazione intorno al treadmill mediante telai microscopio su misura.
Qui, un nuovo metodo è descritto in cui un topo testa fissa può muoversi un homecage mobile-aria alzato che dispone di un pavimento piatto e pareti tangibili, ed esplorare l'ambiente fisico in condizioni di senza stress. Questo articolo illustra le procedure di formazione del mouse e la fissazione di testa, e fornisce esempi rappresentativi dove microscopia a due fotoni, imaging ottico intrinseca e patch-clamp registrazioni vengono eseguite nel cervello di topi Comportarsi sveglio.
Protocollo
Tutte le procedure qui presentate sono state eseguite secondo la guida locale per la cura degli animali (La legge finlandese sulla sperimentazione animale (62/2006)). La licenza animale (ESAVI/2857/04.10.03/2012) è stato ottenuto da autorità locali (ELÄINKOELAUTAKUNTA-ELLA). Topi adulti (età 1-3 mesi, peso 20-40 g) sono stati tenuti in gabbie di stabulazione in gruppo nella struttura animali certificata dell'Università di Helsinki e provvisti di cibo ed acqua ad libitum.
1. Finestra impianto craniale
Finestra del cranio è impiantato secondo protocolli pubblicati 29-31 con modifiche minori, come brevemente descritto di seguito:
- Sterilizzare gli strumenti prima di iniziare la finestra di impianto craniale. Mantenere condizioni di sterilità durante l'intervento chirurgico per ridurre al minimo il rischio di complicanze postoperatorie.
- Somministrare un analgesico (ketoprofene, 2,5 mg / kg) 30 min prima della chirurgia e 24 ore post-intervento chirurgico. Unesthetize il mouse usando una miscela di ketamina (80 mg / kg) e xilazina (10 mg / kg) iniettata per via intraperitoneale. Monitorare regolarmente la profondità dell'anestesia da zampa pizzicare. Utilizzare una piastra elettrica per mantenere la temperatura corporea dell'animale a 37,0 ° C. Per ridurre l'infiammazione indotta da chirurgia ed edema cerebrale, somministrare desametasone (2 mg / kg) per iniezione sottocutanea.
- Applicare il lubrificante occhio per proteggere gli occhi da sempre asciutto. Radersi la testa del topo e pulire l'area rasata. Tagliare la pelle con le forbici chirurgiche e pinze lungo la linea dalla nuca alla fronte. Rimuovere qualsiasi tessuto connettivo attaccato al cranio.
- Lentamente e con attenzione praticare un piccolo bene con l'osso frontale sinistra con un trapano chirurgico ad alta velocità. Avvitare un bullone mini (vedi Materiali) nel pozzo perforato. Eseguire non più di uno-e-un-metà giri completi della vite.
NOTA: Evitare quelle aree che si trovano direttamente sopra i vasi superficiali corticali. Turbativa di questi vessels può portare a una forte emorragia. - Per eseguire craniotomia, praticare una finestra circolare (3-3,5 mm di diametro) in parietale destro. Applicare una goccia di buffer corteccia (125 mM NaCl, KCl 5 mM, glucosio 10 mM, HEPES 10 mM, 2 mM CaCl 2, e 2 mM MgSO 4 in H 2 O distillata supplementato con penicillina 100 unità / ml e streptomicina 100 mg / ml) e rimuovere con attenzione la parte dell'osso situato all'interno della finestra circolare.
NOTA: Per esprimere una proteina fluorescente di una determinata sottopopolazione di cellule, effettuare l'iniezione intracranica di adeno-associato virale (AAV) o altri vettori virali a questo punto della procedura. - Posizionare un vetrino di vetro rotondo (# 1.5 codice spessore) sulla finestra cranica. Fissare il vetrino al cranio con colla poliacrilico. Posizionare un supporto di metallo sulla parte superiore del vetrino e fissarlo con la miscela di cemento dentale e colla poliacrilico.
NOTA: La procedura sopra descritta è ottimizzata per le finestre cranicheutilizzato in esperimenti di imaging ottico. Per preparare una "rovesciata" finestra del cranio adatto per esperimenti di elettrofisiologia, utilizzare una procedura diversa. Primo, incollare il supporto del metallo al cranio. Perforare una finestra circolare all'interno apertura del titolare come esemplificato nel video. In alternativa, fare una craniotomia più piccolo (inferiore a 0,5 mm di diametro) sulla regione di interesse per prevenire o ridurre al minimo il movimento cervello 32. Aggiornare il buffer corticale o una goccia di adesivo al silicone sulla finestra cranica, quindi chiudere con un vetrino di vetro rotondo. - Dopo aver completato l'operazione, posizionare l'animale in una gabbia riscaldata con cibo facilmente accessibile e acqua. Rispedire l'animale verso la gabbia di stabulazione in gruppo solo dopo che recupera completamente dall'anestesia. Re-somministrare analgesici al rilevamento di eventuali segni di dolore, tra cui riluttanza a muoversi, mangiare o bere, perdita di peso, salivazione, piloerezione o rumori respiratori anomali.
2. Animal Handling
- Prendete il mouse dalla gabbia e semplicemente tenerlo premuto per 5-10 min. Siate calmi durante la manipolazione l'animale, evitare di fare movimenti a scatti e rumori.
- Dopo la manipolazione, ritorno il mouse per sua gabbia.
- Ripetere la procedura di gestione 2-3x con intervalli ineguali tra gli episodi di trattamento, al fine di rendere il mouse agio con la sperimentalista.
- Prendete un piccolo panno morbido e avvolgere l'animale 2-3x con intervalli diseguali.
- Animale deve rimanere calmo e abituarsi ad essere avvolto. Se il mouse è eccitato e nervoso, ripetere le procedure di manipolazione e confezionamento.
3. Formazione animale
- Avviare la formazione dell'animale nel homecage cellulare il giorno dopo l'assuefazione alla movimentazione e confezionamento è completata.
- Registrare l'animale pesare ogni giorno, prima e durante l'allenamento.
NOTA: Se, durante la formazione, l'animale perde più del 10% del suo peso, esso dovrebbe essere escluso dalla tsperimenta. - Regolare la posizione verticale del braccio fissaggio testa del dispositivo homecage cellulare al fine di corrispondere alle dimensioni dell'animale addestrato. Collegare la presa d'aria del dispositivo di presa standard di laboratorio aria pressurizzata (tipicamente, sia un serbatoio o una macchina pneumatica che fornisce una pressione sufficientemente alta e la velocità del flusso d'aria, ossia circa 5 bar e 300 l / min).
- Avvolgere l'animale in uno straccio.
- Inserire il supporto metallico, che è attaccato alla testa dell'animale, nel braccio di fissaggio testa e saldamente fissarlo serrando le viti. Accendere il flusso d'aria e fare in modo che il flusso d'aria è ottimale per libero galleggiamento del homecage-aria sollevata. Rilasciare l'animale nel homecage cellulare rimuovendo il rag.
- Per abituare l'animale al rumore, fornire una costante esposizione a suoni ambientali (utilizzando, per esempio, la radio o musica registrata e vocali) durante tutte le sessioni di formazione nonché durante gli esperimenti.
- Durante il primo allenamento, tenere la luce della stanza per la prima ora, poi spegnere la luce fino al termine della sessione di allenamento.
- Dopo 2 ore di formazione nel homecage mobile, liberare l'animale dalla fissazione testa e tornare alla sua gabbia con un approvvigionamento di acqua e cibo. Lasciare per almeno 2 ore in condizioni di riposo.
- Pulire il homecage cellulare dopo ogni sessione di allenamento con una soluzione di etanolo al 70% e sciacquare con acqua di rubinetto. Soak-l'acqua con il tovagliolo di carta usa e getta e asciugare il homecage mobile prima del successivo utilizzo.
- Eseguire allenamenti consecutivi per 2 ore, con la luce della stanza spento mentre l'animale è stato addestrato.
- Eseguire la sessione di allenamento due volte al giorno.
- Dopo 8 a 12 allenamenti, utilizzare l'animale in una sessione sperimentale per un massimo di 2 ore alla volta.
NOTA: Durante le sessioni di allenamento prolungate che durano più di 1-2 ore, si consideri che fornisce il mouse wacqua potabile iesima, che può essere fornita manualmente o utilizzando un supporto pipetta fissato al telaio homecage mobile. In alternativa, l'acqua può essere fornita ad libitum per uso dell'animale mettendo gocce viscose di idro-gel direttamente sulle pareti del homecage mobile.
NOTA: Ricordarsi di pesare gli animali ogni giorno prima formazione per escludere eventuali effetti dello stress cronico. Escludere un animale da esperimento se, in qualsiasi punto nel tempo, si dimostra reazioni di stress come il congelamento, vocalizzazione, o diarrea indotta da stress.
4. Applicazioni
- Due fotoni di imaging in Svegliatevi mouse Muoversi Mobile Homecage
- Assemblare il homecage mobile. Controllare la posizione del ponte e del braccio di fissaggio testa.
- Avvolgere l'animale addestrato in uno straccio. Mettere l'animale nel homecage mobile. Fissare il supporto metallico nel braccio di fissaggio testa. Rimuovere il rag.
- Pulire il vetro di copertura impiantato dalla polvere utilizzandouna soluzione di etanolo al 70% e lasciare asciugare.
- Mettere una goccia di fluido immersione sulla classe coperchio. Preferibilmente, utilizzare una soluzione viscosa, perché l'acqua evapora rapidamente.
- Posizionare il dispositivo homecage mobile con l'animale addestrato sotto il microscopio (a meno che non si dispone di un secondo dispositivo identico, che è fermo nel setup microscopio).
- Eseguire imaging utilizzando una misura o un sistema laser di misura a immagini microscopio disponibile in commercio dotato di un laser pulsato a femtosecondi infrarossi.
- Trova la regione di interesse utilizzando la modalità a grande campo del microscopio a fluorescenza. Utilizzare i filtri passa lunghi per valutare vascolare cerebrale e selezionare un appropriato area di destinazione dopo aver esaminato il modello di vasi sanguigni.
- Per immagine vascolarizzazione corticale, iniettare una soluzione all'1% di destrano coniugato Red 70.000 MW Texas (o suo analogo), sia nella vena della coda, mentre l'animale viene immobilizzato lo straccio, o retro-orbitale mentre laanimale è posizionato nel homecage mobile. Tune il laser a due fotoni a 860 nm e utilizzare il filtro passa banda (590-650 nm) per raccogliere la luce emessa. Utilizzare il filtro per le emissioni 515-560 nm per valutare i particolari fini morfologia neuronale o attività neuronale utilizzando, per esempio, i topi transgenici che esprimono YFP o il Ca 2 + - sensibile proteina fluorescente GCaMP3 in una sottopopolazione di neuroni sotto il promotore Thy1.
- Utilizzare un software appropriato per l'acquisizione delle immagini.
- Dopo l'imaging, rilasciare l'animale dal braccio fissazione testa allentando le viti. Rispedire l'animale verso la sua gabbia e lasciarlo riposare per almeno 2 ore prima di iniziare la prossima sessione di imaging.
- Memorizzare le coordinate di ogni regione di interesse (ROI) per la successiva re-imaging. Immagine stessa ROI nel tempo, e regolare le coordinate ogni tempo per sfruttare la sovrapposizione dell'immagine.
- Analizzare le immagini e rendere ricostruzioni tridimensionali utilizzando un softw appropriatosono (ad esempio, ImageJ, ecc).
- Intrinseca Imaging ottico in Svegliatevi mouse Muoversi Mobile Homecage
- Assemblare il homecage cellulare sotto l'immagine della telecamera acquisizione di un setup imaging ottico intrinseco.
- Avvolgere l'animale addestrato in uno straccio. Mettere l'animale nel homecage mobile. Fissare il supporto metallico nel braccio di fissaggio testa.
- Pulire il vetro di copertura impiantato dalla polvere utilizzando una soluzione di etanolo al 70% e lasciare asciugare.
- Mettere una goccia di glicerolo sul vetro impiantato e coprire con un coperchio rotondo slittamento 8 mm.
- Posizionare un manipolatore con il tubo getto d'aria di fronte alla vibrissa controlaterale.
- Regolare la posizione della telecamera ad alta velocità e concentrarsi sul sistema vascolare corticale.
- Utilizzare la luce verde (filtro 546BP30) senza filtro fotocamera per acquisire la pescherecci mappa.
- Concentrarsi più in profondità nella corteccia, circa 400 micrometri di sotto della superficie corticale.
- Per l'immagine tlui (BOLD) segnale ottico in dipendenza del livello di ossigenazione del sangue, inserire il filtro 590LP di fronte alla telecamera e illuminano la corteccia con luce rossa (filtro 630BP30).
- Regolare l'illuminazione della superficie corticale modo che sia distribuito uniformemente attraverso la regione di interesse, evitando sovraesposizione. Regolare l'intensità di illuminazione in modo che la regione di interesse è compreso nel segmento 70-90% del range dinamico della telecamera.
- Utilizzare LongDaq software di acquisizione di immagini per raccogliere immagini dalla fotocamera.
- Utilizzare l'immagine frequenza di acquisizione da 1 a 10 Hz (cioè tra 1 e 10 fotogrammi al secondo) per esperimenti con la stimolazione a bassa frequenza (0,05 Hz).
- Spegnere la luce della stanza per evitare interferenze con il segnale ottico intrinseco.
- Lasciare almeno 30 min per il mouse per adattarsi alla homecage mobile.
- Immagine l'attività di base nel corso di una di 6 minuti episodio senza stimolazione.
- Per registrare evocato cattività ortical, stimolare vibrissa in una modalità ON/10 sec OFF 10 sec (0,05 stimolazione Hz) con una elevata frequenza (25 Hz) treno di sbuffi d'aria per il periodo totale di 6 min.
- Dopo l'acquisizione delle immagini, rilasciare il mouse dal braccio di fissaggio testa e tornare alla sua gabbia.
- Non usare ulteriore filtraggio dei dati per la frequenza, perché le ampiezze delle risposte stimolazione tendono ad essere relativamente elevato negli animali svegli, con conseguente ottimo rapporto segnale rumore.
- Convertire i set ottenute delle immagini in file di stack tif *. Ed analizzare ulteriormente utilizzando, ad esempio, il software open source FIJI (ImageJ). Sottrarre la linea di base dell'attività spontanea dei fotogrammi ottenuti durante vibrissa la stimolazione con lo strumento Calcolatrice immagine. In alternativa, i dati del filtro nel dominio della frequenza utilizzando il programma adatto.
- Registrazioni di patch-clamp in Awake mouse Muoversi Mobile Homecage
- Assemblare il homecage mobile.
- Avvolgere l'animale addestrato in uno straccio. Somministrare trimetoprime (5 mg / kg) e sulfadoxine (25 mg / kg) per prevenire l'infezione batterica. Mettere l'animale nel homecage mobile. Fissare il supporto metallico nel braccio di fissaggio testa.
- Pulire e sterilizzare il cemento dentale "cap" impiantato e vetro di copertura con una soluzione di etanolo al 70% o 0,5% di clorexidina digluconato e lasciarlo asciugare.
- Lentamente e con attenzione rimuovere il vetro di copertura dal supporto metallico.
- Aggiornare il buffer corticale supplementato con penicillina, streptomicina e pulire la finestra del cranio da detriti con un tampone emostatico sterile.
- Posizionare l'elettrodo di massa nel buffer corticale.
- Posizionare il headstage elettrofisiologia in un micromanipolatore.
- Realizzare pipette in vetro borosilicato, che mira a resistenza di punta che vanno da 6,5 a 8.5MΩ. Riempire la pipetta di patch con una soluzione intracellulare. La composizione della soluzione cerotto pipetta è l'seguente (in mM): 8 KCl, 111 K-gluconato, 0,5 CaCl 2, 2 NaOH, 10 glucosio, 10 HEPES, 2 Mg-ATP, e 5 BAPTA, pH è stato regolato a 7,2 con KOH. I valori di potenziale di membrana devono essere corretti per un potenziale di giunzione liquida calcolato -12 mV 33.
- Target la regione di interesse utilizzando coordinate stereotassica, e rapidamente spostare l'elettrodo nel cervello mantenendo forte pressione positiva sulla punta della pipetta. Dopo la penetrazione dura madre e il posizionamento pipetta, misurare la resistenza di punta e scartare gli elettrodi che mostrano un aumento della resistenza di più di 10-15%, al fine di migliorare il tasso di successo dei passi successivi.
- Ridurre la pressione positiva di mezzo per evitare rigonfiamento del tessuto cerebrale circostante. Ulteriori iniziative sono simili al protocollo standard "toppa cieca". Per trovare un neurone registrare dal, abbassare la punta nel cervello in modo graduale fino al rilevamento di un neurone in un primo proximity della punta della pipetta, come indicato da una caratteristica sequenza temporale dei cambiamenti di impedenza degli elettrodi. L'indicatore chiave della presenza di un neurone è un aumento monotono in resistenza dell'elettrodo attraverso vari passaggi consecutivi della pipetta (tipicamente, un aumento del 20% nella resistenza pipetta attraverso tre passaggi 2-micron).
- Per formare un contatto gigaseal con il neurone mirato, applicare una pressione negativa e iperpolarizzazione della pipetta.
- Applicare un breve impulso di una grande pressione negativa alla cella per stabilire la configurazione whole-cell. Ritrarre l'elettrodo di 2-3 micron per mantenere una buona tenuta.
- Record attività spontanea o evocata durante un periodo di tempo desiderato, fino a 20-40 min.
- Dopo la registrazione, rimuovere la pipetta dal cervello.
- Aggiornare il buffer corticale o una goccia di adesivo al silicone sulla finestra cranica, poi incollare un vetrino di vetro rotondo sulla parte superiore del supporto metallico.
- Rilasciare il animal dal braccio di fissaggio testa svitando le viti. Restituire l'animale nella sua gabbia per almeno un giorno prima della registrazione successiva.
- Analizzare i dati con, ad esempio, il software Fitmaster.
- Assuefazione-Dishabituation Olfattivo test in Svegliatevi mouse Muoversi Mobile Homecage
- Attaccare un pezzo di cotone pulito (2 x 2 cm) immerso in acqua di rubinetto al lato interno della parete della homecage cellulare tramite un biadesivo. Dividere la parete homecage cellulare in quattro zone ponendo indicatori di colore sul lato esterno della parete in modo che il pezzo di cotone si trova al centro della "zona bersaglio". Fissare l'animale in braccio headholder di fronte al segmento di muro di fronte alla zona "target" e permettono di adattarsi al homecage mobile per 30 min.
- Prendere un altro pezzo di cotone pulito e bagnarlo con qualche goccia di estratto di vaniglia 1%. Sostituire il cotone pulito sul muro homecage mobile con quella che porta la vanilLa odore. Presentare l'odore per 5 min. Seguire i movimenti del homecage mobile durante il periodo di presentazione odore. Stimare il livello di interesse per l'odore misurando il tempo cumulativo che l'animale trascorre fronte alla zona "target" rispetto al tempo totale di movimento homecage mobile.
- Ripetere la sessione dell'applicazione di 5 minuti per tre volte con l'odore di vaniglia, con un intervallo di 5 minuti tra-session. Utilizzare un nuovo pezzo di cotone "vanilla" in ogni sessione.
- Presentare l'animale con un odore socialmente significativo durante l'ultima, quinta sessione. Bagnate un pezzo pulito di cotone con alcune gocce di urina (ottenuti il giorno precedente da un animale di sesso opposto) e posizionarlo al centro della zona target per 5 min.
- Riconoscimento odore romanzo sveglio mouse in movimento in tutto il homecage cellulare
- Dividere la parete in quattro zone ponendo indicatori di colore sul lato esterno della parete homecage mobile. AttACH due pezzi di cotone pulito (2 x 2 cm) immerse in acqua di rubinetto al lato interno della parete nel mezzo delle zone opposte tra loro (designato come zona obiettivo 1 e zona obiettivo 2). Fissare l'animale in braccio headholder di fronte a un segmento di muro al di fuori delle zone di destinazione e permettono di adattarsi al homecage mobile per 30 min.
- Sostituire entrambi i pezzi di cotone con quelli freschi:. Posto un pezzo di cotone bagnato con l'estratto di vaniglia 1% per la zona 1 bersaglio e un altro bagnato con acqua di rubinetto per zona 2 indirizzare Registrare il video dei movimenti homecage mobile per 10 minuti durante l'odore sessione di presentazione. Calcolare l'odore partecipare come percentuale del tempo che l'animale trascorre fronte zona obiettivo 1 rispetto al tempo totale trascorso rivolto zone 1 e 2.
- Dopo un intervallo di 10 min, inserire un'altra coppia di applicatori sulla parete homecage per il successivo periodo di 10 min. Posizionare il cotone "vanilla" nella zona target 1 e applicatore di cotone bagnato con 1% di banana eXtract nella zona di destinazione 2. Effettuare una registrazione video dei movimenti homecage mobili. Calcola la preferenza per il romanzo odore come la percentuale di tempo che l'animale trascorre di fronte al segmento di muro con il romanzo odore (zona target 2) rispetto al tempo totale di fronte a zone 1 e 2.
Risultati
Il metodo presentato qui è inteso per l'imaging microscopico o monocellulari registrazioni elettrofisiologiche in Svegliatevi, topi testa fissa ma altrimenti liberamente in movimento e si comportano. L'animale può muoversi in due dimensioni in un vero e proprio (al contrario di virtuale), l'ambiente tangibile e familiare, mentre il cranio degli animali è fissato saldamente al braccio di fissaggio testa. Abituare i topi al homecage mobile-aria sollevata consiste di 4-6 giorni di sessioni di formazione di 2 ore due volte al giorno (Figura 1). Gli animali addestrati possono essere usati negli esperimenti immediatamente. Uno studio tipico comprende un certo numero di sessioni di imaging o sessioni di registrazione patch-clamp che sono distanziati a intervalli che vanno da poche ore a diversi giorni o settimane. È importante sottolineare che entrambe le registrazioni ottiche ed elettrofisiologiche possono essere eseguite contemporaneamente stimoli cognitivi o comportamentali e letture, in un singolo esperimento.
Per valutare la stabilità meccanicatesta di fissaggio del mouse nella homecage mobile, le sequenze di immagini di navi corticali etichettati con destrano fluorescente coniugato e dei dendriti corticali esprimenti YFP sono stati raccolti mentre gli animali sperimentali sono state navigando il homecage mobile (Figura 2). Gli spostamenti massimi del cervello durante la locomozione dell'animale non hanno in genere superano 1-1,5 micrometri. Tali spostamenti sono verificati nelle direzioni orizzontale e molto raramente provocato uno spostamento rilevabile del piano dell'immagine, rendendo superflua qualsiasi correzione di artefatti di movimento. Stabile fissazione testa homecage mobile consente la quantificazione delle singole spine dendritiche in animali svegli con la stessa affidabilità in topi anestetizzati. Densità delle spine dendritiche, la morfologia e il fatturato possono essere monitorati durante gli studi longitudinali con più sessioni di imaging eseguiti ad intervalli che vanno da poche ore a diversi giorni o settimane.
L'usabilità del mobile homecage per l'imaging ottico funzionale è stato testato in corteccia somatosensoriale di topi svegli utilizzando due approcci: i) microscopia a due fotoni sui topi transgenici Thy1-GCaMP3 e ii) intrinseca di imaging segnale ottico in topi wild-type. Ca 2 + immagini sono state eseguite a livello 2/3, che contiene corpi cellulari di molti neuroni fluorescente, così come i loro dendriti e assoni (Figura 3). Le trame di fluorescenza-over-time provenienti da regioni selezionate di interesse (ROI) sono mostrati in figura 3, dimostrando l'attività neuronale spontanea (misurata come aumenti transitori GCaMP3 fluorescenza) durante la navigazione attiva del mouse nella homecage mobile. Imaging ottico basato su segnali intrinseci permette la mappatura della distribuzione spaziale dei domini funzionali. Figura 4 illustra i cambiamenti ondulatori nel livello di ossigenazione del sangue (che riflettono attivazione neuronale regionale) che propagano lungo corteccia somatosensoriale in risposta a vibrissa stimolazione alla frequenza di 0,05 Hz.
Per testare la fattibilità di registrazioni di patch-clamp con homecage mobile, abbiamo usato 2-3 mesi di età topi C57BL/6J. Layer 2/3 neuroni nella corteccia somatosensoriale sono stati registrati in configurazione da cellula intera utilizzando la modalità morsetto corrente. Registrazione patch-clamp nel cervello di topi sveglio testa fissa sulle homecage mobile era essenzialmente simile ai non vedenti di patch-clamp in fettine cerebrali. Circa il 50% dei tentativi provocato formazione gigaseal successo, di cui più del 70% ha prodotto la registrazione cellula intera configurazione stabile. Non sono stati osservati eventi di perdere il contatto gigaseal dovuti allo spostamento meccanico delle cellule. Figura 5 illustra un frammento di 60 secondi di un rappresentante di 10 minuti lungo di registrazione corrente-clamp correlata con episodi di attivo (in esecuzione) di topo e (a riposo) stati passivi.

Figura 1. Metodo della testa di fissaggio di topi sveglio nel homecage mobile. A) Presentazione del progetto homecage mobile-aria sollevata e illustrazioni del concetto generale. B) Schema di un tipico temporale sperimentale. Lo studio inizia con l'impianto della finestra cranica due settimane prima abituare il mouse per movimentazione e confezionamento, che è seguita da otto allenamenti due volte al giorno. Lo studio tipico include un numero di sessioni di imaging o sessioni di registrazione patch clamp che sono distanziati a intervalli che vanno da poche ore a diversi giorni o settimane. Entrambe le misure ottiche ed elettrofisiologiche può essere fatto in parallelo con stimoli e letture cognitive o comportamentali all'interno di un singolo esperimento. Cliccate qui per vedere una versione più grande di questa figura.
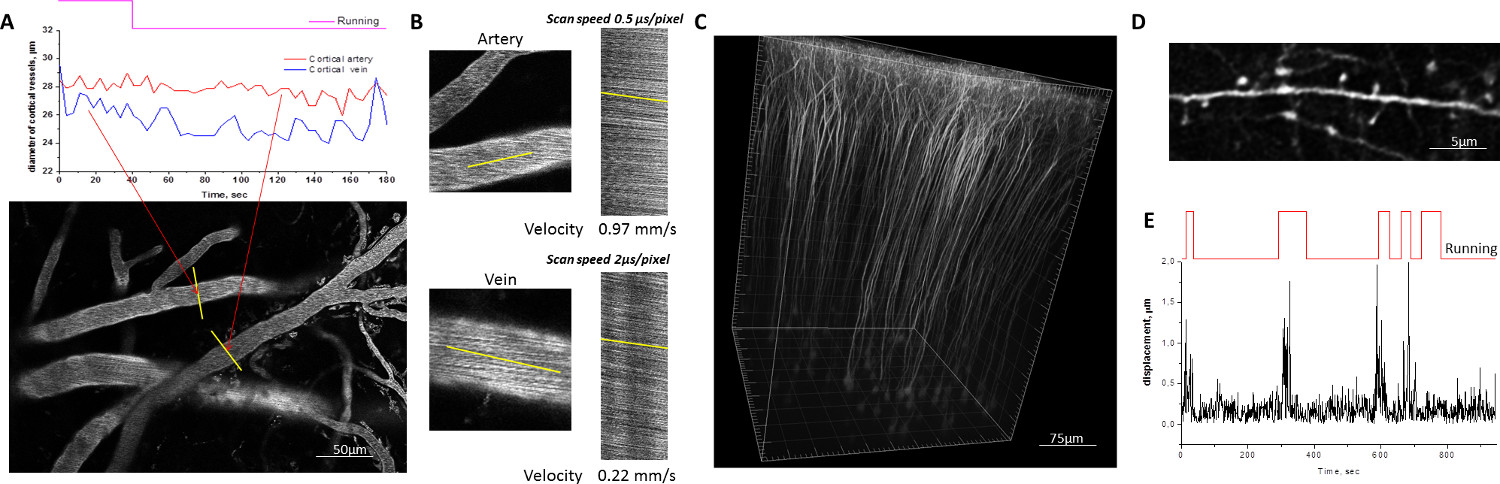
Figura 2. Esempio di due fotoni di imaging microscopico su topi svegli movimento intorno al homecage mobile. A, B) vascolare corticale, etichettato con il destrano Red coniugato 70 kDa Texas. Il diametro dei singoli segmenti di flotta è misurata tracciando nel tempo il profilo delle linee tracciate tra il lume del vaso durante i periodi di riposo di topo e in esecuzione (A). Il tasso di flusso di sangue nelle arterie e vene viene misurata mediante scansione lineare lungo le linee tracciate parallelamente alla parete del serbatoio (B). C, D) Belle dettagli di morfologia neuronale visualizzato nel cervello di topi transgenici che esprimono YFP in sottopopolazione di neuroni sotto il promotore Thy1. Ricostruzione tridimensionale dei neuroni piramidali corteccia somatosensoriale del mouse (C). Le immagini di un dendritica branch acquisito in una veglia, comportandosi del mouse sono sufficientemente stabili per la quantificazione dei singoli spine morfologia dendritica (D). E) Quantificazione del movimento cerebrale causato da movimenti del mouse. Più grandi spostamenti di ampiezza correlano con i periodi di funzionamento del mouse. Cliccate qui per vedere una versione più grande di questa figura.
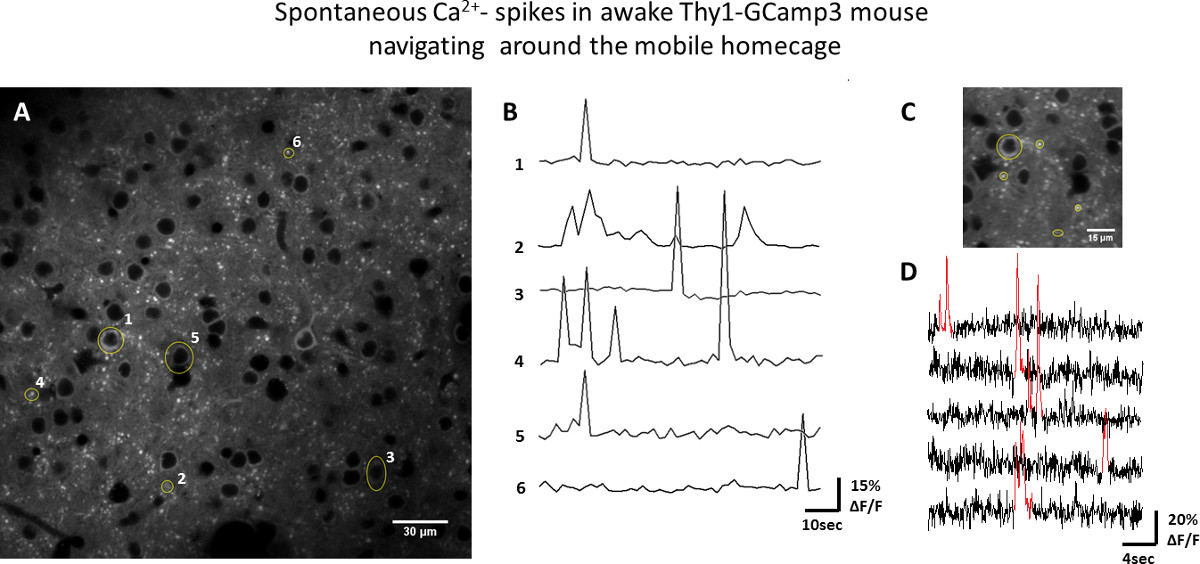
Figura 3. Esempio di attività della popolazione neuronale in veglia Thy1-GCaMP3 del mouse si muove intorno al homecage mobile. A) l'immagine a due fotoni di strato corticale II / III neuroni. ROI, per esempio neuronali corpi cellulari, dendriti e assoni sono mostrati in giallo. B) Af / F tracce della fluorescenza GCaMP3 dal ROI mostrati in A (tempo di serie registrata a 1.5 sec / frame). C) ingrandita in regione ripreso a 65 msec / telaio. D) Fluorescenza dal ROI gialli in C tracciato nel corso del tempo, mostra i transitori aumenti (rosso) in fluorescenza GCaMP3 che corrispondono all'azione potenziali indotti Ca 2 + episodi afflusso. Cliccate qui per vedere una versione più grande di questa figura.
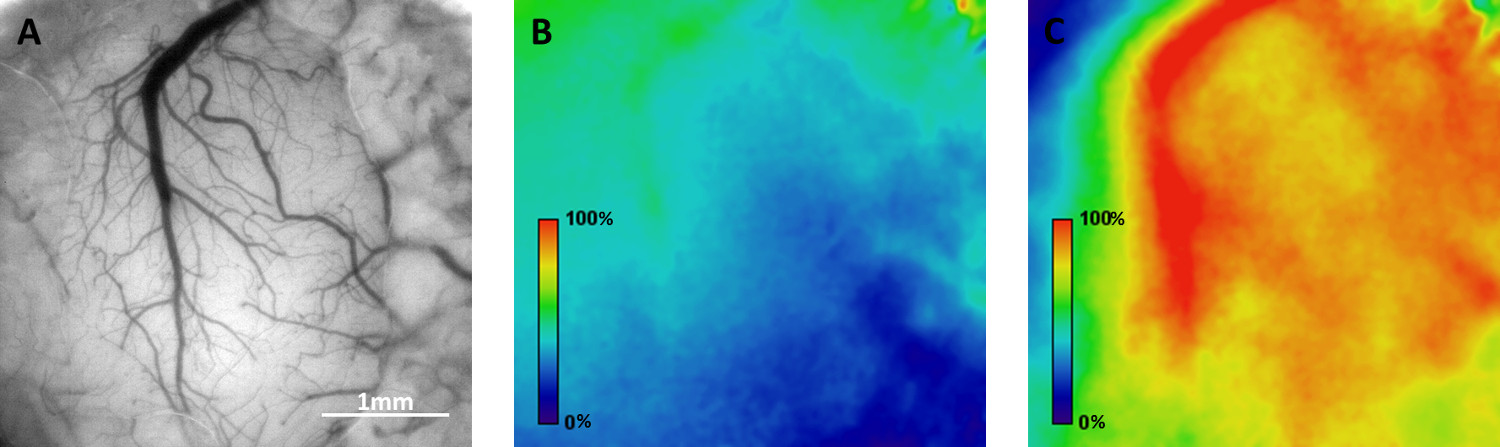
Figura 4. Esempio di mappatura della distribuzione spaziale delle risposte funzionali nella corteccia di un mouse sveglio mediante l'imaging segnali ottici intrinseci. A) Visione luminosa campo dei vasi sanguigni superficiali attraverso la finestra cranica. B) Entità mappa della attività di base in mobile homecage durante un episodio di 6 minuti. C) mappa Entità dell'attività neuronale si propaga lungo corteccia somatosensoriale in risposta alla stimolazione vibrissa ad una frequenza di 0,05 Hz. Cliccare qui per vedere una versione più grande di questa figura.
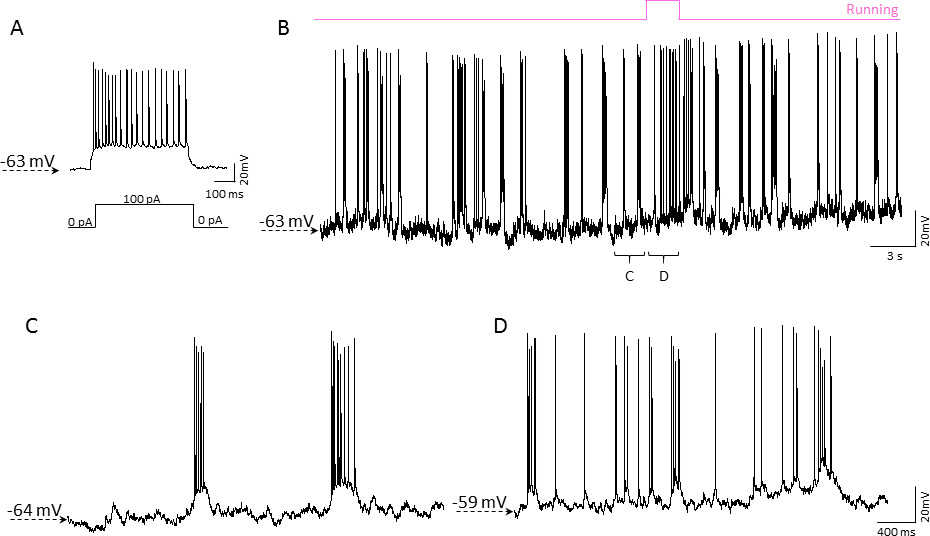
Figura 5. Esempio di whole-cell patch-clamp registrazione nella corteccia di un mouse sveglio spostamento in homecage mobile. A) di registrazione corrente-clamp da un neurone nello strato corticale del mouse 2/3. 0,5 sec, iniezione di corrente da 100 pA (di seguito indicato la traccia), si traduce in uno scoppio di potenziali d'azione. La cella ha mostrato adattamento frequenza caratteristica spike per i neuroni piramidali. B) Continuo registrazione corrente-clampdal medesimo neurone correlata con l'attività del mouse 'locomotoria (mostrato in rosa sopra la traccia). Attività spontanea Rappresentante dello strato di 2/3 dei neuroni durante i periodi di mouse del riposo (C) e in esecuzione (D). Cliccare qui per vedere una versione più grande di questa figura.
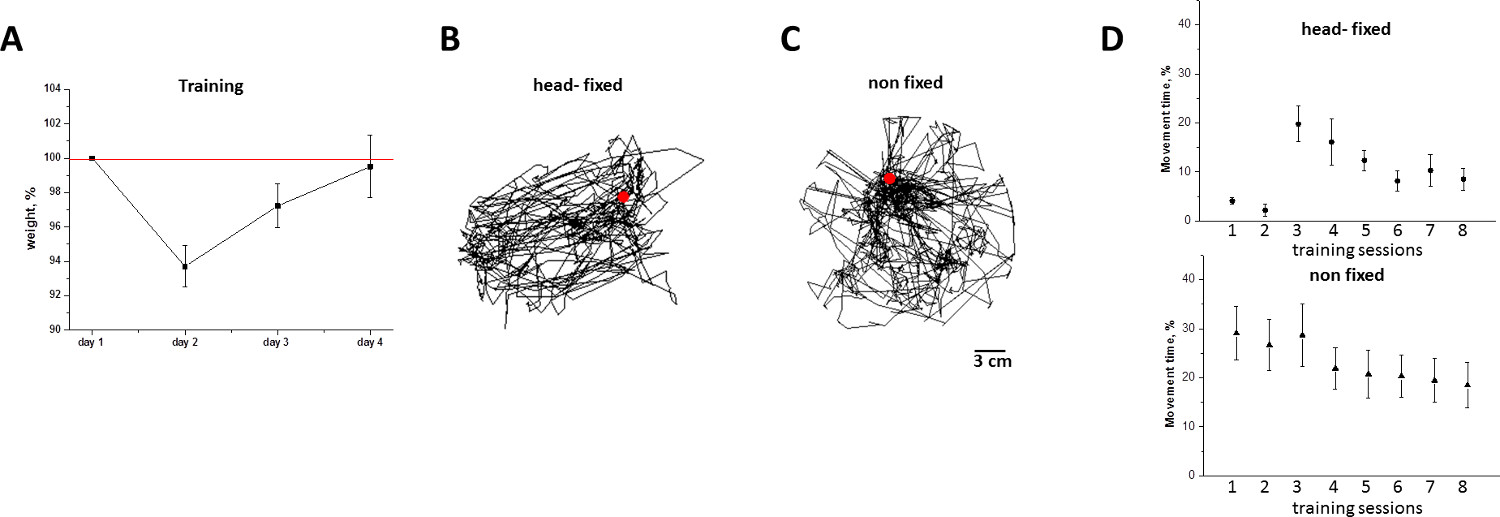
Figura 6. Perdita di peso degli animali e dell'attività locomotoria nei topi head-fixed/non-fixed durante le sessioni di formazione in homecage mobile. A) il peso degli animali (media + SD,%) prima di allenamenti. Si noti che la perdita di peso è completamente annullata dalla 7-8 ° allenamento. B) traiettoria del mouse locomozione orizzontale rispetto al homecage mobile,che è stato estrapolato dal movimento tracciato della homecage mobile durante 8 ª sessione di formazione. C) i movimenti cingolati di un mouse non-head-fisso esplorare la gabbia rotonda durante l'8 ª sessione di formazione. D) Durata della testa fissa (cerchio) e non fisso (triangolo) il movimento topi durante 1-4 ° giorno di allenamento (media + SD,%). Si noti che, il giorno 4, i topi testa-fisso non presentano né congelamento (come il giorno 1), né un eccesso di attività locomotoria. cliccate qui per vedere una versione più grande di questa figura.
Discussione
Per meglio comprendere la fisiologia del cervello e patologia, la ricerca deve essere eseguita su una varietà di livelli di complessità di preparazione, utilizzando le tecniche più appropriate per ciascun preparato. Allo stato attuale, una vasta gamma di metodologie neuroscienze (da full-body fMRI alla microscopia STED sub-organello) sono facilmente applicati agli animali anestetizzati, mentre esperimenti su animali svegli e comportarsi hanno rappresentato una sfida metodologica significativo.
Qui, un nuovo approccio è descritto in cui un animale da laboratorio, pur essendo fermamente testa fissa, in grado di muoversi un homecage mobile-aria alzato ed esplorare il suo ambiente concreto in condizioni senza stress. La preparazione animale testa fissa comportarsi qui presentato offre una serie di vantaggi importanti. In primo luogo, i dati elettrofisiologici o di imaging ottenuti con questo metodo sono compromessi né dalla anestesia né da stress vincolare indotta. Posizionamento del mouse in casa mobilegabbia è veloce e non richiede l'anestesia l'animale, anche transitoriamente. In secondo luogo, la homecage aria sollevata assicura la stabilità meccanica necessaria per quantificare i cambiamenti in fine morfologia neuronale e registrare cella singola attività elettrofisiologica in animali svegli. Infine, il design del homecage mobile è più compatta rispetto al tapis roulant sferica, consentendo il posizionamento della homecage mobile sotto un microscopio verticale standard per due fotoni imaging o registrazione patch-clamp in cervello sveglio del mouse.
Fissazione testa ferma nel homecage mobile richiede l'impianto di un supporto metallico a quattro ali appositamente progettato, con una apertura circolare al centro per l'accesso ottica o elettrica alla regione cerebrale sottostante. Questi supporti metallici sono attaccati al cranio mediante una combinazione di colla, cemento dentale e di una vite avvitata nell'osso cranio. Questa procedura chirurgica è stata sviluppata sulla base di un gran numero di precedentementeprocedure pubblicate, ed è stato trovato per causare un preparato finestra cranica stabile e riproducibile. Per gli esperimenti in vivo elettrofisiologiche, una finestra a forma di mezzaluna 34, una piccola craniotomia dimensioni (inferiore a 0,5 mm) 32, e una preparazione copertura in vetro forato 35 sono state utilizzate. Qui, il "invertito" finestra del cranio è stato impiantato sia con un grande (diametro 3,5 mm) o piccole (diametro inferiore a 0,5 mm) craniotomia. Riducendo al minimo movimento del cervello è fondamentale per le registrazioni singola cellula stabili, è per questo che è consigliabile eseguire craniotomie di piccole dimensioni per esperimenti di elettrofisiologia. Dopo l'impianto della finestra cranica per esperimenti di imaging ottico, gli animali possono recuperare per almeno 2 o 3 settimane, durante il quale la finestra perde prima transitoriamente la sua trasparenza e poi riacquisisce essa (con una resa del 50-70%, a seconda background genetico del ceppo mouse). La trasparenza della finestra cranica e la stabilitàlità del cemento "tappo" dentale attaccato al cranio può essere verificata mediante un microscopio binoculare regolare e ispezione fisica durante la movimentazione degli animali. Al termine del periodo di recupero di 2-3 settimane, gli animali che presentano segni di infiammazione residua post-operativa o difetti meccanici in cemento dentale dovrebbero essere escluse dagli esperimenti e terminati.
L'età ottimale per iniziare la formazione del topo è di 2-4 mesi (corrispondente al peso di 20-40 g). Negli animali giovani, ancoraggio del cemento "tappo" dentale al cranio può essere inaffidabile, che può diminuire la sua resistenza alle sollecitazioni meccaniche che viene imposto dal locomozione del mouse testa fissa nel homecage mobile. Sebbene topi maschi e femmine appaiono ugualmente disposti a spostarsi in homecage mobile, c'è una tendenza per ottenere una migliore percentuale di intervalli cranici recuperare la loro trasparenza nei topi femmina (dati non mostrati). Quindi, per to garantire un equilibrato mix di generi nella coorte di animali selezionati per l'imaging, l'impianto finestre craniche in circa il 30% più topi maschi è raccomandato. Interazioni sociali sono noti per migliorare il benessere degli animali e ridurre lo stress, quindi è consigliabile che fratellini siano gestiti e addestrati in parallelo e tenuti insieme in gabbie di stabulazione in gruppo.
In contrasto con le procedure pubblicate per la preparazione treadmill sferica 13, il metodo che utilizza la homecage mobile non richiede anestetizzare il mouse al momento del fissaggio testa. Questa differenza è importante perché consente di escludere eventuali effetti residui che anche una breve e "leggera" episodio anestesia rischia di avere sulle misurazioni fisiologiche ottenute poco dopo. Infatti, anche se negli studi in cui la fissazione di testa è stato fatto sotto anestesia e gli esperimenti reali sono state avviate dopo un breve periodo di attesa 13, non si puòescludere eventuali effetti a lungo termine del breve episodio anestesia sui dati sperimentali. Altri studi si sono basati sulla privazione di acqua per assuefazione sistematica degli animali a testa di fissaggio e usato ricompensa acqua come mezzo di motivare l'animale a rimanere immobile 36. Tuttavia, il metodo di fissazione testa ricompensa a base limita la scelta dei test comportamentali applicabili e, soprattutto, occupa una delle associazioni stimolo-ricompensa ben consolidati. Al contrario, il metodo di topo assuefazione alla testa di fissaggio in homecage mobile non richiede privazione di acqua e successiva premio.
Completando la homecage mobile con un sistema di erogazione di acqua è consigliato per gli esperimenti di lunga durata. Le sessioni di addestramento di animali ed esperimenti qui presentate sono state fatte durante il giorno (8:00-06:00), che corrisponde al periodo fisiologicamente passivo per quei topi che vengono tenuti sotto il piano della luce di 12 ore standard (lillum na su alle 6 del mattino e si spegne alle 06:00). Poiché l'assunzione di acqua è direttamente associato con l'attività del topo, durante i topi periodo passivi non richiedono erogazione acqua se la durata di una sessione di allenamento / immagini / registrazione non superi 2 ore. Oltre alla tempistica e la durata delle sessioni di formazione, si ha la necessità di affrontare la questione del numero ottimale di sedute necessarie per abituare gli animali homecage mobile. A tal fine, due criteri sono stati utilizzati per valutare lo stress indotto dalla testa le procedure di fissaggio: i) la perdita di peso, e ii) il livello di attività locomotoria. Come mostrato in Figura 6, la perdita di peso raggiunge il livello medio del 6% sulla formazione giorno 2, ed è completamente invertito giornata di formazione 4 (Figura 6A). Coerentemente con le dinamiche di pesatura, il livello di attività locomotoria degli animali testa-fisso viene soppresso il primo giorno di formazione, ma stabilizza dopo giorno formazione 4 (Figura 6D). In base a queste misurazioni, si sugt che la durata minima del periodo di formazione mouse su homecage cellulare è di 4 giorni, come descritto nel presente protocollo.
L'uso del-aria sollevata, homecage mobili TV a pavimento permette di aggiungere compiti complessi (sensomotorie, percettive e cognitive) ai paradigmi di formazione per topi testa-fisso. Nel presente studio vengono presentati due protocolli di test comportamentali. Entrambi i protocolli utilizzano tracce olfattive e possono essere combinati con longitudinali immagini / registrazioni nella corteccia mouse. Anche se il homecage cellulare viene prodotta con materiali non assorbenti, bisogna comunque tenere conto di possibili interferenze tra l'odore del dispositivo e prova di odore (s). Un altro fattore che può interferire con visuali / segnali tattili di un esperimento comportamentale è la giunzione tra la parete e l'inserto, che non è perfetta e può, quindi, essere percepito dal l'animale come un punto di riferimento. Vale la pena notare qui che, al fine di minimizzare lo stress dell'animale durante tale integrazionerventions il posizionamento di un cotone odore presentando alla parete homecage mobile, sperimentatore dovrebbero praticare effettuare tali interventi il più rapidamente possibile, evitando manipolazione prolungata della gabbia carbonio. Strategie per romanzo presentazione odore / oggetto alternative sono concepibili, ad esempio, ponendo soluzione a base di idrogel gocce o oggetti (quali chip alimentari) su piccole mensole fissate alla superficie interna della parete della gabbia carbonio all'altezza compatibile con posizionamento testa dell'animale.
Homecage Mobile consente di animali testa-fisso per eseguire una vasta gamma di movimenti bidimensionali tra cui locomozione orizzontale, situp, governare, sbattere, leccare, naso frugando, i movimenti delle zampe anteriori qualificati, e toccante parete con arti anteriori, come illustrato nel presente studio . Utilizzando homecage mobile e protocolli qui presentati, i ricercatori possono studiare il sistema neuronale sensomotoria con un alto livello di controllo sia la condizione di stimolaziones e alle letture comportamentali. Inoltre, studi di capacità cognitive nei topi svegli possono essere eseguite durante il condizionamento, la navigazione spaziale e compiti decisionali.
Ci sono diverse limitazioni pratiche di questo metodo. In primo luogo, è necessaria una notevole quantità di aria in pressione per raggiungere la potenza-homecage sollevamento ed effettuare esperimenti di lunga durata. In secondo luogo, la homecage cellulare nella sua attuale implementazione è solo 18 cm di diametro, e quindi fornisce una relativamente piccola e semplice spazio rispetto alla realtà virtuale, dove un ambiente sperimentale complesso può essere progettato senza limitazioni spaziali. In terzo luogo, durante il baffo stimolazione ed esperimenti a base di ricompensa-qui presentati, un dispositivo è stato utilizzato che limita la possibilità al muro contatto per il mouse. Aggiunta di un canale visivo o sensoriale esterno stimolazione (ad esempio un proiettore di luce-eye diretto) richiederebbe la progettazione di un dispositivo più ergonomico e compatto rispetto aii multipli a schermo o dome-proiezione soluzioni che sono stati utilizzati negli esperimenti tapis roulant sferiche.
In sintesi, l'uso dei topi testa fissa spostano nella homecage mobile-aria sollevata facilita notevolmente gli studi che combinano livelli cellulari, molecolari e comportamentali di osservazione e manipolazione in un singolo esperimento. Le applicazioni specifiche qui illustrati sono due fotoni di imaging microscopico, intrinseco di imaging segnale ottico e registrazioni di patch-clamp in topi Comportarsi non anestetizzati. Si prevede che questo approccio aprirà nuovi orizzonti nella sperimentazione su svegli, comportandosi mouse e servire come un utile strumento sia per lo sviluppo di farmaci e la ricerca di base delle funzioni cerebrali.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano il Prof. Eero Castren per i suoi preziosi commenti sul manoscritto. Il lavoro è sostenuto da finanziamenti L'Accademia di Finlandia, il Centro per la Mobilità Internazionale della Finlandia, e il finlandese Graduate School of Neuroscience (cervello e della mente Dottorato).
Materiali
| Name | Company | Catalog Number | Comments |
| Tweezers, Stainless Steel, 115 mm | XYtronic | XY-2A-SA | |
| Animal trimmer, shaving machine | Aesculap | Isis GT420 | |
| Binocular Microscope | Zeiss | Stemi 2000 | |
| Biological Temperature Controller with stainless steel heating pad | Supertech | TMP-5b | |
| Blunt microsurgical blade | BD | REF 374769 | |
| Borosilicate tube with filament | Sutter Instruments | BF120-69-10 | For patch pipette production |
| Camera | Foscam | FI8903W | Night visibility |
| Carprofen | Pfizer | Rimadyl vet | |
| Dental cement | DrguDent, Dentsply | REF 640 200 271 | |
| Dexamethasone | FaunaPharma | Rapidexon vet | |
| Disposable drills | Meisinger | HP 310104001001008 | |
| Dulbeco’s PBS 10x | Sigma | D1408 | |
| Dumont #5 forceps, 110 mm | FST | 91150-20 | |
| Eyes-lubricant | Novartis | Viscotears | For eyes protection during operation and as viscose solution for immersion |
| Foredom drill control | Foredom | FM3545 | |
| Foredom micro motor handpiece | Foredom | MH-145 | |
| Four-winged metal holder | Neurotar | ||
| Head Holder for Mice | Narishige | SG-4N | Assembled on stereotaxic instrument |
| Hemostasis Collagen Sponge | Avitene, Ultrafoam BARD | Ref 1050050 | |
| Imaris | Bitplane | ||
| Ketamine | Intervet | Ketaminol vet | |
| Kwik-Sil | WPI | ||
| Mai Tai DeepSee laser | Spectra-Physics | ||
| Micro dressing forceps, 105 mm | Aesculap | BD302R | |
| Microelectrode puller | Narishige | PC-10H | Vertical puller for glass pipette production |
| Micromanipulator | Sensapex | ||
| Mini bolt | Centrostyle | Ref. 00343 s/steel M1.0x4.5 | |
| Mobile Homecage | Neurotar | ||
| Multiphoton Laser Scanning Microscope | Olympus | FV1000MPE | |
| Nonwoven swabs, 5 x 5 | Molnlycke Health Care | Mesoft | Surgical tampons |
| Polyacrylic glue | Henkel | Loctite 401 | |
| Round glass coverslip | Electron Microscopy Sciences | 1.5 thickness | |
| Small animal stereotaxic instrument | David Kopf Instruments | 900 | |
| Student iris scissors, straight 11.5 cm | FST | 91460-11 | |
| Xylazine | Bayer Health Care | Rompun vet |
Riferimenti
- Li, N., et al. mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists. Science. 329, 959-964 (2010).
- Sitdikova, G., et al. Isoflurane suppresses early cortical activity. Annals of Clinical and Translational Neurology. 1 (1), 15-26 (2013).
- Helmchen, F., Fee, M. S., Tank, D. W., Denk, W. A miniature head-mounted two-photon microscope. high-resolution brain imaging in freely moving animals. Neuron. 31, 903-912 (2001).
- Piyawattanametha, W., et al. In vivo brain imaging using a portable 2.9 g two-photon microscope based on a microelectromechanical systems scanning mirror. Optics letters. 34, 2309-2311 (2009).
- Sawinski, J., Wallace, D. J., Greenberg, D. S., Grossmann, S., Denk, W., Kerr, J. N. D. Visually evoked activity in cortical cells imaged in freely moving animals. Proceedings of the National Academy of Sciences of the United States of America. 106, 19557-19562 (2009).
- Fee, M. S. Active stabilization of electrodes for intracellular recording in awake behaving animals. Neuron. 27, 461-468 (2000).
- Greenberg, D., Houweling, A., Kerr, J. Population imaging of ongoing neuronal activity in the visual cortex of awake rats. Nat Neurosci. 11 (7), 749-751 (2008).
- Fujiwara-Tsukamoto, Y., et al. Reinforcing operandum: rapid and reliable learning of skilled forelimb movements by head-fixed rodents. Journal of Neurophysiology. 108, 1781-1792 (2012).
- Scott, B. B., Brody, C. D., Tank, D. W. Cellular Resolution Functional Imaging in Behaving Rats Using Voluntary Head Restraint. Neuron. 80, 371-384 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nat Neurosci. 13, 1433-1440 (2010).
- Parry, T. J., McElligott, J. G. A method for restraining awake rats using head immobilization. Physiolog & behavior. 53 (5), 1011-1015 (1993).
- Brecht, M., Schneider, M., Sakmann, B., Margrie, T. W. Whisker movements evoked by stimulation of single pyramidal cells in rat motor cortex. Nature. 427 (6976), 704-710 (2004).
- Van Looij, M. A. J., Liem, S. -. S., van der Burg, H., van der Wees, J., De Zeeuw, C. I., van Zanten, B. G. A. Impact of conventional anesthesia on auditory brainstem responses in mice. Hearing research. 193, 75-82 (2004).
- Hentschke, H., Schwarz, C., Antkowiak, B. Neocortex is the major target of sedative concentrations of volatile anaesthetics: strong depression of firing rates and increase of GABAA receptor-mediated inhibition. The European journal of neuroscience. 21, 93-102 (2005).
- Margrie, T. W., Brecht, M., Sakmann, B. In vivo, low-resistance, whole-cell recordings from neurons in the anaesthetized and awake mammalian brain. Pflugers Archiv: European journal of physiology. 444, 491-498 (2002).
- Crochet, S., Petersen, C. C. H. Correlating whisker behavior with membrane potential in barrel cortex of awake mice. Nat Neurosci. 9, 608-610 (2006).
- Houweling, A. R., Brecht, M. Behavioural report of single neuron stimulation in somatosensory cortex. Nature. 451, 65-68 (2008).
- Poulet, J. F. A., Petersen, C. C. H. Internal brain state regulates membrane potential synchrony in barrel cortex of behaving mice. Nature. 454, 881-885 (2008).
- Bryant, J. L., Roy, S., Heck, D. H. A technique for stereotaxic recordings of neuronal activity in awake, head-restrained mice. Journal of neuroscience methods. 178, 75-79 (2009).
- De Kock, C. P. J., Sakmann, B. Spiking in primary somatosensory cortex during natural whisking in awake head-restrained rats is cell-type specific. Proceedings of the National Academy of Sciences of the United States of America. 106, 16446-16450 (2009).
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large-scale neural activity with cellular resolution in awake, mobile mice. Neuron. 56, 43-57 (2007).
- Hentschke, H., Haiss, F., Schwarz, C. Central signals rapidly switch tactile processing in rat barrel cortex during whisker movements. Cerebral cortex. 16, 1142-1156 (2006).
- Stüttgen, M. C., Rüter, J., Schwarz, C. Two psychophysical channels of whisker deflection in rats align with two neuronal classes of primary afferents. J. neuroscience. 26, 7933-7941 (2006).
- Connor, D. H., Peron, S. P., Huber, D., Svoboda, K. Neural activity in barrel cortex underlying vibrissa-based object localization in mice. Neuron. 67, 1048-1061 (2010).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extend arteriole capacity. Proceedings of the National Academy of Sciences of the United States of America. 108 (20), 8473-8478 (2011).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461, 941-946 (2009).
- Chen, G., King, J. A., Burgess, N., O’Keefe, J. How vision and movement combine in the hippocampal place code. Proceedings of the National Academy of Sciences of the United States of America. 110 (1), 378-383 (2013).
- Harvey, C. D., Coen, P., Tank, D. W. Choice-specific sequences in parietal cortex during a virtual-navigation decision task. Nature. 484 (7392), 62-68 (2012).
- Holtmaat, A., et al. Long-term , high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat Protoc. 4 (8), 19-22 (2009).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. J. Vis. Exp. (12), (2008).
- Portera-Cailliau, C., Trachtenberg, J. T., de Paola, V., Svoboda, K., Wilbrecht, L., Holtmaat, A. Imaging Neocortical Neurons through a Chronic Cranial Window. Cold Spring Harbor Protocols. 2012, (2012).
- Garaschuk, O., Milos, R. -. I., Konnerth, A. Targeted bulk-loading of fluorescent indicators for two-photon brain imaging in vivo. Nat Protoc. 1 (1), 380-386 (2006).
- Barry, P. H. JPCalc, a software package for calculating liquid junction potential corrections in patch-clamp, intracellular, epithelial and bilayer measurements and for correcting junction potential measurements. Journal of neuroscience methods. 51 (1), 107-116 (1994).
- Golshani, P., Gonçalves, J. T., Khoshkhoo, S., Mostany, R., Smirnakis, S., Portera-Cailliau, C. Internally mediated developmental desynchronization of neocortical network activity. The Journal of neuroscience. 29 (35), 10890-10899 (2009).
- Polack, P. -. O., Friedman, J., Golshani, P. Cellular mechanisms of brain state-dependent gain modulation in visual cortex. Nat Neurosci. 16 (9), 1331-1339 (2013).
- Schwarz, C., et al. The head-fixed behaving rat--procedures and pitfalls. Somatosensor., & motor research. 27, 131-148 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon