Method Article
Minimal procedura chirurgica invasiva di indurre infarto miocardico nei topi
In questo articolo
Riepilogo
A highly reproducible model for myocardial infarction in mice with minimal invasive manipulations is described. The model can be easily performed, resulting in a high reproducibility and survival rate. Thus, the described model will reduce the number of required animals as requested by the 3R principle (Replacement, Refinement and Reduction).
Abstract
Infarto del miocardio rimane ancora la principale causa di morte nei paesi occidentali, nonostante i notevoli progressi nel settore dello sviluppo dello stent negli ultimi decenni. Per chiarimento dei meccanismi alla base e lo sviluppo di nuove strategie terapeutiche, la disponibilità di modelli animali validi sono obbligatori. Dal momento che abbiamo bisogno di nuove intuizioni in meccanismi patogenetici delle malattie cardiovascolari sotto le condizioni in vivo per combattere l'infarto del miocardio, la validità del modello animale è un aspetto cruciale. Tuttavia, la protezione degli animali sono molto rilevante in questo contesto. Pertanto, stabiliamo un modello mini-invasiva e semplice di infarto miocardico nei topi, che garantisce una riproducibilità elevata e il tasso di sopravvivenza degli animali. Così, questo modello soddisfa i requisiti del principio 3R (Replacement, miglioramento e riduzione) per gli esperimenti sugli animali e garantire le informazioni scientifiche necessarie per l'ulteriore sviluppo di strategie terapeutiche per cardiovmalattie ascular.
Introduzione
L'infarto miocardico è una delle principali cause di morte nei paesi industrializzati. Nonostante innegabili progressi di approcci diagnostici e terapeutici, le malattie cardiovascolari sono ancora la principale causa di mortalità. Data la speranza di vita migliore e rischi connessi con la vita, un continuo aumento dell'incidenza di malattie cardiovascolari è prevista per il futuro. Pertanto, vi è una forte necessità di stabilire e validare nuovi approcci per il trattamento delle malattie cardiovascolari. Le informazioni di studi sull'uomo soffrono suoi limiti, questi studi sono generalmente sufficienti per spiegare e comprendere i meccanismi a livello molecolare, essendo in grado di fornire soluzioni a questi problemi di salute.
Inoltre, la ricerca di base è stato limitato a causa della complessità e difficoltà di riprodurre i meccanismi di malattie cardiovascolari in laboratorio. Pertanto, per aumentare la nostra conoscenza sulla fisiopatologia di cardiomalattie vascolari, è essenziale per convalidare modelli animali 1,2. Tuttavia, per identificare tutte le cascate di eventi molecolari coinvolti nella guarigione dopo infarto miocardico, analisi a differenti tempi è necessaria, causando un gran numero di animali esperimenti.
Esperimenti di infarto del miocardio sono spesso eseguiti utilizzando modelli animali. Indurre infarto miocardico nei piccoli animali 3-11 è il modello più adatto ed efficiente impiegato per indagare gli eventi cellulari e molecolari di modelli animali di grandi dimensioni. Inoltre, nessuna altra specie presenta la disponibilità di transgenici o knockout ceppi come mouse a 12. Questi modelli di topo sono molto utili in altre malattie, tra cui patologie cardiovascolari (come l'aterosclerosi, in stent restenosi) 13,14. Inoltre, il periodo di bassa gravidanza e l'elevato numero di progenie qualificano modelli murini come sistema più attraente per lo studio dei meccanismi molecolari di INFA miocardicarction 12.
Tuttavia, la dimensione del cuore nei topi aspetta elevata precisione di manipolazione durante microchirurgia. Insegnare tale personale qualificato e specializzato di chirurgia è in termini di tempo e di processo ad alta intensità di lavoro. Pertanto, noi qui presentiamo una procedura di microchirurgia dettagliata, compresi suggerimenti e trucchi per guidare i collaboratori anche con qualifiche medie, come studenti o ai tecnici di eseguire il complesso modello di infarto miocardico nei topi.
Inizialmente, l'intubazione viene eseguita mediante una cannula corta senza utilizzare la tracheotomia. L'incisione toracica si trova nella zona intercostali, evitando lesioni di nervature o / e il tessuto circostante. Questo sotto-fase è molto importante per assicurare un veloce recupero e guarigione 15. La legatura è fatta differenziale per i modelli di ischemia cronica e ischemia / riperfusione, per un elevato tasso di sopravvivenza, pur mantenendo una dimensione significativa infarto. La nostra esperienza mostra that con sutura di seta assicura una riproducibilità più elevato rispetto a crio-lesioni 16.
In conclusione, il metodo qui descritto è applicabile sia ischemia cronica e modelli di ischemia / riperfusione in piccoli animali. I trucchi e suggerimenti presentati in questo procedimento hanno lo scopo di consentire al personale in possesso della qualifica anche basso o medio da applicare in piccoli modelli animali.
Protocollo
NOTA: Gli esperimenti presentati in questo documento vengono eseguiti di conseguenza per il basso tedesco e alle linee guida europee per la cura degli animali. Gli animali vengono allevati nella struttura animali di Institute for Laboratory Animal Science, Universiy ospedale Aachen, in Germania, sotto la supervisione del Prof. Dr. R. Tolba e Dr. A. Teubner (animale assistente sociale).
1. Animal Care
- Tenere i topi in un reparto di terapia specializzata, assicurando un adeguato accesso al cibo e controllo veterinario specializzato e il trattamento. Se gli animali vengono spostati o acquistati all'esterno, si prega di assicurare una settimana alloggio prima di subire la procedura.
2. intubazione
- Anestetizzare 8-10 settimane vecchio maschio C57BL / 6 topi wild-type, 25-27 g con iniezione intraperitoneale di 100 mg / kg di ketamina e 10 mg / kg xylazina. Monitorare il livello di anestesia da punta riflessi pizzico. Posizionare vet unguento sugli occhi per prevenire la secchezza durante la procedura.
- gestire la terapia del dolore con buprenophine 0,1 mg / kg di peso corporeo per via sottocutanea prima di iniziare la procedura chirurgica, seguendo le linee guida per la cura degli animali della vostra istituzione.
- Assicurare il mantenimento delle condizioni di sterilità per evitare infezioni durante l'intervento chirurgico, utilizzando materiali e strumenti sterili.
- Posizionare il mouse anestetizzato in posizione supina su un tavolo operatorio riscaldato. Rimuovere i capelli da entrambi zona ventrale del collo e la metà sinistra del torace utilizzando un piccolo rasoio e disinfettare con alcool al 70% prima incisione.
- Eseguire una piccola incisione mediana di 0.5 cm usando forbici chirurgiche nel centro del collo. Sotto la pelle, passare attraverso i corpi grassi 2 con una pinza sterile curve e visualizzare la trachea sotto stereomicroscopio attraverso la trasparenza del muscolo copertura.
- Introdurre oralmente la cannula di intubazione nella trachea sotto vista utilizzando lo stereomicroscopio (Figura 1A). Distinguere la cannula metallica through il tessuto trasparente. E controllare, la posizione e la posizione durante l'operazione in qualsiasi momento (Figura 1B).
- Collegare la cannula al piccolo ventilatore animali e regolare le impostazioni di ventilazione secondo produce linee guida (volume corrente tra i 100-150 ml e una frequenza respiratoria tra 100-150 al minuto).
3. Myocardial Infarction induzione
- Eseguire una incisione cutanea meno di 0,5 centimetri nel bel mezzo di una linea tra xifoideo e axila sinistra. Utilizzare pinze per separare lo strato muscolare dalle costole sottostanti.
- Eseguire una piccola incisione tra nervature utilizzando una piccola forbice fino alla cavità toracica è aperta 17. Per miocardico cronico, eseguire l'incisione nel 5 ° spazio intercostale (Figura 1C) e / o per il modello di ischemia / riperfusione, nel 4 ° spazio intercostale (Figura 1D): per un numero più facile approccio dal basso TH 2 e la 3 ° spazio intercostale, rispettivamente).
- Posizionare i divaricatori nell'incisione di aprire cavità toracica e di visualizzare il cuore.
- Rimuovere con attenzione il pericardio per evitare eccessive processi fibrotici.
- Visualizzare coronaria sinistra discendente (LAD) come una luce nave rosso intenso posizionato. Se il LAD non può essere visualizzato, prendere in considerazione alcuni punti di riferimento per aumentare la riproducibilità.
- Per il modello miocardico cronico, posizionare la legatura a metà del lato ventrale del cuore (tra il padiglione auricolare e apice), avendo come riferimento la vena come mostrato nella Figura 1C. Associare entrambi i rami dell'arteria con 0/7 sutura di seta per ottenere un transmurale anteriore e posteriore del miocardio. Il colore grigio indica la posizione di legatura e può essere ripetuto se necessario (Figura 1C).
- Per ischemia modello / riperfusione, posizionare la legatura sotto il padiglione auricolare, il corpo principale della LAD (Figura 1D). Il ligature si trova su un tubo in silicone per proteggere l'integrità della nave. Il colore grigio indica l'area infartuata e dovrebbe comparire in tutta cuore (Figura 1D). Posizionare suture temporali sulle costole durante il periodo di ischemia e bagnare con un impacco per evitare l'essiccamento del tessuto. Dopo ischemia, rimuovere il tubo di silicone e tagliare la sutura con piccole forbici per visualizzare la riperfusione.
- Oltre ai anestetici e analgesici utilizzati all'inizio del procedimento (passi 2.1 e 2.2), utilizzare 0,5% isoflurano durante l'intervento per garantire il corretto comodità dell'animale, o seguire le linee guida per la cura degli animali della vostra istituzione.
4. sutura e ripristino
- Eliminare l'aria residua dal torace riempiendo con soluzione calda di sale isotonica.
- Chiudere il torace con 3 suture 0/6 (come mostrato nella Figura 2A e 2B). Posizionare suture mediali ad un angolo di 90 °, per assicurare comeealed chiusura delle nervature, come mostrato nella Figura 2 (Figura 2A, B).
- Chiudere lo strato muscolare con 2 punti di sutura (Figura 2C) e la pelle con 3-4 punti di sutura 0/6 (Figura 2D). Eseguire queste suture separatamente per ottenere una finestra adeguata per ulteriori misurazioni ecocardiografica.
- Staccare la cannula di intubazione dal ventilatore e consentire respiro spontaneo. Per l'identificazione, marcando il mouse utilizzando il sistema locale (chiedere al responsabile del benessere degli animali dal vostro istituto).
- Adagiare il mouse sul lato sinistro sotto la lampada rossa fino a quando non si sveglia. Non lasciare un animale incustodito fino a quando non ha ripreso conoscenza sufficiente. Non consentire a un animale che è stato sottoposto a un intervento chirurgico per essere in compagnia di altri animali fino alla completa guarigione.
- Gestire la terapia del dolore con buprenophine 0,1 mg / kg di peso corporeo, per via sottocutanea per i prossimi 3 giorni, seguendo le linee guida per la cura degli animali della vostra istituzione.
5. Analisi del Myocardial Infarction
- Monitorare regolarmente la funzione cardiaca mediante ecocardiografia (figura 3A): la frazione di eiezione, frazione di accorciamento, gittata cardiaca e le dimensioni del cuore.
- Anestetizzare gli animali utilizzando iniezione intraperitoneale di 100 mg / kg ketamina e 10 mg / kg xilazina. Verificare il corretto anesthetization prima dell'intervento dalla mancanza di riflessi.
- Aprire la cavità toracica e accise cuore, ponendolo in soluzione sterile PBS lavaggio ampiamente il sangue residuo.
- Se necessario, raccogliere il sangue direttamente dal cuore, evitando la lesione delle regioni infracted, o dopo la rimozione del cuore, dalla cavità toracica.
- Dopo il lavaggio, si ferma il cuore in Diastola in soluzione KCl satura (sterile filtrato 3M KCl in PBS). Per l'analisi istologica riparare il cuore in formalina al 10% e procedere con il punto 5.7.
- Se necessario, misurare la vitalità della vetturacellule DIAC da Evans-Blue / Trifenil cloruro di tetrazolio (TTC) colorazione. Dopo aver ricostruito la legatura nel luogo iniziale, profumato cuore con 200 microlitri 1% Evans Blu Solution utilizzando una cannula aortica e congelare cuore in un sacchetto di plastica a -20 ° C, senza lavaggio.
- Dopo 2 ore, effettuare 5 scivoli trasversalmente con un bisturi tagliente e incubare per 10-15 min in soluzione TTC a 37 ° C, come descritto da fabbricati. Fissare i vetrini per 10 min in formalina al 10% e metterli tra i preparati microscopici per ulteriori analisi.
- Incorporare il tessuto cardiaco in paraffina, posizionando il cuore sulla punta, effettuare trasversali sezionamento. Eseguire sezione seriale del 5 micron. Raccogliere le prime 20 sezioni e scartare il prossimo 300 micron. Continuare il protocollo sezione finché il livello della valvola mitrale è stato raggiunto (Figura 3A, B). Sezioni seriali, 400 micron a parte lungo tutto cuore sono raccolti e possono essere colorati fo l'analisi qualitativa e quantitativa.
- Misurare le dimensioni del miocardio usando di Gomori one-step colorazione 6-8.
- Analizzare l'angiogenesi, il contenuto di collagene o di cellule infiammatorie reclutamento nella sezione seriale utilizzando solito colorazione immunohistological.
Risultati
La procedura di infarto miocardico si verifica entro 25-30 minuti e mostra un tasso di mortalità del 10%. Dopo l'intervento chirurgico, i topi recuperare da anestesia entro il prossimo 15 min. Nessun danno fisico è stato osservato al mouse operato. Tuttavia, vi è un elevato rischio di rottura cuore una settimana dopo infarto miocardico post-cronica, se i processi di riparazione sono disturbati durante la fase infiammatoria. Poiché cuore è in grado di modificare significativamente le dimensioni durante il pompaggio, è importante che tutti i cuori ottenuti da arrestare nella stessa posizione, ad esempio in Diastola. Ciò può essere ottenuto mediante perfusione del cuore con soluzione KCl satura. Aumento blocchi concentrazione extracellulare K + pompe ioniche, diminuisce il potenziale di membrana delle cellule cardiache, causando un arresto diastolico dell'attività cardiaca.
L'area del miocardio può essere visto in analisi ad ultrasuoni (Figura 3A, pannello inferiore). In confronto amiocardio normale, regioni ischemiche apparire sottile e ipocinetico (figura 3A, pannello superiore). A seconda del modello utilizzato, la dimensione del miocardio sarà diverso. Il modello di infarto cronica induce circolare, infarto transmurale dell'apice (figura 3B), mentre l'ischemia / riperfusione induce un sottile, mezza parete e per tutta cuore (Figura 3C). Ci sono molti metodi per determinare le dimensioni del miocardio. Se l'obiettivo è quello di analizzare l'effetto diretto sulla vitalità cardiaca, un Evans-Blue / TTC colorazione 18 è indicato da eseguire almeno 2 ore dopo la riperfusione, per essere in grado di vedere eventuali cambiamenti nel miocardio. Le sezioni possono essere analizzati immediatamente (figura 3B, pannello centrale) dopo colorazione o possono essere mantenuti fra vetrini in formalina per 2-3 giorni (Figura 3C, pannello centrale). L'area blu rappresenta il miocardio sano, non affetti da ischemia. La zona rossa rappresenta il miocardio vitale all'interno the area ischemica (miocardio rischio), e l'area bianca rappresenta il tessuto morto. Solitamente, la dimensione infarto è espressa come percentuale della zona a rischio.
La cicatrice maturo risultante dopo processi di rimodellamento può essere facilmente misurato con immunohistolgy utilizzando uno-fase di colorazione di Gomori. Aree blu-tinto infartuati e rosse macchiate sani ventricolari (Figura 3B e C, i pannelli di destra) sono determinati nella prima sezione di ciascun livello fino alla valvola mitrale. Per evitare la variazione dovuta al legame LAD a diversi livelli, l'infarto da ogni sezione è considerata ed espresso come percentuale del volume totale del ventricolo sinistro. Un volume infarto del 15-20% nel modello infarto cronica e del 10-15% dopo modello ischemia / riperfusione può essere raggiunto. Inoltre, il modello di infarto cronico induce una dilatazione accentuato, non osservate nel modello ischemico / riperfusione (Figura 3B e C righPannello t).
Procedure di colorazione convenzionali possono essere utilizzati, come ad esempio: la colorazione CD31 utilizzato per rivelare la angiogenesi (rosso, figura 4A) o liscio colorazione actina del muscolo per determinare miofibroblasti (verde, figura 4B). Doppia colorazione in fluorescenza può essere applicato anche per identificare differenti molecole bersaglio nella zona infarto, poiché l'assenza di cardiomiociti fornisce alcuna auto-immunofluorescenza (Figura 4C).
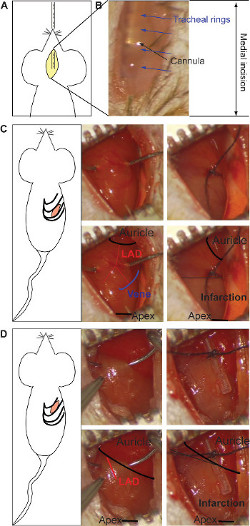
Figura 1: Incisione mediale ed inserimento della cannula del intubazione (A). La visualizzazione stereomicroscopio della cannula metallica attraverso la trasparenza del tessuto (B). Gli anelli tracheali (frecce blu) e la cannula (freccia nera) sono evidenziate. L'incisione intercostali per il mo infarto cronicodel e la legatura di LAD (C). La legatura si trova al centro del cuore (tra il padiglione auricolare e apice, nero pannello inferiore), prendendo come riferimento la fine della vena (schematica in blu, pannello inferiore). Entrambi i rami dell'arteria devono essere vincolati (rosso a pannello inferiore). Il colore grigio indica dell'area infartuata e appare nella mezza parte inferiore del cuore (riquadro in basso a destra). La legatura per il modello di ischemia / riperfusione è fatto sotto il padiglione auricolare, legando il corpo principale della LAD (rosso pannello inferiore) su un tubo di silicone (destra) (D). Il colore grigio indica l'area d'infarto, che è presente su tutto il cuore (pannello in basso a destra). Clicca qui per vedere una versione più grande di questa figura.
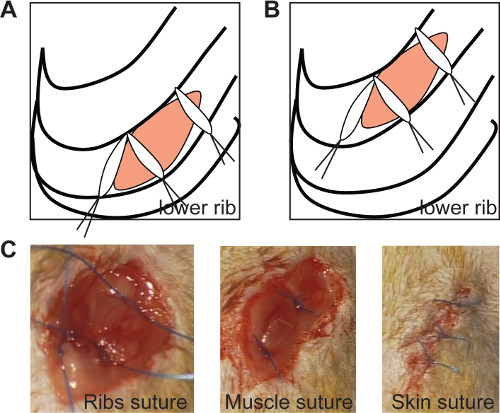
Figura 2: Le guarnizioni sutura nervature l'incisione toracica se le suture mediali sono posizionati a un angolo di 90 ° in entrambe cronica (A) e ischemia / riperfusione modello (B, pannello di sinistra). immagini in vivo di nervature di sutura (C, pannello di sinistra ), la sutura dei muscoli (C, pannello centrale) e suturare la pelle (C, pannello di destra). Clicca qui per vedere una versione più grande di questa figura.
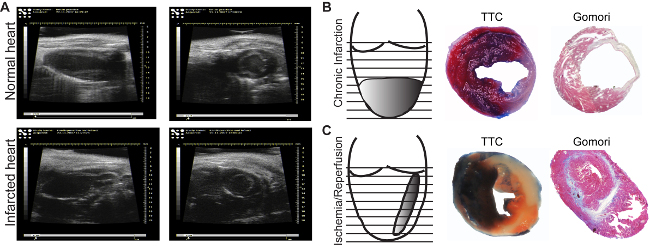
Figura 3: immagini ecocardiografiche. Immagini di normale (A, pannello superiore) e aree infartuati (A, pannello inferiore), vengono acquisiti in asse lungo (, pannelli longitudinali sinistra) o in asse corto (trasversale, pannelli di destra) .. miocardio indotta da legatura cronica(B) e da una ischemia hr seguita da riperfusione (C). Evans blu / TTC colorazione permette di identificare perfuso (blu) / zone non perfuso nonché il vitali (rosso) / morti (bianco) miocardio (B, C, pannelli centrali). Di uno stadio di colorazione di Gomori permette l'individuazione delle aree infartuati (blu), e li differenzia dalle normali regioni (rosso) (B, C, pannelli di destra). Clicca qui per vedere una versione più grande di questa figura.
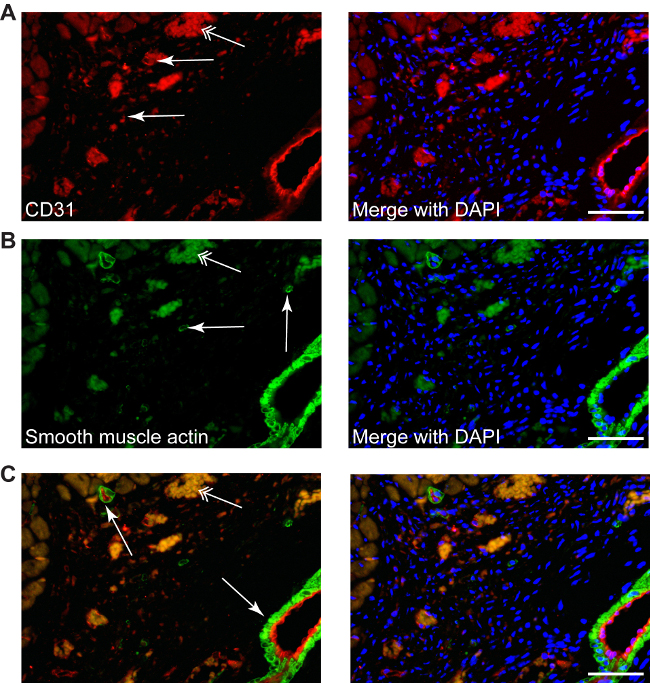
Figura 4: differenti colorazioni possono essere eseguite nella zona d'infarto, come descritto al CD31 neo-angiogenesi (A, rosso, frecce semplici), o actina muscolo liscio per miofibroblasti (B, green, frecce semplici), così come doppia colorazione (C, CD31-rosso / actina-verde del muscolo liscio), contrastate con DAPI per nuclei (blu). Miofibroblasti possono essere differenziati facilmente da cellule muscolari lisce da piccoli o grandi arterie, che sono sempre accompagnati da uno strato endoteliale (C, frecce). Doppie frecce puntano il eritrociti autofluorescenza. Scala bar 50 micron.
Discussione
Durante la procedura, ci sono alcuni punti critici da notare: la intubazione, la aprendo la cavità toracica e la legatura LAD. Il primo passo fondamentale è l'intubazione dell'animale prima experiements. Molti gruppi utilizzano un supporto verticale per il fissaggio del mouse e una sorgente di luce per inserire la cannula direttamente nella trachea. Questo metodo ha incertezza riguardo il corretto inserimento della cannula nella trachea ed è la più incline alla rottura dai novizi. Facendo una piccola incisione, la posizione della cannula può essere controllata durante l'intera manovra, riducendo così il tasso di default. Inoltre, la tracheotomia viene superato, diminuendo così le complicazioni e riducendo il tempo di funzionamento.
Il successivo passo critico è l'apertura della cavità toracica. La sternotomia mediana rappresenta una manovra ad alto rischio di ritardare il recupero degli animali. L'incisione laterale sinistra implicando il taglio di 2-3 nervature 15 , porta a recupero carenti e aumento della mortalità. Abbiamo utilizzato nel modello piccolo, incisione discreta tra le costole che offrono un peso minimo. Gli animali recuperano molto rapidamente dopo l'intervento chirurgico e non lo fanno i difetti presenti o guarigione disturbato. Lo spazio intercostale inferiore viene preso come punto di riferimento. Considerando questo, il corretto e differenziato accesso al luogo di legatura per cronica e ischemia / riperfusione modella, non solleva seri problemi.
La legatura stesso rappresenta la fase più critica. La coronaria discendente sinistra è difficile da essere visualizzato, e spesso ha bisogno di essere vincolati senza vista. Pertanto, alcuni punti di riferimento anatomici sono segnalati per aiutare il chirurgo di eseguire la legatura corretta. Per il modello di infarto cronica, la legatura è collocato nel centro del lato ventrale del cuore, tra il padiglione auricolare e l'apice, sopra la fine dei principali anterior vena (Figura 2B). L'efficienza può essere Controriempito visualizzando l'aspetto del colore grigio nelle zone colpite. Se l'area infartuata appare anteriore e non include la parete posteriore, un nuovo sutura può essere posizionato alla sinistra del primo suture. La radice principale LAD è sempre visibile sotto il padiglione auricolare 18, e quindi non presenta gravi problemi nel rilevare questa parte. Tuttavia, il padiglione auricolare presenta il maggior rischio di sanguinamento e deve essere maneggiato con cura.
La procedura è limitata dalla presenza di attrezzature adeguate. Il ventilatore e il sistema adeguato di anestesia per piccoli animali sono costosi e richiedono collegamenti al sistema gas e ventilazione del locale. Inoltre, una stretta sorveglianza degli animali è necessaria nella prima settimana dopo il procedimento per rilevare la possibile clinica. Per esaminare la funzione cardiaca durante l'esperimento, sono tenuti ad alta risoluzione ultrasuoni, complesso perfusione sistema Langendorf, o piccoli intraventricolare misurazioni catetere, involving alti costi e ulteriori competenze.
Considerando l'infarto miocardico, non ci sono metodi alternativi di riprodurre la complessità degli eventi in vitro. A seconda del punto di interesse, ex vivo perfusione del cuore isolato nel sistema Langendorff fornisce informazioni sulla contrattilità, funzione cardiaca e vitalità miocardica in risposta a differenti stimoli o farmaci. Tuttavia, esclude tutte le interferenze dei componenti del sangue e del sistema immunitario, e non è indicato per-lunghi studi di rimodellamento e di guarigione dopo infarto miocardico.
Dopo aver eseguito la procedura di infarto del miocardio, tutte le altre analisi funzionale può essere effettuata, come la misurazione della pressione intraventricolare, ultrasuoni (piccoli sistemi a ultrasuoni animale) o cuore isolato Langendorff-perfusione. Inoltre, tutte le analisi biologiche e molecolari può essere effettuata per identificare le cellule, proteine, mRNA, microRNA, genes o altri biomarker, che possono essere utilizzati come bersagli terapeutici per sviluppare nuove strategie di trattamento per infarto del miocardio.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was supported by Interdisciplinary Centre for Clinical Research IZKF Aachen (junior research group to E.A.L.) within the faculty of Medicine at RWTH Aachen University. We are grateful Dr. Rusu and Ashley Christina Vourakis for critical review of the manuscript and Mrs. Roya Soltan for the professional help with immunohistochemistry staining.
Materiali
| Name | Company | Catalog Number | Comments |
| Stereomicroscope | Olympus | SZ/X9 | |
| Mouse ventilator | Harvard Apparatus | 730043 | Model Minient 845 |
| Dual Anesthesia System (Tabletop Version) | Harvard Apparatus | Selfcontained isofluranebased anesthesia unit for use on lab tables, with a compact 8" x 11" footprint. | |
| Intubation cannula | Harvard Apparatus | 732737 | |
| Forceps | FST, Germany | 9119700 | standard tip curved 0.17 mm x 0.1 mm |
| Scissors | FST, Germany | 9146011 | straight |
| Vannas scissor | Aesculap, Germany | OC 498 R | |
| Retractors | FST, Germany | 1820010 | 2.5mm wide |
| Retractors | FST, Germany | 1820011 | 5 mm wide |
| Wire handles | FST, Germany | 1820005 | 10 cm |
| Wire handles | FST, Germany | 1820006 | 14 cm |
| Ketamine 10% | CEVA, Germany | ||
| Xylazine 2% | Medistar, Germany | ||
| Bepanthene eye and nose cream | Bayer, Germany | ||
| Silicon tube | IFK Isofluor, Germany | custommade product | diameter 500 µm |
| section thickness 100 µm | |||
| polytetrafluorethylene catheter | |||
| PROLENE Suture 6/0 | ETHICON | 8707H | polypropylene monofilament suture, unresorbable, needle CC1, 13 mm, 3/8 Circle |
| 7/0 Silk | Seraflex | IC 1005171Z | |
| Ultrasound | Vevo, Canada | 770 Vevo |
Riferimenti
- Liehn, E. A., Postea, O., Curaj, A., Marx, N. Repair after myocardial infarction, between fantasy and reality: the role of chemokines. J Am Coll Cardiol. 58 (23), 2357-2362 (2011).
- Liehn, E. A., Radu, E., Schuh, A. Chemokine contribution in stem cell engraftment into the infarcted myocardium. Curr Stem Cell Res Ther. 8 (4), 278-283 (2013).
- Alexander, S., et al. Repetitive transplantation of different cell types sequentially improves heart function after infarction. J Cell Mol Med. 16 (7), 1640-1647 (2012).
- Liehn, E. A., et al. Compartmentalized protective and detrimental effects of endogenous macrophage migration-inhibitory factor mediated by CXCR2 in a mouse model of myocardial ischemia/reperfusion. Arterioscler Thromb Vasc Biol. 33 (9), 2180-2186 (2013).
- Liehn, E. A., et al. Ccr1 deficiency reduces inflammatory remodelling and preserves left ventricular function after myocardial infarction. J Cell Mol Med. 12 (2), 496-506 (2008).
- Liehn, E. A., et al. A new monocyte chemotactic protein-1/chemokine CC motif ligand-2 competitor limiting neointima formation and myocardial ischemia/reperfusion injury in mice. J Am Coll Cardiol. 56 (22), 1847-1857 (2010).
- Liehn, E. A., et al. Double-edged role of the CXCL12/CXCR4 axis in experimental myocardial infarction. J Am Coll Cardiol. 58 (23), 2415-2423 (2011).
- Oral, H., et al. CXC chemokine KC fails to induce neutrophil infiltration and neoangiogenesis in a mouse model of myocardial infarction. J Mol Cell Cardiol. 60, 1-7 (2013).
- Projahn, D., et al. Controlled intramyocardial release of engineered chemokines by biodegradable hydrogels as a treatment approach of myocardial infarction. J Cell Mol Med. 18 (5), 790-800 (2014).
- Schuh, A., et al. Novel insights into the mechanism of cell-based therapy after chronic myocardial infarction. Discoveries. 1 (2), e9 (2014).
- Schuh, A., et al. Effect of SDF-1 alpha on Endogenous Mobilized and Transplanted Stem Cells in Regeneration after Myocardial Infarction. Curr Pharm Des. 20 (12), 1964-1970 (2013).
- Zaragoza, C., et al. Animal models of cardiovascular diseases. J Biomed Biotechnol. 2011, 497841 (2011).
- Kanzler, I., Liehn, E. A., Koenen, R. R., Weber, C. Anti-inflammatory therapeutic approaches to reduce acute atherosclerotic complications. Curr Pharm Biotechnol. 13 (1), 37-45 (2012).
- Liehn, E. A., Zernecke, A., Postea, O., Weber, C. Chemokines: inflammatory mediators of atherosclerosis. Arch Physiol Biochem. 112 (4-5), 229-238 (2006).
- Kolk, M. V. V., et al. LAD-Ligation: A Murine Model of Myocardial Infarction. J. Vis. Exp. (32), 1438 (2009).
- Ryu, J. H., et al. Implantation of bone marrow mononuclear cells using injectable fibrin matrix enhances neovascularization in infarcted myocardium. Biomaterials. 26 (3), 319-326 (2005).
- Frobert, A., Valentin, J., Cook, S., Lopes-Vicente, J., Giraud, M. N. Cell-based Therapy for Heart Failure in Rat: Double Thoracotomy for Myocardial Infarction and Epicardial Implantation of Cells and Biomatrix. J. Vis. Exp. (91), e51390 (2014).
- Xu, Z., Alloush, J., Beck, E., Weisleder, N. A Murine Model of Myocardial Ischemia-reperfusion Injury through Ligation of the Left Anterior Descending Artery. J. Vis. Exp. (86), e51329 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon