È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Selezione del flusso e sequenza di Exome delle cellule Reed-Sternberg del linfoma classico di Hodgkin
In questo articolo
Riepilogo
Qui descriviamo un sistema di classificazione delle celle citometriche a flusso combinato e un protocollo di costruzione della libreria di nuova generazione, progettato per produrre dati di alta qualità e di esito intero dalle cellule Hodgkin Reed-Sternberg (HRS) del linfoma classico Hodgkin (CHL).
Abstract
Le cellule Hodgkin Reed-Sternberg del linfoma classico di Hodgkin sono distribuite scarsamente in uno sfondo di linfociti infiammatorie e tipicamente contengono meno dell'1% della massa tumorale. Il materiale derivato da tumore sfuso contiene il contenuto di tumore ad una concentrazione insufficiente per la caratterizzazione. Pertanto, la classificazione delle cellule attivata con fluorescenza usando otto anticorpi, così come spostamento laterale e in avanti, è descritta qui come un metodo di separazione rapida e concentrazione con migliaia di cellule HRS di alta purezza del tumore per il successivo studio. Allo stesso tempo, poiché i protocolli standard per il sequenziamento di exome richiedono tipicamente 100-1.000 ng di DNA in ingresso, spesso troppo elevato, anche con l'ordinamento dei flussi, forniamo anche un protocollo di costruzione della biblioteca ottimizzato e basso in grado di produrre una qualità Dati da appena 10 ng di DNA in ingresso. Questa combinazione è in grado di produrre librerie di nuova generazione adatte alla cattura di ibridazione di interi eXome baits o pannelli mirati più mirati, come desiderato. La sequenza di Exome delle cellule HRS, se confrontata con le cellule T o B intratecorali, può identificare alterazioni somatiche, comprese le mutazioni, le inserzioni e le delezioni e le alterazioni del numero di copie. Questi risultati illustrano la biologia molecolare delle cellule HRS e possono rivelare vie per trattamenti farmacologici mirati.
Introduzione
Gli avanzamenti nella genomica del cancro a seguito della sequenza di prossima generazione hanno portato a significativi progressi nell'identificazione di bersagli terapeutici e nella prognosticazione di molte neoplasie ematologiche e non ematologiche. Nuove strategie di trattamento individualizzate basate su alterazioni genomiche specifiche vengono rapidamente introdotte in molti tipi di tumori (esaminati nei riferimenti 1 , 2 ). Nonostante un notevole progresso nella genomica del linfoma, il genoma delle cellule HRS neoplastiche nel linfoma classico di Hodgkin (CHL) era stato indebolito. Le indagini sono state ostacolate dalla scarsità di cellule HRS neoplastiche all'interno di un microambiente reattivo, rendendo difficile l'isolamento delle popolazioni cellulari HRS purificate 3 .
Il metodo per isolare cellule HRS vitali da tumori primari è stato sviluppato da Fromm et al. 4 ,Ref "> 5 , 6. Il metodo utilizza un cocktail di otto anticorpi, composto da CD30, CD15, CD40, CD95, CD45 CD20, CD5 e CD64, per identificare in modo inequivocabile le cellule HRS da una sospensione tumorale CHL. Sono in grado di isolare almeno 1000 cellule HRS vitali dalle sospensioni cellulari fresche o congelate da biopsie tumorali costituite da almeno 10 cellule (circa 10 mg di tessuto). La purezza è superiore al 90% mediante analisi citometrica a flusso e si stima che sia Almeno 80% da analisi genomica exome di dieci casi consecutivi.
Abbiamo raffinato una tecnica di isolamento delle cellule citometriche di flusso che ha notevolmente facilitato il processo, consentendo il rapido isolamento di migliaia di cellule HRS vitali da tumori primari CHL 7 . Abbiamo utilizzato la tecnica per produrre quello che si crede essere la prima sequenza di esomeri intero delle cellule tumorali nei casi primari del linfoma di Hodgkin. I nostri studi dimostrano thLa fattibilità di studi di elevata produttività e genoma su singoli casi di CHL e hanno già portato all'identificazione di nuove alterazioni genomiche con il potenziale per spiegare aspetti della patogenesi CHL.
Abbiamo ulteriormente sviluppato una pipeline per utilizzare il DNA estratto per studi genomici ad alto rendimento. Al fine di ottenere risultati affidabili da ben 1000 cellule HRS ordinate (il minimo ottenuto da casi sequenziali), abbiamo ulteriormente sviluppato una procedura di costruzione della libreria di DNA di nuova generazione 8 che ci ha permesso di aumentare l'efficienza della legatura dell'adattatore e di generare librerie di frammenti di DNA Senza amplificazione eccessiva. Questo metodo consente l'analisi di campioni clinici di routine e la rilevazione di mutazioni ricorrenti e alterazioni cromosomiche 7 .
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Tissue Processing e Congelamento
- Raccogliere il tessuto dei linfonodi in soluzione salina fosfatica (PBS) o Roswell Park Memorial Institute (RPMI) e procedere entro 24 ore dalla raccolta. Trasferire il tessuto linfonodale ecceduto 9 in un piatto di Petri contenente 10 mL di RPMI con il siero di vitello fetale del 2% (FCS) e finemente tritarlo con una lama di bisturi fresca. Utilizzare il dorso di uno stantuffo da 10 ml per smerigliare / dissociare il tessuto.
- Trasferire il liquido in un tubo conico da 50 ml attraverso un filtro da 100 μm. Sciacquare il piatto di Petri e il filtro con altri 10 mL di RPMI 2% FCS.
- Ottieni un conteggio delle cellule utilizzando un contatore automatico o un emocitometro.
NOTA: generalmente, almeno da 2 x 10 7 cellule sarebbero previste da circa 5 mm3 di tessuto linfonodale CHL. Si prevede una redditività di oltre l'80%, ma può variare a seconda del campione. - Spin giù le cellule a 400 xg per 10 minuti e aspiraIl supernatante. Mettere il tubo contenente pellet di cellula sul ghiaccio.
- Pregelare il mezzo di congelamento sul ghiaccio. Resuspendere le cellule in un mezzo di congelamento a freddo ad una concentrazione di 2 x 10 7 / mL e risospenderlo pipettando. Non vorticarsi. Incubare la sospensione in ghiaccio per 10 min.
- Aliquota il campione da 1 ml / flaconcino (pre-raffreddato sul ghiaccio). Trasferire i flaconcini a un congelatore da -80 ° C per 1-2 giorni e trasferirli nuovamente in azoto liquido.
2. Preparazione delle sospensioni delle cellule per la selezione delle celle
NOTA: Ogni lotto di anticorpo deve essere titolato correttamente utilizzando 10 milioni di cellule in un volume di colorazione di 300 μl. Il sangue periferico può essere utilizzato per tutti gli anticorpi ad eccezione di CD30, per i quali la linea cellulare KMH2 spicolata in sangue periferico può essere utilizzata per la titolazione 10 . Cominciamo generalmente con il volume raccomandato dal produttore di anticorpi e si eseguono due diluizioni a due volte e un aumento di due volte (quattro punti dati)Per ciascun lotto di titolazione dell'anticorpo. Ad esempio, se il produttore raccomanda un volume di 10 μl, eseguire la titolazione usando i volumi di 2, 5, 10 e 20 μL.
- Impostare un bagno d'acqua a 37 ° C. Premiare la quantità titolata di anticorpi in un flacone di vetro scuro e aggiungere PBS + 2% BSA per un volume totale di cocktail di 100 μL.
NOTA: Anche se si consiglia di titolare gli anticorpi, possono essere utilizzati i seguenti volumi: CD64, 20 μL; CD95, 5 μL; CD30, 20 μL; CD5, 10 μL; CD20, 10 μL; CD15, 20 μL; CD40, 5 μL; E CD45, 10 μL. - Trasferire il flaconcino dall'azoto liquido in un secchio di ghiaccio contenente ghiaccio secco per evitare lo scongelamento. Pre-riscaldare 50 ml di mezzo di disgelo contenente RPMI / 20% FCS / DNasi (100 μg / ml) in un tubo conico da 50 ml in un bagno d'acqua di 37 ° C.
- Trasferire 45 ml di terreno di scongelamento in un tubo fresco e tenerlo a 37 ° C. Rapidamente scongelare le celle tenendo una fiala criogenica in un batuffolo da 37 ° CH finché rimane solo una piccola parte congelata.
- Versare il contenuto della fiala nel tubo contenente 45 ml di mezzo di disgelo. Sciacquare il flacone criogenico vuoto 2 volte con 1 ml di mezzo di disgelo e combinare i risciacqui.
- Incubare le cellule a temperatura ambiente per 15 minuti per consentire la digestione della DNasi e la ri-equilibrazione delle cellule. Spin giù le cellule a 500 xg per 10 minuti e aspirare il surnatante.
- Risospendere le cellule in circa 200 μl del mezzo di disgelo mantenuto indietro (5 mL) e lasciarlo equilibrare a temperatura ambiente per 2-3 min. Si prevede il recupero di> 70% delle cellule vitali congelate.
NOTA: Facoltativamente, per una maggiore purezza di cellule HRS ordinate che possono essere rosettate da cellule T allegate, a questo punto può essere aggiunto un cocktail di anticorpi non contrassegnati (vedere il protocollo opzionale). - Aggiungere 100 μl di un cocktail anticorpale e incubare per 15 minuti a temperatura ambiente (RT), protetto dalla luce. Aggiungere 3 ml di materiale di selezione, spin giù le cellule a 500 xgPer 10 min, aspirare il surnatante.
- Riposizionare le cellule in 1 ml di mezzo di smistamento e trasferirle in un filtro superiore da 5 ml di flusso.
- Sciacquare entrambi i tubi conici da 50 ml e il filtro cellulare con un ulteriore 1 ml di materiale di smistamento e posizionare le cellule sul ghiaccio.
3. (Blocco delle Rosette Cellule T)
NOTA: Le cellule HRS sono rosettate da cellule T nelle sezioni dei tessuti e nella sospensione cellulare e queste cellule T possono potenzialmente contaminare la frazione HRS ordinata. Queste interazioni sono mediate da CD54 e CD58 sulla cellula HRS legata a LFA-1 e CD2 sulle cellule T 4 , 11 . Queste interazioni possono essere bloccate con anticorpi non etichettati a queste molecole di adesione.
- Aliquota da 100.000 a 500.000 cellule in 100 μl di RPMI.
- Incubare la sospensione cellulare con anticorpi non contrassegnati su CD2, CD54, CD58 e LFA-1 (10 μl ciascuno) su ghiaccio per 1 ora. TLa sospensione cellulare può ora essere etichettata con anticorpi fluorescenti.
4. Isolamento HRS-, B- e T-cellule mediante selezione delle cellule
NOTA: Anche se abbiamo utilizzato uno speciale strumento di ricerca per la ricerca usando 5 laser (vedere il foglio di calcolo Materiali), ogni classificatore con la capacità di rilevare i fluorochromi utilizzati nel pannello anticorpale dovrebbe essere sufficiente. L'esecuzione dei passaggi che seguono richiede una familiarità con la funzione del software 12 e una conoscenza di base delle operazioni di suddivisione delle celle. Per istruzioni dettagliate, fare riferimento al manuale del software online.
- Impostazione del citometro:
- Accendere il computer e accedere. Accendere le prese BSC (e le prese BSC), quindi accendere il citometro. Attendere almeno 90 secondi per avviare la CPU interna del citometro, quindi aprire il software di controllo laser e verificare che tutti i laser siano accesi. Avviare il software citometro 13 e il login.
- All'interno del software citometro, fare clic su "Cytometer → View Configurations". Quando viene aperta la finestra di dialogo per il sottoprogramma di configurazione, evidenziare la configurazione personalizzata di 130 μm e fare clic su "configurazione di configurazione" e "OK". Uscire dal sottoprogramma di configurazione.
- Osservare la finestra di dialogo del software citometro e fare clic su "utilizzare le impostazioni CS & T". Installare uno ugello da 130 μm nello strumento e accendere il flusso facendo clic sul pulsante rosso "X" nella finestra del flusso. Lasciare scaldare lo strumento per almeno 30 minuti.
- Eseguire un controllo delle prestazioni dello strumento utilizzando il metodo desiderato (è incluso un modulo software di monitoraggio delle prestazioni con il riepilogo descritto qui, consultare il manuale del software (pp. 117-122) e lo standard di riferimento (fare riferimento ai Materiali per lo standard utilizzato in Questa configurazione).
- Fai clic su "Cytometer → CST", accertati che il campo "Caratterizza" sia impostato su "ChecK Performance "nel menu a discesa e fare clic su" Esegui ". Quando richiesto dal software, caricare un tubo di particelle di riferimento nella fase del campione e fare clic su" OK ".
- Dopo l'esecuzione completata, fare clic su "Fine" e chiudere il modulo software. Dopo che il software citometro ha terminato la riconnessione al citometro, fare clic su "utilizzare le impostazioni CS & T" nella finestra di dialogo visualizzata.
- Determinare il ritardo di caduta corretto utilizzando la funzione di ritardo automatico del software citometro (vedi pagg. 154-161 del manuale del software).
- Aprire l'esperimento "Delay Delay" nella finestra "Browser" del software citometro, installare un tubo di particelle di taratura nella fase di campionamento e fare clic su "Load" nella finestra "Acquisition Dashboard". Attiva la funzione di monitoraggio del flusso automatico facendo clic sul pulsante "Sweet spot" nella finestra "Stream". Lasciare questa funzionalità in qualsiasi momento per tutti i followinG passi.
- Accendere la tensione della piastra di deflessione facendo clic sul pulsante "Tensione" nella finestra del flusso laterale e quindi attivare la selezione dei test facendo clic sul pulsante "Test sort" immediatamente adiacente al pulsante "Tensione".
- Regolare tutte le impostazioni dei flussi laterali su zero a parte il flusso lato sinistro. Regolare l'impostazione del flusso lato sinistro in modo che due spot di flusso siano visibili nella finestra di flusso laterale. Fai clic sul pulsante "Filtro ottico" e verifica che il punto di flusso lato sinistro rientri nella casella di sinistra che appare nell'area nera della finestra laterale.
- Se necessario, regolare l'impostazione del flusso laterale sinistro. Disattivare l'ordinamento dei test facendo clic sul pulsante "Test Sort". Nella finestra "Browser", espandere l'elemento "Foglio di lavoro globale" dell'esperimento "Ritardare ritardo" facendo clic sul pulsante "+".
- Fare doppio clic su "Ordina Layout_001" per aprire il layout di ordinamento, verificare per ispezione visivaIone che la popolazione di sinistra ha "P1" assegnato ad esso e fai clic su "Ordina" nella finestra "Ordina layout". Nella finestra "Ordina layout", fare clic su "Ritardo automatico" e quindi su "Esegui".
- Al termine dell'esecuzione, fare clic su "Esci". Installare un tubo di acqua sterile sterile nella fase di campionamento e fare clic su "Carica" nella finestra "Acquisition Dashboard". Eseguire il tubo d'acqua per almeno 5 minuti per eliminare le particelle di prova residua dallo strumento prima di procedere.
- Esegui i comandi di compensazione (utilizzando i bordi di compensazione dal foglio di calcolo Materiali o equivalente) utilizzando una configurazione di compensazione integrata nel software di destinazione (vedere pagine 131-137 del manuale del software per ulteriori informazioni).
- Crea un nuovo esperimento facendo clic su "Esperimento nuovo esperimento". Nella scheda "Parametri" della finestra "Stato strumento", eliminare eventuali parametri non utilizzati. Fai clic su "Experiment Compensat"Impostazione di ioni per creare controlli di compensazione. "
- Nella finestra "Browser" espandere il campione "Compensation Controls" facendo clic sul segno "+". Eseguire i tubi di controllo della compensazione senza registrare i dati e, se necessario, regolare le tensioni dei rivelatori (nella scheda "Parametri" della finestra "Stato strumento") in modo che le popolazioni di branco colorate positivamente per ciascun fluorochrome siano tra il canale 10.000 e 100.000 Il più luminoso nel loro canale di rilevamento primario.
- Scrivere le tensioni necessarie per ogni parametro per ogni tubo. Evidenziare il tubo "Unstained Control" sotto il campione "Compensation Controls" con un singolo click a sinistra. Caricare il tubo di controllo non colorato nella fase di campionamento e fare clic su "Load" nella finestra "Acquisition Control".
- Immettere manualmente le tensioni determinate eseguendo singoli comandi di compensazione nei campi di tensione del rivelatore per tutti i parametri eQuindi fare clic su "Record" nella finestra "Acquisition Control". Eseguire tutti i comandi di compensazione rimanenti, registrando i dati senza modificare le impostazioni del rivelatore. Installare un tubo di acqua sterile e deionizzata per 5 minuti per rimuovere qualsiasi materiale residuo dallo strumento prima di procedere.
- Cancellazione delle cellule HRS:
- Acquisire e registrare almeno 100.000 eventi per il gating iniziale durante la regolazione della portata per acquisire 3.000-4.000 eventi / s (vedere la fase 4.1).
NOTA: Potrebbe essere necessario aggiungere un altro mezzo di smistamento per diluire le cellule se la concentrazione cellulare è troppo alta. Interrompere l'acquisizione. - Porta le cellule HRS utilizzando i passi descritti in Figura 1
NOTA: nella maggior parte dei casi CHL, tra lo 0,01% e lo 0,1% delle cellule saranno cellule HRS.
- Acquisire e registrare almeno 100.000 eventi per il gating iniziale durante la regolazione della portata per acquisire 3.000-4.000 eventi / s (vedere la fase 4.1).
- Cancellazione delle cellule B e T:
- Identificare i controlli somatici (cellule B e T) dal gating di CD20 e CD5, respeCtively (linfociti gating by CD45 / SSH), seguito da CD20 contro CD5 (vedi figura 1 ).
- I raccolti di raccolta mirano i tubi di raccolta in un rack di raccolta a due o quattro vie prefrequenzato. Riempire i tubi di flusso oi tubi in centrifuga da 15 ml, almeno a metà del mezzo di raccolta.
- Assegnare HRS e controllare le popolazioni a tubi di raccolta adeguati nella configurazione del tipo seguendo le istruzioni del fornitore. Riavviare l'acquisizione delle celle e avviare l'ordinamento.
- Raccogliere tutte le cellule HRS e fino a 1 milione di cellule B e T. Orientare i flussi di raccolta nei tubi di raccolta in un rack di raccolta a quattro vie (o bidirezionale) pre-refrigerato.
5. Estrazione del DNA
- Il pellet ha raccolto le cellule per centrifugazione in tubi conici da 1,5 mL a 3,000 xg per 10 min e risospeso una volta con 1 mL di PBS per lavare le cellule.
- Pellet ancora una volta a 3000 xg per 10 minuti e rimuovere il surnatante; Essere molto attenti a non disturbareIl minuscolo pellet.
- Aggiungere 150 μl di tampone di lisi (o un volume appropriato per il kit utilizzato) alle celle lavate e mescolare pipettando verso l'alto e verso il basso.
NOTA: Si può memorizzare il lisato cellulare a -70 ° C a questo punto, se necessario. - Costruire un gruppo di colonne inserendo la colonna del filtro all'interno del tubo e aggiungere il lisato dalla fase 5.5 alla colonna. Spin il gruppo a 13.000 xg per 3 minuti.
- Rimuovere la minicolonna dall'assemblea e scartare il liquido nel tubo di raccolta. Sostituire la minicolonna nel tubo di raccolta.
- Aggiungere a ciascun assieme 650 μL di soluzione di lavaggio a colonna. Centrifugare per 1 min a 13.000 x g. Scartare il liquido dal tubo di raccolta. Ripetere questo passaggio per un totale di 4 lavaggi.
- Scartare il liquido dal tubo di raccolta e ricollegare l'assemblaggio della minicolonna. Centrifugare per 2 min a 13.000 xg per asciugare la matrice di legame.
- Trasferire la minicolonna in un nuovo tubo da 1,5 mL e aggiungere 25 μl di 10 mM Tris-Cl, cheÈ preferito per la successiva fase di sonicazione, o Acqua libera da Nucleasi riscaldata a 65 ° C. Incubare per 2 minuti a temperatura ambiente e centrifugare l'assemblaggio a 13.000 xg per 1 min. Ripetere ancora una volta con 25 μL per un totale di 50 μL.
- Mescolare l'eluizione del DNA pipettando su e giù e quantificando usando la fluorimetria 14 .
6. Costruzione della biblioteca
- Preparazione prima dell'inizio:
- Impostare il sonicatore a livello dell'acqua 12, Intensità 5, Cicli / burst 200 e Temp 7.
- Sulla base della quantità di DNA disponibile determinata dalla fluorimetria e sul disegno sperimentale, determinare la quantità di DNA da utilizzare per la costruzione della libreria.
NOTA: tenere presente che se si utilizza troppo poco il DNA e che la qualità della biblioteca è compromessa, potrebbe esservi scarsa applicazione per i materiali lasciati indietro per scopi di convalida. Per le quantità di input non conformi, maggiore è la massa di ingresso, maggiore è la compLexity della libreria di sequencing risultante. Alcune linee guida per questo protocollo sono le seguenti: 10 ng dovrebbe produrre buoni risultati e 50 ng può essere considerato un massimo grezzo. - Decidere sull'adattatore: inserire il rapporto molare basato leggermente sui valori della tabella 1 .
- Calcolare la quantità di adattatore da utilizzare come segue:
NOTA: Numero di mole di input di DNA, n
io. N = 1,54e-12 -12 * massa di input (in ng) / (dimensione media di frammento)
ii. Quando la dimensione media del frammento è di 200 bp, questo semplifica a:
N = 7.7e-15 * massa di ingresso (in ng)
Numero di moli di adattatore da includere, a
io. A = n * r
Volume del supporto adattatore da utilizzare in fase di ligation dell'adattatore, v
io. V (in μL ) = a / [ 10 -12 * stock adattatoreConcentrazione (in μM )]
NOTA: Se la concentrazione dell'adattatore è bassa, per assicurare che sia inclusa la quantità necessaria di adattatore, la soluzione adattatore può essere usata per diluire i reagenti di riparazione finale in sostituzione dell'acqua.
Esempio: Per 100 ng di DNA in ingresso con una dimensione media di 200 bp, per un adattatore molare desiderato: rapporto di inserto di 15: 1 e una concentrazione di stock di adattatore di 2 μM, il volume consigliato di adattatore da utilizzare è di 5,8 μL. - Assegnare i codici a barre indicizzati ai campioni.
NOTA: le librerie che verranno raggruppate in una reazione di ibridazione o una corsia su una cella di flusso del sequencer non devono contenere indici ridondanti.
- Costruzione della biblioteca - Taglio del DNA:
- Aggiungere la quantità totale di DNA da utilizzare per un tubo di sonicazione. Se il volume di campione contenente solo il DNA di ingresso è inferiore a 50 μL, aggiungere Buffer EB fino a un volume totale di 50 μL e mescolare.
- Sonicare per 30 s.
- Rimuovere il tubo e eseguire una rapida rotazione in una mini centrifuga sufficiente a raccogliere qualsiasi spruzzo dalla parte superiore delle pareti del microtube.
- Ripetere i passaggi 6.2.2-6.2.3 per un totale di sette sessioni di sonicazione da 30 secondi per un totale di 210 secondi di sonicazione.
NOTA : prova a dividere i 210 s in meno sessioni.
- Costruzione della biblioteca - Ripara la riparazione, la coda di taglio e la legatura dell'adattatore:
NOTA: Evitare di eseguire qualsiasi selezione delle dimensioni prima della fase di amplificazione PCR della libreria.- Seguire le istruzioni del produttore 19 per la riparazione finale e l'A-tailing dopo la sonicazione del DNA campione.
- Dopo A-tailing, utilizzare la quantità appropriata di moli di adattatore (calcolata al punto 6.1.3) nella reazione. Combinare l'adattatore, i frammenti del DNA a coda, l'enzima e il tampone e incubare per una notte a 20 ° C per circa 16 ore.
- libRari costruzione - Amplificazione biblioteca:
- Eseguire una pulizia del tallone della reazione di ligation dell'adattatore. Dopo aver aggiunto le perle al prodotto PCR, attendere 5 minuti a temperatura ambiente. Posizionarlo contro uno stand magnetico e rimuovere i liquidi, lavare due volte in 200 μl di etanolo dell'80%, asciugare le perle abbastanza a lungo per rimuovere la maggior parte del liquido senza sovraccarico e eluire il DNA fuori delle perle pipettando 25 μL di Come suggerito, sulle perle mentre il tubo rimane contro un supporto magnetico.
NOTA: può essere possibile sperimentare la conservazione delle perle in polietilenglicole
(PEG) fino a dopo l'amplificazione invece di scartarli, ma questo non è stato testato. - Includere 0,6 μL di una diluizione 1: 1.000 di tinture verdi per 50 μL di miscela master PCR. In alternativa, utilizzare un colorante intercolante compatibile con PCR in tempo reale nel volume appropriato per l'apparecchiatura.
- Programmare la reazione PCR a 98 ° C per45 s per la denaturazione iniziale, seguita da un ciclo di denaturazione, annealing e estensione a 98 ° C per 15 s, 60 ° C per 30 s e 72 ° C per 30 s oppure scegliere il programma appropriato se si utilizza un'alternativa Enzima polimerasi.
- Impostare la macchina per ottenere dati di fluorescenza a 72 ° C per ogni ciclo. Programmare un'estensione finale a 72 ° C per 1 min, seguita da una ritenzione a 4 ° C per un tempo indefinito. I primer PCR per l'amplificazione della libreria con legatura adattativa utilizzando reagenti nella tabella supplementare sono: Oligo 1, AATGATACGGCGACCACCGAGA e Oligo 2, CAAGCAGAAGACGGCATACGAG
- Amplificare la libreria usando le condizioni di PCR sopra descritte osservando i valori di intensità della fluorescenza in tempo reale con il software qPCR, fermandosi poco prima della fine della fase di crescita esponenziale.
- Dopo l'amplificazione, effettuare una pulizia standard del branello (vedere la fase 6.4.1) usando 0.8x il volume della reazione di amplificazione recovTipicamente 0,8 x 50 = 40 μL di perline. Aggiungere le perle al prodotto PCR e attendere 5 minuti a temperatura ambiente.
- Posizionarlo contro uno stand magnetico e rimuovere i liquidi, lavare due volte in 200 μl di etanolo dell'80%, asciugare le perle abbastanza a lungo per rimuovere la maggior parte del liquido senza sovraccarico e eluire aggiungendo acqua senza nucleasi alle perle asciutte.
- Quantificare il DNA risultante usando fluorimetria. Visualizzare i frammenti della libreria per le dimensioni; Vedere la sezione relativa alle aspettative di Data QC per ulteriori dettagli.
- Eseguire una pulizia del tallone della reazione di ligation dell'adattatore. Dopo aver aggiunto le perle al prodotto PCR, attendere 5 minuti a temperatura ambiente. Posizionarlo contro uno stand magnetico e rimuovere i liquidi, lavare due volte in 200 μl di etanolo dell'80%, asciugare le perle abbastanza a lungo per rimuovere la maggior parte del liquido senza sovraccarico e eluire il DNA fuori delle perle pipettando 25 μL di Come suggerito, sulle perle mentre il tubo rimane contro un supporto magnetico.
7. Ibridazione Exome
- Combina quattro librerie con codici a barre adattatori distinti.
NOTA: La massa mediante fluorimetria e la dimensione per gel vengono utilizzati per calcolare la molarità e quindi le biblioteche sono combinate in quantità equimolari per un totale di una massa di biblioteca riunita da 1000 ng. È meglio mantenere tutte le coppie normali tumorali piuttosto che separarle in piscine separate. - Applicare il protocollo di cattura di exome Up class = "xref"> 15 e fare 8 cicli PCR dopo la pulizia di cattura. Possono essere possibili altre scelte di obiettivi di cattura.
8. Sequencing Multiplexed
- Sequenza una singola acquisizione di ibridazione contenente quattro librerie multiplex in una singola corsia sulla piattaforma di sequenza indicata nel foglio di calcolo dei materiali 16 .
NOTA: le configurazioni alternative sono possibili per utenti avanzati che desiderano pianificare ulteriormente e ottimizzare la loro profondità di lettura target di copertura.
9. Analisi (può essere sostituito con pipeline alternative se desiderato)
- Snps e piccoli indels:
- Mappare i dati grezzi al genoma di riferimento umano, UCSC hg19, utilizzando Burrows-Wheeler Aligner (BWA) 17 o un algoritmo alternativo di scelta. Il filtro o il marchio legge con un punteggio di qualità di mappatura inferiore a 20 e duplicati PCR usando Samtools 18 o PicardRef "> 19.
- Rileva varianti di nucleotidi somatici e piccoli indelli nei campioni HRS rispetto ai controlli somatici delle cellule T usando Strelka 20 o una chiamante di variante scelta. Applicare snpEff 21 per annotare l'output di Strelka. Se lo si desidera, controllare sistematicamente loci di variante per gli artefatti utilizzando il Visualizzatore Integrato Genome (IGV) 22 , 23 .
- Modifiche del numero di copie:
- Calcola il rapporto " ltr " trasformato in log per ogni intervallo di bersaglio exome " i " dei conteggi di lettura normalizzati del tumore nei tumori rispetto a quelli del normale nel seguente modo:
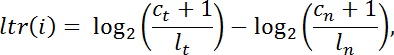
NOTA: c è il numero di letture mappate ad un determinato intervallo di cattura, l è la dimensione totale della libreria, t indica il tumore e n indica normalmente. - Filtrare gli intervalli con copertura insufficiente ( C t + C n <100 letture) per ulteriori analisi. Condurre la segmentazione del pan-intervallo usando DNAcopy v.1.0 24 da Bioconductor in R.
NOTA: Si consideri i segmenti dove il valore assoluto del ltr medio è inferiore a 0,5 per essere neutrale della copia. I segmenti rimanenti possono essere indicati come guadagni di numero di copia, se il segno del ltr medio è positivo (in altre parole, nel campione tumorale sono significativamente più letti rispetto al campione normale dopo la normalizzazione) o perdite di numero di copie se il segno Del ltr medio è negativo.
- Calcola il rapporto " ltr " trasformato in log per ogni intervallo di bersaglio exome " i " dei conteggi di lettura normalizzati del tumore nei tumori rispetto a quelli del normale nel seguente modo:
Access restricted. Please log in or start a trial to view this content.
Risultati
Una trama di bioanalizzatore dovrebbe essere presa dopo l'amplificazione della biblioteca e la pulizia del branello 0.8x. Si dovrebbe vedere una distribuzione "di tipo normale" di dimensioni del frammento nell'intervallo desiderato ( Figura 2a ). Le deviazioni da questa forma, come una "spalla" visibile nella curva, indicano la presenza di un artefatto di peso alto o basso. Ad esempio, la Figura 2b
Access restricted. Please log in or start a trial to view this content.
Discussione
Applicazioni future o indicazioni dopo masterizzazione di questa tecnica
Questo lavoro consente di sequenziare exome da campioni contenenti almeno 10 ng di DNA. Nel contesto clinico, questo limite esclude la maggior parte dei campioni di aspirazione a fine ago a causa di materiale insufficiente, ma comprende adeguate biopsie di base e campioni di biopsia excisa. Ciò consentirà l'acquisizione di dati da un insieme più ampio di campioni possibili.
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno niente da rivelare.
Riconoscimenti
Lo sviluppo di questo metodo di progetto è stato finanziato dal Dipartimento di Patologia e Medicina di Laboratorio di Weill Cornell Medical College. Riconosciamo il programma triennale di formazione in biologia e medicina computazionale per un finanziamento parziale. Vorremmo ringraziare gli scienziati che hanno condiviso il loro tempo e conoscenza con noi, in particolare Maryke Appel; Dan Burgess; Iwanka Kozarewa; Chad Locklear; E tutti dal Wemel Cornell Medical Center, tra cui Jenny Zhang, Xiaobo (Shawn) Liang, Dong Xu, Wei Zhang, Huimin Shang, Tatiana Batson e Tuo Zhang.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Petri or Cell Culture Dish (sterile) | |||
| RPMI-1640 Media | Roswell Park Memorial Institute | ||
| Fetal Calf Serum (FCS), (heat inactivated) | |||
| Freezing Media (RPMI, 20% FCS, 10% dimethylsulfoxide (DMSO))-make fresh and keep sterile | |||
| RPMI with 2% FCS (make fresh or store for up to 1 month) | |||
| scalpel with fresh blade | |||
| 10 mL syringe (no needle) | |||
| Cryogenic vials | |||
| 50 mL conical centrifuge tubes, force | |||
| Centrifuge | capable of handling 50 mL conical centrifuge tubes and providing 400g | ||
| Hepes buffer(1 M, cell culture grade) | |||
| phosphate buffered saline (PBS) | |||
| Pluoronic-F68 | Thermo-Fisher | 24040-032 | |
| DNAase-I | Sigma-Aldrich, St. Louis, MO | D4527-10KU | store as 5 mg/mL in RPMI in -200 °C |
| Bovine Serum Albumin (BSA) | |||
| Sort Media (PBS + 2% BSA + 25 mM HEPES + Pluoronic –F68 (1x)) | |||
| CD64-FITC (22) | Beckman Coulter, Miami, FL | 20 μL suggested starting volume; Titering is suggested | |
| CD30-PE (BerH83) | BD Biosciences, San Jose, CA | 20 μL suggested starting volume; Titering is suggested | |
| CD5-ECD (BL1a) | Beckman Coulter, Miami, FL | 10 μL suggested starting volume; Titering is suggested | |
| CD40-PerCP-eFluor 710 (1C10) | Ebiosciences, San Diego, CA | 5 μL suggested starting volume; Titering is suggested | |
| CD20-PC7 (B9E9) | Beckman Coulter, Miami, FL | 10 μL suggested starting volume; Titering is suggested | |
| CD15-APC (HI98) | BD Biosciences, San Jose, CA | 20 μL suggested starting volume; Titering is suggested | |
| CD45 APC-H7 (2D1) | BD Biosciences, San Jose, CA | Can be substituted with 10 μL suggested volume of CD45-Krome Orange (J.33, Beckman Coulter); Titering is suggested | |
| CD95-Pacific Blue (DX2) | Life Technologies, Grand Island, NY | 5 μL suggested starting volume; Titering is suggested | |
| CD2 (5 μg; clone RPA-2.10) | Biolegend, San Diego, CA | For optional protocol; Titering is suggested | |
| CD54 (10 μg; clone 84H10) | Serotec, Oxford, United Kingdom | For optional protocol; Titering is suggested | |
| CD58 (10 μg; clone TS2/9) | eBioscience, San Diego, CA | For optional protocol; Titering is suggested | |
| LFA-1 (12 μg; clone MHM23) | Novus Biologicals, Littleton, CO | For optional protocol; Titering is suggested | |
| BD CS&T Beads | BD Biosciences, San Jose, CA | ||
| BD Accudrop Beads | BD Biosciences, San Jose, CA | ||
| BC Versa Comp antibody capture beads | Beckman Coulter, Miami, FL | Compensation Beads | |
| BD-FACS ARIA special research order instrument using 5 lasers | BD Biosciences, San Jose, CA | any BD-FACS aria with capabilities to detect the fluorochromes in the antibody panel should be sufficient | |
| Wizard | Promega | A2360 | |
| 10 mM Tris-Cl buffer | NA | ||
| Qubit dsDNA HS Assay kit | Life Technologies, Carlsbad, CA | ||
| S2 Sonicator | Covaris, Woburn, MA | Alternatives may be substituted | |
| microTUBE | Covaris, Woburn, MA | ||
| Low-Throughput Library Preparation Kit | Kapa Biosystems, Wilmington, MA | KK8221 | |
| Sybr Green | Sigma-Aldrich, St. Louis, MO | S9430 | |
| Agencourt AMPure XP Beads | Beckman Coulter, Miami, FL | ||
| Bioanalyzer | Agilent Technologies, Santa Clara, CA | ||
| SeqCap EZ Exome v.3.0 | Roche Nimblegen | 6465684001 | |
| HiSeq | Illumina | ||
| TruSeq-style Universal adapter | Integrated DNA Technologies (IDT), Coralville, Iowa | HPLC purification; AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGAT*C*T | |
| TruSeq-style index adapter | Integrated DNA Technologies (IDT), Coralville, Iowa | HPLC purification; /5Phos/GATCGGAAGAGCACACGTCTGAACTCCAGTCACNNNNNNATCTCGTATGCCGTCTTCTGCTTG | |
| TruSeq-style PCR primer 1 | Integrated DNA Technologies (IDT), Coralville, Iowa | AATGATACGGCGACCACCGAGA | |
| TruSeq-style PCR primer 2 | Integrated DNA Technologies (IDT), Coralville, Iowa | CAAGCAGAAGACGGCATACGAG | |
| Nuclease Free Duplex Buffer | Integrated DNA Technologies (IDT), Coralville, Iowa | ||
| BD FACSDIVA software | BD Biosciences, San Jose, CA | ||
| BD Falcon Tubes | BD Biosciences, San Jose, CA | ||
| BD Flow Tubes | BD Biosciences, San Jose, CA |
Riferimenti
- Abrams, J. National Cancer Institute's Precision Medicine Initiatives for the new National Clinical Trials Network. American Society of Clinical Oncology educational book / ASCO. American Society of Clinical Oncology. Meeting. , 71-76 (2014).
- Gagan, J., Van Allen, E. M. Next-generation sequencing to guide cancer therapy. Genome medicine. 7, 80(2015).
- Matsuki, E., Younes, A. Lymphomagenesis in Hodgkin lymphoma. Seminars in cancer biology. 34, 14-21 (2015).
- Fromm, J. R., Kussick, S. J., Wood, B. L. Identification and purification of classical Hodgkin cells from lymph nodes by flow cytometry and flow cytometric cell sorting. Am J Clin Pathol. 126 (5), 764-780 (2006).
- Fromm, J. R., Thomas, A., Wood, B. L. Flow cytometry can diagnose classical hodgkin lymphoma in lymph nodes with high sensitivity and specificity. Am J Clin Pathol. 131 (3), 322-332 (2009).
- Roshal, M., Wood, B. L., Fromm, J. R. Flow cytometric detection of the classical hodgkin lymphoma: clinical and research applications. Advances in hematology. 2011, 387034(2011).
- Reichel, J., et al. Flow sorting and exome sequencing reveal the oncogenome of primary Hodgkin and Reed-Sternberg cells. Blood. 125 (7), 1061-1072 (2015).
- Kozarewa, I. A Modified Method for Whole Exome Resequencing from Minimal Amounts of Starting DNA. PLoS ONE. 7 (3), e32617(2012).
- Brunicardi, F. C. Schwartz's Principles of Surgery. , 10th ed, McGraw-Hill Education / Medical. (2014).
- Kantor, A. B., Roederer, M. FACS analysis of leukocytes. Handbook of Experimental Immunology. 2, Blackwell Scientific. (1996).
- Sanders, M. E. Molecular pathways of adhesion in spontaneous rosetting of T-lymphocytes to the Hodgkin's cell line L428. Cancer Res. 48 (1), 37-40 (1988).
- Biosciences. FACSDiva Software v6.0. , Available from: http://www.bdbiosciences.com/in/instruments/software/facsdiva/resources/overview.jsp (2007).
- Biosciences. FACSAria II User's Guide. Part No. 644832, Revision A. , (2009).
- Life Technologies. Qubit 3.0 Fluorometer, Catalog Number Q33216. , Available from: https://www.thermofisher.com/order/catalog/product/Q33216 (2017).
- Roche Nimblegen. SeqCap EZ Library SR User's Guide ver. 4.1. , (2013).
- Illumina. HiSeq High-Throughput Sequencing System. , Available from: http://www.illumina.com/systems/hiseq_2500_1500.html (2016).
- Li, H., Durbin, R. Fast and accurate short read alignment with Burrows-Wheeler transform. Bioinformatics. 25 (14), 1754-1760 (2009).
- Li, H. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- The Broad Institute. Picard Tools. , Available from: http://broadinstitute.github.io/picard/ (2016).
- Saunders, C. T. Strelka: accurate somatic small-variant calling from sequenced tumor-normal sample pairs. Bioinformatics. 28 (14), 1811-1817 (2012).
- Cingolani, P., et al. A program for annotating and predicting the effects of single nucleotide polymorphisms, SnpEff: SNPs in the genome of Drosophila melanogaster strain w1118; iso-2; iso-3. Fly (Austin). 6 (2), 80-92 (2012).
- Dobin, A. STAR: ultrafast universal RNA-seq aligner. Bioinformatics. 29 (1), 15-21 (2013).
- Thorvaldsdottir, H., Robinson, J. T., Mesirov, J. P. Integrative Genomics Viewer (IGV): high-performance genomics data visualization and exploration. Briefings in bioinformatics. 14 (2), 178-192 (2013).
- DNA copy number data analysis. v.R package version 1.34.0. , Available from: https://omictools.com/dnacopy-tool (2013).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon