Method Article
Caricamento di un colorante di calcio in terminazioni di nervi della rana attraverso il ceppo del nervo: registrazione transitoria del calcio nella giunzione neuromuscolare della rana
In questo articolo
Riepilogo
Qui descriviamo un metodo per caricare un colorante sensibile al calcio attraverso il ceppo nervoso della rana nelle estremità nervose. Presentiamo inoltre un protocollo per la registrazione e l'analisi dei rapidi transitori di calcio nei terminali nervosi periferici.
Abstract
Uno dei metodi più efficaci per misurare i livelli di calcio presinaptici nei terminali nervosi presinaptici è la registrazione ottica. Si basa sull'utilizzo di coloranti fluorescenti sensibili al calcio che cambiano l'intensità di emissione o la lunghezza d'onda a seconda della concentrazione di calcio libero nella cella. Ci sono diversi metodi usati per macchiare le cellule con coloranti di calcio. I più comuni sono i processi di caricamento dei coloranti attraverso una micropipetta o pre-incubazione con le forme di acetossimetil estere dei coloranti. Tuttavia, questi metodi non sono abbastanza applicabili alle giunzioni neuromuscolari (NMJ) a causa di problemi metodologici che si presentano. In questo articolo, abbiamo presentato un metodo per caricare un colorante sensibile al calcio attraverso il ceppo nervoso della rana del nervo della rana nelle terminazioni nervose. Poiché l'ingresso di calcio esterno nei terminali nervosi e il successivo legame con il colorante di calcio si verificano entro la scala temporale di millisecondi, è necessario utilizzare un sistema di imaging veloce per registrare tali interazionins. Qui descriviamo un protocollo per la registrazione del transitorio di calcio con una veloce CCD.
Introduzione
Gli ioni di calcio (Ca 2+ ) partecipano a molti processi di segnalazione neuronale, tra cui l'iniziazione, la manutenzione e la plasticità del rilascio del mediatore 1 , 2 , 3 , 4 , 5 . All'arrivo del potenziale d'azione, Ca 2+ entra nel terminale nervoso e inizia la rilascio del neurotrasmettitore. In alcune sinapsi, la corrente di calcio può essere misurata direttamente con metodi elettrofisiologici 6 , 7 , 8 . Nel caso della giunzione neuromuscolare (NMJ), non si può usare il morsetto di patch diretto e le tecniche di morsetto di tensione a due elettrodi a causa della minima dimensione delle terminazioni nervose.
Le registrazioni delle correnti Ca 2+ all'interno delle estremità del nervo nel NMJ possono essere effettuate mediante elettrodi indiretteMetodi iologici 9 , 10 . Tuttavia, questi metodi richiedono il pretrattamento della sinapsi da parte dei bloccanti del canale di sodio e di potassio. I metodi ottici non richiedono la separazione farmacologica delle correnti ioniche nel terminale nervoso e permettono di registrare l'afflusso di Ca 2+ , innescato da potenziali d'azione e la successiva elevazione degli ioni Ca 2+ negli axoplasmi 11 , 12 , 13 , 14 . Questi metodi sono basati su registrazioni di cambiamenti nella fluorescenza di coloranti specifici Ca 2+ sensibili al legame di ioni liberi Ca 2+ 15 , 16 , 17 , 18 , 19 .
Gli indicatori Ca 2+ possono essere caricati nella cAttraverso una varietà di metodi, a seconda dello scopo dell'esperimento. I ricercatori utilizzano l'applicazione del bagno di forme permeabili per membrana 20 , 21 , caricamento tramite pipetta patch 22 o microinjection 23 , 24 , 25 . Tuttavia, tutti questi metodi hanno alcune limitazioni nel caso del NMJ a causa delle sue peculiarità nell'architettura sinaptica. Per il NMJ, il metodo più conveniente e di successo è quello di caricare il colorante attraverso il ceppo nervoso, un metodo di riempimento in avanti 26 , 27 , 28 , 29 . Questa tecnica può essere utilizzata per il caricamento di vari coloranti fluorescenti nelle finali nervose periferiche. Questo metodo è stato utilizzato con successo per i terminali nervosi Drosophila 28 , il nervo motorio della lucertola28 e terminali nervi motori rana 17 , 26 , 27 , 30 . A seconda dell'oggetto in oggetto, i dettagli metodici possono variare. È possibile impiegare una micro-pipetta di vetro per i piccoli nervi delle larve 28 . Molti ricercatori hanno descritto un metodo 27 , 28 in cui una fine tagliata di nervo che innerva un muscolo è immersa in un pozzo pre-riempito con un colorante. La preparazione viene quindi lasciata per diverse ore per immergere il colorante. Il colorante è assorbito dagli assoni e trasportato ai terminali nervosi. In questo documento descriviamo un metodo di caricamento di un indicatore di fluorescenza in terminali nervosi motori rane attraverso il ceppo nervoso. Il nostro protocollo utilizza una punta di pipetta di plastica per l'incubazione del tessuto con un colorante. Descriviamo anche come acquisire ed analizzare la fluorescenza Ca 2+nsients.
Protocollo
Sono stati eseguiti esperimenti su preparati isolati dal nervo muscolare del muscolo cutaneo pectoris dalla rana Rana ridibunda . La dimensione degli animali di entrambi i generi era di circa 5-9 cm. Le procedure sperimentali sono state eseguite secondo le linee guida per l'uso degli animali da laboratorio dell'Università Federale Kazan e dell'Università di Kazan, in conformità alla Guida NIH per la cura e l'uso degli animali da laboratorio. Il protocollo sperimentale ha soddisfatto i requisiti della direttiva del Consiglio europeo 86/609 / CEE ed è stato approvato dal comitato etico dell'Università medica di Kazan.
1. Preparazione delle soluzioni
- Preparazione della soluzione di Ringer.
- Preparare la soluzione di Ringer: 113,0 mM NaCl, 2,5 mM KCl, 3,0 mM NaHCO 3 e 1,8 mM CaCl2. Regolare il pH a 7,2-7,4.
- Preparare la soluzione di Ringer con un basso Ca 2+ ed alto contenuto di Mg 2+ : 113,0 mM NaCl, 2,5 mM KCl, 3,0 mM NaHCO 3 , 6,0 mM MgCl2, 0,9 mM CaCl2. Regolare il pH a 7,2-7,4.
- Preparazione della soluzione di tintura.
- Preparare la soluzione a base di acqua contenente HEPES-Na a 10 mM (pH 7,2-7,4).
- Aggiungere 14 μL della soluzione HEPES ad una fiala con il colorante 30 .
NOTA: il colorante indicatore Ca 2+ viene fornito in una fiala da 500 μl con 500 μg di polvere. - Vortex e spin giù per mescolare accuratamente.
- Diluire la soluzione per portare la concentrazione finale dell'indicatore Ca 2+ fino a 30 mM. Evitare l'esposizione alla luce e conservare a -20 ° C.
2. Procedura di caricamento del colore
- Disseccare il muscolo cutaneo pectoris con un pezzo del nervo pectoralis proprius .
NOTA: è disponibile la procedura di dissezioneIn un download gratuito della carta di Blioch et al. , 1968 31 .- Per la procedura di dissezione, utilizzare due pinze fine e forbici corneali (vedi tabella dei materiali ). Trasferire il tessuto sezionato in un piatto di Petri rivestito con elastomero in silicone pre-riempito con la soluzione di Ringer e fissare il tessuto con i perni fini di acciaio inossidabile in modo che sia leggermente allungato nel piatto.
- Riempire il piatto di Petri con una nuova aliquota della soluzione di Ringer. Rimuovere i tessuti connettivi. Non danneggiare il nervo.
- Preparare la pipetta di riempimento: usando una lama di rasoio, tagliare un pezzo di circa 2 mm della parte conica di una punta di plastica standard da 10 μL.
- Preparare un pezzo di argilla modellante per montare la pipetta di riempimento sul piatto di Petri.
- Collegare la parte posteriore della pipetta di riempimento ad una siringa di plastica tramite tubi in silicone e adattatori di collegamento in plastica fatti da punte pipetta.
- Prima della dSi rimuove la soluzione di Ringer dal piatto di Petri usando una pipetta di plastica. Asciugare la preparazione del muscolo-nervo utilizzando una siringa fine; Questo impedirà la diluizione del colorante Ca 2+ al successivo caricamento della pipetta di riempimento.
- Rimuovere il flacone indicatore Ca 2+ dal congelatore e lasciarlo scongelare a temperatura ambiente in un luogo buio.
- Sotto controllo stereomicroscopico con ingrandimento basso (10 ×), rilevare la giunzione tra il muscolo e il nervo. Con fine pinzette e forbici, tagliare il nervo pectoralis proprius vicino alla superficie muscolare (vedere passo 2.1). Lasciare un ceppo di nervo lungo circa 2 mm.
- Fissare la pipetta di riempimento attaccata al tubo e la siringa sul piatto di Petri utilizzando l'argilla di modellazione.
- Spostare la punta della pipetta vicino al ceppo nervoso.
- Senza pizzicare, aspirare delicatamente il ceppo nervoso nella punta della pipetta di riempimento.
- Rimuovere il tubo di aspirazione dalla fiammaT della pipetta di riempimento.
- Rimuovere attentamente la soluzione in eccesso dalla pipetta di riempimento usando una siringa con un ago lungo (vedi tabella dei materiali ). Non pizzicare il ceppo nervoso.
- Alzare verticalmente la punta della pipetta di riempimento leggermente, mantenendo inalterata la punta del nervo nella punta.
- Isolare la parte aspirata del ceppo nervoso dall'esterno della punta della pipetta di riempimento utilizzando la gelatina di petrolio.
- Se necessario, seccare il nastro nervo isolato nella pipetta di riempimento: aspirare delicatamente l'eccesso di soluzione dalla pipetta di riempimento usando una siringa con un ago lungo.
- Disegnare 0,5 μL della soluzione di carica del colorante (vedere la fase 1) usando una pipetta con una punta pipetta lunga.
- Inserire delicatamente la punta della pipetta con la soluzione di carico nella pipetta di riempimento. Estrarre la miscela direttamente sul ceppo nervoso.
- Sigillare l'estremità aperta della pipetta di riempimento con gelatina di petrolio.
- Aggiungere una piccola aliquota di RingerOlution al piatto di Petri per mantenere la preparazione bagnata.
- Incubare la preparazione a temperatura ambiente in condizioni scure e bagnate per 5 ore.
- Rimuovere la pipetta di riempimento con soluzione di carico, sciacquare la preparazione con la soluzione di Ringer e tenerlo in frigorifero a 8 ° C.
3. Preparazione del tessuto per la microscopia
- Montare la preparazione nella camera di elastomero in silicone e fissarla con micro-aghi d'acciaio in modo che sia leggermente allungato.
- Sciacquare il tessuto con una aliquota di soluzione fresca di Ringer.
- Utilizzare un elettrodo di aspirazione per stimolare il nervo; La costruzione dell'elettrodo è disponibile dal download gratuito della carta da parte di Kazakov et al. , 2015 32 . Posizionare la punta dell'elettrodo vicino all'estremità tagliata del nervo e aspirare il ceppo nervoso nell'orifizio dell'elettrodo.
- Montare la camera di preparazione sulla fase del microscopio. PlacE la sonda di temperatura e gli scarichi di entrata e di uscita nella camera.
- Collegare il cavo di alimentazione all'elemento Peltier.
- Per superfusione della preparazione, utilizzare un semplice sistema a gravità. Per rimuovere la soluzione in eccesso, accendere la pompa di aspirazione della perfusione.
- Accendere l'unità termo-regolatore.
- Impostare il controllo della temperatura a 20 ° C.
- Montare lo schermo di protezione ultravioletto.
- Collegare l'elettrodo di filo stimolante allo stimolatore elettrico e osservare le contrazioni muscolari sotto il microscopio con un obiettivo obiettivo 4x.
- Riempire il sistema di perfusione con la soluzione di Ringer con contenuto basso contenuto Ca 2+ e alto-Mg 2+ .
NOTA: Questa soluzione è utilizzata per prevenire contrazioni muscolari. Una riduzione della concentrazione di calcio esterno e un'elevazione del magnesio esterno provocano la riduzione dell'ampiezza dei transitori Ca 2+. Tuttavia, sulla base dell'esperienza precedente, 0.9 mM CaCl 2 e 6 mM MgCl2 sono ancora sufficienti per risolvere in modo affidabile l'ampiezza dei transienti Ca 2+ . Vale la pena ricordare che esistono altri modi per diminuire le contrazioni muscolari senza ridurre la concentrazione di Ca 2+. Ad esempio, l'uso di d-tubocurarina o alfa-bungarotossina, bloccanti specifici di recettori della acetilcolina nicotinica, bloccerebbe parzialmente o parzialmente i twitch muscolari 17 , 27 , 28 , 30. Tuttavia, l'aggiunta di queste tossine può anche pregiudicare l'ingresso di calcio presinaptico 33 . Per evitare ciò, è possibile utilizzare μ-conotossina GIIIA 27 . - Accendere la pompa e avviare la superfusione del preparato con la soluzione di Ringer con basso livello di Ca 2+ e di alta Mg 2+ .
- Passare alla lente obiettivo 40 × sul microscopio.
- Accendere t Monocromatore (vedi tabella dei materiali ).
- Selezionare una lunghezza d'onda di emissione di 488 nm e una modalità di illuminazione continua nel software di controllo del monocromatizzatore.
- Sotto l'ingrandimento elevato in modalità di fluorescenza, assicurarsi che i terminali nervosi siano stati caricati con il colorante.
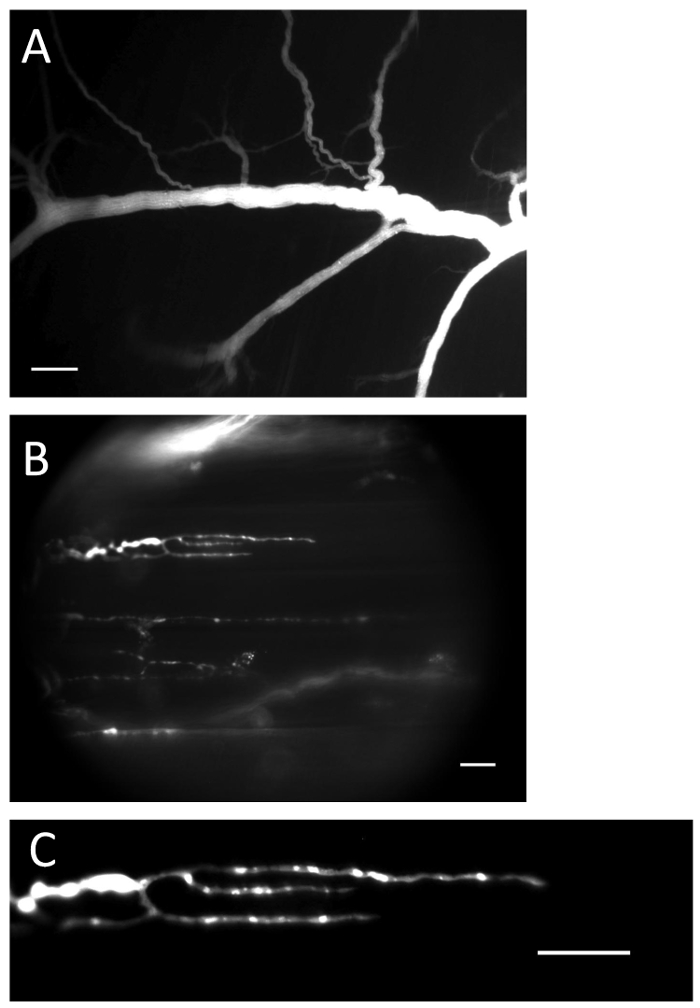
Figura 1 : nervo e terminali con indicatore Ca 2+ caricato. ( A ) Il nervo è riempito con l'indicatore Ca 2+ dopo la procedura di caricamento. Barra di scala = 200 μm. ( B ) Terminazioni nervose riempite con indicatore Ca 2+ . Barra di scala = 20 μm. ( C ) La fluorescenza dell'indicatore Ca 2+ è chiaramente visibile nella fine del nervo. Barra di scala = 20 μm._blank "> Clicca qui per visualizzare una versione più grande di questa figura.
- Lasciare che la preparazione sia equilibrata per almeno 30 minuti nella soluzione bassa Ca 2+ e high-Mg 2+ .
4. Cattura video con la fotocamera digitale CCD
Nota: i dettagli di acquisizione dei segnali di fluorescenza sono specifici per ciascun tipo di microscopio e fotocamera, ma la considerazione chiave è la velocità di acquisizione delle immagini.
- Utilizzare 1 kHz come frequenza di acquisizione minima per le registrazioni di singoli transienti Ca 2+ nel NMJ.
NOTA: le fotocamere digitali CCD digitali sono necessarie per la rappresentazione in fluorescenza (vedere tabella dei materiali ). Qui sono stati utilizzati il sistema di acquisizione dati e il software (vedere la tabella dei materiali ) per la sincronizzazione della fotocamera, del monocromatico e dello stimolatore. In breve, questo protocollo consente la generazione di impulsi di sincronizzazione sulle uscite digitali dei datiSistema di acquisizione per aprire l'otturatore, catturare il segnale video e avviare la stimolazione. Tutti i parametri temporali possono essere impostati nei protocolli e / o sugli apparecchi. Un tipico protocollo è una serie di 500 fotogrammi acquisiti a 1 kHz (80 x 80 pixel). Illuminazione con luce di eccitazione può sbiancare l'indicatore Ca 2+ e fotodamage il tessuto cellulare. Evitare quindi lunghe esposizioni alla luce di eccitazione. In questo protocollo, l'otturatore è aperto solo per il tempo necessario per catturare il video. Acquisire venti serie per terminale nervoso specifico. Lo scopo è monitorare gli stessi siti nel gruppo di controllo e dopo la consegna di farmaci. - Sotto l'obiettivo obiettivo 4X di un microscopio, utilizzare il regime di campo luminoso per visualizzare i rami del muscolo e del nervo.
- Passare alla lente obiettivo 40X e, usando il regime di epifluorescenza e una lunghezza d'onda di eccitazione di 488 nm, cercare terminazioni nervose caricate. Identificare una regione di interesse nervoso.
- Sul tubo trinoculare oF il microscopio, selezionare i livelli di scambio del percorso della luce: 100% di luce alla fotocamera.
- Avviare il software di acquisizione per la fotocamera CCD.
- In modalità "Live", individuare il ROI e regolare la messa a fuoco.
- Selezionare il menu "Modifica".
- Utilizza la "Configurazione di base" a 1.000 fotogrammi al secondo (fps), con una risoluzione di 80 x 80.
- Impostare il numero di frame in ingresso a 500.
- Inserisci il nome dell'esperimento.
- Scegli "Trigger esterno".
- Impostare il tempo di pre-attivazione a 10 ms.
- Impostare il numero di ripetizioni su 20.
- Nel software di controllo monochromatore, selezionare una lunghezza d'onda di emissione di 488 nm e una modalità "illuminazione trigger esterna".
- Eseguire il software di acquisizione dati.
- Caricare il protocollo di stimolazione.
- Prima di registrare il video, catturare la cornice scura usando il software di acquisizione video.
- Eseguire il protocollo di stimolazione.
- Selezionare il ROI e il checK il segnale registrato.
5. Analisi dei dati
NoOTE: Per l'analisi dei dati, utilizzare il software CCD e ImageJ; I dati vengono rappresentati come una curva in un programma di fogli di calcolo. Nel software della fotocamera CCD, la media 20 ripete e esporta i risultati in un file di supporto ImageJ. In ImageJ, selezionare il ROI e lo sfondo. Sottrai lo sfondo dal ROI. Rappresentare i dati come rapporto: (ΔF / F 0-1) x 100%, dove ΔF è l'intensità della fluorescenza durante la stimolazione e F 0 è l'intensità della fluorescenza in riposo.
- Nel software di acquisizione della telecamera CCD, fare clic su File> File medi. Seleziona i file e li media.
- Salvare il file medio come file .fit facendo clic su "Salva come file di adattamento".
- Eseguire il software ImageJ. Eseguire le seguenti operazioni:
- Fai clic su Immagine> regola> luminosità / contrasto.
- Fai clic su Immagine> pile> strumenti>; Stack sorter.
- Fare clic su Analisi> strumenti> Gestore ROI.
- Trascinare e rilasciare il file medio di .fit nella finestra ImageJ.
- Ingrandire la finestra per una migliore visione.
- Spostando il cursore, seleziona l'ultimo fotogramma e lo elimina (questo è il telaio scuro)
- Selezionare un ROI rettangolare sulla superficie ritenuta essere lo sfondo. Aggiungilo al gestore del ROI
- Misurare lo sfondo facendo clic su Altro> Multi Measure. Nota il MEAN. Copiare i dati, esportarli in un programma di fogli di calcolo e calcolare il valore medio della soglia per un rapporto.
- Sottrarre la soglia dagli stack facendo clic su Process> Main> Subtract. Immettere il valore medio della soglia.
- Selezionare un ROI rettangolare attorno a un terminale nervoso. Aggiungilo al gestore del ROI.
- Fare clic su Altro> MultiMisure. Nota il MEAN. Copia ed esporta in un programma di fogli di calcolo.
- Media l'offset dei segnali.
NOTA: utilizzare il tastoPrima parecchie dozzine di punti che dimostrano la fluorescenza del colorante di base senza stimolazione; Questa è la fluorescenza a riposo. - Divide i segnali dalla fluorescenza a riposo.
- Sottrai "1" e moltiplica il 100%.
- Progettare il segnale e calcolare l'ampiezza del transitorio Ca 2+ .
Risultati
Dopo il caricamento del tinture e sulla stimolazione del nervo del motore, è possibile rilevare un aumento dell'ampiezza del segnale fluorescente (Ca 2+ transiente) nei terminali nervosi (vedi Figura 2 ). I parametri dei transienti Ca 2+ sono riportati nella Tabella 1 . Quantitativamente, i parametri dei transitori Ca 2+ misurati nel nostro studio sono vicini ai dati ottenuti da altri scienziati in sinapsi degli animali a sangue freddo 15 , 34 . I parametri dei transitori Ca 2+ dipendono dalla velocità di legame di Ca 2+ con il colorante e dalla successiva dissociazione. Il tasso di ingresso di Ca 2+ nella terminazione del nervo, l'interazione con il colorante e la diffusione nel citoplasma influenzano tutti i tempi di salita del transitorio Ca 2+ . Il tempo di decadimento del segnale fluorescente dipende dall'affinità del colorante,La velocità dell'interazione Ca 2+ con i tamponi intracellulari e la rimozione delle pompe ioniche 35 . L'analisi di ampiezza dei transitori Ca 2+ può essere utilizzata per studiare l'influenza di varie sostanze sull'entrata del calcio che partecipa al rilascio del neurotrasmettitore 33 .

Figura 2 : La media di Ca 2+ Transitorio misurato nella rana NMJ. Il transitorio Ca 2+ è stato calcolato sulla base della media dei segnali da 13 rane NMJ. Clicca qui per visualizzare una versione più grande di questa figura.
| PiccoΔF / F (%) | Tempo di salita 20% -80% (ms) | Τ (ms) |
| 12,6 ± 1,1 (n = 13) | 4,6 ± 0,5 (n = 13) | 115,3 ± 8,3 (n = 13) |
Tabella 1: I parametri medi del transitorio Ca 2+ . I dati sono presentati come la media ± SE; N è il numero di misurazioni in NMJ distinti. Il picco ΔF / F è l'ampiezza media di ΔF / F.
Discussione
In questo lavoro abbiamo presentato il metodo di caricamento di coloranti sensibili al Ca 2+ nelle finali nervose delle rane attraverso il ceppo nervoso. Alla fine della procedura di caricamento, tutti i terminali nella parte prossimale del nervo hanno livelli significativi di fluorescenza. È stato stimato che la concentrazione intra-terminale della sonda varia tra 40 e 150 μM 17 .
La procedura di incubazione è condotta in due fasi: a temperatura ambiente e ad una temperatura inferiore in frigorifero. È importante controllare il tempo dell'incubazione dei tessuti con il colorante a temperatura ambiente. A seconda della lunghezza effettiva del ceppo del nervo, del colorante specifico e della temperatura, il tempo di incubazione può variare. Se sovraesposte, i terminali nelle parti prossimali vicine al ceppo nervoso possono essere sovraccaricate. Tuttavia, nella parte centrale del nervo, è ancora possibile trovare terminali caricati in modo soddisfacente. Durante la thLa lunga incubazione nel frigorifero, il colorante è distribuito uniformemente sulle terminazioni nervose.
Le nostre osservazioni 33 , 35 , nonché i dati di altri ricercatori 30 dimostrano la mancanza di un'influenza sensibile della procedura di caricamento sull'ampiezza della risposta postsinaptica o sulla frequenza dei potenziali miniaturizzati della lastra. La buona longevità è stata documentata nei preparati carichi. Ci sono alcuni punti importanti che vorremmo attirare l'attenzione su. È molto essenziale posizionare il ceppo nervoso nella soluzione di caricamento del tinture con diversi minuti dopo l'escissione per consentire al colorante di entrare negli assoni del nervo tagliato; I ritardi possono causare carichi inefficaci, presumibilmente dovuti alla recessione degli assoni nervosi 27 , 36 . Alcuni ricercatori immergono il ceppo nervoso in 100 mM di EDTA (un catalizzatore Ca 2+ e Mg 2+) Immediatamente dopo l'escissione del nervo per impedire l'assonamento degli assoni tagliati. Il tampone viene rimosso dopo 1-2 minuti e sostituito con una soluzione di carica del tintura 37 . L'uso di una gelatina di petrolio invece di tubi di plastica per la procedura di caricamento consente l'impiego di un ceppo nervoso più corto. Utilizzando questo approccio, il nervo viene tagliato dopo che è immerso nella soluzione HEPES con colorante e gli assoni non si risalgono a causa della mancanza di ioni bivalenti nella soluzione di coloranti 27 , 28 .
Nel nostro studio abbiamo usato la forma di sale solubile in acqua dell'indicatore Ca 2+ invece del dextran. I coniugati dextranici diffondono nell'assone più lentamente delle forme di sale. Tuttavia, l'uso del coniugato di dextran riduce la compartimentalizzazione e la manipolazione dei coloranti mediante il nervo e le NMJ. Calcio Vergine 1-3.000 MW di dextran coniugato ha un buon tasso di diffusione e dimostra la riduzione della compartimentalizzazione Up class = "xref"> 38.
È molto importante evitare un lungo periodo di illuminazione fluorescente del tessuto, perché questo influenza la sua salute e sopravvivenza. Usiamo l'ottica Nomarski nel canale di luce visibile per cercare terminali nervosi. Durante la registrazione, limitiamo il campo illuminato utilizzando un diaframma.
È interessante notare che questo metodo di caricamento è adatto solo per preparazioni in grado di sopportare lunghe incubazioni. Per ridurre il tempo di caricamento del colorante quando si stanno effettuando studi su tessuti più fragili ( ad es., Sinapsi di animali a sangue caldo), è necessario ridurre la lunghezza del ceppo nervoso e utilizzare micropipette per il caricamento 29 , 39 .
Questa tecnica di caricamento è adatta per i cambiamenti di immagine in Ca 2+ citosolica, con indicatori fluorescenti sotto la stimolazione singolo-nervo e attività sinaptica ritmicaEf "> 17 , 27 , 35. L'analisi dell'ampiezza Ca 2+ -transiente può essere utilizzata per studiare l'influenza di diverse sostanze sull'entrata del calcio che partecipa al rilascio del neurotrasmettitore 33 .
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata condotta nell'ambito del Programma governativo russo per la crescita competitiva dell'Università federale di Kazan e di una sovvenzione della Fondazione russa per la ricerca di base (16-04-01051, 16-34-00817, 15-04-02983). Ringraziamo i quattro recensori anonimi per aver fornito commenti utili su precedenti bozze del manoscritto. Esprimiamo la nostra gratitudine a Yuliya Aratskaya per la registrazione vocale. Siamo grati al dottor Victor Ilyin per i numerosi commenti utili e per l'aiuto alla redazione finale del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| Ca2+ indicator | Molecular Probes, USA | Oregon Green 488 BAPTA-1 hexapotassium salt, O6806 | 500 μg |
| Silicone Elastomer | Dow Corning, USA | Sylgard 184 elastomer | |
| Pipette | Biohit, Russia | 720210 | 0.5-10µL |
| Pipette tip | Fisher Scientific, USA | 02-707-175 | 10µL |
| Pipette tip | Biohit, Russia | 781349 | 10µL |
| Razor Blade | Fisher Scientific, USA | 12-640 | |
| Minutien Pins | Fine scince tools, Canada | 26002-20 | |
| Corneal Mini-Scissors | MT MEDI CORP, Canada | S-1111 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9610 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9611 | |
| Modelling clay | local producer | can be replaced by any local producer | |
| Petroleum jelly | local producer | can be replaced by any local producer | |
| Microspin FV 2400 | Biosan, Latva | BS-010201-AAA | |
| Multi-spin MSC 3000 | Biosan, Latva | BS-010205-AAN | |
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40mm |
| Syrynge | local producer | 0.5 ml | |
| HEPES | Sigma-Aldrich, USA | H0887 | 100ml |
| Microscope, BX51 | Olympus, Japan | ||
| Data acquisition system | Molecular Devices, USA | Digitdata 1550 | |
| software | Molecular Devices, USA | pClamp software, Version 10 | protocol can be download from : http://kpfu.ru/portal/docs/F_230007060/Video.capture.with. RedShirt.Neuro.CCD.camera.pro |
| Bath and bath temperature controler | Experimental Builder | can be replaced by any chamber with temperature control. For example from https://www.warneronline.com/ | |
| Monochromator | Till Photonics, Germany | Polychrome V | no longer available, can be replaced by other sutable stable light source 488 nm |
| monochromator control software | Till Photonics, Germany | Polycon | |
| Digital CCD camera | Redshirt imaging, USA | Neuro CCD SMQ | |
| Model 2100 Isolated Pulse Stimulator | A-M Systems, USA | ||
| Acquisition software for CCD camera | Redshirt imaging, USA | Turbo SM software | |
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel |
Riferimenti
- Llinás, R., Sugimori, M., Silver, R. B. Microdomains of high calcium concentration in a presynaptic terminal. Science. 256, 677-679 (1992).
- Augustine, G. J. How does calcium trigger neurotransmitter release?. Curr Opin Neurobiol. 11, 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37, 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Curr Opin Neurobiol. 15, 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Curr Opin Cell Biol. 22, 496-505 (2010).
- Borst, J. G., Sakmann, B. Calcium influx and transmitter release in a fast CNS synapse. Nature. 383, 431-434 (1996).
- Borst, J. G., Sakmann, B. Calcium current during a single action potential in a large presynaptic terminal of the rat brainstem. J Physiol. 506, 143-157 (1998).
- Yazejian, B., DiGregorio, D. A., Vergara, J. L., Poage, R. E., Meriney, S. D., Grinnell, A. D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J Neurosci. 17, 2990-3001 (1997).
- Molgó, J., Mallart, A. Effects of Anemonia sulcatatoxin II on presynaptic currents and evoked transmitter release at neuromuscular junctions of the mouse. Pflugers Arch. 405 (4), 349-353 (1985).
- Slutsky, I., Rashkovan, G., Parnas, H., Parnas, I. Ca2+-independent feedback inhibition of acetylcholine release in frog neuromuscular junction. J Neurosci. 22 (9), 3426-3433 (2002).
- Haugland, R. P., Gregory, J. Indicators for Ca2+, Mg2+, Zn2+ and other metal ions. Handbook of fluorescent probes and research products. , 771-826 (2002).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods Cell Biol. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harb Protoc. 2010 (3), (2010).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. J Physiol. 505, 585-592 (1997).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophys J. 74, 1549-1563 (1998).
- Suzuki, S. Ca2+ dynamics at the frog motor nerve terminal. Pflug Arch Eur J Phisiol. 440, 351-365 (2000).
- Sabatini, B. L., Oertner, T. G., Svoboda, K. The life cycle of Ca2+ ions in dendritic spines. Neuron. 33, 439-452 (2002).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. Single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. J Neurosci. 31, 11268-11281 (2011).
- Regehr, W. G., Yuste, R., Konnerth, A. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in neuroscience and development: a laboratory manual. , 307-314 (2005).
- Macleod, G. T. Topical Application of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 786-790 (2012).
- Eilers, J., Konnerth, A. Dye loading with Patch Pipettes. Cold Spring Harb Protoc. 2009 (4), 277-281 (2009).
- Coleman, W. L., Bill, C. A., Simsek-Duran, F., Lonart, G., Samigullin, D., Bykhovskaia, M. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. J Physiol. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct Injection of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 797-801 (2012).
- Talbot, J. D., David, G., Barrett, E. F., Barrett, J. N. Calcium dependence of damage to mouse motor nerve terminals following oxygen/glucose deprivation. Exp Neurol. 234 (1), 95-104 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca2+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10, 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. alpha-Latrotoxin releases calcium in frog motor nerve terminals. J Neurosci. 20 (23), 8685-8692 (2000).
- Newman, Z., Malik, P., Wu, T. Y., Ochoa, C., Watsa, N., Lindgren, C. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. Eur J Neurosci. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harb Protoc. 2012 (7), 3440-3450 (2012).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Blioch, Z. L., Glagoleva, I. M., Liberman, E. A., Nenashev, V. A. A study of the mechanism of quantal transmitter release at a chemical synapse. J Physiol. (1), 11-35 (1968).
- Kazakov, A., Aleksandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Mezhdunarodnyj nauchno-issledovatel'skij zhurnal. 40 (9), 13-16 (2015).
- Khaziev, E. Acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Front Physiol. 7 (621), 1-10 (2016).
- Bélair, E. L., Vallée, J., Robitaille, R. Long-term in vivo modulation of synaptic efficacy at the neuromuscular junction of Rana pipiens frogs. J Physiol. 569 (1), 163-178 (2005).
- Samigullin, D., Fatikhov, N., Khaziev, E., Skorinkin, A., Nikolsky, E., Bukharaeva, E. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Front Synaptic Neurosci. 6 (29), 1-10 (2015).
- Angleson, J. K., Betz, W. J. Intraterminal Ca2+ and spontaneous transmitter release at the frog neuromuscular junction. J Neurophysiol. 85 (1), 287-294 (2001).
- Shahrezaei, V., Cao, A., Delaney, K. R. Ca2+ from one or two channels controls fusion of a single vesicle at the frog neuromuscular junction. J Neurosci. 26 (51), 13240-132499 (2006).
- Troncone, L. R., et al. Promiscuous and reversible blocker of presynaptic calcium channels in frog and crayfish neuromuscular junctions from Phoneutria nigriventer spider venom. J Neurophysiol. 90 (5), 3529-3537 (2003).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Sudakov, I. A., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoSci. 7 (1), 162-166 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon