È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Il WinCF Modello - Un Microcosmo Economico e Tractable di un muco bronchiale Plugged per studiare la Microbiologia del polmone Infezioni
In questo articolo
Riepilogo
Le vie respiratorie del flusso mucoso di fibrosi cistica (CF) sono un ambiente ideale per i patogeni microbici a prosperare. Il manoscritto descrive un nuovo metodo per studiare il microbioma polmonare CF in un ambiente che imita dove provocano malattie e come le alterazioni delle condizioni chimiche possano guidare la dinamica microbica.
Abstract
Molte malattie croniche delle vie respiratorie comportano un attacco muco delle vie aeree. I polmoni di un individuo con fibrosi cistica sono un caso esemplare in cui i loro bronchioli collegati a muco creano un habitat favorevole alla colonizzazione microbica. Vari agenti patogeni prosperano in questo ambiente che interagiscono tra loro e guidano molti dei sintomi associati alla malattia di CF. Come tutte le comunità microbiche, le condizioni chimiche del loro habitat hanno un impatto significativo sulla struttura e sulla dinamica della comunità. Ad esempio, diversi microrganismi crescono in livelli diversi di ossigeno o di altre concentrazioni di soluto. Questo è anche vero nel polmone CF, in cui si ritiene che le concentrazioni di ossigeno possano guidare la fisiologia e la struttura comunitaria. I metodi qui descritti sono progettati per simulare l'ambiente polmonare e sviluppare patogeni in un modo più simile a quello da cui provocano malattie. La manipolazione dell'ambiente chimico di questi microbi è poi usata per studiare come i chemiStriato delle infezioni polmonari regola la sua ecologia microbica. Il metodo, chiamato sistema WinCF, si basa su un mezzo artificiale di espettorato e da tubi capillari stretti intesi a fornire un gradiente di ossigeno simile a quello che esiste nei bronchioli a muco. La manipolazione di condizioni chimiche, come il pH media dello spettro o la pressione degli antibiotici, consente di visualizzare le differenze microbiologiche in quei campioni usando indicatori colorati, osservando la produzione di gas o biofilm, oppure estraendo e sequenziando i contenuti dell'acido nucleico di ciascun campione.
Introduzione
Il metodo descritto in questo manoscritto è chiamato il sistema WinCF 1 . L'obiettivo generale di WinCF è quello di fornire una configurazione sperimentale in grado di simulare l'ambiente di un bronchiolo polmonare pieno di muco. Ciò consentirà un sistema tracciato per studiare patogeni microbici delle malattie polmonari con un fenotipo di ipersecrezione del muco, tra cui la fibrosi cistica (CF), la malattia polmonare cronica ostruttiva (COPD), l'asma e altri. La procedura è stata progettata appositamente per lo studio del CF, caratterizzato da mutazioni che causano la secrezione polmonare divenuta spessa e difficile da eliminare, eventualmente riempendo bronchioli e altri piccoli passaggi con muco 2 . Tali blocchi nel polmone inibiscono lo scambio di gas perché l'aria inalatoria non è più in grado di raggiungere molti alveoli e fornisce anche un habitat per la colonizzazione batterica 3 , 4 . L'incapacità di prevenire la crescita microbica nelIl muco polmonare eccessivo porta infine allo sviluppo di infezioni croniche complesse della via aerea. Queste comunità contengono una varietà di organismi, inclusi virus, funghi e batteri come Pseudomonas aeruginosa , interagenti tra loro 5 , 6 , 7 , 8 . Si ritiene che l'attività del microbiolo del polmone CF sia coinvolta in flare dei sintomi chiamati exacerbazioni polmonari 1 , 9 , 10 , 11 . WinCF consente di studiare il comportamento della comunità microbica attorno a queste esacerbazioni ed è ora ampliato per agire come sistema sperimentale di base per studiare l'ecologia microbica del polmone. Tradizionalmente, le esacerbazioni sono state studiate attraverso l'analisi diretta di campioni prelevati dal polmone. Molti fattori confondenti fanno un'analisi diretta del microbiale behavior nei polmoni impegnative, con il sistema WinCF, molti di questi fattori vengono rimossi e il comportamento del microbiome polmone può essere studiato più direttamente, per consentire analisi più fine di attività batterica in un bronchiolo muco-collegato.
Il sistema WinCF fornisce un metodo per crescere e analizzare i batteri in un modo che simula efficacemente l'ambiente polmone. I metodi tradizionali per la coltivazione di batteri polmonari campioni di coltura spesso coinvolti su piastre di agar tradizionali. Questi metodi lasciano i campioni aperti all'ossigeno atmosferico, trascurando per tenere conto del ipossico e condizioni anossiche spesso disponibili a bronchioli polmonari tappati con muco 12, 13. Coltura su agar in condizioni aerobiche è niente come l'ambiente del polmone CF e può trarre in inganno medici e ricercatori sul comportamento degli agenti patogeni che stanno cercando di trattare. Inoltre, le sostanze nutritive disponibili ai batteri su piastre di agarSono dissimili a quelli disponibili nello sputo effettivo, che è rappresentato in WinCF utilizzando l'espansione artificiale (ASM). Come mostrato dalle colture di Pseudomonas in Sriramulu et al. 14 , ASM include un insieme specifico di componenti che imita le risorse disponibili per espellere i microbi e replica anche la consistenza fisica dello sputo. Poiché un polmone malato ha un microbioma specifico, lo studio di tali microrganismi dovrebbe essere idealmente avvenuto anche nelle condizioni specifiche del polmone.
Il sistema WinCF consente un'analisi rapida e una facile manipolazione delle condizioni sperimentali per osservare i cambiamenti microbici simili a come si verificherebbero in un efficace bronchiolo polmonare. Questa tecnica consente l'inoculazione di una miriade di tipi di campioni correlati tra cui sputum, saliva, altre secrezioni corporee e colture batteriche pure o miste. La natura dell'installazione sperimentale consente un'immediata interpretazione visiva diIl comportamento della comunità microbica ed è progettato per consentire una facile applicazione a valle di una moltitudine di procedure microbiologiche e omiche. Tali studi sono importanti perché i cambiamenti della composizione della comunità batterica si basano sulle condizioni fisico-chimiche del loro ambiente. Con WinCF le condizioni chimiche dei media possono essere manipolate per analizzare gli effetti sull'attività batterica. Ad esempio, l'acidità dei supporti può essere modificata prima dell'inoculazione con un campione. Dopo l'incubazione, l'attività batterica in ognuna di queste condizioni può essere confrontata direttamente e si possono trarre conclusioni su come i batteri in questi campioni di sputo si comportino in risposta al pH variabile. Qui descriviamo le procedure per l'applicazione del sistema WinCF e gli esempi di come la chimica dei media può essere manipolata per studiare gli effetti sul microbioma polmonare.
Protocollo
1. Preparazione delle scorte per i mezzi di sputum artificiali
- Crea una soluzione al 5% di mucina. Aggiungere 1,0 g di mucina dello stomaco di suino disidratato a 20 ml di acqua deionizzata. Autoclave la soluzione risultante.
NOTA: la sterilizzazione della mucina distruggerà la sua struttura inerente; Altri metodi per sterilizzare la mucina nella sua forma asciutta includono sterilizzazione UV e irraggiamento. Questi metodi non sono stati ampiamente utilizzati per il sistema WinCF tuttavia. - Aggiungere 2,2 g di KCl a 50 ml di acqua deionizzata e permettere la dissoluzione. Aggiungere 5,0 g di NaCl a 50 ml di acqua deionizzata e permettere la dissoluzione. Autoclave queste due soluzioni.
- Aggiungere 100 mg di DNA sperma di salmone a 10 ml di acqua sterile deionizzata. Scaldare questa soluzione a circa 85 ° C in un bagno d'acqua per alcune ore per assicurare la dissoluzione.
- Aggiungere 5,0 mg di ferritina a 5,0 ml di acqua sterile deionizzata.
2. Preparazione del mezzo di espettorato artificiale
- combinareI seguenti componenti: 16 ml di soluzione di mucina, 2,0 ml di soluzione di KCl, 2,0 ml di soluzione di NaCl, 200 μL di emulsione di tuorlo d'uovo, 5,6 ml di soluzione di DNA, 120 μL di soluzione di ferritina, 5,78 ml di essenziali La soluzione amminoacidica, 5,78 ml di soluzione aminoacido non essenziale e 2,44 ml di acqua sterile.
- Se appaiono piccole quantità di sedimento, agitare dolcemente per mescolare.
- Pipettare 5,0 ml di supporti in otto centrifughe sterili da 15 ml.
NOTA: Le condizioni chimiche di ogni tubo possono essere manipolate come desiderato. Ad esempio, a ciascun tubo possono essere aggiunte soluzioni tampone e indicatori di pH allo scopo di confrontare il comportamento microbico a livelli distinti del pH. Una dimostrazione di questo è mostrata nella sezione dei risultati rappresentativi con 8 livelli di pH distinti, da 5,0 a 8,5 in 0,5 incrementi di pH.
- Una volta che le condizioni chimiche dei supporti sono manipolate con successo, congelare per un utilizzo successivo. I media resteranno stabilizen a -20 ° C per diversi mesi. Vortex su di scongelamento.
3. Preparazione di un comando di marcia del Provette capillari
- In un biohood sterile, riempire otto tubi microcentrifuga sterili con 250 microlitri di media ciascuno.
- Acquisire otto sterili 15 provette per centrifuga ml, ogni tubo corrispondente ad una provetta indicato nel passaggio 3.1.
- Sterilizzare un tovagliolo di carta con una soluzione di etanolo al 70% e lasciare asciugare. Una volta asciutto, strappare la spugna a pezzetti di circa quattro pollici quadrati ciascuno, e rovinarli ogni pezzo sul fondo di una provetta da centrifuga 15. Per i tubi aggiuntivi, spray e asciutti asciugamani di carta aggiuntivi, se necessario.
- Con un ciuffo di carta sul fondo di ogni provetta, inumidire leggermente ogni ciuffo carta con circa 1,0 mL di acqua sterile per creare un ambiente umido.
- Ottenere tre tubi capillari di vetro per ogni provetta preparata nella fase 3.1 e un blocco di tubo capillare mastice sealant.
- Per ogni provetta, riempire tre tubi capillari con i media di circa 5 mm di distanza dal marcatore blu vicino alla parte superiore del tubo.
- Riempire tenendo un'estremità del tubo nella provetta e inclinando verso l'orientamento orizzontale, consentendo un'azione capillare per guidare il mezzo nel tubo (vedere Figura 1).
- Interrompere il riempimento inserendo delicatamente un dito guantato sopra l'estremità aperta del tubo, e quindi sigillare l'altra estremità del tubo premendolo nel blocco sigillante.

Figura 1: Esempio pH Pendenza, Riempire Tubo capillare con artificiale espettorato Medium. Il mezzo viene aggiunto inserendo un'estremità del tubo nel liquido e inclinando per facilitare l'azione capillare. La colorazione media in questo esempio è dovuto indicatore di pH aggiunto per aiutare demoneStrati i potenziali cambiamenti nell'acidità dopo l'incubazione. Clicca qui per visualizzare una versione più grande di questa figura.
- Posizionare ogni set di tre tubi capillari in tubi di centrifuga da 15 ml riempiti di asciugamani di carta completamente inumiditi con acqua sterile, rivestiti lateralmente. Bloccare il tubo e l'etichetta. Questi tre capillari sono per la replica di ogni condizione di controllo.
- Quando tutti i tubi di centrifuga da 15 ml vengono riempiti con i loro tubi capillari designati, posizionare i tubi in un rack di contenimento. Mettere il rack in modo tale che i tubi saranno incubati orizzontalmente (per catturare le bolle di gas) (vedi figura 2 ). Incubare i tubi capillari all'interno dei tubi di centrifuga (contenenti i grumi di carta inumiditi) a 37 ° C per 48 ore.
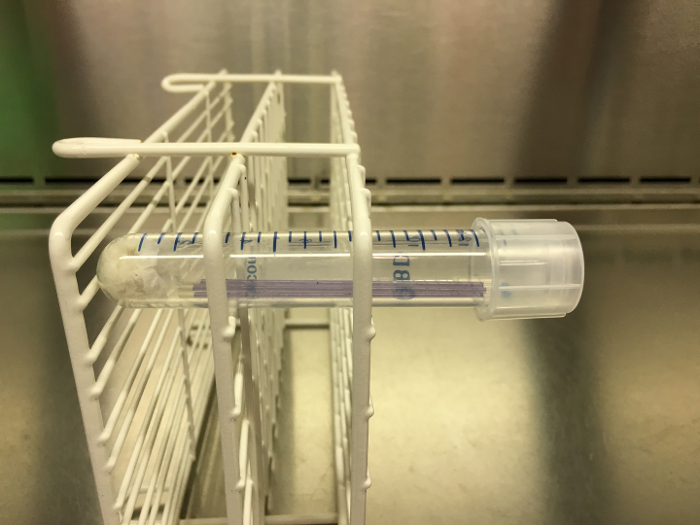
Figura 2: Grado di pH dell'esempio, tubi capillari pronti per l'incubazione. Una volta che tre tubi capillari sono stati riempiti e sigillati, vengono collocati in un tubo di centrifuga con un tovagliolo di carta umido nella parte inferiore. Questo tubo viene quindi chiuso e messo in un rack. Il rack deve essere orientato lateralmente durante l'incubazione, come qui illustrato, in modo che la produzione di gas possa essere osservata una volta completata l'incubazione. Clicca qui per visualizzare una versione più grande di questa figura.
4. Imaging dei tubi capillari di controllo dopo l'incubazione
- Rimuovere il rack di tubi di centrifuga dall'incubatore, assicurandosi di mantenere i tubi orizzontali. Spostare con cautela i tubi capillari dai tubi di centrifuga, mantenendo ogni set di tre separati da altri set.
- Disporre i tubi capillari uno accanto all'altro su una lightbox, tutti allineati in modo che il contenuto dei tubi sia visOttima e illuminata. Lasciare un vuoto ogni tre tubi per separare le diverse condizioni chimiche.
- Con i tubi allineati e la lightbox accesa, foto direttamente sopra. (Vedi figura 3 )

Figura 3: Grado di pH dell'esempio, Run di controllo, Preincubazione, Nessun sputum aggiunto. Medio sputato artificiale dopo essere stato aggiunto a tubi capillari in set di tre, aumentando il pH da sinistra a destra. La combinazione di indicatori aggiunti al mezzo provoca più tubi acidi che appaiono più gialli, mentre i tubi meno acidi diventano più porpora. I tubi sono disposti orizzontalmente e sono illuminati da sotto, fotografati dall'alto. Clicca qui per visualizzare una versione più grande di questa figura.
- Smaltire ilMateriali di controllo nei rifiuti biologici.
5. Inoculare i tubi capillari WinCF con un campione di sputum
- In una bioina sterile, riempire otto tubi di microcentrifuga sterili con 225 μL di supporti ciascuno.
- Homogenizzare il campione di sputo ritirando e espellendo lo sputo ripetutamente con una siringa da 3 ml (una siringa di plastica senza ago). Fai questo fino a quando l'espettorato è di consistenza liscia.
- Aggiungere 25 μl di espettorato omogeneizzato a ciascun tubo di microcentrifuga (diluizione 1/10 nei supporti ASM) preparato nel punto 5.1. Poi vortex i tubi per 30 s per mescolare in modo sufficientemente.
- Aggiungere i supporti ai tubi capillari seguendo la stessa procedura dei passi da 3.2 a 3.5.
6. Imaging dei tubi a capillare campione dopo l'incubazione
- Dopo il tempo di incubazione di 48 ore, rimuovere e ricavare i tubi capillari seguendo la stessa procedura dei passi da 4.1 a 4.3.
- Se le bolle sono presenti nei tubi, faiche le fotografie scattate chiaramente raffigurano la delimitazione tra le bolle e dei media nei tubi. Se biofilm è presente, assicurarsi che le fotografie possono rappresentare in modo chiaro la sua presenza pure.
7. La rimozione dei supporti per applicazioni a valle
- Per semplificare l'analisi a valle, rimuovere i supporti dai tubi capillari dopo imaging. Le possibili applicazioni includono la coltura e il DNA / RNA sequenziamento e profilazione metabolomica.
Attenzione: I tubi capillari di vetro riempiti con agenti patogeni sono un rischio biologico significativo, in tal modo, questi passaggi deve essere fatto con molta attenzione con attrezzature specifiche. Se tubi capillari si rompono, smaltire in contenitori per materiali pericolosi taglienti. - Utilizzare contundenti aghi ended di calibro 25 e 0,5 pollici di lunghezza per rimuovere il supporto. Inserire l'ago ended smussato nella estremità chiusa del tubo per rompere il sigillo.
- Dopo la rottura del sigillo, ruotare il tubo capillare capovolta e dei media gocciolare dalla porzione superiore. ioI supporti non esauriscono facilmente, utilizzare una pipetta con una punta da 200 μl ed espellere il supporto fuori dal tubo premendo sullo stantuffo della pipetta quando viene inserito nell'estremità del tubo capillare. Raccogliere il supporto tubo espulso in un contenitore appropriato (tubo da centrifuga da 1,5 ml).
NOTA: per analisi trascrizionale o altri RNA, i media possono essere espulsi direttamente in buffer stabilizzanti RNA.
8. Il sistema WinCC FLUD
NOTA: Il sistema WinCC Fluid Loading Utility Device (FLUD) è una suite opzionale di dispositivi complementari progettati per ottimizzare il throughput del WinCF System. Il sistema WinCC FLUD è principalmente costituito da materiali stampabili 3D. La produzione stampata 3D consente una sostituzione rapida e semplice dei materiali per garantire tempi di inattività minimi per i ricercatori e requisiti minimi di produzione. I disegni, i file stl, le istruzioni per la stampa 3D e il manuale WinCF FLUD sono disponibili nel sito onlinent.
- Preparazione di supporti per il carico del tubo capillare
- In una bioina sterile, riempire otto tubi sterilizzatori di microcentrifuga da 2 ml con 900 μL di ciascuno.
- Omogeneizzare tutti i campioni di sputo ritirando e espellendo lo sputo ripetutamente con una siringa da 3 ml (una siringa di plastica senza ago). Fai questo fino a quando l'espettorato è di consistenza liscia.
- Aggiungere 100 μl di espettorato omogeneizzato a ciascun tubo di microcentrifuga (diluizione 1/10 in mezzo) preparato al punto 8.1.1. Poi vortex i tubi per 30 s per mescolare in modo sufficientemente.
- Fissare i tubi di microcentrifuga riempiti e aperti nel supporto del tubo del rotatore orientato in modo che i tubi siano verticali.
- Posa di tubi capillari
- Recuperare tre tubi capillari per ogni tubo di microcentrifuga nel punto 8.1.
- Inserire tre tubi nella base di gomma in modo che siano allineati con i tubi di microcentrifuga all'altra estremità dell'apparecchio.Assicurarsi che le estremità contrassegnate dei tubi siano lontane dai tubi di microcentrifuga. Inserire correttamente i tre fori sulla base della culla sopra i tre prigionieri sul supporto per culla.
- Con i tubi capillari collocati nei loro canali di guida sull'apparecchiatura, posizionare saldamente il tampone di gomma sopra le loro medie sezioni per evitare lo spostamento. (Vedi figura 4 )

Figura 4: Il sistema FLUD completamente caricato con i tubi capillari assicurati dal Tamp Rubber Tampone sulle loro Midsections. Clicca qui per visualizzare una versione più grande di questa figura.
- Caricamento dei supporti nei tubi capillari
- Usare con cautela una mano per afferrare l'estremità dell'apparato dove sono presenti i tubi capillariADED, e utilizzare l'altra mano per tenere la cremagliera rotatore in cui vengono caricate le provette da microcentrifuga.
- Delicatamente ruotare il rack microcentrifuga modo che i tubi da microcentrifuga sono quasi orizzontale e procedere a spingere lentamente la cremagliera verso i tubi capillari. (Vedi Figura 5)
- Quando le estremità dei tubi capillari entrano in contatto con i media nei tubi microcentrifuga, affinché l'azione capillare inizia immediatamente riempimento dei tubi capillari. Per regolare tasso di riempimento e il livello di riempimento, ruotare delicatamente l'apparecchio nel suo complesso. Nel fare questo, fare attenzione a non versare i media fuori dei tubi microcentrifuga. (Vedere Figura 6)
- Quando i tubi capillari sono riempiti ai livelli desiderati, posizionare il livello apparecchio su una superficie e accuratamente ancora estrarre rapidamente il rack di provette da microcentrifuga le estremità dei tubi capillari per cessare di riempimento. I tubi microcentrifuga possono essere retratti fino in posizione verticale e chiusi.
- Sigillare le estremità sporgenti dei tubi capillari premendo un blocco sigillante su ciascun set triplice, sigillando un set alla volta finché tutti i set sono sigillati. Per ridurre il rischio di contaminazione, premere una parte diversa del blocco sigillante su ciascuna serie triplicata (vedi Figura 7 ).

Figura 5: Il sistema FLUD con tubi medi, distribuiti ad orientamento orizzontale, pronti a realizzare contatti con i tubi capillari. Clicca qui per visualizzare una versione più grande di questa figura.
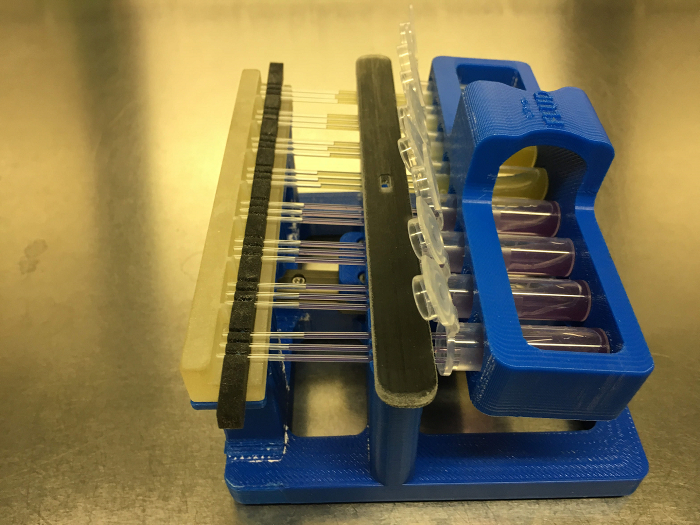
Figura 6: Il sistema FLUD con tubi capillari Caricamento con i mezzi mediante azione capillare. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Tenuta dei tubi capillari riempiti sul sistema FLUD Un triplicato impostato alla volta utilizzando un blocco di tenuta. Questo blocco sigillante aveva plastica lungo i bordi che erano stati tagliati per impedire il contatto con i set trippati vicini durante la sigillatura. Clicca qui per visualizzare una versione più grande di questa figura.
- incubazione
- Togliere il tampone di gomma sopra i midsections del tubo e sollevare la base di gomma dall'apparato principale. Questo dovrebbe prendere con sé tutti i tubi capillari. Ora regolare la base e i tubi che si trovano sul rack di imaging. Questo raCk ha tre mozziconi che si inseriscono nella base, così come piccoli canali di guida per impostare i tubi.
- Impostare il rack dell'immagine nel suo complesso nella scatola di incubazione in plastica trasparente. Immergere piccole quantità di asciugamani sterili in acqua sterile e collocare lungo i due lati più corti della scatola per fornire l'umidità durante l'incubazione. (Vedi figura 8 )
- Chiudere completamente la scatola e impostare all'interno di un incubatore a 37 ° C, assicurandosi di mantenere i tubi orizzontali. Incubare per 48 h.
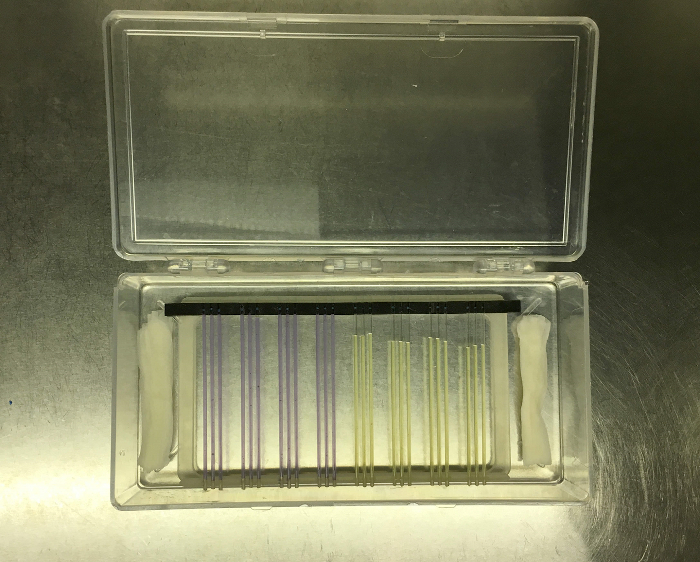
Figura 8: Tubi capillari in culla di gomma Trasferiti dal sistema FLUD ad un rack di imaging, che è stato collocato in una scatola di incubazione trasparente accanto a asciugamani di carta umida per fornire umidità. Clicca qui per visualizzare una versione più grande di thè figura.
- Imaging ed estrazione
- Rimuovere il rack di imaging passo i tubi dalla casella di incubazione e collocarlo su una lightbox, illuminato dal basso. Con i tubi già nel rack di imaging, gli insiemi triplicato saranno opportunamente distanziati e pronte per l'immediato.
- Mettere a fuoco sui tubi in modo tale che tutti sono visibili nel campo visivo e la luce dalla casella di luce fornisce un sufficiente contrasto e visualizzazione del colore nei coloranti tubo. Fotografia da direttamente sopra.
- Per estrarre il contenuto dei tubi, togliere i tubi capillari dalla gomma culla una serie di triplicati in un momento. sollevare delicatamente i tubi e fuori della culla o scivolare fuori.
- Per ciascun gruppo di triplicato, seguire la procedura di estrazione descritto nei passaggi da 7.1 a 7.3.
Risultati
crescita microbiologica attraverso le diverse condizioni chimiche indotte nei campioni variato drammaticamente in alcuni casi e più sottile in altri. Molti cambiamenti nell'attività erano a carattere visivo, essendo facilmente evidente non appena il periodo di incubazione è conclusa. Nell'esempio di manipolazione pH, i campioni attraverso lo spettro pH varia notevolmente come dimostrato da diversi fattori che sono diventate evidenti dopo incubazione. Quando non campioni di esp...
Discussione
Il trucco microbiologica di un polmone con CF contiene una grande varietà di organismi, ma le condizioni all'interno del polmone probabilmente un'influenza significativa su quali tipi di microbi possono sopravvivere e prosperare 13, 15. specifici meccanismi attraverso i quali queste condizioni cambiano e gli effetti precisi che hanno sul microbioma polmone sono in genere poco chiaro al momento. In questo metodo sperimentale, presentiamo un'analisi d...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori vorrebbero riconoscere Vertex Pharmaceuticals e il Premio Innovazione Ricerca Fibrosi Cistica per il finanziamento R. Quinn e il NIH / NIAID per concedere finanziamenti 1 U01 AI124316-01, un approccio di biologia dei sistemi per il trattamento di patogeni resistenti a più farmaci. Vorremmo anche ringraziare il Dipartimento di Meccanica e Ingegneria Aerospaziale presso corso di design di alto livello di ingegneria meccanica di laurea della UCSD per facilitare la collaborazione con gli aspetti ingegneristici di questo lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| Color-Coded Capillary Tubes | Fisher Scientific | 22-260943 | |
| Cha-seal Tube Sealing Compound | Kimble-Chase | 43510 | |
| Mucin from porcine stomach | Sigma | M1778 | |
| Ferritin, cationized from horse spleen | Sigma | F7879 | |
| Salmon sperm DNA Sodium salt (sonified) | AppliChem Panreac | A2159 | |
| MEM Nonessential Amino Acids | Corning cellgro | 25-025-CI | |
| MEM Amino Acids | Cellgro | 25-030-CI | |
| Egg Yolk Emulsion, 50% | Dalynn Biologicals | VE30-100 | |
| Potassium Chloride | Fisher Scientific | P2157500 | |
| Sodium Chloride | Fisher Scientific | S271500 | |
| 15 mL centriguge tubes with Printed Graduations and Flat Caps | VWR | 89039-666 | |
| 50 mL centrifuge tubes with Printed Graduations and Flat Caps | VWR | 89039-656 | |
| 1.5 mL microcentrifuge tubes | Corning | MCT-150-R | |
| 2.0 mL microcentrifuge tubes | Corning | MCT-200-C |
Riferimenti
- Quinn, R. A., et al. A Winogradsky-based culture system shows an association between microbial fermentation and cystic fibrosis exacerbation. ISME J . 9, 1024-1038 (2015).
- Quinton, P. M. Cystic fibrosis: impaired bicarbonate secretion and mucoviscidosis. Lancet. 372 (9636), 415-417 (2008).
- Harrison, F. Microbial ecology of the cystic fibrosis lung. Microbiology. 153 (Pt 4), 917-923 (2007).
- Caverly, L. J., Zhao, J., LiPuma, J. J. Cystic fibrosis lung microbiome: Opportunities to reconsider management of airway infection. Pediatr pulmonol. 50, S31-S38 (2015).
- Blainey, P. C., Milla, C. E., Cornfield, D. N., Quake, S. R. Quantitative analysis of the human airway microbial ecology reveals a pervasive signature for cystic fibrosis. Sci Transl Med. 4 (153), 153ra130 (2012).
- Willner, D., et al. Spatial distribution of microbial communities in the cystic fibrosis lung. ISME J. 6 (2), 471-474 (2012).
- Delhaes, L., et al. The airway microbiota in cystic fibrosis: a complex fungal and bacterial community--implications for therapeutic management. PloS one. 7 (4), e36313 (2012).
- Rogers, G. B., et al. D. Bacterial diversity in cases of lung infection in cystic fibrosis patients: 16S ribosomal DNA (rDNA) length heterogeneity PCR and 16S rDNA terminal restriction fragment length polymorphism profiling. J clin microbiol. 41 (8), 3548-3558 (2003).
- Stenbit, A. E., Flume, P. A. Pulmonary exacerbations in cystic fibrosis. Curr Opin Pulm Med. 17 (6), 442-447 (2011).
- Twomey, K. B., et al. Microbiota and metabolite profiling reveal specific alterations in bacterial community structure and environment in the cystic fibrosis airway during exacerbation. PloS one. 8 (12), e82432 (2013).
- Carmody, L. A., et al. Changes in cystic fibrosis airway microbiota at pulmonary exacerbation. Ann. Am. Thorac. Soc. 10 (3), 179-187 (2013).
- Worlitzsch, D., et al. Effects of reduced mucus oxygen concentration in airway Pseudomonas infections of cystic fibrosis patients. J. Clin. Invest. 109 (3), 317-325 (2002).
- Cowley, E. S., Kopf, S. H., LaRiviere, A., Ziebis, W., Newman, D. K. Pediatric Cystic Fibrosis Sputum Can Be Chemically Dynamic, Anoxic, and Extremely Reduced Due to Hydrogen Sulfide Formation. mBio. 6 (4), e00767-e00715 (2015).
- Sriramulu, D. D., Lünsdorf, H., Lam, J. S., Römling, U. Microcolony formation: a novel biofilm model of Pseudomonas aeruginosa for the cystic fibrosis lung. J. Med. Microbiol. 54 (Pt 7), 667-676 (2005).
- Quinn, R. A., et al. Biogeochemical forces shape the composition and physiology of polymicrobial communities in the cystic fibrosis lung. mBio. 5 (2), (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon