È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Dieta grassa alta alimentazione e Throughput elevato dosaggio di Triacylglyceride in Drosophila Melanogaster
In questo articolo
Riepilogo
Si tratta di una dieta grassa alta alimentazione protocollo per indurre l'obesità in Drosophila, un modello per la comprensione dei meccanismi molecolari fondamentali implicati in lipotoxicity. Fornisce inoltre un'analisi di triacylglyceride throughput elevato per misurare l'accumulo di grasso in Drosophila e potenzialmente altri modelli (insetti) in varie condizioni dietetiche, ambientali, genetiche o fisiologiche.
Abstract
La malattia di cuore è la causa numero uno di morte umana in tutto il mondo. Numerosi studi hanno dimostrato forti connessioni tra l'obesità e malfunzionamento cardiaco negli esseri umani, ma più strumenti e gli sforzi di ricerca sono necessari delucidare meglio i meccanismi coinvolti. Per oltre un secolo, il modello geneticamente altamente trattabile di Drosophila è stato strumentale nella scoperta di geni chiave e vie molecolari che ha dimostrato di essere altamente conservata tra le specie. Molti processi biologici e meccanismi di malattia sono funzionalmente conservati al volo, come sviluppo (ad es., piano di corpo, cuore), cancro e malattie neurodegenerative. Recentemente, lo studio dell'obesità e patologie secondarie, come le malattie cardiache negli organismi di modello, ha svolto un ruolo molto critico nell'identificazione dei regolatori chiave coinvolti nella sindrome metabolica in esseri umani.
Qui, ci proponiamo di utilizzare questo organismo di modello come strumento efficace per indurre l'obesità, cioè, eccessivo accumulo di grasso e sviluppare un efficiente protocollo per monitorare il contenuto di grassi sotto forma di accumulo di tag. Oltre a altamente conservata, ma meno complesso genoma, al volo ha anche una durata breve per sperimentazione rapida, combinata con rapporto costo-efficacia. Questo documento fornisce un protocollo dettagliato per l'alimentazione di alta dieta di grassi (HFD) in Drosophila per indurre l'obesità e un'analisi di triacylglyceride (TAG) di throughput elevato per la misurazione l'associato aumento nel contenuto di grassi, con l'obiettivo di essere altamente riproducibile e efficiente per lo screening genetico o chimico su larga scala. Questi protocolli offrono nuove opportunità per efficientemente indagare meccanismi regolatori coinvolti nell'obesità, nonché fornire una piattaforma standard per la ricerca di scoperta di farmaci per il test rapido dell'effetto di farmaci candidati sullo sviluppo o prevenzione dell'obesità, diabete e malattie metaboliche correlate.
Introduzione
Siamo in un tempo dove l'obesità e suoi associati oneri economici, è un problema mondiale1. Due su ogni tre americani sono in sovrappeso o obesi con patologie relative al cuore, la causa primaria di morte entro la popolazione adulta2. Nuovi metodi efficienti sono necessari studiare adeguatamente i componenti genetici e molecolari implicati nella regolazione della sindrome metabolica utilizzando organismi modello. Per questo motivo, abbiamo scelto il moscerino della frutta Drosophila modello perché condivide i più elementari processi biologici con i mammiferi, compreso gli esseri umani e topi3,4,5,6. Genoma di drosophilaè altamente conservato durante l'evoluzione, ma nel complesso molto più piccolo con meno duplicazione genica e di complessità metabolica, che lo rende ideale per la comprensione dei meccanismi fondamentali implicati in molte malattie umane4 , 7 , 8. Inoltre, caratteristici processi effettuati dal tessuto adiposo, intestino e pancreas sono rappresentate in tempo reale e mediare le funzioni di regolamentazione nel metabolismo glucidico e lipidico, ad esempio, che sono simili a esseri umani9, 10,11. Inoltre, la base delle vie molecolari coinvolte nel controllo dell'obesità, insulino-resistenza e diabete negli esseri umani sono funzionalmente conservate in Drosophila melanogaster12,13,14 , 15 , 16. come organismi superiori, Drosophila ha un cuore che batte che si forma durante lo sviluppo di processi simili a quella del cuore di un mammifero3,17. Così, lo sviluppo di un affidabile HFD alimentazione protocollo e throughput elevato TAG dosaggio, adatte a scopi di screening efficiente utilizzando la casella degli strumenti genetici di Drosophila, fornire un importante mezzo per studiare e comprendere le basi genetiche fondamentali malattie metaboliche complesse sottostanti.
Il cibo HFD stesso fatta da un alimento standard del laboratorio integrato con olio di cocco, che è costituita principalmente da acidi grassi saturi, conosciuti per essere associato con la sindrome metabolica18. Mentre che inducono l'obesità nei modelli dei mammiferi, come roditori, può richiedere mesi19,20, nostro HFD ottimizzata protocollo di alimentazione in Drosophila in modo efficace e riproducibile aumenta organismal tenore di materia grassa in una questione di giorni12,14. Questo protocollo, in combinazione con un dosaggio elevato throughput TAG, permette lo screening di massa efficiente per gli effetti di fattori genetici, influenze ambientali e i farmaci candidati per scoprire nuovi modulatori del metabolismo dei grassi. Di conseguenza, questi protocolli sono probabili rilevanti per capire e/o combattere l'obesità e le patologie associate all'obesità.
Il protocollo di alimentazione è versatile e può essere applicato per studiare gli effetti metabolici e funzionali dei singoli acidi grassi saturi o insaturi. L'uso di questo test di velocità effettiva elevata TAG non è limitato a d. melanogaster, ma può essere adattato ad una varietà di organismi modello piccolo con cuticola o dure matrici extracellulari (ad es., altre specie di Drosophila , c. elegans e altri emergenti organismi invertebrati marini modello) per misurare il tenore di materia grassa in differenti condizioni ambientali, genetiche o fisiologiche, in qualsiasi fase di sviluppo, età adulta o fase di malattia metabolica. Il dosaggio di TAG è basato su una misurazione colorimetrica di una serie di reazioni enzimatiche che degradano i tag in acidi grassi, glicerolo, glicerolo 3-fosfato e, infine, H2O2 che reagisce con 4-amminoantipirina (4-AAP) e 3,5- dicloro-2-idrossibenzene sulfonato (3,5 DHBS) per produrre un prodotto colorato di rosso che viene misurato mediante uno spettrofotometro a 96 pozzetti.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. HFD alimentazione protocollo
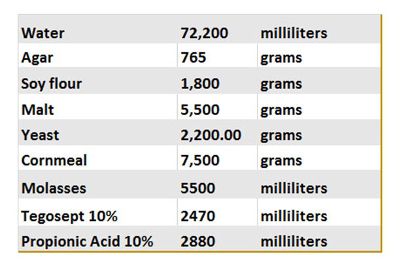
tabella 1. Ricetta di cibo volare.
La tabella seguente riassume i diversi ingredienti utilizzati per preparare il nostro controllo cibo. Una volta effettuata, 10 mL del cibo è versato in fiale, raffreddato e conservato a 4 ° C per la conservazione a lungo termine.
- Preparazione HFD
- per fare 1 kg di cibo grasso alto, pesare 700 g di alimento normale pre-fatta (cfr. tabella 1) e 300 g di olio di cocco in due contenitori separati usando una bilancia analitica.
- Di calore ogni contenitore individualmente nel microonde, fino a quando il contenuto si fondono completamente. Versare l'olio di cocco nel contenitore per alimenti volare. Mescolare con una frusta fino a quando l'olio è ben amalgamato nel cibo volo.
Nota: Nessun pezzi di cibo o di olio devono essere visibile. Quando l'alimento si sta sciogliendo nel microonde, interrompere a intervalli di 1 min a mescolare il cibo ed evitare l'ebollizione. - Ripesare il cibo grasso alto. Se il peso totale è inferiore a 1 kg (700 g di cibo + 300 g di olio di cocco), aggiungere l'acqua (circa 10 mL) per compensare l'evaporazione durante il riscaldamento e per riportare il peso di 1 kg.
- Versare circa 10 mL di omogeneizzato alto cibo grasso per flaconcino (circa il 25% del volume del flaconcino). Successivamente, coprire con una garza per evitare mosche ' contaminazione. Raffreddare per 1 h a temperatura ambiente, poi le fiale a 4 ° C per lo stoccaggio di trasferimento fino a 4 settimane.
Nota: Il cibo normale (NF) viene utilizzato come un alimento di controllo. Anche versare 10 mL (circa il 25% del volume di fiala) di NF per flaconcino. Per il cibo HFD, sostituire il 30% del cibo NF con olio di cocco. Per il controllo e condizioni sperimentali, le mosche ci hanno dato la stessa quantità di NF e HFD (10 mL di cibo per flaconcino).
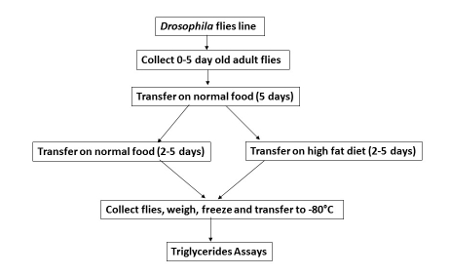
Figura 1 . HFD alimentazione in Drosophila.
Lo schema mostra le diverse fasi di alimentazione per le mosche su un alimento di controllo (dieta normale senza aggiunta di olio di cocco-NF) o HFD (con l'aggiunta di olio di cocco). L'intero processo richiede 10 giorni dopo la raccolta iniziale di mosche adulte. Clicca qui per visualizzare una versione più grande di questa figura.
- HFD alimentazione di d. melanogaster
Nota: questo protocollo comprende controllo cibo e HFD alimentazione procedure che sono compatibili con qualsiasi linea di volo. Controllo e sperimentali mosche sono messi in flaconcini contenenti lo stesso cibo di quantità (NF o HFD).- Uso CO 2 ad anestetizzare le mosche.
Nota: Per i neofiti, per favore leggi di riferimento 21 per una panoramica sulla generazione e la gestione di d. melanogaster. - Raccogliere 0-5 mosche di giorno vecchio da fiale e trasferimento (girando) le mosche nei nuovi flaconi contenenti NF (precedentemente riscaldato a temperatura ambiente). Lasciare che l'età di mosche per ulteriori 5 giorni a 21 ° C.
- Alla fine dei 5 giorni, togliere i flaconcini contenenti HFD e NF da 4 ° C.
Nota: poiché le temperature fredde possono sollecitare vivente mosche, lasciate le fiale riposare per 30 min a temperatura ambiente per riscaldare prima dell'uso. - Uso salviettine, pulire e rimuovere il liquido in eccesso dai lati delle fiale.
- Inserire un piccolo pezzo di carta da filtro, circa 1 cm x 3 cm, nell'alto alimento grasso di assorbire qualsiasi liquido in eccesso.
Nota: Questo passaggio è fondamentale per prevenire le mosche di attaccarsi al cibo HFD. - Trasferimento le mosche sul cibo grasso elevato (girando). Posare le fiale orizzontalmente dalla loro parte, (non permanente) 21-22 ° c per 5 giorni.
Nota: Evitare temperature superiori come questo può fondere parzialmente il cibo grasso alto, causando le mosche a bastone per il cibo e il die. - Dopo 5 giorni, trasferimento (girando) le mosche da NF e HFD nei flaconi di nuovi senza cibo per consentire loro coraggio di vuoto per 30 min. Successivamente, procedere alla pesatura le mosche.
Nota: Uno dei passaggi critici in questo HFD protocollo di alimentazione è quello di preparare un omogeneizzato HFD, gratuitamente qualsiasi pezzi di cibo volo o olio condensato. Miscelazione omogenea e la HFD a 45-30 ° C di raffreddamento è consigliabile, prima versando in fiale e immagazzinare il cibo all'età corretta di 4 ° C. corrispondenza di controllo e sperimentali mosche è importante così come Priore condizioni nutrizionali e ambientali controllate per l'alimentazione di HFD. Durante la fase di alimentazione, controllo e mosche sperimentale devono essere data la stessa quantità di NF e HFD. Mai raccogliere mosche da sovraffollate fiale o flaconi (per evitare effetti transgenerazionali). Sempre mettere un massimo di 25 mosche per flaconcino durante NF e HFD per evitare la restrizione dietetica o altri effetti di affollamento. La HFD è composto di 30% di olio di cocco, così temperature superiore ai 22 ° C parzialmente potrebbero fondere la HFD, causando le mosche attaccare il cibo oleoso e morire. Prima di indossare le mosche la HFD, pulire le fiale per rimuovere eventuali residui di olio e inserire un filtro di carta per assorbire il liquido in eccesso nel cibo. Durante l'incubazione delle mosche su HFD, le fiale vengono deposte sui loro lati per fornire una superficie orizzontale senza grassi per le mosche.
- Uso CO 2 ad anestetizzare le mosche.
- Le mosche di pesatura
- per ciascun genotipo e sesso per essere testato, utilizzare una scala ultra-sensibile per registrare i pesi dei tubi pre-etichettata, vuoto 1,7 mL.
- Utilizzando anestetico Vola o CO 2, anestetizzare e raccogliere 36 mosche dello stesso genotipo, genere, e alimentando uno stato con un pennello pre-pesati 1,7 mL tubo.
- Pesare nella provetta contenente le mosche con la stessa scala ultra-sensibile.
- Determinare il peso medio di volare seguendo questa formula:
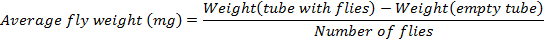
Nota: il numero di mosche in questo protocollo è 36. - Flash congelare le provette di 1,7 mL contenenti mosche immergendo nell'azoto liquido per 2 min. raccogliere e mettere i tubi in scatole. Successivamente, trasferire le caselle a-80 ° C (temperatura di preferibile) per deposito fino all'utilizzo con il dosaggio TAG.
Attenzione: L'azoto liquido è ad una temperatura estremamente bassa. Si prega di utilizzare l'equipaggiamento protettivo personale appropriato.
2. TAG analisi
- preparazione delle concentrazioni standard TAG
- preparare 500 mL di PBT (PBS 1X, 0.05% Triton).
- Utilizzando provette da 0,5 mL e la soluzione di TAG (Tabella materiali), preparare 100 µ l di blank (PBT solo) e 100 µ l di sei concentrazioni standard di TAG (2 µ g / µ l; 1 µ g / µ l; 0,5 µ g / µ l; 0,25 µ g / µ l; 0.125 µ g / µ l; 0,0625 µ g / µ l) con il PBT.
- Mettere i tubi sul ghiaccio e procedere con le mosche di macinazione.
- Rettifica le mosche
- prendere le mosche congelate da-80 ° C (punto 1.3). Trasferire le provette contenenti le mosche sul ghiaccio
- In primo luogo, disponga 2 mm metallo sfere di macinazione in un dispenser di 96 pozzetti palla, utilizzare un piccolo pennello per rimuovere palle extra.
- Posto la macinazione di 96 pozzetti piastra capovolta in cima al distributore di palla e flip per trasferire le sfere di metallo direttamente nella piastra di macinazione. Ci dovrebbe essere una palla per pozzetto.
- Utilizzando una pipetta multicanale, aggiungere 600 µ l di PBT in ogni riga della piastra 96 pozzetti macinazione.
- Con il forcipe, aggiungere 3 mosche per pozzetto. Indicare la condizione di genotipo, sesso e cibo delle mosche in ogni riga/pozzetto della piastra 96 pozzetti macinazione.
- Posto saldamente i tappi sulla piastra 96 pozzetti rettifica. Nastro può essere posizionato sulla parte superiore per garantire che non vi siano perdite.
- Inserire correttamente le piastre da 96 pozzetti rettifica la rettificatrice. Impostare la macchina per la massima velocità e premere " eseguire " per macinare le mosche per 3 min.
- Dopo 3 min, sospendere la macinazione e procedere con centrifugazione piastra: eleGE per 15 min a 4.000 x g, 4 ° C. Dopo la centrifugazione, gestire la piastra di macinazione con attenzione per evitare di mescolare il surnatante con il pellet.
- Caricamento del campione e determinazione del contenuto di TAG
- prendere una nuova piastra 96 pozzetti spettrofotometro. Utilizzando una pipetta multicanale, caricare 200 µ l del reagente TAG in ogni riga della piastra.
- Di carico 20 µ l di PBT nel pozzo prima della prima riga, per creare uno spazio vuoto. Mescolare pipettando su e giù. Evitare la formazione di bollicine. Pozzi di
- carico 20 µ l di ciascuna diluizione standard (dal punto 2.1.2) nel restante della prima fila e Miscelare pipettando su e giù. Evitare la formazione di bollicine.
- Utilizzando una pipetta multicanale, trasferire 20 µ l di supernatante da ogni riga del piatto rettifica per la riga corrispondente nella piastra 96 pozzetti spettrofotometro. Pipettare su e giù per amalgamare bene. Evitare la formazione di bollicine.
- Successivamente, inserire un foglio di gas-permeabili sopra la parte superiore della piastra 96 pozzetti.
- Incubare la piastra a 37 ° C per 10 min.
Nota: Se ci sono bolle nei pozzetti, centrifugare la piastra per 2 min a 2.000 x g per rimuovere tutte le bolle. La presenza di bolle interferirà con la lettura dell'assorbanza. - Leggere l'assorbanza di ciascun pozzetto della piastra a 550 nm utilizzando un lettore di micropiastre compatibile. Quindi, tracciare la curva standard e determinare la concentrazione [µ g / µ l] dei campioni sconosciuti.
- Per determinare la quantità di contenuto del TAG a medio peso Mosca, utilizzare la seguente formula:
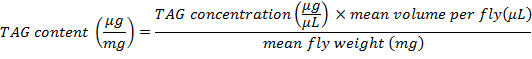
Nota: nel presente protocollo, sono stati tritati 3 mosche in 600 µ l di PBT; di conseguenza, il volume medio per volare è 200 µ l.
- Analisi di Bradford e la normalizzazione del contenuto dei TAG con contenuto proteico
- preparare sette 100 µ l di albumina di siero bovino (BSA) diluizioni standard (100 µ g/mL; 150 µ g/mL, 75 µ g/mL; 200 µ g/mL; 250 µ g/mL; 500 µ g/mL; 1.000 µ g/mL) con il PBT.
- Prendere una nuova piastra a 96 pozzetti e caricare 200 µ l di reagente di Bradford X 1 in ogni riga della piastra.
- Nel primo pozzetto della prima riga, aggiungere 10 µ l di PBT per creare uno spazio vuoto. Mescolare pipettando su e giù. Evitare la formazione di bollicine. Pozzi di
- aggiungere 10 µ l di ciascuna diluizione standard nel restante della prima fila e Miscelare pipettando su e giù. Evitare la formazione di bollicine.
- Utilizzando una pipetta multicanale, trasferire 10 µ l del surnatante fly da ogni riga del piatto rettifica nella riga corrispondente della piastra a 96 pozzetti. Pipettare su e giù per amalgamare bene. Evitare la formazione di bollicine.
- Posizionare un foglio permeabile al gas sopra la parte superiore della piastra 96 pozzetti.
- Incubare la piastra a temperatura ambiente per 5 min. Se ci sono bolle nei pozzetti, centrifugare la piastra per 2 min a 2.000 x g per rimuoverli.
Nota: La presenza di bolle interferirà con la lettura dell'assorbanza. - Uso uno spettrofotometro leggere l'assorbanza dello spazio in bianco, standard e campioni incogniti a 595 nm. Utilizzare la curva standard per determinare le concentrazioni [µ g / µ l] dei campioni in ogni riga.
- Normalizzare il TAG contenuto con livello di proteina utilizzando la seguente formula:

Access restricted. Please log in or start a trial to view this content.
Risultati
In d. melanogaster, come è il caso con altre specie, non c'è dimorfismo sessuale tra maschi e femmine22. È noto che le femmine sono più grandi, con più grasso in loro addomi, di maschi22. Per testare l'efficacia del nostro protocollo, abbiamo eseguito saggi di TAG per determinare le differenze di contenuto TAG tra maschi e femmine di laboratorio standard wildtype (w1118) Vola. I dati mostrano che le femmine ...
Access restricted. Please log in or start a trial to view this content.
Discussione
Induzione di obesità nei topi può richiedere mesi19,20. In mosche, questo HFD alimentazione protocollo consente per l'induzione dell'accumulo di grasso in eccesso in una questione di giorni o meno, causando aumenti in accumulo di grasso solo dopo 18 ore (Vedi Figura 2). HFD alimentando con il protocollo descritto aumenta il glucosio contenuto 12 e diminuisce Bmm lipasi e PGC-1 espressione
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Vorremmo ringraziare Erika Taylor per l'editing di questo manoscritto. Questo lavoro è stato finanziato da sovvenzioni dal National Institutes of Health (P01 HL098053, P01 AG033561 e HL054732 R01) a R.B., un supplemento di ricerca post-dottorato (R01 HL085481) e comunione (AAUW) a S.B.D. e dall'associazione americana del cuore di S.B.D. e r.t.b.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Talboys Ball dropper/bead Dispenser | Talboys | #: 930150 | |
| Talboys High Throughput Homogenizer | Talboys | #: 930145 | |
| Grinding Balls, Stainless Steel | OPS Diagnostics, LLC | # GBSS 156-5000-01 | 5000 balls |
| Masterblock 96 Well deep Microplates | Greiner Bio-One | # T-3058-1 | case of 80 plates |
| Greiner 96 well microplate flat bottom | Sigma Aldrich | # M4436 | 40 plates |
| Greiner CapMat for sealing multiwell plates | Sigma Aldrich | # C3606 | 50 sealing plates |
| Reagent Reservoirs | Thomas Scientific | # 1192T71 | 12/PK |
| Thermo Scientific Finnpipette 4661040 | Thermo Scientific | # 4661040 | 1-10 ul multipipette |
| Thermo Scientific Finnpipette 4661070 | Thermo Scientific | # 4661070 | 30-300ul multipipette |
| Thermo Scientific Finnpipette 4661020 | Thermo Scientific | #4661020 | 10-100ul multipipette |
| Multichannel tips | Denville Scientific Inc | # P3131-S | for 10 uL pipette |
| Multichannel tips | Denville Scientific Inc | # P3133-S | for 200 uL pipette |
| Multichannel tips | Denville Scientific Inc | #P1125 | for 100 uL pipette |
| Forceps | Roboz Surgical | # 5 Dumonts | Super fine forceps |
| Mettler Toledo Excellence XS Analytical Balance Mfr# XS64 | Cole-Parmer scientific experts | # EW-11333-00 | |
| Metler Toledo Excellence XS Toploading Balance | Cole-Parmer scientific experts | # EW-11333-49 | |
| 96-Well microplate Centrifuge | Hettich Zentrifugen | # Rotina 420R | |
| Microplate Reader | Molecular devices | # SpectraMax 190 | |
| Lab-Line Bench Top Orbit Environ Shaker Incubator | Biostad | # 3527 | |
| Infinity Triglycerides reagent | Thermo Scientific | # TR22421 | |
| Triglyceride Standard | Stanbio | #2103 - 030 | |
| Quick Start Bradford Protein Assay | Bio-RAD | # 500-0205 | 1x dye Reagent |
| Coconut oil | Nutiva | # 692752200014 | 15 0z jar |
| PBS 10X | Thermo Scientific | # AM9625 | 500 ml |
| Triton X-100 | Sigma Aldrich | # 9002-93-1 | |
| Gas-permeable Foil | Macherey-Nagel | # 740675 | 50 pieces |
| filter Paper | VWR | # 28317-241 | Pack of 100 |
| Drosophila vials | Genesee Scientific | Cat #: 32-116SB | |
| Quick Start Bovine Serum Albumin Standard | Bio-Rad | # 5000206 | |
| FlyNap Anesthetic | Carolina | # 173025 | 100 mL |
| Kimwipes Low-Lint | Uline | # S-8115 | 1-Ply, 4.4 x 8.4" |
Riferimenti
- Ng, M., et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 384, 766-781 (2014).
- Murphy, S. L., et al. Mortality in the United States, 2014. NCHS data brief, no 229. , Available from: https://www.cdc.gov/nchs/products/databriefs/db229.htm (2015).
- Bodmer, R. Heart development in Drosophila and its relationship to vertebrates. Trends Cardiovasc Med. 5, 21-28 (1995).
- Brumby, A. M., Richardson, H. E. Using Drosophila melanogaster to map human cancer pathways. Nat Rev Cancer. 5, 626-639 (2005).
- Chan, H. Y., Bonini, N. M. Drosophila models of human neurodegenerative disease. Cell Death Differ. 7, 1075-1080 (2000).
- Levine, M., et al. Human DNA sequences homologous to a protein coding region conserved between homeotic genes of Drosophila. Cell. 38, 667-673 (1984).
- Bier, E. Drosophila, the golden bug, emerges as a tool for human genetics. Nat Rev Genet. 6, 9-23 (2005).
- Bier, E., Bodmer, R. Drosophila, an emerging model for cardiac disease. Gene. 342, 1-11 (2004).
- Noyes, B. E., et al. Identification and expression of the Drosophila adipokinetic hormone gene. Mol Cell Endocrinol. 109, 133-141 (1995).
- Rajan, A., Perrimon, N. Of flies and men: insights on organismal metabolism from fruit flies. BMC Biol. 11, 38(2013).
- Rulifson, E. J., et al. Ablation of insulin-producing neurons in flies: growth and diabetic phenotypes. Science. 296, 1118-1120 (2002).
- Birse, R. T., et al. High-fat-diet-induced obesity and heart dysfunction are regulated by the TOR pathway in Drosophila. Cell Metab. 12, 533-544 (2010).
- Musselman, L. P., et al. A high-sugar diet produces obesity and insulin resistance in wild-type Drosophila. Dis Models Mech. 4, 842-849 (2011).
- Diop, S. B., Bodmer, R. Gaining Insights into Diabetic Cardiomyopathy from Drosophila. Trends Endocrinol Metab. 26, 618-627 (2015).
- Williams, M. J., et al. The Obesity-Linked Gene Nudt3 Drosophila Homolog Aps Is Associated With Insulin Signaling. Mol Endocrinol. 29, 1303-1319 (2015).
- Morris, S. N., et al. Development of diet-induced insulin resistance in adult Drosophila melanogaster. Biochim Biophys Acta. 1822, 1230-1237 (2012).
- Bodmer, R. The gene tinman is required for specification of the heart and visceral muscles in Drosophila. Development. 118, 719-729 (1993).
- Erkkila, A., et al. Dietary fatty acids and cardiovascular disease: an epidemiological approach. Prog Lipid Res. 47, 172-187 (2008).
- Ganz, M., et al. High fat diet feeding results in gender specific steatohepatitis and inflammasome activation. World J Gastroenterol. 20, 8525-8534 (2014).
- Wang, C. Y., Liao, J. K. A mouse model of diet-induced obesity and insulin resistance. Methods Mol Biol. 821, 421-433 (2012).
- Stocker, H., Gallant, P. Getting started: an overview on raising and handling Drosophila. Methods Mol Biol. 420, 27-44 (2008).
- Mathews, K. W., et al. Sexual Dimorphism of Body Size Is Controlled by Dosage of the X-Chromosomal Gene Myc and by the Sex-Determining Gene tra in Drosophila. Genetics. 205, 1215-1228 (2017).
- Golay, A., Bobbioni, E. The role of dietary fat in obesity. Int J Obes Relat Metab Disord. 21, Suppl 3 2-11 (1997).
- Diop, S. B., et al. PGC-1/Spargel Counteracts High-Fat-Diet-Induced Obesity and Cardiac Lipotoxicity Downstream of TOR and Brummer ATGL Lipase. Cell Rep. 10, 1-13 (2015).
- Chatterjee, D., et al. Control of metabolic adaptation to fasting by dILP6-induced insulin signaling in Drosophila oenocytes. Proc Natl Acad Sci U S A. 111, 17959-17964 (2014).
- Palanker, L., et al. Drosophila HNF4 regulates lipid mobilization and beta-oxidation. Cell Metab. 9, 228-239 (2009).
- Heinrichsen, E. T., Haddad, G. G. Role of high-fat diet in stress response of Drosophila. PLoS One. 7, 42587(2012).
- Kitahara, C. M., et al. Association between class III obesity (BMI of 40-59 kg/m2) and mortality: a pooled analysis of 20 prospective studies. PLoS Med. 11, 1001673(2014).
- Reis, A., et al. A comparison of five lipid extraction solvent systems for lipidomic studies of human LDL. J Lipid Res. 54, 1812-1824 (2013).
- Turne, C., et al. Supercritical fluid extraction and chromatography for fat-soluble vitamin analysis. J Chromatogr A. 936, 215-237 (2001).
- Na, J., et al. Drosophila model of high sugar diet-induced cardiomyopathy. PLoS Genet. 9, 1003175(2013).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon