Method Article
Sonde ottiche Screening di nuovi batteri specifici sul tessuto polmonare umano Ex Vivo di endomicroscopia confocale Laser
In questo articolo
Riepilogo
Questa tecnica viene descritto un processo di screening efficace per la valutazione dei batteri specifici agenti imaging ottici all'interno di ex vivo tessuto polmonare umano, mediante microscopia a fluorescenza confocale fibrata per la rapida identificazione di piccola molecola chimica sonda-candidati con potenziale traducibili.
Abstract
Migliorando la velocità e la precisione del rilevamento batterica è importante per la stratificazione del paziente e per garantire l'uso appropriato degli antimicrobici. Per raggiungere questo obiettivo, lo sviluppo di tecniche diagnostiche di riconoscere la presenza batterica in tempo reale presso il punto-di-cura è necessaria. Imaging ottico per identificazione diretta di batteri all'interno dell'host è un approccio attraente. Parecchi tentativi di sonda chimica progettazione e validazione sono stati studiati, tuttavia nessuno sono ancora correttamente tradotte in clinica. Qui descriviamo un metodo per la convalida ex vivo di sonde di batteri specifici per l'identificazione dei batteri all'interno del polmone distale, ripreso da microscopia di fluorescenza confocale fibered (FCFM). Il nostro modello utilizzato ex vivo tessuto polmonare umano e una piattaforma di endomicroscopia (CLE) laser confocale clinicamente approvata al romanzo schermo batteri specifici composti, che imita molto attentamente imaging condizioni dovute essere verificato con i pazienti di imaging. Pertanto, lo screening di composti da questa tecnica fornisce fiducia del potenziale clinico trattabilità.
Introduzione
Questa tecnica viene descritto un processo di screening rapido per la valutazione dei batteri specifici agenti imaging ottici all'interno di ex vivo tessuto polmonare umano di CLE utilizza FCFM per la rapida identificazione di composti con potenziale utilità clinica per la visualizzazione batteri nel polmone distale in situ.
C'è un'urgente necessità globale di razione prescrizione antimicrobica nell'era della crescente resistenza agli antimicrobici1. A tal fine, lo sviluppo di metodi diagnostici che agiscono per identificare l'infezione batterica con alta specificità, sensibilità e in tempo reale sono altamente cercato2. Tecniche correnti per confermare una diagnosi di polmonite in pazienti criticamente malati, come quelli all'interno di unità di terapia intensiva (ICUs), spesso si basano sull'interpretazione non specifiche caratteristiche cliniche o radiologiche insieme a tecniche di coltura batterica da aspirato fluidi/tessuti, che può durare fino a 3 giorni per produrre risultati. Inoltre, coltura batterica dal liquido instillato nel polmone distale ed estratto è soggetto a contaminazione da più prossimale airways3 e spesso è cultura negativa a causa di concomitante terapia antimicrobica o tecniche di campionamento poveri. Inoltre, le tecniche molecolari come reazione a catena della polimerasi sono eccessivamente sensibili quando viene utilizzato su liquidi aspirati, rischiando di overtreatment di pazienti. Un approccio diagnostico emergente è molecular imaging ottico, rendendo in situ patologia molecolare dei tessuti una possibilità; Tuttavia, lo sviluppo e la convalida dei composti di imaging ottici è necessaria. Tuttavia, la visualizzazione diretta dei batteri, tramite sonde ottiche attivabile è potenzialmente un metodo molto potente per permettere lo studio della presenza ed evoluzione di polmonite nel paziente e soprattutto, potrebbe essere utilizzato per studiare le interazioni ospite-patogeno in risposta alle terapie in tempo reale in situ.
CLE è una procedura ormai investigativa in molteplici malattie4, compresi all'interno dei campi di gastroenterologia5, oncologia6,7e per interrogare airways e sacche alveolari8, 9. esso permette l'imaging strutturale a point-of-care del tessuto malato usando una fibra in bundle, che passa attraverso il canale operativo di un endoscopio clinico di imaging e forme diretto contatto con la superficie del tessuto siano imaged mediante microscopia confocale. Tuttavia, una limitazione che rimane è la necessità di agenti di contrasto generico. Pertanto, l'uso di sonde specifiche di malattia, quali agenti batterici specifici, potrebbe espandere notevolmente l'utilità di questa modalità visualizzando direttamente i batteri nel sito di sospetta infezione. Agenti ottici offrono molti vantaggi rispetto ad altre tecniche, consentendo la formazione immagine ad alta risoluzione in tempo reale con potenziale diagnostico. Inoltre, sonde ottiche offrono la prospettiva di multiplexing per interrogare i bersagli multipli, tutti raggiunti ad un costo relativamente basso. Un numero di agenti ottici è in fase di sviluppo per tale scopo, tuttavia non sono ancora state attuate con successo entro la clinica10. Abbiamo sintetizzato una libreria di sonde chimiche piccola molecola con specificità verso batteri e sviluppato una pipeline di rapida ed efficace per la valutazione della funzione di sonda per il rilevamento di polmonite batterica in situ11.
Per identificare i candidati idonei sonda, i seguenti prerequisiti dovevano essere compiute prima dell'interrogatorio della sonda su ex vivo tessuto polmonare umano di FCFM: i) acquoso solubilità, ii) specificità e selettività per l'etichettatura rapida clinicamente i batteri rilevanti, iii) un alto rapporto segnale-rumore e iv) resistenza alla degradazione all'interno dell'ambiente del polmone. Quest'ultima è stata valutata dal fluido di lavaggio broncoalveolare (BALF) dai pazienti con sindrome da distress respiratorio (ARDS), che è una condizione che è caratterizzata da ambienti proteolitici e infiammatori nel polmone in terapia intensiva. Inoltre, le sonde doveva avere un fluoroforo adatto per il rilevamento di un dispositivo clinicamente approvato di CLE imaging ottico all'interno del tessuto alveolare del polmone umano.
La pipeline per interrogare ognuno di questi prerequisiti è stato come segue (in ogni fase, solo le sonde che passati sono state riportate al successivo): (1) una libreria di sonde per essere indagato è stata sintetizzata; (2) ogni sonda è stato aggiunto a un pannello di batteri vivi per laser confocale microscopia (CLSM) per assicurare l'etichettatura batterica; (3) selettività di etichettatura batterica sopra cellule di mammifero in co-colture con neutrofili umani primari è stato stabilito da CLSM; (4) stabilità e successo etichettatura dei batteri in presenza del paziente ARDS BALF è stata determinata da CLSM e Matrix Assisted Laser desorbimento/ionizzazione-tempo di spettrometria di massa (MALDI-TOF) di volo; (5) concentrazione ottimale dei candidati è stata determinata da CLSM, garantire la selettività per batteri sopra cellule di mammiferi è stata mantenuta; (6) i candidati erano imaged di FCFM in sospensione e su ex vivo del polmone umano tessuto alveolare per assicurare stabilità e che il segnale-rumore era adeguato per il rilevamento. Passaggio 6 è descritto in dettaglio all'interno di questo protocollo. Metodologia per passaggi 1-5 è stato precedentemente segnalati11.
Protocollo
Tutto il tessuto polmonare umano è stato ottenuto a seguito di consenso informato e lo studio è stato approvato dal comitato etico regionale.
1. preparazione dei campioni biologici
-
Preparazione delle sonde
- Costituiscono una soluzione stock di 1 mM di ogni sonda (ad es., calceina, UBI-3, UBI-10, ecc.) in sterile dH2O, utilizzando un buon equilibrio per pesare il liofilizzato sonda composto11. Calcolare il volume di dH2O aggiungere basato sulla massa pesata e peso molecolare della sonda.
-
Preparazione delle colture batteriche
Nota: Per questo metodo, lo stafilococco aureo è stato utilizzato come ceppo exemplar. Qualsiasi ceppo batterico appropriato può essere selezionato. Qualsiasi tintura commerciale che le etichette di batteri con un'adeguata eccitazione e spettri di emissione possa essere selezionato positivamente etichettare i batteri.- Selezionare una singola Colonia del ceppo batterico desiderato da una piastra di agar Lisogenesi brodo (LB) fresco con un'ansa sterile. Inoculare la Colonia in 10 mL di LB in una provetta da centrifuga 50ml immergendo la fine del ciclo in terreni di coltura. Incubare a 37 ° C, 250 giri/min per 16 h (o notte).
- Determinare il OD595 della cultura durante la notte aggiungendo 100 µ l della coltura durante la notte a 900 µ l LB in una provetta 1 mL. Misurare il diametro esterno a 595 nm (utilizzando una provetta con 1 mL LB come uno spazio vuoto) in uno spettrofotometro. Moltiplicare il OD ottenuti per 10 per ottenere il diametro esterno per la coltura durante la notte.
- Sottocultura la cultura durante la notte. Eseguire questa operazione regolando la densità ottica a 595 nm (OD595) a 0,1 in 10 mL di lb fresco calcolare il volume richiesto di cultura durante la notte per essere aggiunti a 10 mL fresca LB per regolare il OD595 a 0.1. Incubare la coltura a 37 ° C, 250 giri/min fino a quando raggiunge la cultura Mid-registro fase (OD595 0.6 - 0.8), circa 4 ore.
- Misurare la densità ottica di cultura (punto 1.2.2) e la raccolta 1 x 108 unità formanti colonia (UFC) (OD595 ~ 1-1 x 108 UFC/mL) della coltura batterica in una microprovetta 1,5 mL (ad esempio, se la coltura batterica è OD595 0,6, raccogliere mL 1,67). Centrifugare la coltura a 10.000 x g e a temperatura ambiente per 1 min a pellet i batteri. Lavare la pallina due volte in fosfato tampone salino (PBS) pipettando ematico (su e giù con attenzione) il pellet in 1 mL di PBS, centrifugazione come sopra, scartare il surnatante e ripetendo. Fare attenzione a non per sloggiare il pellet batterico quando si rimuove il supernatante. Risospendere il pellet finale in 1 mL di PBS.
Nota: Preparare come molti campioni come richiesto per ogni procedura di etichettatura. Il protocollo può essere messo in pausa qui per fino a 1 h, seguito da passo 1.2.5.1, 1.2.5.2 o 1.2.5.3. - Macchiatura batterica
- Per etichettare i batteri con calceina, aggiungere il colorante ad una concentrazione finale di 1 µM nella coltura batterica lavata. Incubare la cultura per 30 min a 37 ° C con agitazione a 300 giri/min. Lavare la sospensione batterica counterstained in PBS 3 volte per centrifugazione come descritto al punto 1.2.4 rimuovere tinture per eccesso. Risospendere in 1 mL di PBS, diluire 100 µ l 1:1 in PBS per ottenere 200 µ l di OD595 calceina 0,5 sono batteri macchiati. Il protocollo può essere messo in pausa qui per fino a 1 h.
- Per etichettare i batteri con sonde di prova (ad es., UBI-3 o UBI-10), diluire 100 µ l della coltura batterica 1:1 in PBS per ottenere OD595 0,5 a 200 µ l PBS. Aggiungere che sia delle sonde ad una concentrazione finale di 10 µM. invertire la microprovetta parecchie volte per garantire la completa miscelazione dei batteri e la sonda.
Nota: Imaging deve essere eseguita immediatamente dopo l'aggiunta della sonda per imitare lo scenario clinico. - Per preparare il controllo campioni batterici non macchiati, diluito 100 µ l della cultura 1:1 con PBS per ottenere 200 µ l di non macchiate OD595 0,5 campione.
-
Preparazione di ex vivo tessuto polmonare umano
Nota: I campioni di tessuto polmonare umano sono stati ottenuti da pazienti sottoposti a resezione chirurgica per carcinoma del polmone. Tutti i tessuti utilizzati per l'imaging è stato ottenuto da campioni di tessuto polmonare normale lontano la crescita tumorale. Campioni sono stati prelevati freschi dalla sala operatoria e memorizzati nei tubi per microprovette o centrifuga a-80 ° C fino all'utilizzo.- Immediatamente prima di formazione immagine, è necessario rimuovere il campione di tessuto polmonare umano dal freezer il ghiaccio secco. A temperatura ambiente, consentire al tessuto di scongelare leggermente; quanto basta per essere affettato con un bisturi in sezioni2 1 x 4 mm.
Nota: Il livello di scongelamento è importante; troppo congelati e il tessuto non farà a fette senza scheggiarsi fuori, troppo scongelati e il tessuto è troppo morbido per affettare. - Utilizzando forcipe, posizionare il tessuto polmonare umano affettato nei pozzetti di una piastra di coltura del tessuto trasparente 96 pozzetti a fondo piatto. Restituire immediatamente tutto il tessuto polmonare umano inutilizzato al contenitore e posto il ghiaccio secco per il trasporto verso il congelatore a-80 ° C.
- Aggiungere 100 µ l PBS per ogni campione di tessuto polmonare con una pipetta. Utilizzare la punta della pipetta per garantire tutto il tessuto è coperto in PBS (e non attaccato alle pareti del pozzo). I tessuti si gonfiano leggermente e possono galleggiare. Lasciare il PBS sul campione per pochi minuti per permettere qualsiasi sangue a lisciviare dal tessuto nella soluzione. Rimuovere la maggior quantità di PBS come possibile. Il tessuto può bloccare l'estremità della punta della pipetta; tenta di angolo il posizionamento della piastra/punta per impedire questo.
- Pipettare 100 µ l di non macchiate, calceina è etichettato o sonda di prova con l'etichetta batteri ogni contenente tessuto polmonare. Anche impostare i controlli con tessuto polmonare e 100 µ l PBS. Questi pozzetti di controllo, sonde senza batteri possono essere aggiunti per misurare qualsiasi aumento della fluorescenza di fondo e/o attivazione aspecifica della sonda di tessuto polmonare da solo. Dovrebbe essere incluso anche un pozzo con tessuto polmonare e PBS.
- Immediatamente prima di formazione immagine, è necessario rimuovere il campione di tessuto polmonare umano dal freezer il ghiaccio secco. A temperatura ambiente, consentire al tessuto di scongelare leggermente; quanto basta per essere affettato con un bisturi in sezioni2 1 x 4 mm.
2. imaging con il dispositivo CLE con FCFM
-
Messa a punto del dispositivo CLE
Nota: Preparare il sistema CLE 20 min prima della taratura per consentire al laser per riscaldarsi.- Premere l'interruttore on/off sul retro del trasformatore del sistema e accendere il computer designato. Premere il pulsante on/off sulla parte anteriore del laser scansione unità (LSU). Confermare l'aspetto della luce verde, che indica che l'unità è accesa.
- Fare doppio clic sull'icona del software CLE. Immettere i dettagli di login e attendere la LSU inizializzare (10-30 s).
- Per l'utilizzo del nuovo FCFM fibre di imaging, installazione con il CD fornito è necessaria. Inserire il CD di installazione nell'unità CD del computer e seguire le istruzioni visualizzate.
- Pulire l'unità di connettore FCFM imaging fibra con una fibra più pulita. Strofinare il connettore sulla barra multifunzione pulizia in un movimento in avanti per rimuovere qualsiasi polvere/sporco. Rimuovere il cappuccio protettivo giallo dalla parte anteriore della LSU.
- Preparare il mozzo LSU ruotando delicatamente il mozzo argento anti-orario fino all'arresto. Inserire il connettore di fibra FCFM imaging sul mozzo con il lato piatto del connettore rivolto verso l'alto. Tenere la fibra in posizione e ruotare il mozzo argento in senso orario finché scatta due volte. Completare la connessione ruotando il mozzo argento in senso orario di un ulteriore 45°.
Nota: Se la fibra non viene riconosciuta, verifica che il FCFM fibra di imaging è stato installato e collegato con l'orientamento corretto. - Seguire le istruzioni che saranno pop-up per completare il FCFM taratura fibra di imaging. Ci sono 3 passi: test di fibra (1) FCFM (passi 2.1.7 - 2.1.8), imaging acquisizione (2) sfondo (passo 2.1.9), (3) fibra di rilevazione (passo 2.1.10).
- Premere il pulsante 'start laser' sullo schermo. Il laser sarà il centro.
- Selezionare freschi fiale (giallo: calibrare; rosso: pulire; blu: risciacquo) dalla taratura kit e seguire le istruzioni visualizzate: posizionare l'estremità distale del FCFM fibra di imaging nel flaconcino giallo e guardare per l'aumento di fluorescenza sul monitor, quindi inserire il punta della fibra nel flacone rosso (senza mescolare). Attendere la fluorescenza (come mostrato sul monitor del computer) a scomparire. Infine sciacquare la punta della fibra nel flacone blu.
Nota: Se la fluorescenza non scomparsa, pulire la fibra di imaging FCFM con 8% H2O2 e lente pulizia tessuti e ricominciare. Ripetere il processo fino a quando si ottengano risultati soddisfacenti (la qualità dell'immagine è chiara e segni di sporcizia non sono evidenti). - Posizionare il FCFM fibra di imaging nel flacone blu. Premere 'start laser' seguito da 'Calcola' quando questo diventa un'opzione.
- Posizionare il FCFM fibra di imaging nel flaconcino giallo. Premere 'start laser' seguito da 'Calcola' quando questo diventa un'opzione.
- Durante la calibrazione automatica, pulire l'estremità distale del FCFM fibra di imaging inserendo nel flacone rosso per > 10 s, seguita dal flaconcino blu per > 4 s, come indicato dal software.
-
Raccolta di dati con CLE
- Dopo l'installazione, si aprirà una finestra per selezionare il percorso di archiviazione e il prefisso del file. Selezionare la cartella desiderata per l'archiviazione dati e nome il prefisso di conseguenza.
- Posizionare i pedali in modo che essi è facilmente raggiungibile dall'operatore. Pedale sinistro: laser on/off; pedale centrale: mettere in pausa; pedale destro: registra/stop.
Nota: I controlli laser possono essere richiamati anche attraverso controlli sullo schermo. - Fare clic su 'start' sullo schermo o premere il pedale sinistro per attivare il laser. Verrà avviata l'acquisizione e ottenere immagini utilizzando 100% potenza del laser e un frame rate di 12 fotogrammi/s (impostazioni predefinite).
Nota: Per altre applicazioni, queste impostazioni possono essere modificate nella schermata se necessario, a seconda del tipo di campione. - Ogni immagine dei campioni sospensione batterica.
- Inserire l'estremità distale della fibra imaging FCFM e spostare la fibra lentamente attraverso la sospensione per interrogare il campione.
- Registrare video di qualsiasi lunghezza (fino a 10 min) premendo il pedale del piede destro o selezionando i controlli record sullo schermo, come la fibra si muove lentamente intorno al campione.
- Pulire l'estremità distale della fibra imaging FCFM con 8% H2O2 e tessuti tra i campioni di pulizia delle lenti.
Nota: Le lunghezze tipiche dei video di 10-30 secondi sono sufficienti per l'imaging in vitro .
- Ogni immagine dei campioni di tessuto polmonare.
- Inserire l'estremità distale del FCFM fibra di imaging nel campione, garantendo che il contatto diretto tra la fine della fibra e il tessuto è fatto. Spostare delicatamente l'estremità della fibra imaging intorno per interrogare il campione.
Nota: L'estremità della fibra dal tessuto di sollevamento rimuoverà il tessuto dal piano focale; Tuttavia, questo può essere usato all'immagine con etichettati batteri che non aderiscono al tessuto. - Registrare video di qualsiasi lunghezza (fino a 10 min) premendo il pedale del piede destro o selezionando i controlli record sullo schermo, come la fibra si muove lentamente intorno al campione.
Nota: In genere, video lunghezze di 30 s sono sufficienti per l'ex vivo imaging sul tessuto. - Pulire l'estremità distale della fibra imaging FCFM con tessuti e 8% H2O2 tra i campioni di pulizia delle lenti.
- Inserire l'estremità distale del FCFM fibra di imaging nel campione, garantendo che il contatto diretto tra la fine della fibra e il tessuto è fatto. Spostare delicatamente l'estremità della fibra imaging intorno per interrogare il campione.
-
Spegnere il sistema
- Spegnere il laser premendo il pedale del piede sinistro o cliccando il pulsante sul display.
- Scollegare la fibra imaging FCFM CLE girando il mozzo LSU argento in senso antiorario finché non si arresta. Rimuovere il FCFM imaging fibra dall'hub LSU tirando delicatamente il connettore di fibra dalla LSU.
- Pulire e disinfettare la fibra imaging FCFM con 8% H2O2 e pulizia tessuti dell'obiettivo. Restituire i tappi di protezione per l'estremità prossimale della fibra imaging FCFM e la parte anteriore dell'unità LSU. Posizionare delicatamente la fibra in scatola per la conservazione.
- Nelle vicinanze la data capture software e copia qualsiasi file salvati su un dispositivo USB esterno. Arrestare il computer e spegnere il dispositivo LSU premendo il pannello frontale i/o per 3 s fino a quando la luce verde scompare.
- Disporre di tessuto polmonare umano e batteri secondo le normative locali.
3. analisi dei dati
- Aprire il software e importare i file per l'analisi selezionando la directory appropriata sul computer tramite l'icona 'Vai a' sul cruscotto software. In alternativa, il file possono essere trascinati e rilasciati nel cruscotto software.
- Fare doppio clic su ogni file video per aprirli. Il video verrà riprodotto automaticamente con tabella di ricerca ottimizzato colore (LUT) e regolare la tabella dei colori. Disabilitare l'intensità automatica ridimensionamento, facendo clic sul pulsante bacchetta sopra la barra della scala di intensità. La funzione è disattivata quando non c'è Nessun ombreggiamento nero intorno al pulsante.
Nota: Ridimensionamento automatico intensità deve essere disattivato per evitare l'aumento di contrasto continuo durante ogni video, rendendo impossibile per confrontare e analizzare lo stesso set di dati video. - Selezionare l'intensità desiderata scala spostando le barre di minime e massime per dare il miglior contrasto. Utilizza lo strumento istogramma quando selezionando l'intensità scala per assicurare la più ampia gamma dinamica viene catturato.
Nota: Assicurarsi che la gamma dinamica è tale che le immagini non sono saturi (cioè limitare le regioni bianche dell'immagine, che indicano la saturazione), affinché le caratteristiche di bassa intensità non sono mancati. - Una volta raggiunta la scala desiderata, fare clic destro sul pulsante del menu a discesa elencato come 'Default (verde)'. Selezionare l'opzione per salvare il LUT. Salvare il LUT in una posizione desiderata.
- Per l'altro dei video all'interno del set di dati, applicare lo stesso LUT facendo clic con il pulsante destro del mouse sopra il menu a discesa 'Default (verde)' e selezionare 'Carico LUT'. Selezionare il file appropriato applicare coerente intensità scala a tutti i video all'interno di un dataset.
- Esportazione di elaborazione video facendo clic sul pulsante 'bobina di film'. Selezionare il formato video desiderato, ad esempio 'per scopi di presentazione', che produrrà un file MPG. Premere 'Esporta' e ha scelto il percorso del file per salvare il file video. Istantanee di singoli fotogrammi possono essere esportati facendo clic sul pulsante 'fotocamera'. È possibile salvare un file. png,. bmp o. jpg. Scegliere la destinazione del file e premere Salva.
Nota: Video quindi possa essere importati in qualsiasi software per la preparazione di presentazioni o ulteriore quantificazione. Batteri con etichettati vengono visualizzati come punti verdi 'lampeggiante' nel video. Struttura del tessuto del polmone sarà evidente come ordinati fili fluorescenti, con spazio alveolare che appare nero.
Risultati
In questo studio, abbiamo dimostrato un metodo per lo screening rapido di nuove sonde di batteri specifici in un ex vivo polmonare alveolare umano tessuto modello di infezione usando un dispositivo CLE clinicamente approvato.
CLE di FCFM è adatto per l'ottenimento di informazioni strutturali all'interno del polmone distale, come questa regione (a causa di un'elevata abbondanza di elastina e collagene) è naturalmente altamente fluorescente quando eccitato con un laser di 488 nm8. Al contrario, lo spazio alveolare non reagiscono, e come tale consente ad alto contrasto tra la struttura del tessuto e dello spazio aereo per essere visualizzate (Figura 1).
L'aggiunta della malattia relative sonde o agenti di contrasto, come ad esempio batteri specifiche sonde dovrebbero attivare informazioni funzionali sui processi di malattia di ottenere in tempo reale. Precedentemente abbiamo descritto la sintesi e iniziale in vitro screening di una libreria di batteri specifici sonde11; dove batterico-specificità, proteolitici stabilità e conservazione all'interno della membrana batterica nel tempo è stata determinata. Una sonda promettente di batteri specifici (UBI-10) è stata identificata all'interno dello studio, così come uno che ha dimostrato scarsa ritenzione all'interno della membrana cellulare batterica (UBI-3). Questi sono stati confrontati a un controllo di commerciale colorazione di contrasto (calceina) che è stato utilizzato per etichettato S. aureus.
Senza macchia, calceina, UBI-3 e UBI-10 etichettato S. aureus erano imaged in sospensione da FCFM con potenza di 100% 488 nm laser e un frame rate di 12 fotogrammi/s (Figura 2). Dove erano imaged senza etichetta batteri in PBS, nessun segnale fluorescente era rilevabile. Questo è in contrasto con quando erano imaged con etichettati batteri. Dove sospensioni batteriche con UBI-3 o UBI-10 erano imaged di FCFM, era evidente che la fluorescenza di fondo generale della soluzione è stata elevata rispetto ai controlli solo PBS, questo è perché NBD (il fluoroforo sonda) emettono una piccola quantità di segnale di fluorescenza in soluzione acquosa, tuttavia, puntini luminosi punctate sono chiaramente visibili in tutta la soluzione, senza la necessità di un passaggio di lavaggio. Questo è dovuto un aumento nel segnale di fluorescenza emessa da NDB in un ambiente polare cioè, la membrana batterica. Calceina non è una sonda attivabile, quindi un passaggio di lavaggio dopo la colorazione batterica è stata necessaria per rimuovere lo sfondo fluorescente alto della sonda non associato nella soluzione. Come UBI-3 e UBI-10 con etichettati batteri, batteri etichettati con calceina sono stati rilevati in soluzione FCFM come puntini verde punctate. Come i dati sono raccolti in formato video, questi punti sembrano 'twinkle' come si muovono tra core e -e-out di messa a fuoco, un tratto caratteristico di imaging con etichettati batteri da questo metodo.
I batteri con etichettati sono stati successivamente aggiunti a piccole fette di ex vivo tessuto polmonare umano e ripreso nuovamente da FCFM (Figura 3). Dove solo PBS o senza etichetta S. aureus è stato aggiunto al tessuto polmonare, solo la struttura di autofluorescent del tessuto polmonare è stata rilevata (visto come fili verde brillante di collagene ed elastina e aree scure di spazio alveolare). Nessun puntini punctato sono stato rilevato per queste condizioni di controllo. Allo stesso modo, unico polmone tessuto struttura (e nessun puntini punctato) è stato visualizzato per la patologia del tessuto polmonare con S. aureus più UBI-3; che indica che la sonda non è stata mantenuta stabilmente all'interno il batterico cella membrana cioè, esso è stato lavato fuori e/o è degradato in presenza di enzimi proteolitici nativi all'interno del tessuto polmonare (come precedentemente dimostrato11).
Tuttavia, puntini luminosi punctate erano visibili in entrambi la calceina etichettato campione di controllo positivo Staphylococcus aureus e con la sonda più promettente di batteri specifici (UBI-10) S. aureus campione. I puntini 'scintillanti' erano visibili nonostante il forte tessuto autofluorescence (Figura 3). Così, i risultati ottenuti da FCFM erano in concomitanza con lo pre-screening in vitro del pannello di sonde di batteri specifici da CLSM e ha dimostrato un metodo di rilevazione clinicamente rilevanti per l'imaging di infezioni in tempo reale.
I risultati presentati qui dimostrano che il polmone è un organo appropriato sistema per imaging di FCFM a causa sua autofluorescence distintivo. Le strutture luminose distintive consentono all'operatore CLE stabilire che sono nello spazio alveolare. Queste regioni, accoppiate con le sacche d'aria alveolare scuro forniscono lo sfondo perfetto per imaging fluorescente identificati batteri con contrasto elevato.
Anche se la rilevazione dei batteri ha presentato all'interno di questo studio è determinata qualitativamente visualizzando puntini luminosi punctate, potrebbe essere possibile quantificare il numero di puntini punctate fotogramma per fotogramma utilizzando un software secondario al fine di ulteriormente caratterizzare librerie di sonda.
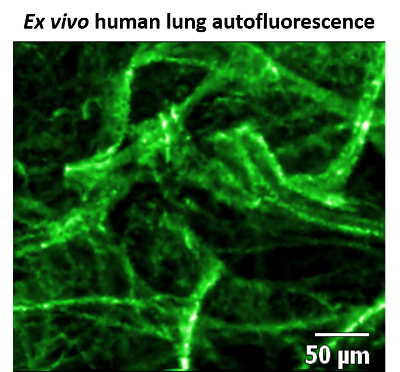
Figura 1: Immagine statica di autofluorescenza del tessuto polmonare umano. Immagine di endomicroscopia (CLE) laser confocale di ex vivo tessuto polmonare umano mediante microscopia a fluorescenza confocale fibered (FCFM), a 488 nm eccitazione, potenza 100% laser e 12 fotogrammi/s. elastina e collagene sono altamente fluorescente (falso colore verde), considerando che lo spazio alveolare non è e appare come regioni nere. Questa figura è stata modificata da Akram et al. 11 Clicca qui per visualizzare una versione più grande di questa figura.
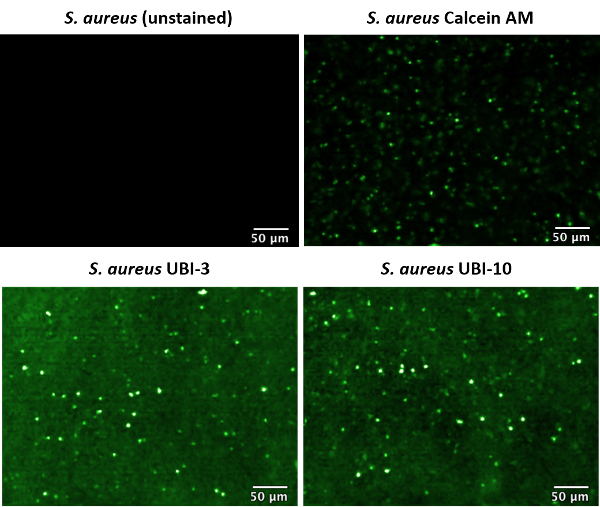
Figura 2: Immagine laser confocale endomicroscopia (CLE) con etichetta S. aureus in sospensione. Microscopia di fluorescenza confocale Fibered (FCFM) è stata usata all'immagine batteri pre-etichettati, a 488 nm eccitazione, potenza 100% laser e 12 fotogrammi/s. con l'etichetta batteri mostrano come altamente fluorescente punctate punti (falso colore verde). Questa figura è stata modificata da Akram et al. 11 Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Laser confocale endomicroscopia (CLE) immagine di ex vivo tessuto polmonare umano con etichetta S. aureus. Microscopia di fluorescenza confocale Fibered (FCFM) è stata usata per immagine ex vivo umano del tessuto polmonare ed etichettato S. aureus, a 488 nm eccitazione, potenza 100% laser e 12 fotogrammi/s. con l'etichetta batteri Visualizza come puntini punctate altamente fluorescente (false color verde) all'interno del campione di tessuto polmonare quando etichettato con calceina o UBI-10. Il contrasto più elevato si osserva dove i batteri sono imaging all'interno dello spazio alveolare. Questa figura è stata modificata da Akram et al. 11 Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Infezioni del tratto respiratorio inferiore rappresentano il secondo più alto carico di malattia a livello globale12,13e un sostanziale aumento il numero delle infezioni attribuite ai batteri resistenti agli antimicrobici è stato segnalato14. Polmonite rimane una causa comune di ospedalizzazione. In terapia intensiva, lo sviluppo di una polmonite è aggravato dalla incertezza diagnostica ed è associato con un tasso di mortalità estremamente alta15. Durante l'insorgenza di polmonite, i batteri proliferano all'interno dello spazio alveolare del polmone distale, un'area che è relativamente sterile, con minima microbiota in salute.
Questo metodo viene descritto relativamente tarda fase ex vivo convalida di batteri specifici optical imaging sonde11, ma la progettazione, sintesi e valutazione di sonda prima di iniziare questo passaggio di convalida è imperativo, come illustrato in precedenza11 .
CLE è una tecnica clinica emergente per interrogare la malattia dichiara in situ in tempo reale. Offre molti vantaggi rispetto alle tecniche tradizionali di indagine sospetta patologia polmonare, che può comportare una biopsia e una raccolta di fluido di lavaggio. Le biopsie sono invasive e possono causare la morbosità e la mortalità in pazienti arieggiati e fluido di lavaggio raccolti è spesso contaminato con batteri dalle vie aeree superiori. L'uso di CLE nella rilevazione di polmonite è tuttavia piuttosto limitata a causa della scarsa disponibilità di imaging compatibile sonde che possono fornire informazioni funzionali della malattia, nonostante molti sforzi concertati10. Combinando la CLE con agenti ottici offre la prospettiva di diagnosi di polmonite più veloce e meno invasivo rispetto alla corrente pratica standard.
I passaggi critici per questo protocollo sono nella preparazione del campione e l'installazione della piattaforma CLE. Ottenimento di tessuti umani rilevanti per l'applicazione clinica finale è anche importante, come il tessuto polmonare umano come dimostrato all'interno di questo studio. È necessario utilizzare tessuto umano perché l'entità del tessuto autofluorescence Mostra la grande variazione inter-specie e pertanto può indurre in errore la sensibilità della sonda-batteri essere imaged. Inoltre, ottenere etica per il recupero e utilizzo del tessuto polmonare umano è essenziale. Da un livello, corretta pulizia tecnica, allegato della fibra imaging per l'imaging LSU piattaforma e calibrazione è essenziale per la buona risoluzione e la formazione immagine coerenza, come è garantendo un numero equivalente di batteri è aggiunti per ogni campione di tessuto polmonare. Per espandere ulteriormente l'utilità di questo metodo per lo screening di pannelli di sonde, ripetendo la procedura con una gamma di agenti patogeni, come quelli di probabili agenti eziologici di polmonite è necessario.
Il più grande limite di questa tecnica è che il dispositivo CLE clinicamente approvato ha un solo laser (488 nm). Pertanto, attualmente, la selezione del fluoroforo per design della sonda è limitata per l'uso con questo sistema, anche se clinicamente approvato singolo colore esistono dispositivi con lunghezze d'onda di eccitazione di 660 nm e nel vicino infrarosso. È altamente auspicabile per avere una seconda linea di laser implementata all'interno del dispositivo stesso per consentire una sonda ad essere sviluppato con un fluoroforo spettralmente distinto per migliorare la sensibilità di batteri-sonda sopra il livello del tessuto autofluorescenza. Mentre i dispositivi dual-color CLE sono in fase di sviluppo, o sono clinicamente non approvati e/o il loro costo è significativo16.
CLE in vitro utilizzando batteri patogeni ed ex vivo tessuto polmonare umano per sonde potenziali schermo colma il divario tra convenzionale in vitro tecniche quali la citometria a flusso e CLSM e utilità clinica. Questo passaggio offre fiducia quando si seleziona composti promettenti per portare avanti per essere accoppiato con CLE clinico di imaging; e fornirà indicazione se la sonda testata mantiene la specificità di bersaglio, o viene illustrato qualsiasi etichettatura fuori bersaglio, ad esempio l'associazione direttamente al tessuto, o Mostra instabilità con host enzimi proteolitici. Inoltre sarebbe opportuno aggiungere ciascuna delle sonde attivabili direttamente ai campioni di tessuto polmonare umano più batteri, per caratterizzare la velocità della sonda associazione e attivazione in tempo reale.
Noi crediamo che la nostra pipeline di screening rapidamente nuove sonde di batteri specifici per valutare il loro potenziale per l'imaging all'interno del polmone distale dei pazienti si tradurrà in traduzione molto più veloce alla clinica. Questo è in gran parte perché la sonda di batteri specifici potrebbe essere recapitata localmente all'interno del polmone attraverso un catetere inserito lungo il canale di lavoro di un broncoscopio, significato che microdose (< 100 µ g) quantità potrebbe essere consegnato. Di conseguenza, consegna sistemica e biodistribuzione del composto non è una preoccupazione, come è il caso per molti altri obiettivi di infezione all'interno del corpo, o con imaging nucleare. Inoltre, offrendo la sonda imaging in una piccola dose riduce il rischio di tossicità relative complicazioni (anche se lo screening di tossicità sarebbe necessario per la traduzione). Dopo l'instillazione della sonda, il catetere potrebbe essere sostituito poi dalla fibra FCFM e della stessa regione del polmone interrogato da CLE, allo stesso modo abbiamo eseguito all'interno di questo metodo. La formazione immagine dovrebbe essere eseguita rapidamente dopo l'installazione della sonda prima la sonda lava via a concentrazioni inosservabili.
È anche importante notare che lo screening della malattia-identificazione sonde da questa tecnica non dovrebbe essere limitati agli agenti batterici-imaging, ma potrebbe anche estendersi alla validazione delle sonde con bersagli alternativi, come l'infiammazione. Questo approccio dovrebbe anche essere adattabile ad altre posizioni di malattia all'interno del corpo dove la formazione immagine via FCFM è ammissibile.
Divulgazioni
KD: Direttore fondatore dell'Imaging molecolare di Edimburgo. Consulenza ricevuta da Mauna Kea Technologies come advisor.
MB: Direttore fondatore dell'Imaging molecolare di Edimburgo.
Riconoscimenti
Vorremmo ringraziare Engineering and Physical Sciences Research Council (EPSRC, Regno Unito) collaborazione interdisciplinare di ricerca grant EP/K03197X/1, il dipartimento della sanità e il Wellcome Trust attraverso salute innovazione Challenge Fund (HICF) . Numero di riferimento del finanziamento: 0510-069.
Materiali
| Name | Company | Catalog Number | Comments |
| 1-14 Microfuge | SciQuip | 90616 | Small benchtop microcentrifuge |
| 96-well plate | Corning | 3370 | Assay plate |
| Calcein AM | Sigma Aldrich | 17783 | Commercial fluorescent dye |
| Cellvizio 488 nm Research CLE | Mauna Kea Technologies | LC-0001-488 | Confocal laser endomicroscopy device |
| Cletop-S | Cletop | 14110601 | Fibre cleaner |
| Eppendorf (1.5 mL) | Eppendorf | 30120086 | 1.5 mL microfuge tube |
| Eppendorf Research Plus Pipettes | Fisher Scientific | 11568663 | Micro pipettes |
| Falcon tube (50 mL) | Scientific Lab Supplies | 352070 | 50 ml centrifugation tube |
| Gibco Phosphate Buffered Saline | Thermo Fisher Scientific | 10010023 | PBS - wash media |
| IC-Viewer | Mauna Kea Technologies | LW-0001 | Data collection and processing software for the research CellVizio 488 nm system |
| Incu-Shake midi | Sciquip | SQ-4020 | Floor standing shaking incubator |
| Lysogeny Broth | Sigma Aldrich (Miller) | L3522 | LB Growth media for S. aureus |
| non-standard research AlveoFlex 488 nm | Mauna Kea Technologies | MP-0002-AF3 | Fibred confocal fluorescence microscopy fibre |
| Quanti Kit 488 nm | Mauna Kea Technologies | LQ-0005 | Calibration kit for the CellVizio 488 system |
| S. aureus ATCC 25923 | ATCC | 25923 | Bacterial strain used in this study |
| Semi-micro spectrophotometry cuvette | Sigma Aldrich | C5416-100EA | For spectrophotometry |
| Thermomixer comfort | Eppendorf | 41102422 | Benchtop heater with shaking |
| UV 1101 Biotech photometer | Biochrom WPA | Spectrophotometer |
Riferimenti
- Tackling drug-resistant infections globally: final report and recommendations. London: H M Government/Wellcome Trust Available from: https://amr-review.org/sites/default/files/160518_Final%20paper_with%20cover.pdf (2016)
- Caliendo, A. M., et al. Better Tests, Better Care: Improved Diagnostics for Infectious Diseases. Clin. Infect. Dis. 57, 139-170 (2013).
- Zumla, A., et al. Rapid point of care diagnostic tests for viral and bacterial respiratory tract infections-needs, advances, and future prospects. Lancet Infect. Dis. 14 (11), 1123-1135 (2014).
- Neumann, H., Kiesslich, R. . Yamada's Textbook of Gastroent. , 2944-2949 (2015).
- Chauhan, S. S., et al. Confocal laser endomicroscopy. Gastrointest Endosc. 80 (6), 928-938 (2014).
- Goetz, M., Malek, N. P., Kiesslich, R. Microscopic imaging in endoscopy: endomicroscopy and endocytoscopy. Nat Rev Gastroenterol Hepatol. 11 (1), 11-18 (2014).
- Abbaci, M., et al. Confocal laser endomicroscopy for non-invasive head and neck cancer imaging: A comprehensive review. Oral Oncol. 50 (8), 711-716 (2014).
- Thiberville, L., et al. Human in vivo fluorescence microimaging of the alveolar ducts and sacs during bronchoscopy. Eur Respir J. 33, (2009).
- Thiberville, L., et al. Confocal fluorescence endomicroscopy of the human airways. Proc Am Thorac Soc. 6 (5), 444-449 (2009).
- Mills, B., Bradley, M., Dhaliwal, K. Optical imaging of bacterial infections. Clin. Transl. Imaging. 4 (3), 163-174 (2016).
- Akram, A. R., et al. A labelled-ubiquicidin antimicrobial peptide for immediate in situ optical detection of live bacteria in human alveolar lung tissue. Chem. Sci. 6 (12), 6971-6979 (2015).
- Dickson, R. P., Erb-Downward, J. R., Huffnagle, G. B. Towards an ecology of the lung: new conceptual models of pulmonary microbiology and pneumonia pathogenesis. Lancet Respir Med. 2 (3), 238-246 (2014).
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380 (9859), 2095-2128 (2012).
- Magiorakos, A. P., et al. The rise of carbapenem resistance in Europe: just the tip of the iceberg. Antimicrob Resist Infect Control. 2 (1), 6 (2013).
- Chastre, J., Fagon, J. -. Y. Ventilator-associated Pneumonia. Am. J. Respir Crit Care Med. 165 (7), 867-903 (2002).
- Krstajić, N., et al. Two-color widefield fluorescence microendoscopy enables multiplexed molecular imaging in the alveolar space of human lung tissue. J Biomed Opt. 21 (4), 046009-046009 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon