È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Uso di zinco sinaptica istochimica per rivelare diverse regioni e lamine nel cervello in via di sviluppo ed adulto
In questo articolo
Riepilogo
Descriviamo una procedura istochimica che rivela la caratteristica dello zinco laminare e areal modelli in diverse regioni del cervello di macchiatura. Il modello di macchiatura di zinco può essere utilizzato in combinazione con altri marcatori anatomici per distinguere attendibilmente strati e regioni nel cervello in via di sviluppo e adulto.
Abstract
Caratterizzazione di organizzazione anatomica e funzionale del cervello e sviluppo richiede un'identificazione accurata di circuiti neurali distinti e regioni nel cervello adulto e immaturo. Qui descriviamo una procedura di colorazione istochimica di zinco che rivela differenze nel pattern di colorazione tra diversi strati e regioni del cervello. Altri hanno utilizzato questa procedura non solo per rivelare la distribuzione di zinco-contenendo i neuroni e circuiti nel cervello, ma anche per delineare correttamente areali e laminari confini nel cervello in via di sviluppo e adulto in diverse specie. Qui illustriamo questa procedura con immagini dallo sviluppo di colorazione e furetto adulto cervelli. Abbiamo rivelato un modello di macchiatura di zinco che serve come indicatore anatomico delle aree e livelli e può essere utilizzati in modo affidabile per distinguere le aree corticali visive nella corteccia visiva in via di sviluppo e adulta. L'obiettivo principale del presente protocollo è di presente un metodo istochimico che permette l'identificazione precisa dei livelli e delle regioni nel cervello adulto e in via di sviluppo dove altri metodi non riescono a farlo. Secondariamente, in concomitanza con analisi densitometrica delle immagini, questo metodo permette di valutare la distribuzione di zinco sinaptica per rivelare potenziali modifiche nel corso dello sviluppo. Questo protocollo descrive dettagliatamente i reagenti, strumenti e passaggi necessari per successivamente macchia sezioni di cervello congelato. Anche se questo protocollo è descritto usando il tessuto di cervello di furetto, può essere facilmente adattato per l'uso in roditori, gatti o scimmie così come in altre regioni del cervello.
Introduzione
Le macchie istologiche sono state usate tradizionalmente per aiutare nell'identificazione delle aree corticali in varie specie, rivelando le differenze nelle caratteristiche architettoniche. L'uso combinato di tecniche istochimiche come sostanza di Nissl, reattività del citocromo ossidasi (CO) o mielina può rivelarsi fruttuosa, come rivelano i limiti areali simili nel cervello adulto. Tuttavia, queste macchie istochimiche non rivelano sempre adeguatamente chiari confini tra aree corticali e livelli nel cervello immaturo.
Nel sistema nervoso centrale, lo zinco ha diverse funzioni critiche che includono la struttura del DNA, che agisce come cofattore degli enzimi, che partecipano a numerose funzioni di regolamentazione e di agire come un neuromodulatore attraverso la sua presenza in vescicole sinaptiche di stabilizzazione 1. zinco sinaptico è unico in quanto possono essere visualizzato utilizzando i metodi istologici, mentre lo zinco legato alle proteine non può essere visualizzato in quel momento2. Questa caratteristica è stata sfruttata per rivelare il disegno di zinco sinaptica in diverse regioni corticali e l'istochimica zinco sinaptica è stato utilizzato in una serie di studi. Un sottoinsieme di neuroni glutamatergici nella corteccia cerebrale contengono zinco nelle vescicole presinaptiche entro loro assoni terminali3,4. Gli studi istochimici hanno rivelato una distribuzione eterogenea di zinco sinaptica in corteccia cerebrale5,6,7. Ci sembra essere una diversa distribuzione area e laminare di zinco histochemically reattiva in diverse regioni corticali (ad es., visual contro corteccia somatosensory), o strati (ad esempio, i livelli dello zinco nella supragranular e infragranular strati della corteccia visiva primaria sono sostanzialmente superiori a livello di input thalamocortical IV con i livelli relativamente bassi dello zinco sinaptica)5,8,9. L'eterogeneità in zinco sinaptico colorazione osservata nella corteccia è particolarmente vantaggioso, in quanto facilita l'identificazione areal e laminare.
Qui presentiamo una descrizione dettagliata di una procedura di istochimica zinco sinaptica, che è una versione modificata 1982 metodo10 di Danscher. Questo metodo utilizza la selenite iniettata intraperitonealmente (IP) in animali come un agente chelante. La selenite viaggia al cervello di reagire con piscine di zinco liberi trovati in vescicole di un sottoinsieme di glutamatergic sinapsi nel cervello. Questa reazione produce un precipitato che può essere migliorato successivamente di sviluppo d'argento2,10,11.
Questa procedura rivela pattern laminare e areali di zinco sinaptico colorazione; l'analisi densitometrica può essere utilizzato per valutare questi modelli sia qualitativamente che quantitativamente nel cervello adulto e immaturo per studiare gli effetti di altri interventi, come manipolazioni sensoriale, ambientale, farmacologiche o genetiche. Inoltre, uno potrebbe anche voler valutare potenziali cambiamenti inerenti allo sviluppo nella distribuzione di zinco sinaptica in altre strutture corticale o sottocorticale in altri sistemi-modello. Le informazioni quantitative che fornisce analisi densitometrica in questo metodo possono essere vantaggiose per il seguente sviluppo del cervello nel corso del tempo. Questo protocollo fornisce un compagno ad altri marcatori istochimici e immuno - per rivelare i confini laminari e areali.
Access restricted. Please log in or start a trial to view this content.
Protocollo
il seguente protocollo segue le linee guida di cura degli animali istituite dall'istituzionale Animal Care e uso Committee (IACUC) presso il City College di New York, che sono conformi a tutti i stato appropriato e le linee guida federali. L'anestesia è appropriato per i furetti e debbono essere modificato secondo le specie studiate.
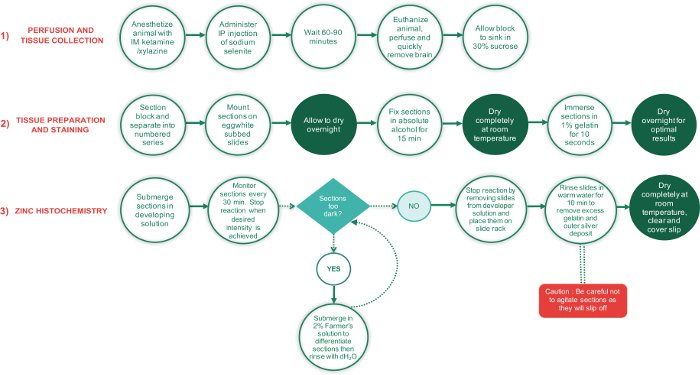
Figura 1: diagramma di flusso che illustra i passaggi principali relativi a 3 fasi del presente protocollo e il tempo necessario per completare ogni passaggio. Periodi che richiedono sezioni asciugare completamente sono mostrati nei circoli testo verde, mentre tutti gli altri passaggi sono nei cerchi di testo bianco. La casella di testo verde a forma di diamante è un punto di decisione, mentre il rettangolo rosso è un passo fondamentale e deve essere eseguito con cura supplementare. Clicca qui per visualizzare una versione più grande di questa figura.
1. passaggi preparatori (Slide sottotitolazioni e soluzione facendo)
- lavare i vetrini unsubbed con un detergente in acqua calda e risciacquare più volte in acqua calda seguita con un risciacquo con acqua distillata per rimuovere completamente qualsiasi sporco o detriti. Vetrini asciugare a temperatura ambiente o in un forno a 37 ° C.
- Una volta diapositive sono completamente asciutti, strato un sottile strato uniforme di bianco d'uovo su ogni diapositiva utilizzando le dita o un pennello. Lasciare per asciugare in forno a 60 ° C per 20-30 min. Per un risultato ottimale ed evitare sezioni scivolare fuori, aggiungere una seconda mano di bianco d'uovo e far per asciugare ancora una volta in forno a 60 ° C.
- Preparare una soluzione di 1% gelatina sciogliendo 1 grammo di gelatina in 100 mL di acqua calda (60 ° C) e attendere che si raffreddi a temperatura ambiente.
- Preparare 200 mL di soluzione di sviluppatore come descritto di seguito per l'uso nella sezione 4.
- Preparare la soluzione di gomma arabica aggiungendo lentamente 40g in incrementi di 120 mL di acqua calda (si scioglie più facilmente in questo modo). Continuare a mescolare la soluzione con un bacchetta di vetro. Una volta che la soluzione si è completamente sciolto, e togliere dal fuoco e lasciare raffreddare per qualche minuto, poi filtrare attraverso 6-8 strati di panno di garza in un imbuto.
- Citrato di preparare buffer aggiungendo 5,04 g di acido citrico più 4,7 g di citrato di sodio in 20 mL dH 2 O e la miscela di dissoluzione. Assicurarsi che il pH di questa soluzione è 4.0 a 25 ° C. regolare il pH se necessario con l'aggiunta di idrossido di sodio o acido cloridrico alla soluzione.
- Preparare la soluzione di idrochinone di riscaldamento 30 mL dH 2 O e sciogliere 1,7 g di idrochinone.
Nota: Riscaldamento della soluzione di idrochinone è essenziale per permettere che si dissolvono facilmente in acqua come idrochinone non è prontamente solubile in acqua a temperatura ambiente. Prestare attenzione a mantenere la temperatura dell'acqua inferiore a 60 ° C, altrimenti può essere ossidato idrochinone. Se la soluzione diventa gialla, scartare e preparare un'altra soluzione fresca. - Preparare argento lattato soluzione sciogliendo 0,22 g in 30 mL di dH 2 O.
- Mescolare le soluzioni (1.4.1 - 1.4.4) nell'ordine in cui sono descritti quando si è pronti per eseguire le reazioni (vale a dire, dopo il sezionamento, asciugatura e fissaggio) ( Figura 2). Aggiungere la soluzione di lattato di argento alla fine. Assicurarsi che questo passaggio è completato rapidamente e la soluzione di sviluppatore è posto al buio fino a quando è il momento di reagire le sezioni come argento lattato è fotosensibile.
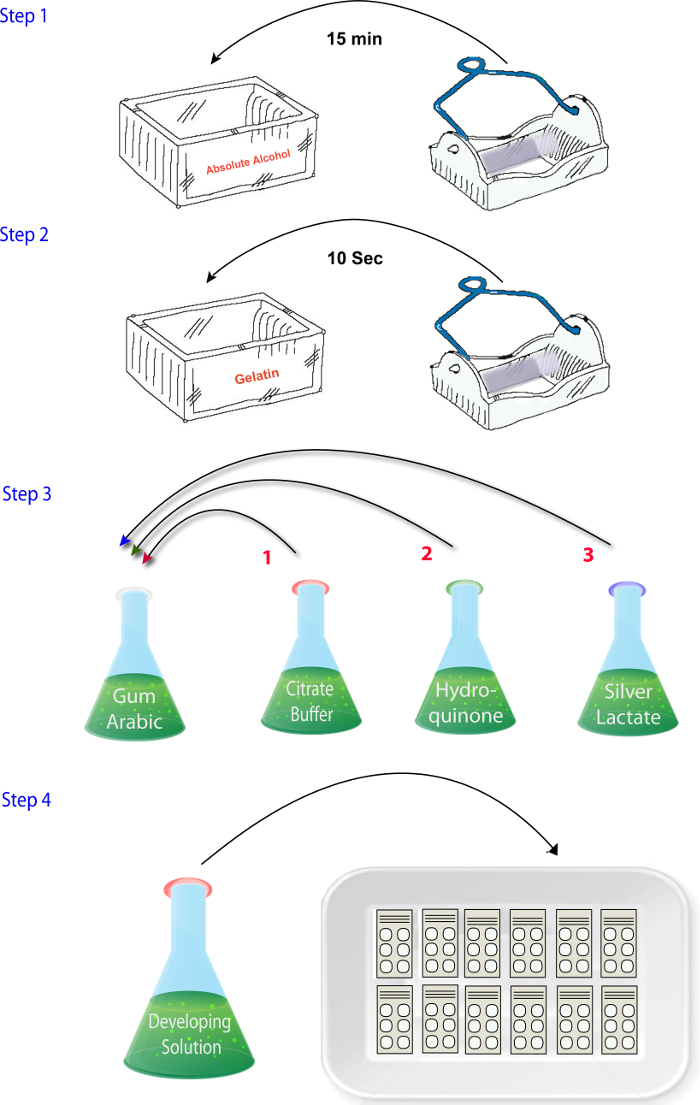
Figura 2: schema che illustra la sequenza di passaggi necessari per miscelazione di reagenti in fase di istochimica zinco del protocollo. Clicca qui per visualizzare una versione più grande di questa figura.
2. trattamento di animale e anestesia
- prima del sedativo l'animale, preparare una soluzione di 1% sodio selenito (Na 2 SeO 3) sciogliendo 10 mg di selenito di sodio in 1 mL dH 2 O.
- Anestetizzare l'animale con un'iniezione intramuscolare di ketamina (25 mg/kg) e xilazina (2 mg/kg).
Nota: Accertarsi che un adeguato livello di anestesia è raggiunto utilizzando il pedale risposta riflessa. - Iniettare zinco soluzione di selenito di sodio chelante (15 mg/kg) per via intraperitoneale (IP).
Nota: La tossicità di selenito di sodio alle età differenti o in altre specie poteva variare. - Consentire 60 a 90 min per il selenito di sodio di viaggiare al cervello. Durante questo periodo, è indispensabile per garantire che l'animale è correttamente sedato e non risponde, quindi controllare la profondità dell'anestesia ogni 5 min.
- Il periodo di selenite, mentre l'animale è anestetizzato, assicurano che gli occhi sono chiusi per prevenire la secchezza, o amministrare unguento oftalmico per tenerli umidi.
3. Preparazione dei tessuti e colorazione
- eutanasia animale attraverso la somministrazione di una dose eccessiva di sodio pentobarbital (100 mg/kg, i. p).
- Eseguire perfusione perfusione con soluzione salina normale per 1 min e con paraformaldeide al 4% per 20 min., infine, somministrare una soluzione con 4% paraformaldeide e 10% di saccarosio (un periodo di fissazione totale di 1 h).
- Rimuovere la testina usando un paio di grandi cesoie.
- Fare un'incisione del midline usando un bisturi dal naso al collo per esporre il cranio.
- Attentamente rimuovere il cervello e separare gli emisferi con una lama.
- Bloccare la parte posteriore del cervello e postfix in paraformaldeide al 4% in tampone fosfato 0,1 M (PB) per diverse ore.
- Posizionare i blocchi in una soluzione di saccarosio 30% in 0.1 M PB e permettere al cervello di lavello.
Nota: Sostituire la soluzione di saccarosio 4% paraformaldeide e 30% con la soluzione di saccarosio al 30% in 0.1 M PB ad affondare il cervello limita il cervello ' s esposizione di paraformaldeide come questo può influenzare la qualità di colorazione del tessuto.
Lavelli di - una volta il cervello, taglio semi-tangenziale 40 µm spessore sezioni attraverso la corteccia visiva o la regione di interesse su un congelamento, scorrevole microtomo o criostato. Questo può essere realizzato inserendo il blocco con il mediale in superficie verso il basso e delicatamente spianatura con un vetrino.
- Raccogliere le sezioni con un pennello e un negozio in un tackle box contenente tampone fosfato salino (PBS).
- Separare le sezioni in serie numerata separato. Immediatamente montare uno o due serie di sezioni del cervello il bianco d'uovo subbed diapositive (sezione 1), permettono di asciugare durante la notte a temperatura ambiente e di elaborare le sezioni histochemically per zinco sinaptico.
Nota: Altre serie possono essere trattata per altri indicatori per il confronto, ad esempio mielina 12 o citocromo ossidasi usando il protocollo modificato 13: incubare per 2-8 h a 40 ° C con 3% di saccarosio, 0.015% citocromo C, catalasi 0.015% e 0,02% diaminobenzidina in PB 0,1 M. Sostanza di Nissl può anche essere utilizzato come un indicatore istologico per distinguere le aree corticali visive. Queste altre macchie istologiche non richiedono che sezioni del cervello sono montate su vetrini subbed bianco d'uovo, quindi le diapositive di gelatina tradizionale rivestito possono essere usate invece.
4. L'istochimica zinco sinaptica
- Difficoltà sezioni scivolo montato in alcool assoluto per 15 min e lasciare per asciugare completamente a temperatura ambiente per 1 h. < lho > immergere brevemente sezioni per 10 s in una soluzione di 1% gelatina (sezione 1) e lasciar asciugare durante la notte a temperatura ambiente.
- Mescolare le soluzioni come descritto al punto 1.8, non appena sono pronti per essere reagito sezioni.
- Reagire le sezioni organizzando le diapositive fianco a fianco in un bicchiere o una vaschetta di plastica, e versando la soluzione in via di sviluppo le diapositive. Verificare che scivoli sono completamente immersi nella soluzione e trasferire il vassoio in uno spazio buio o coprono con una scatola a tenuta di luce.
Nota: Un vassoio di plastica che è di circa 12 pollici lunga da 8 pollici di larghezza può essere utilizzato, che si adatta esattamente 18 scivoli. Un volume totale di 200 mL di soluzione di sviluppatore è sufficiente immergere completamente le diapositive, in modo da garantire che il volume corretto viene utilizzato per il numero di diapositive per essere reagito e regolare di conseguenza la ricetta. Uso di un vassoio di plastica o di vetro anziché utilizzare un vassoio di metallo è consigliabile in quanto c'è un certo grado di cross reattività tra il lattato di argento nella soluzione di sviluppatore e il ferro o altri metalli vassoi di metallo trovati in.
- Reagire le sezioni organizzando le diapositive fianco a fianco in un bicchiere o una vaschetta di plastica, e versando la soluzione in via di sviluppo le diapositive. Verificare che scivoli sono completamente immersi nella soluzione e trasferire il vassoio in uno spazio buio o coprono con una scatola a tenuta di luce.
- Monitorare lo sviluppo della reazione controllando visivamente le sezioni ogni 30 min. Le sezioni richiedono generalmente 120-180 min per lo sviluppo completo.
- Se sezioni diventano overstained (Vedi Figura 3a), differenziare in 2% agricoltore ' soluzione s (9 parti di tiosolfato di sodio 2% in dH 2 O e 1 parte 2% ferricianuro di potassio in dH 2 O) per un minimo di 1-2
Nota: Sezione di esempio che è scarsamente macchiata è illustrato nella Figura 3b. - Una volta ottenuta l'intensità desiderata, terminare la reazione rimuovendo il vetrino montato sezioni dal vassoio e immissione le diapositive in un portavetrini.
- Mettere il portavetrini in un bicchiere grande vaschetta di colorazione e lavare i vetrini in ambiente caldo (40-50 ° C) in acqua corrente per 10 min rimuovere lo strato di gelatina e il deposito di argento esterno.
Nota: Fare attenzione a non agitare il portavetrini per impedire sezioni di scivolare fuori. L'intensità desiderata della sezione è raggiunta quando la variazione laminare sufficiente è evidente e sezioni sono abbastanza scuro ma non esagerato (Vedi Figura 4a). - Lasciare i vetrini asciugare a temperatura ambiente e quindi disidratare in 100% EtOH (5 min), chiaro in xilene (5 min) e coprioggetto con un mezzo di montaggio. In alternativa, porre i vetrini in una serie crescente di alcool, quindi disidratare, chiaro e il vetrino coprioggetti.
- Sezioni uso dagli animali senza trattamento precedente di selenite per servire come controllo negativo. Amplificazione d'argento di queste sezioni non deve cedere nessuna colorazione.
Nota: Per risultati ottimali consentono sezioni per asciugare durante la notte. Permettendo sezioni per asciugare durante la notte produce migliore colorazione tissutale.
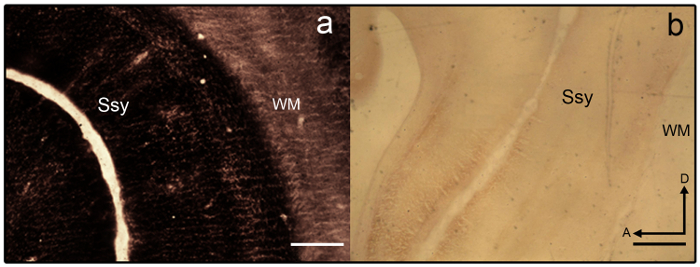
Figura 3: zinco sinaptico macchiatura nel cervello giovanile furetto. Microfotografie di semi-tangenziale sezioni macchiate di zinco che sono un) overstained e b) understained nel cervello giovanile furetto. Areali confini sono difficili da discernere come variazione laminare è carente. Materia bianca è anche fortemente macchiata. Ssy Suprasylvian corteccia, WM bianco importa, un'anteriore, D dorsale. Barra della scala = 500 µm (a-b). Clicca qui per visualizzare una versione più grande di questa figura.
5. distinguere confini Areal e acquisizione di immagini
- uso caratteristiche architettoniche delle regioni differenti del cervello per l'identificazione di areal e laminare.
Nota: ad esempio, nella sviluppo corteccia retrosplenial 14 ratto, gli autori hanno rivelato una modularità transitoria caratterizzata dalla macchiatura pesante per lo zinco, che non è presente nell'adulto, ma poteva essere utilizzato per descrivere corticale organizzazione durante lo sviluppo in questa specie. In un altro studio 15, gli autori hanno rivelato la specificità nella distribuzione sinaptica zinco di diversi nuclei trovato nell'amigdala scimmia macaco, che facilitano l'identificazione di queste divisioni. Aree corticali visive nel cervello in via di sviluppo e adulto furetto sono stati precedentemente descritti 16 , 17 , 18, suddivisione architettonica della neocorteccia in lo scoiattolo di gray sono stati descritti 19. Inoltre, l'istochimica zinco precedentemente utilizzato per distinguere tra aree in scimmia adulta corteccia visiva 8, sviluppando e adulto gatto corteccia visiva 5, lo sviluppo di corteccia somatosensory del ratto 9 , 20 e topo adulto corteccia somatosensoriale 6 , 21. Se disponibili, confrontare il modello di macchiatura nella mielina macchiato, citocromo ossidasi (CO) macchiato e zinco sinaptico macchiato le sezioni del cervello, per confermare i confini areali nell'adulto. Nelle sezioni semi-tangenziale della corteccia visiva di furetto macchiato per zinco sinaptico, esistono importanti differenze tra aree corticali visive che facilitano l'identificazione areal. Ad esempio, aree 17 e 18 del furetto adulto rivelano che zinco sinaptico macchiatura è alta in strati III e V. strato VI colora meno intensamente, mentre strato IV manca quasi di zinco. La cospicua mancanza di zinco macchiatura nel livello IV o contrasti di aree 17 e 18 con la band scuro macchiato trovato nello strato che IV in CO sezioni macchiate. Tuttavia, livello IV dell'area 17 a CO sezioni macchiata mantiene un bordo tagliente con strati III e V, ma strato IV nella zona 18 è caratterizzato da una sottile diminuzione nell'intensità di colorazione e suo limite superiore trovate nello strato III è meno distinguibile. - Esaminare sezioni mediante microscopia in campo chiaro con un obiettivo di bassa potenza (2 X o ingrandimento 4x) e fotografare le aree di interesse.
- Migliora contrasto e luminosità di microfotografie utilizzando software di elaborazione immagine. Le immagini ottenute per misure di densità ottica non devono essere modificate in qualsiasi modo.
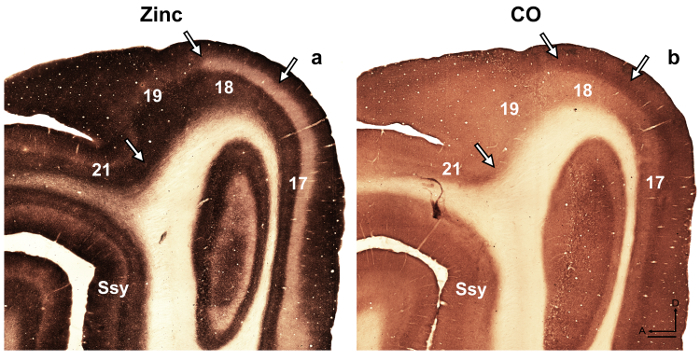
Figura 4: zinco sinaptico nel cervello adulto furetto la macchiatura distingue diverse aree corticali visive. Microfotografie di sezioni semi-tangenziale adiacenti hanno macchiato per (un'un) sinaptica zinco o (b) del citocromo ossidasi (CO) nell'adulto. Le frecce contrassegno i limiti dell'areali. Ssy Suprasylvian corteccia, un'anteriore, D dorsale. Barra della scala = 500 µm. Clicca qui per visualizzare una versione più grande di questa figura.
6. densitometria (opzionale)
Nota: DensitomAdriano analisi possono essere utilizzati per valutare la distribuzione di zinco sinaptica nel cervello misurando la densità ottica di zinco rappresentanza macchiato sezioni nelle regioni di interesse. Questo metodo è anche utile per tenere traccia di potenziali cambiamenti nei livelli di zinco sinaptica durante lo sviluppo.
Sezioni di zinco-macchiate- Using selezionato, scegliere casualmente colonne corticali (colonnare microfotografie) di larghezza appropriata (può essere utilizzata una colonna larga 450 µm) acquisite microfotografie della regione di interesse. Una colonna corticale è una regione che attraversa tutti gli strati corticali dalla superficie pial alla materia bianca.
- Scegliere un numero appropriato di colonne di esempio da diverse sezioni differenti del cervello in ogni regione di interesse.
- Trasferire immagini di esempio di colonne rappresentative in una software di elaborazione immagine.
- Utilizzare lo strumento di selezione rettangolare per comprendere l'intera colonna corticale.
- Utilizzare lo strumento Inverti per creare un'immagine contrasto invertito simile a un negativo fotografico della colonna.
Nota: Inversione di contrasto delle immagini viene eseguita per produrre alta densità ottica valori per i livelli dello zinco sinaptica alta e bassa densità ottica valori per i livelli basso dello zinco sinaptica. Si tratta di un modo più intuitivo per eseguire il rendering grafico profilo grafici simili a quelli visti nella Figura 5. - Produrre profili di densità ottica da queste immagini utilizzando lo strumento di profilo di trama per generare un grafico bidimensionale delle intensità pixel lungo una linea.
- Opzioni di stampa di uso per convertire il grafico del profilo di trama in un profilo verticale e fare clic su trama profilo una volta più.
Nota: La distanza rappresenta asse x lungo la linea e l'asse y rappresenta l'intensità di pixel. Di conseguenza, ogni valore di profilo trama riflette il valore di scala di grigi media ad ogni profondità su tutta la larghezza della colonna. - i valori del profilo apre il diagramma come file di testo in foglio di calcolo, normalizzare e plottati con grafici (Vedi Figura 5).
Nota: Si consiglia di utilizzare la densità relativa di zinco sinaptica per confronto di misure quantitative, come risultati possono essere confuse di variazione di intensità di colorazione generale a seguito di diversi tempi di reazione, lo stainability del tessuto, così come altri variabili. - Calcolare la densità relativa zinco effettuando prima una media di boxcar dei valori di profilo di trama per lisciare i dati.
Nota: Questa operazione viene eseguita facendo la media, ad esempio, ogni 20 o 30 pixel successivi (1 pixel = 2,5 µm) in profondità e quindi normalizzare alla massima intensità per ciascun campione. Di conseguenza, ogni valore di profilo medio trama riflette il valore di scala di grigio medio a quella profondità (intervallo di valori di scala di grigi da 0 a 255). Un metodo di normalizzazione diversi può essere utilizzato da prima acquisizione valori di densità ottica di materia bianca (WM) da regioni di campione che comprendono la materia bianca sottostante nelle aree di interesse. Idealmente, scegliere diverse regioni che sono come leggermente macchiate come possibile per ottenere una media del valore WM. Valori di densità ottica media allora sono divisi da valori medi di WM per ottenere i valori normalizzati di WM. - Determinare valori di densità ottica a livelli specifici delle regioni di interesse medi per confronti quantitativi.
Nota: ad esempio, il valore di densità ottica minima media nello strato IV delle aree corticali visive del furetto sono determinati da che comprende la regione meno macchiata di pixel ± 5. - Densità ottica media calcola valori negli strati supragranular e infragranular delle aree corticali visive del furetto di che comprende la regione macchiata più buia di ± 5 pixel per determinare il valore medio massimo.
- Assicurarsi che i valori di densità ottica medi sono ottenuti da all'interno di particolari strati.
Nota: È fondamentale per verificare i limiti di questi strati nelle immagini contrasto invertito confrontandole con le microfotografie originali così come la sezione CO adiacente. Questo garantisce che uno non sconfinare su strati adiacenti.
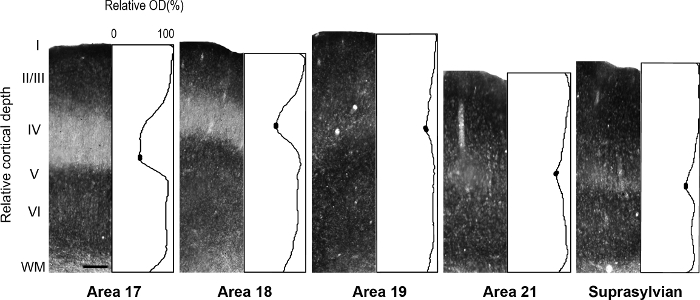
Figura 5: distribuzione laminare di zinco sinaptico in diversa visiva corticale aree nel furetto adulto. Rappresentante microfotografie di colonne attraverso tutti gli strati corticali con profili corrispondenti di densità ottica normalizzato in un adulto. Densità bassa sinaptica zinco nello strato IV dell'adulti aree 17 e 18 è indicata dal trogolo nella trama del profilo. In ogni profilo di trama, riempiti ovali nella depressione del livello IV indicano i valori utilizzati per determinare il valore di intensità media minima in pixel. Barra della scala = 200 µm. Clicca qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
I passaggi principali relativi a questo protocollo per macchiare le sezioni del cervello per zinco sinaptico sono presentati in un diagramma di flusso nella Figura 1. Il protocollo può essere diviso in tre fasi: 1) aspersione e tessuto raccolta, preparazione 2) tessuto e la macchiatura e l'istochimica 3) zinco. Brevemente, durante la prima fase del protocollo, l'animale è anestetizzato e IP iniettato con la dose appropriata di selenito di sodio. Dopo un per...
Access restricted. Please log in or start a trial to view this content.
Discussione
Lo studio corrente impiega una tecnica istochimica basata su una versione modificata del Danscher (1982) metodo10, per cui zinco sinaptica localizzazione può essere rilevato e visualizzato nel cervello. Questo metodo funziona essenzialmente iniettando l'animale con il selenito di sodio chelante (Na2SeO3) di zinco (15 mg/kg). A seguito di iniezione, la selenite viaggia al cervello e si lega di zinco liberi che è localizzato alle vescicole presinaptiche di zinco contenente ne...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni dal centro nazionale per le risorse di ricerca (2G12RR03060-26A1); L'Istituto nazionale sulla salute delle minoranze e le disparità di salute (8G12MD007603-27) dal National Institutes of Health; Professional Staff Congress-City University of New York (PSC-CUNY); e facoltà Research Grant (la RFG II) American University of Sharjah. Ringraziamo Vidyasagar Sriramoju per introdurre noi a questi metodi.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Euthasol (Euthanasia solution) | Henry Schein | 710101 | |
| Sodium selenite | Sigma-Aldrich | 214485 | |
| Ketamine (Ketaved) | Henry Schein | 48858 | 100 mg/ml injectables |
| Xylazine (Anased) | Henry Schein | 33198 | 100 mg/ml injectables |
| Paraformaldehyde | Sigma-Aldrich | F8775 | Dilute to 4% |
| Gum arabic | Sigma-Aldrich | G9752-500G | |
| Citric acid | Sigma-Aldrich | C1909 | |
| Sodium citrate | Sigma-Aldrich | W302600 | |
| Hydroquinone | Sigma-Aldrich | H9003 | |
| Silver lactate | Sigma-Aldrich | 85210 | |
| Fish gelatine | Sigma-Aldrich | G7765 | |
| Cytochrome c | Sigma-Aldrich | C2506 | (Type III, from equine heart) |
| Catalse | Sigma-Aldrich | C10 | |
| Sucrose | Domino | ||
| Xylene | Fisher Scientific | X5P-1GAL | |
| Permount | Fisher Scientific | SP15-500 | |
| 100% Ethanol | Fisher Scientific | A406-20 | Used for dehydration prior to slide mounting |
| Coverslips | Brain Research Laboratories | #3660-1 | |
| Frosted unsubbed slides | Brain Research Laboratories | #3875-FR | |
| Microtome | American Optical Company | 860 | |
| Microscope | Olympus | BX-60 | |
| Adope Photoshop | Adobe Systems, San Jose, CA | To assemble images | |
| ImageJ | Free software can be downloaded at http://rsb.info.nih.gov/ij/ | For densometric measurements | |
| Plastic tray | Any standard plastic tray may be used | to immerse slides in developer solution | |
| Hot plate | Any standard hotplate may be used |
Riferimenti
- Nakashima, A., Dyck, R. H. Zinc and cortical plasticity. Brain Res. Rev. 59, 347-373 (2009).
- Frederickson, C. J. Neurobiology of zinc and zinc-containing neurons. Int Rev Neurobiol. 31, 145-238 (1989).
- Beaulieu, C., Dyck, R., Cynader, M. Enrichment of glutamate in zinc-containing terminals of the cat visual cortex. NeuroReport. 3 (10), 861-864 (1992).
- Martinez-Guijarro, F. J., Soriano, E., Del Rio, J. A., Lopez-Garcia, C. Zinc-positive boutons in the cerebral cortex of lizards show glutamate immunoreactivity. J Neurocytol. 20 (10), 834-843 (1991).
- Dyck, R., Beaulieu, C., Cynader, M. Histochemical localization of synaptic zinc in the developing cat visual cortex. J Comp Neurol. 329 (1), 53-67 (1993).
- Garrett, B., Geneser, F. A., Slomianka, L. Distribution of acetylcholinesterase and zinc in the visual cortex of the mouse. Anat Embryol. (Berl). 184 (5), 461-468 (1991).
- Garrett, B., Osterballe, R., Slomianka, L., Geneser, F. A. Cytoarchitecture and staining for acetylcholinesterase and zinc in the visual cortex of the Parma wallaby (Macropus parma). Brain Behav Evol. 43 (3), 162-172 (1994).
- Dyck, R., Cynader, M. An interdigitated columnar mosaic of cytochrome oxidase, zinc, and neurotransmitter-related molecules in cat and monkey visual cortex. Proc. Natl. Acad. Sci. (90), 9066-9069 (1993).
- Land, P. W., Akhtar, N. D. Experience-dependent alteration of synaptic zinc in rat somatosensory barrel cortex. Somatosens Mot Res. 16 (2), 139-150 (1999).
- Danscher, G. Exogenous selenium in the brain: a histochemical technique for light and electron microscopic localization of catalytic selenium bonds. Histochemistry. 76, 281-293 (1982).
- Danscher, G., Howell, G., Perez-Clausell, J., Hertel, N. The dithizone, Timm's sulphide silver and the selenium methods demonstrate a chelatable pool of zinc in CNS: a proton activation (PIXE) analysis of carbon tetrachloride extracts from rat brains and spinal cords intravitall treated with dithizone. Histochemistry. 83, 419-422 (1985).
- Gallyas, F. Silver staining of myelin by means of physical development. Neurol Res. 1 (2), 203-209 (1979).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Miró-Bernié, N., Ichinohe, N., Perez-Clausell, J., Rockland, K. S. Zinc-rich transient vertical modules in the rat retrosplenial cortex during postnatal development. J Neurosci. 138 (2), 523-535 (2006).
- Ichinohe, N., Rockland, K. S. Distribution of synaptic zinc in the macaque monkey amygdala. J Comp Neurol. 489 (2), 135-147 (2005).
- Innocenti, G. M., Manger, P. R., Masiello, I., Colin, I., Tettoni, L. Architecture and callosal connections of visual areas 17, 18, 19 and 21 in the ferret (Mustela putorius). Cereb Cortex. 12 (4), 411-422 (2002).
- Khalil, R., Levitt, J. B. Zinc histochemistry reveals circuit refinement and distinguishes visual areas in the developing ferret cerebral cortex. Brain Struct Funct. 218, 1293-1306 (2013).
- Manger, P. R., Masiello, I., Innocenti, G. M. Areal organization of the posterior parietal cortex of the ferret (Mustela putorius). Cereb Cortex. 12, 1280-1297 (2002).
- Wong, P., Kaas, J. H. Architectonic subdivisions of neocortex in the gray squirrel (Sciurus carolinensis.). The anatomical record. 291, 1301-1333 (2008).
- Land, P. W., Shamalla-Hannah, L. Experience-dependent plasticity of zinc-containing cortical circuits during a critical period of postnatal development. J Comp Neurol. 447 (1), 43-56 (2002).
- Czupryn, A., Skangiel-Kramska, J. Distribution of synaptic zinc in the developing mouse somatosensory barrel cortex. J Comp Neurol. 386, 652-660 (1997).
- Timm, F. Zur Histochemie der Schwermetalle. Das Sulfid-Silber-Verfahren. Dtsch Z ges gerichtl Med. 46, 706-711 (1958).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon